Quartärstrukturen abiotischer Foldamere
Abstract
Bei abiotischen aromatischen Foldamer-Sequenzen wurde bereits gezeigt, dass sie sich in organischen Lösungsmitteln zu Helix-Turn-Helix-Motiven falten. Mithilfe einfacher rechnergestützter Werkzeuge wurde ein neues Helix-Turn-Helix-Motiv entworfen, das zusätzliche OH-Gruppen als Wasserstoffbrückenbindungs-Donoren trägt, um die Aggregation zu einer echten, trimeren abiotischen Quartärstruktur zu fördern. Diese Sequenz wurde synthetisiert und ihre Selbstorganisation in Lösung durch Kernmagnetresonanz (NMR), Zirkulardichroismus (CD) und Molekulardynamiksimulationen (MD) untersucht. Es wurde das Vorhandensein zweier stabiler abgrenzbarer Aggregate nachgewiesen, von denen eines dem ursprünglich entworfenen Trimer und das andere einem Dimer mit mehreren Wassermolekülen zugeordnet wird. Die beiden Spezies können bei Änderung des Wassergehalts der Lösung oder der Temperatur quantitativ ineinander umgewandelt werden. Diese Ergebnisse sind ein wichtiger Schritt auf dem Weg zur Entwicklung von proteinähnlichen abiotischen Architekturen.
Eine derzeitige Herausforderung in der Foldamer-Forschung besteht darin, über isolierte nicht-natürliche molekulare Helices, Windungen oder lineare Stränge hinauszugehen und mehrere dieser sekundären Bestandteile zu Tertiär- und Quartärstrukturen zu kombinieren. Diese Herausforderung beruht auf der Hoffnung, dass aus komplexeren Objekten anspruchsvolle Funktionen entstehen, wie es bei Proteinen der Fall ist. Was das anbelangt haben rechnergestützte Werkzeuge1, 2 und andere rationale3-7 oder evolutionäre Ansätze,8-10 zur Darstellung nicht-natürlicher Proteine, große Fortschritte gemacht. Der Einbau von nicht natürlichen Einheiten in α-Peptidstrukturen konnte ebenfalls gezeigt werden.11-13 Komplex-gefaltete Objekte, die nicht aus natürlichen Monomeren bestehen, sind nach wie vor selten. So sind einige Helixbündel auf der Basis von β-Peptiden,14, 15 Oligoharnstoffen,16, 17 oder abiotischen aromatischen Aminosäuren18, 19 beschrieben worden. Im Zusammenhang mit letzterem wurden abiotische Helix-Turn-Helix-Tertiärstrukturen, wie die der Sequenz 1 (Abbildung 1b), entworfen.18, 20-23 Soweit wir wissen, gibt es keine wirklichen Quartärstrukturen, d. h. Anordnungen von Tertiärstrukturen.24 So ergab z. B. ein kürzlich unternommener Versuch, eine Quartärstruktur zu entwerfen, stattdessen ein unerwartetes Domain-Swapped-Dimer (DSD), bei dem die ursprüngliche tertiäre Faltung gestört wurde.25 Hier berichten wir über – wie wir glauben – die ersten beiden Beispiele für abiotische Quartärstrukturen, von denen eine das Ergebnis eines rationalen Designs und die andere das Ergebnis einer Entdeckung ist.
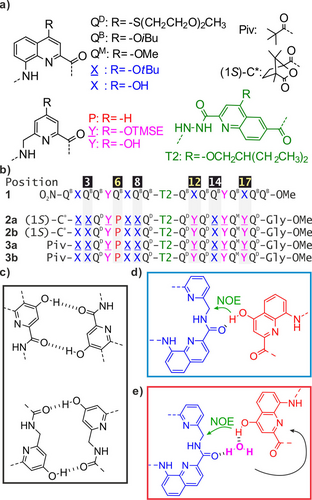
a) Strukturformeln der Aminosäuremonomere QB, QD, QM, X, P, Y und T2 sowie der N-terminalen Piv- und (1S)-C*-Gruppen. X und Y sind die geschützten Vorstufen von X bzw. Y. TMSE=2-Trimethylsilylethyl. QB, QD, QM und T2 tragen in organischen Lösungsmitteln löslichmachende Seitenketten. b) Oligoamid-Foldamer-Sequenzen. Gly steht für Glycin. In 1 ersetzt die Nitrogruppe am N-Terminus die NH-Gruppe. Die Nummerierung der Einheiten von 1 wurde für alle Sequenzen übernommen, d. h. 2 b beginnt mit dem Rest 2. c) Wasserstoffbrückenbindungsmuster, an denen X- und Y-Einheiten innerhalb der intramolekularen Helix-Helix-Grenzfläche von z. B. 1 beteiligt sind. d) Intermolekulares Wasserstoffbrückenbindungsmuster, das die verschobene Dimer-Helix-Helix-Grenzfläche vermittelt, die zur Programmierung des Zusammenbaus von (2 b)3 verwendet wurde. e) Hypothetische Einfügung von Wasser in das in d) gezeigte Muster. Der schwarze Pfeil hebt die Änderung der Position der X-Einheit im Vergleich zu ihrer Position in d) hervor. Die grünen Pfeile markieren die beobachteten intermolekularen NOEs.
Sequenz 121 umfasst zwei δ-Peptidsegmente, die aus 8-Amino-2-chinolincarbonsäure- (Q, X in Abbildung 1a) und 6-Aminomethyl-2-pyridincarbonsäure-Einheiten (P, Y in Abbildung 1a). Beide Segmente nehmen in organischen Lösungsmitteln stabile helikale Konformationen an, die den bekannten Faltungsregeln für aromatische Oligoamid-Foldamere folgen (Abbildung S1 der unterstützenden Informationen).26, 27 Q- und X-Einheiten sind starrer und schablonieren die Faltung der flexibleren Y-Einheit.28 Wesentlich für das Design von Tertiärstrukturen ist, dass X und Y 4-Hydroxy-Substituenten tragen, die Wasserstoffbrückenbindungen zu Amidcarbonylgruppen eingehen können und Helix-Helix-Zusammenschlüsse vermitteln (Abbildung 1c). Die beiden Helixsegmente sind durch eine T2-Turn-Einheit verbunden, die eine stabile Helix-Turn-Helix-Tertiärfaltung begünstigen soll, die durch sechs intramolekulare Wasserstoffbrückenbindungen zwischen den Helices stabilisiert wird. T2 vermittelt dabei auch eine Umkehr der Händigkeit der Helix. Wenn die N-terminale Helix von 1 rechtshändig (P) ist, ist die C-terminale Helix linkshändig (M) und umgekehrt. Eine bildhafte Darstellung der PM Struktur von 1 ist in Abbildung 2a gezeigt, sowie seine Kristallstruktur in Abbildung S2.
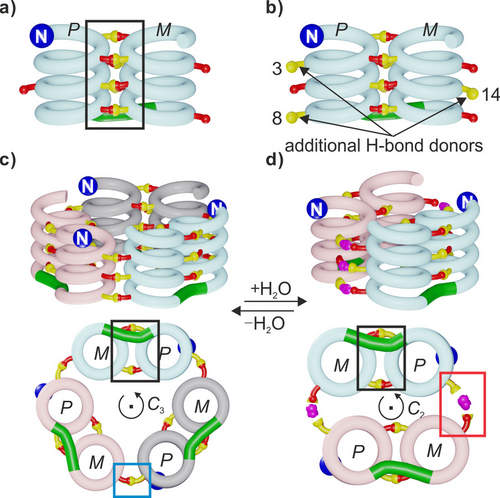
a) Schematische Darstellung einer tertiären Helix-Turn-Helix-Struktur mit einer Umkehrung der Helixhändigkeit. b) Modifikation der Struktur in a), um zusätzliche komplementäre Anordnungen von Wasserstoffbrückenbindungen zu schaffen. Schematische Darstellungen von: c) einem C3-symmetrischen Trimer und d) einem C2-symmetrischen Dimer mit sechs Wassermolekülen (lila gefärbt), welche die Wasserstoffbrückenbindungsschnittstelle überbrücken. Der N-Terminus ist mit einer blauen Kugel markiert. Der T2-Linker ist in Grün dargestellt. Rote und gelbe Kugeln kennzeichnen Wasserstoffbrückenbindungsakzeptoren (Carbonylsauerstoffatome) bzw. -donoren (Hydroxyprotonen). Intramolekulare Grenzflächen sind durch einen schwarzen Kasten hervorgehoben. Intermolekulare Grenzflächen innerhalb des Trimers und des hypothetischen wasservermittelten Dimers sind durch cyanfarbene bzw. rote Kästen hervorgehoben.
Die Tertiärfaltung von 1 scheint ein erstklassiger Kandidat für die Einführung zusätzlicher Hydroxygruppen zu sein, um intermolekulare Wechselwirkungen und die Bildung einer quaternären Struktur zu begünstigen. In einem ersten Versuch haben wir Hydroxygruppen an den Positionen 4, 9 und 13 der Sequenz von 1 eingeführt, um eine neue intermolekulare Schnittstelle mit Wasserstoffbrückenbindungen zu schaffen. Jedoch wurde dieser ab initio-Entwurf auf der Grundlage von Molecular Modeling experimentell nicht bestätigt. Wie bereits erwähnt, bildete sich stattdessen eine DSD, die zur Störung der tertiären Faltung führte.25 Diese Dimerisierung führte zu einer gauche ~90°-Torsion um die N−N-Bindung von T2 anstelle der flachen anti-Konformation, die in der Struktur von 1 beobachtet wurde (Abbildung S2).21 Die beiden Konformationen führten jeweils zu charakteristischen Werten der chemischen 15N NMR -Verschiebung. In einem neuen Versuch wollten wir eine bereits charakterisierte, durch Wasserstoffbrückenbindungen vermittelte intermolekulare Helix-Helix-Zusammenschluss ausnutzen, die als „verschobene Dimerisierung“ bezeichnet wird.19 In CDCl3 fördert die Wasserstoffbrückenbindung zwischen den von den X-Einheiten getragenen Hydroxygruppen und den mit den P-Einheiten verbundenen Carbonylgruppen (Abbildung 1d) die head-to-tail Assoziation einer P- und einer M-Helix (Einzelheiten siehe Abbildung S3).19 Da die Struktur von 1 bereits aus einer P- und einer M-Helix besteht, welche head-to-tail angeordnet sind – wenn auch innerhalb einer Tertiärfaltung – wurde vorhergesagt, dass die intermolekulare verschobene Dimerisierung die abgrenzbare Aggregation von 1 befördert. Zu diesem Zweck wurden Hydroxygruppen an den Positionen 3, 8 und 14 von 1 eingeführt, d. h. sowohl an den N-terminalen als auch an den C-terminalen Helices, um ergänzende Anordnungen von Wasserstoffbrückenbindungs-Donoren und Akzeptoren an der Peripherie der Tertiärstruktur zu schaffen (Abbildung 2b). Die verschobene Dimerisierung erforderte auch die Veränderung von Q- zu P- und von X- zu Y-Einheiten an den Positionen 6, 12 und 17. Neue Sequenzen 2 b und 3 b, die alle diese Merkmale aufweisen (Einzelheiten zu den Experimenten finden Sie in den begleitenden Informationen) wurden synthetisiert. Sie unterscheiden sich nur durch ihren N-Terminus: die Sequenz 2 b trägt eine (1S)-Camphanylgruppe, die die Händigkeit ihrer N-terminalen Helix quantitativ in Richtung P und damit ihrer C-terminalen Helix in Richtung M lenken.21, 29 Im Gegensatz dazu liegt die achirale 3 b als racemische Mischung aus PM- und MP-Konformeren vor. Ein Molekülmodell von zwei PM-Konformern von 2 b, die durch eine verschobene Dimerisierungsschnittstelle (d. h. mit der P-Helix des einen Moleküls und der M-Helix des anderen Moleküls) verbunden sind, wurde mit Maestro energieminimiert.30 Dabei zeigte sich, dass die beiden Moleküle in einem Winkel von 54° stehen (Abbildung S4). Dieser Wert liegt nahe bei den 60°, welchen man in einem zyklischen Trimer (PM-2 b)3 – unter Einbeziehung drei verschobener intermolekularer Grenzflächen – finden würde. In der Tat könnte ein solches C3-symmetrisches Trimer mit minimaler Verzerrung gegenüber der Dimerstruktur, d. h. mit vermutlich minimaler Energiestrafe, aufgebaut werden (Abbildungen 2c, 3a und S4). Es ist zu beachten, dass die PM-3 b- und MP-3 b-Konformationsenantiomere der achiralen Sequenz 3 b möglicherweise mehr Möglichkeiten haben sich zu vereinen. Die Studien in Lösung wurden daher mit der chiralen Sequenz 2 b, die ausschließlich PM ist, gestartet. Die 1H NMR -Spektren der Hydroxygruppen-geschützten Vorstufen 2 a und 3 a in CDCl3 waren ähnlich wie die der Vorstufe von 1,21 und zeigten ein Gemisch aus neben- und hauptdiastereomeren Konformer, wie z. B. PM und PP für 2 a (Abbildungen 4a und S5). Nach der Entschützung der Seitenkette zeigte das Spektrum der chiralen Sequenz 2 b in CDCl3 „aus der Flasche“ zwei Sätze scharfer Signale, die auf das Vorhandensein von zwei gut definierten Spezies hinweisen (Abbildung 2c). In sorgfältig getrocknetem CDCl3 (über Al2O3 – wobei „getrocknet“ nicht unbedingt streng trocken bedeutet) wurde nur eine Spezies beobachtet, während in feuchtem CDCl3 (nach Schütteln mit Wasser) nur die andere Spezies beobachtet wurde (Abbildungen 2b, 2d). Dazwischenliegende Verhältnisse wurden bei der Verwendung von Mischungen aus feuchtem und getrocknetem Chloroform erzielt (Abbildung S6). Im Gegensatz dazu veränderte die Zugabe vergleichbarer Mengen trockenen Methanols das Gleichgewicht nur geringfügig. Die 1H,15N-Heteronuclear Single Quantum Coherence (HSQC)-Spektren ermöglichten die Zuordnung von OH-Resonanzen als austauschbare Protonen, die nicht mit 15N korrelieren (Abbildungen S7, S8, S9). Die OH-Signale weisen Resonanzen zwischen 7.9 ppm und 12.0 ppm auf, was auf ihre Beteiligung an Wasserstoffbrückenbindungen unterschiedlicher Stärke hinweist und bleiben sogar in der feuchten Probe scharf, was auf einen langsamen Austausch mit Wasser hindeutet. Da es unwahrscheinlich ist, dass alle Wasserstoffbrückenbindungen intramolekular verwirklicht sind, kann man davon ausgehen, dass beide Spezies Aggregate sind. In Übereinstimmung damit zeigten DOSY-Experimente (Diffusion Ordered Spectroscopy), dass die von 2 b in feuchtem CDCl3 gebildete Spezies deutlich größer ist als ihr monomerer Vorläufer 2 a, d. h., dass sie dimer oder größer sein muss. Umgekehrt zeigte das DOSY, dass das Aggregat von 2 b in getrocknetem CDCl3 deutlich größer ist als sein Aggregat in feuchtem CDCl3, d. h., dass es mindestens trimer sein muss (Abbildung 4e, f, siehe auch Abbildung S10). Das Verdünnen einer Lösung des trimeren Aggregats in getrocknetem CDCl3 bis zu 20 μM zeigte keine Anzeichen von Dissoziation, was auf die Robustheit dieser Spezies in Abwesenheit von Wasser hinweist.
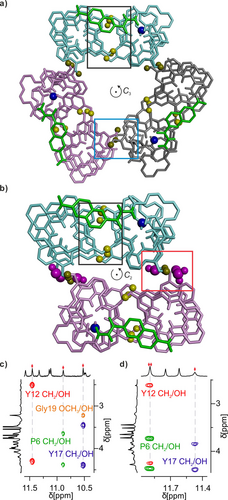
Vereinfachte Untersichten der energieminimierten Modelle von: a) (PM-2 b)3; und b) (PM-2 b)2(H2O)6. Wassermoleküle, welche die intermolekulare Grenzfläche überbrücken, sind lila eingefärbt. Einzelne Sequenzen sind in hellblauer, rosa und grauer Tube-Darstellung gezeigt. Hydroxyprotonen sind als gelbe Kugeln dargestellt. T2-Linker sind in grün dargestellt. Zur Verdeutlichung ist nur der äußere Rand der Helices dargestellt. Die Seitenketten von Q und T2 wurden weggelassen. Die schwarzen, cyanfarbenen und roten Kästen umreißen dieselben Bereiche wie in Abbildung 2. c) Ausschnitt aus dem 1H,1H NOESY-Spektrum (500 MHz, 298 K) von 2 b in getrocknetem CDCl3, das intermolekulare NOEs zwischen OH-Protonen (rote Rauten) und diastereomeren Paaren von CH2-Protonen von P6, Y12 und Y17 sowie dem C-terminalen OCH3 zeigt. d) Gleich wie (c) in feuchtem CDCl3.
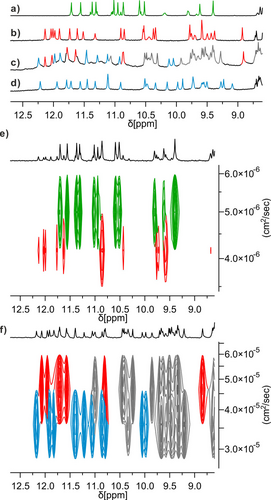
Auszug aus den 1H NMR -Spektren (500 MHz, 298 K) von 2 a (a), 2 b in feuchtem CDCl3 (b), 2 b in trockenem CDCl3 (d) und „normalem“ CDCl3 (c). e) DOSY-Spektren einer Mischung aus 2 a und 2 b in feuchtem CDCl3. Korrelationen, die der Verbindung 2 a entsprechen, sind grün und die der Verbindung 2 b rot hervorgehoben. f) DOSY-Spektren von 2 b, in denen zwei verschiedene Spezies koexistieren. Signale, die zwei verschiedenen Spezies entsprechen, sind rot bzw. blau hervorgehoben.
Der Effekt der Temperatur auf die Aggregation von 2 b bestätigte die Hypothese, dass Wasser an dem kleineren Aggregat beteiligt ist. In Chloroform aus der Flasche wurde das größere Aggregat quantitativ bei höheren Temperaturen (≥308 K) und das kleinere Aggregat quantitativ bei niedrigeren Temperaturen (≥253 K) gebildet (Abbildung S11). Die Temperatur, bei der der Übergang stattfindet (bei der die Signale für beide Spezies die gleiche Intensität haben), kann durch Variation des Wassergehalts der Lösung von über 318 K bis unter 223 K angepasst werden (Abbildungen S12, S13). Eine solche Temperaturabhängigkeit steht scheinbar im Widerspruch zum erwarteten Effekt der Entropie, lässt sich aber erklären, wenn das kleinere Aggregat (dasjenige, das laut DOSY den kleineren Diffusionskoeffizienten hat) tatsächlich die höhere Molekularität aufweist, weil es sowohl 2 b, als auch Wassermoleküle enthält. Die genaue Anzahl der Wassermoleküle ist nicht bekannt, aber sie muss hoch genug sein, damit die Temperaturabhängigkeit derart ausgeprägt ist. Die Tatsache, dass es im Rahmen von nur ca. 35 K zu einer nahezu quantitativen Umwandlung von Dimeren und Trimeren kommt, deutet darauf hin, dass der damit verbundene entropische Term recht groß sein muss (Abbildung S11).
Als nächstes sammelten wir Informationen über die Art und Struktur der Aggregate. Mit den uns zur Verfügung stehenden Instrumenten konnten wir keinen Nachweis über die Molekularität durch Massenspektrometrie erbringen. Die Vielzahl der NMR-Signale zeigt deutlich, dass in jedem Aggregat alle 2 b-Moleküle äquivalent sind. Die Aggregate sind also symmetrisch. Während die Sequenz von 2 b darauf ausgelegt war, ein C3-symmetrisches Trimer zu bilden (Abbildungen 2c, 3a), waren wir nicht in der Lage, ein sinnvolles Modell für ein symmetrisches Aggregat mit vier oder mehr Molekülen zu erstellen. Wir halten es daher für vernünftig vorzuschlagen, dass das größere Aggregat von 2 b das entworfene C3-symmetrische Trimer ist und dass das kleinere Aggregat ein Dimer (2 b)2 ⋅ (H2O)n ist. Wir können daraus schließen, dass n>1 ist, jedoch konnte sein Wert experimentell nicht bestimmt werden. Selbst bei 223 K scheint das Wasser innerhalb des Aggregats schnell zu taumeln oder zwischen dem Lösungsmittel und dem Aggregat auszutauschen. Ein überzeugendes Modell eines hydratisierten C2-symmetrischen Dimers könnte vorgeschlagen werden, wenn man Wassermolekülbrücken in jede Wasserstoffbrücke der verschobenen Grenzflächen einfügt (Abbildungen 1e, 2d, 3b). Dies läuft darauf hinaus, dass die Anordnung der Wasserstoffbrückenbindungen als Scharnier verwendet wird und der Winkel zwischen den Molekülen von 2 b auf 0° in (2 b)2 ⋅ (H2O)6, verglichen mit 60° in (2 b)3, reduziert wird. Eine derartige Einfügung mehrerer Wassermoleküle wurde bereits in verwandten Foldamer-Anordnungen,23 als auch in selbstanordnenden Calix[4]resorcinaren-basierten Kapseln31 beobachtet. Um seine Stabilität zu bewerten, wurde das energieminimierte Modell von (2 b)2 ⋅ (H2O)6, 1 ns langen MD-Simulationen bei 200, 300, 400 und 500 K unter Verwendung von CHCl3 als enthaltenes Lösungsmittel unterzogen (siehe unterstützende Informationen). Die Temperaturerhöhung führte zur Dissoziation der Wassermoleküle (alle dissoziieren bei 500 K), aber das Dimer 2 b blieb zusammen, auch wenn alle intermolekularen Wasserstoffbrückenbindungen in Abwesenheit von überbrückenden Wassermolekülen nicht aufgebaut werden konnten (Abbildung S14). Eine weitere Simulation wurde bei 400 K durchgeführt, nachdem alle drei OH-Gruppen und die drei Wassermoleküle von einer der beiden intermolekularen wasserstoffgebundenen Grenzflächen von (2 b)2 ⋅ (H2O)6 entfernt worden waren. Nach der Freisetzung der Wassermoleküle von der anderen Grenzfläche während des MD-Laufs wurde beobachtet, dass sich das Dimer wie ein Klappmesser öffnete, wobei sich der Winkel zwischen den beiden Molekülen von 2 b schließlich wieder auf 54° einstellte (Abbildung S15), was die Rolle eines Scharniers der verschobenen intermolekularen Grenzfläche unterstützt – je nachdem, ob es sich um verbrückende Wassermoleküle handelt oder nicht (Abbildung S15).
Es wurden Kristalle von 2 b erhalten, die jedoch für eine kristallografische Strukturaufklärung nicht ausreichend Beugung zeigten, sodass wir uns auf NMR und CD stützten, um die Struktur seiner Aggregate in Lösung zu beurteilen. Die CD-Spektren von 2 b zeigten eine relativ schwache Intensität und geringe Temperaturabhängigkeit (Abbildungen S16 und S17), was mit der durch T2 vermittelten Umkehrung der Händigkeit der Helix, wodurch sich die Beiträge der beiden Helices weitgehend aufheben, übereinstimmt. Die charakteristischen 1H- und 15N NMR -chemischen Verschiebungswerte der Diacylhydrazingruppe von T2 (9.0–10.0 ppm für 1H, 125–130 ppm für 15N) deuten darauf hin, dass sie die flache anti-Konformation von 1 sowohl in den kleinen als auch in den großen Aggregaten annimmt (Abbildungen S7, S8). Im Vergleich dazu wurden Resonanzen bei 8.0–8.5 ppm für 1H und 110–120 ppm für 15N im gauche-Konformer der DSD gefunden.25 Ebenfalls im Einklang mit der anti-Konformation sind Korrelationen zwischen diesen beiden NH-Protonen in der 1H,1H-Corelation Spectroscopy (COSY) zu sehen, nicht aber in der 1H,1H Nuclear Overhauser Effect Spectroscopy (NOESY). Insgesamt deutet dies darauf hin, dass 2 b in seinen Aggregaten seine U-förmige Helix-Turn-Helix-Konformation annimmt. Die 1H,1H-NOESY-Spektren von 2 b ermöglichten die eindeutige Zuordnung aller Amid-NH-Signale in beiden Aggregaten (Abbildungen S19, S22) und bestätigten die Konformation von T2 (Abbildungen S23). Skalare Kopplungen zwischen NH-Protonen und benachbarten CH2-Protonen in Y und P ermöglichten dann die Zuordnung der letzteren als diastereomere Paare (Abbildungen S18, S21). NOESY-Spektren zeigten, dass die CH2-Protonenpaare an den Positionen 6, 12 und 17 jeweils mit einem OH-Proton in beiden Aggregaten korrelieren (Abbildung 3c, d). Die Abstände innerhalb der Helix-Turn-Helix-Motive deuten darauf hin, dass solche Korrelationen intramolekular nicht erreicht werden können. Sie sind jedoch vollständig mit der verschobenen intermolekularen Dimer-Grenzfläche vereinbar – unabhängig davon, ob ein Wassermolekül eingefügt wurde oder nicht (Abbildung 1d, e) – und unterstützen die in den Abbildungen 2 und 3 gezeigten Modelle nachdrücklich. In weiteren Experimenten wurde das Lösungsmittel variiert und dazu 3 b, das achirale Analogon von 2 b verwendet. Die 1H NMR -Spektren von 2 b in nassem und getrocknetem CD2Cl2 zeigten eine Spezies. Bei Verwendung von Lösungsmittelgemischen erwiesen sich diese Spezies als dieselben, wie die in nassem, bzw. getrocknetem CDCl3 beobachteten Spezies (Abbildungen S24 und S25). Dies war zum Teil überraschend, weil die Art des chlorierten Lösungsmittels die verschobene Dimerisierung grundsätzlich verändert. CD2Cl2 kann ein verschobenes Dimer, anstelle der P-Helix/M-Helix die in CDCl3 bevorzugt wird und für das Design von (2 b)3 verwendet wurde, zwischen Helices mit der gleichen Händigkeit begünstigen (Abbildung S3).19 Das Fehlen von Störung der quaternären Strukturen in CD2Cl2, könnte auf ihre inhärente Stabilität und auf die Tatsache zurückzuführen sein, dass die Wirkung von CD2Cl2 an verschobenen Grenzflächen mit weniger Wasserstoffbrückenbindungen, wie in 2 b schwächer ist.19 Fortan – in Übereinstimmung mit früheren Experimenten derselben Art21, 25 – führte die schrittweise Zugabe von DMSO-d6, einem Lösungsmittel, welches mit Wasserstoffbrückenbindung konkurriert, zu einer Lösung von 2 b in CDCl3 zum sukzessiven Auftreten neuer Spezies, die der monomeren tertiären Faltung von 2 b (bei 4–12 Vol.-% DMSO-d6) und dann dem gestörtem (d. h. teilweise ungefalteten) monomeren 2 b (bei 20–36 Vol.-% DMSO-d6) zugeordnet werden konnten (Abbildung S26).
Schlussendlich ist das 1H NMR -Spektrum von 3 b in feuchtem CDCl3 dem von 2 b sehr ähnlich, was auf die Bildung eines einzigen Aggregats hinweist und nahelegt, dass die PM- und MP-Konformationsenantiomere von 3 b eine narzisstische Selbstsortierung in (PM-3 b)2 ⋅ (H2O)n und (MP-3 b)2 ⋅ (H2O)n (Abbildungen S27, S28). Im Gegensatz dazu ist das Spektrum von 3 b in getrocknetem CDCl3 und CD2Cl2 so breit, dass keine Signale voneinander abgegrenzt werden können (Abbildungen S29, S30), was auf eine Art von Polymerisation schließen lässt. Bei fehlender Selbstsortierung kann es zu einer verschobenen Dimerisierung zwischen jeder Art von P-Helix (entweder aus dem PM- oder dem MP-Konformer) und jedem Typus von M-Helix kommen, was zu mehreren Aggregaten führt (Abbildung S31). Die Polymerisation erfolgt auch in feuchtem CDCl3 beim Erhitzen (Abbildung S32). Zusammenfassend lässt sich sagen, dass wir die Aggregation der tertiären Helix-Turn-Helix-Faltung von 1 durch Hinzufügen von Wasserstoffbrückenbindungs-Donoren an konkreten Stellen der Peripherie und ohne Anzeichen einer Störung der Konformation, die es als Monomer annimmt, befördert haben. Die Strukturen der resultierenden wohldefinierten dimeren und trimeren quaternären Strukturen werden durch CD- und NMR-Daten, sowie Molecular Modeling stark unterstützt. Ihre Anteile können durch Variation der Temperatur oder der Wassermenge in CDCl3 quantitativ gesteuert werden. Weiterführende Arbeiten, die darauf abzielen, die Bildung von Dimeren zu verhindern, V-förmige heteromere Dimere (Trimere, bei denen eine Einheit fehlt) zu fördern, die Anzahl der an den intermolekularen Kontakten beteiligten Wasserstoffbrückenbindungen zu erhöhen und den großen Hohlraum des Trimers auszunutzen, sind in Arbeit und werden zu gegebener Zeit berichtet.
Unterstützende Informationen
Die Autoren haben zusätzliche Referenzen in den unterstützenden Informationen angegeben.32-34
Danksagung
Wir bedanken uns für die finanzielle Unterstützung durch den China Scholarship Council (CSC, Stipendium für S. W.) und danken Victor Maurizot und Alexandru Grozavu für zweckdienliche Diskussionen. Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Interessenkonflikt
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.
Open Research
Data Availability Statement
Die Daten, die die Ergebnisse dieser Studie unterstützen, sind auf begründete Anfrage beim Autor erhältlich.




