Fluorierte Dialkyl Chloronium Salze: Synthese und Reaktivität für CH2CF3-Übertragungs- und Hydridabstraktions-Reaktionen
Abstract
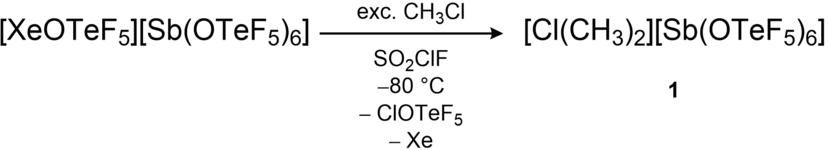
Es wird ein neuer Ansatz für die Synthese von Dialkylchloronium-Kationen [R−Cl−R]+ beschrieben (R=CH3, CH2CF3), der die Herstellung von fluorierten Derivaten ermöglicht. Unter Verwendung des Xenonium-Salzes [XeOTeF5][M(OTeF5)n] (M=Sb, n=6; M=Al, n=4) werden Chloratome von Chloralkanen oder dem deaktivierten Chlorfluoralkan CH2ClCF3 oxidiert und als ClOTeF5 abgespalten, wodurch die Isolierung des entsprechenden Chloronium-Salzes möglich ist. Da das resultierende stark elektrophile Kation [Cl(CH2CF3)2]+ in der Lage ist, schwache Nukleophile zu alkylieren, kann diese Verbindung für die Einführung einer fluorierten Alkylgruppe verwendet werden. Darüber hinaus weist das fluorierte Alkylchloronium-Kation eine hohe Hydrid-Ionen-Affinität auf, sodass lineare Kohlenwasserstoffe auch bei niedrigen Temperaturen durch Hydridabstraktion aktiviert werden und so verzweigte Carbokationen bilden.
Einleitung
Dialkylchloronium-Salze können durch die Reaktion eines Überschusses an Chloralkanen mit starken Lewis-Säuren wie SbF51 oder Brønsted-Supersäuren wie der Carboransäure H[CHB11Cl11]2 oder der Teflat-basierten Säure H[Al(OTeF5)4]3 synthetisiert werden. Bisher wurden jedoch nur einfache Vertreter der Alkylchloronium-Kationen, wie das Dimethyl- oder Diethyl-Derivat, im Festkörper strukturell charakterisiert.2, 3 Im Allgemeinen ist die Vielfalt der Alkylsubstituenten in Dialkylchloronium-Salzen in ihrer Komplexität begrenzt. In der Literatur finden sich nur zwei halogenierte Beispiele, das symmetrische [Cl(CH2Cl)2]+- und das asymmetrische [Cl(CH3)(CH2Cl)]+-Kation.4 Aufgrund der hohen Elektrophilie und ihres Potenzials, als starke Alkylierungs- oder Arylierungsreagenzien eingesetzt zu werden,3, 5, 6 waren wir an der Synthese fluorierter Alkylchloronium-Verbindungen interessiert, um Fluoralkylgruppen elektrophil auch auf schwache Nukleophile zu übertragen.
Ergebnisse und Diskussion
Die Reaktion erfolgt durch das Kondensieren eines Überschusses an CH3Cl bei −196 °C auf die gelbe Lösung von frisch hergestelltem [Xe(OTeF5)][Sb(OTeF5)6] in SO2ClF. Beim Erwärmen der Mischung auf −80 °C kommt es zur Gasentwicklung durch die Bildung von Xenon und innerhalb von Minuten zur Entfärbung der Lösung. Nach Abschluss der Reaktion werden alle flüchtigen Bestandteile im Vakuum entfernt. Das Chloronium-Salz 1 wird in quantitativer Ausbeute als farbloses kristallines Pulver erhalten. Die chemische Verschiebung von 1 in den 1H- und 13C{1H} NMR-Spektren (δ(1H)=4,68 ppm; δ(13C{1H})=50,9 ppm; 1JC−H=162,1 Hz) sind im Vergleich zum Edukt CH3Cl (δ(1H)=3,46 ppm; δ(13C{1H})=24,6 ppm) in das Tieffeld verschoben. Die Schwingungsbanden im IR-Spektrum von 1, die dem Kation zugeordnet wurden, stimmen mit den zuvor berichteten Spektren des Dimethylchloronium-Salzes [Cl(CH3)2][Al(OTeF5)4] überein.3 Durch das Überschichten einer Lösung von 1 in SO2ClF bei −10 °C mit n-Pentan und anschließendes Abkühlen auf −80 °C, war es möglich, für die Röntgenbeugung geeignete Einkristalle zu erhalten. Die Verbindung kristallisiert in der triklinen Raumgruppe mit einer Fehlordnung des Kations, wodurch eine genaue Analyse der Bindungslängen und -winkel nicht möglich ist (SI Abbildung S36). Angelehnt an die erfolgreiche Synthese des Dimethylchloronium-Salzes 1 wurde versucht, fluorierte Derivate dieser Verbindung auf analoge Weise zu erhalten. Die Reaktion von [Xe(OTeF5)][Sb(OTeF5)6] mit einem Überschuss an CH2ClF oder CHClF2 führte jedoch nicht zu den gewünschten Chloronium-Kationen [Cl(CH2F)2]+ und [Cl(CHF2)2]+, sondern zur Zersetzung des Anions. Die quantenchemische Betrachtung der Chloronium-Ionen zeigt, dass die Anwesenheit von Fluoratomen in α-Position relativ zum Chloratom die C−Cl-Bindung des Kations drastisch destabilisiert. Die π-Donor-Eigenschaft der α-F-Atome führt zur Übertragung von Elektronendichte der freien Elektronenpaaren des Fluoratoms in das σ*C−Cl-Orbital, wodurch die C−Cl-Bindung geschwächt wird. Die Donor-Eigenschaft der freien Elektronenpaare (pF) des Fluoratoms führt zu einer Erhöhung der Elektronenpopulation von 0,118 im antibindenden σ*C−Cl-Orbital des Bis(fluormethyl)chloronium-Kations [Cl(CH2F)2]+ und zu einer weiteren Erhöhung auf 0,232 im Fall des antibindenden σ*C−Cl-Orbital des Bis(difluormethyl)chloronium-Kations [Cl(CHF2)2]+. Die resultierenden Carbokationen [CH2F]+ und [CHF2]+, welche sich durch den Bruch der C−Cl-Bindung bilden, werden durch die α-Fluoratome aufgrund der Übertragung von Elektronendichte von den freien Elektronenpaaren (pF) in das leere pz-Orbital am Kohlenstoff stabilisiert.10 Das [Sb(OTeF5)6]−-Anion ist jedoch nicht in der Lage diese hochreaktiven fluorierten Carbokationen zu stabilisieren, sodass die beobachtete Zersetzung erfolgt.
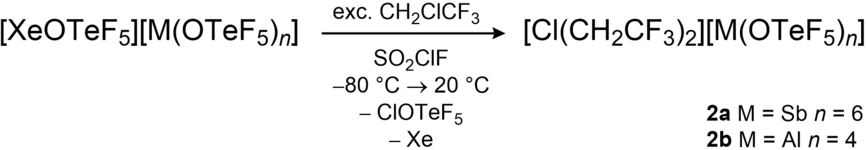
Die 1H- und 13C{1H,19F} NMR-Spektren von 2 a (δ(1H)=5,87 ppm; δ(13C{1H,19F})=63,8 ppm, 119,7 ppm; 1JC−H=167,7 Hz) zeigen die erwartete Tieffeldverschiebung der Signale der Methylengruppe im Vergleich zu CH2ClCF3 (δ(1H)=4,06 ppm; δ(13C{1H})=40,0 ppm, 123,4 ppm). Des Weiteren ist im 1H,13C-HMBC-Spektrum ein Kreuzsignal zu beobachten, welches durch die 3JC-H-Kopplung zwischen den vom Chloratom getrennten Methylengruppen hervorgerufen wird. Das 19F NMR-Spektrum zeigt das charakteristische Signal des kollabierten AB4-Spinsystems der OTeF5-Gruppen im Antimonat-Anion (42,0 ppm), welches ausführlich in der Literatur beschrieben ist11 sowie das Signal der CF3-Gruppen im [Cl(CH2CF3)2]+-Kation (−67,5 ppm; 1JC-F=117,7 Hz). Das Aluminat-basierte Chloronium-Salz [Cl(CH2CF3)2][Al(OTeF5)4] 2 b wurde in ähnlicher Weise wie 2 a durch Verwendung des kürzlich publizierten Xenonium-Salzes [Xe(OTeF5)][Al(OTeF5)4]12 [Gl. (2)] hergestellt.
Das Erhalten von Einkristallen der fluorierten Alkylchloronium-Salze erwies sich als schwierig, da die Lösungsmittelwahl aufgrund ihrer außergewöhnlich hohen Reaktivität sehr begrenzt ist. Es hat sich gezeigt, dass die Salze 2 a und 2 b nur in SO2ClF ohne Anzeichen einer Zersetzung löslich sind.
Für die Röntgenbeugung geeignete Einkristalle konnten durch das Kondensieren von Isobutan bei −196 °C auf eine gefrorene Lösung von 2 a in SO2ClF und anschließendes Lagern der noch gefrorenen Lösung bei −80 °C erhalten werden. Die Verbindung 2 a kristallisiert in der triklinen Raumgruppe (Abbildung 1). Das Anion, das in der Literatur bereits ausführlich beschrieben wurde,11, 13 besteht aus einem Antimonzentrum, welches nahezu oktaedrisch von sechs OTeF5-Einheiten koordiniert ist. Im Kation ist das Chloratom an zwei CH2CF3-Gruppen gebunden. Die CF3-Gruppen zeigen in entgegengesetzte Richtungen mit einem Torsionswinkel C3−C1−C2−C4 von 150,81(8)°. Der C1−Cl1−C2-Bindungswinkel mit 104,5(4)° und die C−Cl-Bindungslängen mit 181,7(9) pm und 180,3(10) pm im [Cl(CH2CF3)2]+-Kation sind etwas kleiner als die im [Cl(CH2CH3)2]+-Kation (105,6(2)°, 184,0(4) pm und 184,1(6) pm).2
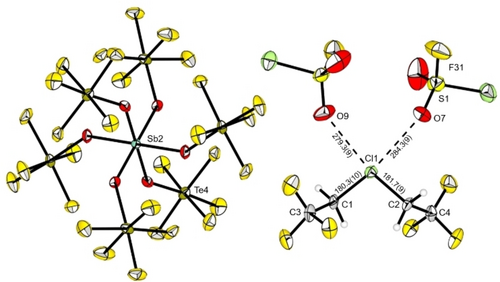
Molekülstruktur im Festkörper des Chloronium-Salzes 2 a. Ein drittes co-kristallisiertes Lösungsmittelmolekül SO2ClF ist aus Gründen der Übersichtlichkeit nicht abgebildet. Schwingungsellipsoide sind für eine Aufenthaltswahrscheinlichkeit von 50 % gezeigt. Ausgewählte Bindungslängen [pm] und -winkel [°]: C1−C3 150,3(14), C2−C4 151,2(13), C1-Cl1-C2 104,5(4), O7-Cl1-O9 61,368(267). Kristallographische Details sind in den Hintergrundinformationen aufgeführt.
Interessanterweise koordinieren zwei Moleküle des schwach basischen Lösungsmittels SO2ClF an das Cl1-Atom (Cl1−O7 284,3(9) pm, Cl1−O9 279,3(9) pm), sodass auf eine hohe Lewis-Acidität an diesem Atom geschlossen werden kann. Im Allgemeinen existieren nur wenige Beispiele in der Literatur in denen SO2ClF als Donor agiert.9, 14-16 Quantenchemische Berechnungen des Chloronium-Kations [Cl(CH2CF3)2]+ in der Gasphase zeigen tatsächlich eine hohe positive NAO-Ladung von 0,523 am Chloratom in der optimierten Struktur. Die Visualisierung des elektrostatischen Potentials zeigt zwei σ-Löcher am Cl1-Atom (Abbildung 2), die mit den Sauerstoffatomen an den SO2ClF-Molekülen wechselwirken können. Aufgrund der hohen Richtungsabhängigkeit von Halogenbindungen17 ist das Cl1-Atom von C1, C2, O7 und O9 nahezu planar umgeben. Eine vergleichbare planare Koordination an einem Cl-Atom wurde bereits für das Difluorchloronium-Kation [ClF2]+ berichtet, das mit den Fluoratomen des Gegenions im festen Zustand wechselwirkt. Als Ergebnis beobachtet man entweder die Bildung von Dimeren wie in [ClF2][BF4] und [ClF2][AuF4] oder eine kettenartige Anordnungen wie in [ClF2][MF6] (M=Nb, Ta, Ru, Os, Ir, Sb, Bi).18
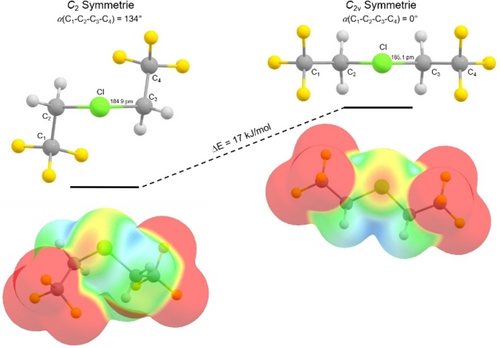
Elektrostatisches Potenzial der optimierten Strukturen von [Cl(CH2CF3)2]+ in C2 (links) und C2v (rechts) Symmetrie in der Gasphase im Bereich von 0,19 a.u. (rot) bis 0,27 a.u. (blau), abgebildet auf der Elektronendichte mit einem Isoflächenwert von 0,003 a.u. (B3LYP/def2-TZVPP).
Das extrem schwach koordinierende [Sb(OTeF5)6]−-Anion in 2 a zeigt keine Wechselwirkungen mit dem [Cl(CH2CF3)2]+-Kation, wodurch die Koordination der SO2ClF-Moleküle an das Chloratom ermöglicht wird. Das gleiche Phänomen wurde auch in der Molekülstruktur von [Xe(OTeF5)(SO2ClF)][Sb(OTeF5)6] beobachtet, wobei ein SO2ClF-Molekül an das Xenonium-Kation mit einem kurzen Xe−OLösungsmittel-Kontakt von 247,9(4) pm14 bzw. 242,6(4) pm15 koordiniert ist. Auch hier wird keine Wechselwirkung zwischen dem Kation und dem Anion beobachtet. Wenn das sterisch anspruchsvolle [Sb(OTeF5)6]−-Anion aber gegen das kleinere [AsF6]−-Anion ausgetauscht wird, führen starke Anion-Kation-Wechselwirkungen zu einem FAnion−Xe-Kontakt von 224(3) pm im [XeOTeF5][AsF6]-Salz.19 Das Entfernen aller flüchtigen Bestandteile im dynamischem Vakuum führt hingegen zur Isolierung der SO2ClF-freien Chloronium-Salzen 2 a und 2 b, welches durch IR-Spektroskopie bestätigt wurde (SI Abbildung S32).
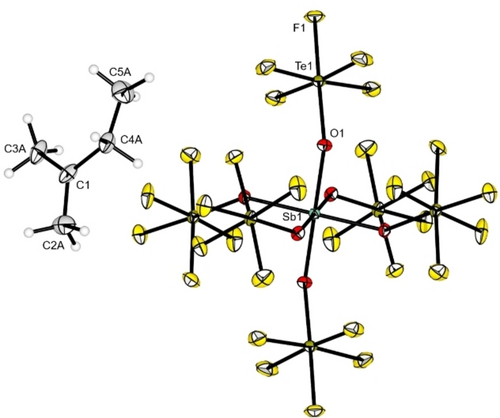
Molekülstruktur im Festkörper des Isopentyl-Salzes 3 b. Schwingungsellipsoide sind für eine Aufenthaltswahrscheinlichkeit von 50 % gezeigt. Ausgewählte Bindungslängen [pm] und -winkel [°]: C1−C2A 143,0(5), C1−C3A 142,9(4), C1−C4A 148,3(4), C4A−C5A 153,1(11), C2A−C1−C3A 122,4(3), C3A−C1−C4A 119,8(3), C2A−C1−C4A 117,8(3). Kristallographische Details sind in den Hintergrundinformationen aufgeführt.
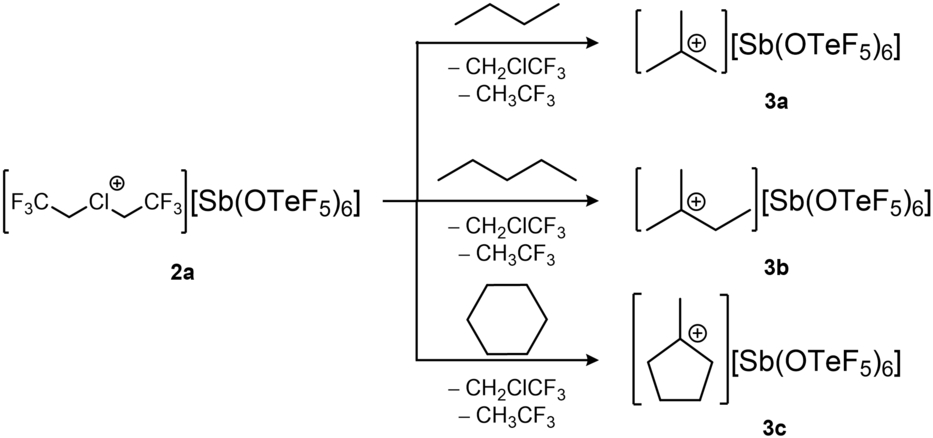
Da tertiäre Carbokationen eine höhere thermodynamische Stabilität aufweisen als primäre oder sekundäre, erhält man nach der Aktivierung von n-Pentan das verzweigte tertiäre Isopentyl-Kation, da in Carbokationen leicht Wasserstoff- oder Methyl-1,2-Umlagerungen auftreten können.21 Die ausschließliche Bildung der verzweigten Carbokationen aus linearen Alkanen wurde mittels NMR-Spektroskopie bestätigt. Zur Herstellung von NMR-Proben wurde 2 a in n-Butan, n-Pentan oder einer Mischung aus Cyclohexan und Isobutan (1 : 1) suspendiert und mehrere Tage bei −20 °C gerührt. Das 19F NMR-Spektrum der Alkan-Lösungen zeigt die erwartete Bildung der Nebenprodukte CH3CF3 und CH2ClCF3 (SI Abbildung S17). Das Entfernen aller flüchtigen Bestandteile aus den Reaktionsgemischen unter Vakuum führte in allen Fällen zu einem farblosen Feststoff. Die 1H NMR-Spektren der Produkte zeigen die Bildung des tert-Butyl-Kations 3 a (SI Abbildung S14), des Isopentyl-Kations 3 b (SI Abbildung S15) bzw. des Methylcyclopentyl-Kations 3 c (SI Abbildung S16). Interessanterweise reagiert Isobutan unter denselben Bedingungen nicht mit 2 a. Dies lässt den Schluss zu, dass das Chloronium-Kation nicht in der Lage ist, ein Hydridion von den CH3-Gruppen des Isobutans zu abstrahieren, um das intermediäre primäre Carbokation zu bilden, während das H-Atom am tertiären Kohlenstoffatom möglicherweise sterisch zu stark von den CH3-Gruppen abgeschirmt ist, um angegriffen zu werden.
Eine ähnliche Beobachtung der selektiven Bildung von verzweigten Carbokationen aus Alkanen wurde von Reed et al. gemacht, wobei das hoch elektrophile “CH3+”-Reagenz CH3(CHB11Me5Br6) zum Abstrahieren eines Hydridions verwendet wurde.24 Im Gegensatz zum fluorierten [Cl(CH2CF3)2]+-Kation und dem “CH3+”-Reagenz zeigt das nicht fluorierte Chloronium-Kation [Cl(CH3)2]+ keine Reaktivität gegenüber Alkanen. Zum Vergleich sind die berechneten Hydrid-Ionen-Affinitäten (HIA) und Fluorid-Ionen-Affinitäten (FIA) ausgewählter Kationen in Tabelle 1 dargestellt (für weitere Details zu den Berechnungen siehe SI). Zu beachten ist, dass die Hydrid- oder Fluoridabstraktion zur Zersetzung des Kations durch Bildung der entsprechenden neutralen Moleküle führt. Der hohe HIA-Wert des fluorierten Chloronium-Kations [Cl(CH2CF3)2]+ mit 1130 kJ/mol übertrifft die der nicht fluorierten Chloronium-Kationen um mehr als 100 kJ/mol und den des Trityl-Kations [C(C6H5)3]+, das üblicherweise zum Abstrahieren von Hydridionen verwendet wird, um mehr als 300 kJ/mol.
Verbindung |
HIA [kJ/mol] |
FIA [kJ/mol] |
|---|---|---|
[Cl(CH2CF3)2]+a |
1130 |
907 |
[Cl(CH2CH3)2]+a |
986 |
794 |
[Cl(CH3)2]+a |
1048 |
828 |
[CH3]+ |
1327 |
1107 |
[I(CH2CF3)2]+a |
1074 |
851 |
[C(C6H5)3]+ |
80123 |
599[23] |
[C(C6F5)3]+ |
955[23] |
69723 |
- a) Die HIA- und FIA-Werte für die Chloronium-Kationen werden anhand der negativen Reaktionsenthalpie für die Reaktion [X(R)2]++YSi(CH3)3→RX+RY+[Si(CH3)3]+, berechnet, wobei Me3SiH bzw. Me3SiF als Ankerpunkte verwendet werden.
Die chemischen Verschiebungen des Pyridinium-Kations im 19F NMR-Spektrum (Fo=−94,1 ppm, Fm=−151,1 ppm, Fp=−99,1 ppm) sind im Vergleich zu denen des Edukts C5F5N (Fo=−88,2 ppm, Fm=−162,2 ppm, Fp=−134,8 ppm) verschoben, wie es bereits für das methylierte Pentafluorpyridinium-Kation berichtet wurde.5
Das Signal der CF3-Gruppe (−71,0 ppm) zeigt die Kopplung zur Methylengruppe (3JF−H=7,0 Hz) und die Fernkopplung zu den ortho-Fluoratomen des Pyridin-Rings (5JF−F=9,6 Hz), wodurch eine Aufspaltung in ein Triplett von Tripletts beobachtet wird. Das Anion zeigt das erwartete kollabierte AB4-Muster bei −42,2 ppm.
Durch das Überschichten einer Lösung des Pyridinium-Salzes 4 in SO2ClF bei −10 °C mit n-Pentan und anschließendes Abkühlen auf −80 °C war es möglich, Einkristalle zu erhalten, die für die Röntgenbeugung geeignet sind. Die Verbindung kristallisiert in der triklinen Raumgruppe (Abbildung 4). Das Kation ist fehlgeordnet, sodass eine genaue Analyse der Bindungslängen und -winkel nicht möglich ist. Es kann jedoch beobachtet werden, dass die CF3-Gruppe fast senkrecht zur Ringebene steht (Torsionswinkel: C5A−N1A−C6−C7=90,6(18)°, C5B−N1B−C6−C7=92,6(20)°.
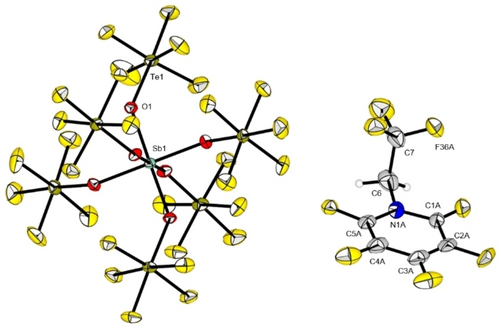
Molekülstruktur im Festkörper des Pyridinium-Salzes 4. Schwingungsellipsoide sind für eine Aufenthaltswahrscheinlichkeit von 50 % gezeigt. Ausgewählte Bindungslängen [pm] und -winkel [°]: C1A−C2A 137,0(13), C2A−C3A 135,9(14), C3A−C4A 138,9(13), C4A−C5A 134,5(10), N1A−C1A 134,9(9), N1A−C5A 134,1(10), N1A−C6 145,1(10), C6−C7 149,9(6), C1A−N1A−C5A 123,7(9), N1A−C6−C7 105,3(16). Kristallographische Details sind in den Hintergrundinformationen aufgeführt.
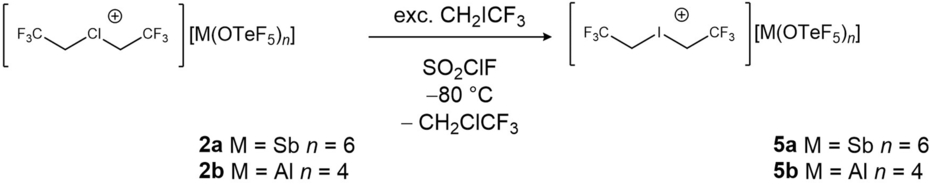
Die Iodonium-Salze sind in DCM bei 20 °C ohne Anzeichen von Zersetzung löslich. Die reinen Salze können bei Raumtemperatur unter inerten Bedingungen für unbestimmte Zeit gelagert werden. Durch das Überschichten einer Lösung von 5 a in DCM mit n-Pentan und anschließendes Abkühlen auf −80 °C war es möglich, Einkristalle zu erhalten, die für die Röntgenbeugung geeignet sind (Abbildung 5). Eine ausführliche Diskussion der NMR-Daten, der Molekülstruktur im Festkörper und der Reaktivität von 5 a und 5 b befindet sich in den Hintergrundinformationen.
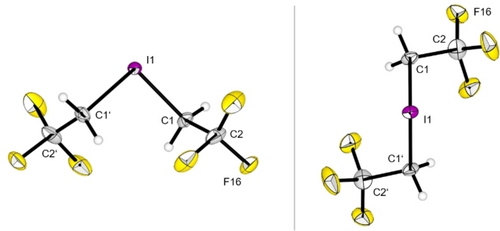
Molekülstruktur im Festkörper des Iodonium-Salzes 5 a. Schwingungsellipsoide sind für eine Aufenthaltswahrscheinlichkeit von 50 % gezeigt. Das Anion ist aus Gründen der Übersichtlichkeit nicht abgebildet. Das Kation ist aus zwei verschiedenen Perspektiven abgebildet, um die räumliche Ausrichtung der CF3-Gruppen zu verdeutlichen. Ausgewählte Bindungslängen [pm] und -winkel [°]: I1−C1 213,5(3), C1−C2 149,4(4), C1−I1−C1′ 98,78(16), I1−C1−C2 111,0(2), C2−C1−C1′−C2′ 139,3(4). Kristallographische Details sind in den Hintergrundinformationen aufgeführt.
Zusammenfassung
Zusammenfassend berichten wir über einen konzeptionell neuen Weg zur Synthese von Alkylchloronium-Salzen durch Oxidation des Chlorid-Substituenten von Chloralkanen und Chlorfluoralkanen. Dieser Ansatz ermöglicht die quantitative Synthese und Charakterisierung der ersten fluorierten Alkylchloronium-Salze 2 a und 2 b. Die hohe Elektrophilie dieser Salze wurde durch die Aktivierung von linearen Alkanen durch Hydridabstraktion verdeutlicht, da sich so die verzweigten Carbokationen 3 a, 3 b und 3 c bildeten. Die Alkylierung der schwach nukleophilen Stickstoffbase C5F5N und des Iodfluoralkans CH2ICF3 mit Hilfe der Alkylchloronium-Salze 2 a und 2 b führte zur Isolierung und Charakterisierung des Pyridinium-Salzes 4 und der fluorierten Alkyliodonium-Salze 5 a und 5 b.
Hintergrundinformationen
Die Autoren haben weitere Quellen in den Hintergrundinformationen angegeben.25-34, 35-40
Danksagung
Gefördert durch die Deutsche Forschungsgemeinschaft (DFG) Projekt-ID 387284271 – SFB 1349 und des European Research Council (ERC) Projekt HighPotOx (ID: 818862). Rechenzeit wurde vom Hochleistungsrechenzentrum am FUB-IT der Freien Universität Berlin zur Verfügung gestellt. Außerdem möchten wir uns für die Unterstützung durch die von der DFG geförderte Core Facility BioSupraMol bedanken. Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Interessenkonflikt
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.
Open Research
Data Availability Statement
Die Daten, die die Ergebnisse dieser Studie unterstützen, sind auf begründete Anfrage beim Autor erhältlich.