Gasdiffusionselektroden für die Elektrokatalytische Oxidation von Gasförmigem Ammoniak: Das Überqueren des Thermodynamischen Tals der Stickstoffdreifachbindung
Abstract
Da Ammoniak als vielversprechender Wasserstoffträger immer mehr an Interesse gewinnt, wird auch die elektrochemische Ammoniak-Oxidationsreaktion (AmOR) immer interessanter. Um die Freisetzung von H2 in einer umgekehrten Haber–Bosch-Reaktion unter Bildung des energetisch günstigeren N2 zu vermeiden, schlagen wir die Oxidation von Ammoniak zu Nitrit (NO2−) vor, das üblicherweise während des Ostwald-Prozesses gewonnen wird. Wir untersuchten die anodische Oxidation von gasförmigem Ammoniak, der direkt einer Gasdiffusionselektrode (GDE) zugeführt wird, unter Verwendung verschiedener, in ihrer Zusammensetzung unterschiedlicher Multimetallkatalysatoren, die auf Ni-Schaum abgeschieden sind, bei gleichzeitiger Bildung von H2 an der Kathode. Dadurch wird die H2-Menge pro Ammoniakmolekül verdoppelt, während gleichzeitig ein niedrigeres Überpotential als bei der Wasserelektrolyse (1,4–1,8 V gegen RHE bei 50 mA cm−2) angelegt wird. Eine Selektivitätsstudie zeigte, dass einige der Katalysatorzusammensetzungen in der Lage waren, erhebliche Mengen an NO2− zu produzieren. Weitere Untersuchungen mit dem vielversprechendsten Katalysator Nif_AlCoCrCuFe, der in eine GDE integriert ist, zeigten eine Faraday-Effizienz von bis zu 88 % für NO2− an der Anode, gekoppelt mit einer Faraday-Effizienz von nahezu 100 % für die kathodische H2-Produktion.
Einleitung
Ammoniak ist eine chemische Verbindung, die für viele chemische und industrielle Prozesse verwendet wird und für die Herstellung von Düngemitteln von entscheidender Bedeutung ist.1 In den letzten Jahren wurde jedoch zunehmend mehr Aufmerksamkeit auf Ammoniak als vielversprechende Verbindung für die Energiespeicherung im Bereich der H2-Wirtschaft gerichtet. Ammoniak wird nach dem Haber–Bosch-Verfahren hergestellt, das aufgrund seiner hohen Betriebstemperatur und seines hohen Drucks den Nachteil hoher Treibhausgasemissionen und eines hohen Energiebedarfs aufweist.2 Darüber hinaus wird der für die Herstellung von NH3 im Haber–Bosch-Verfahren benötigte H2 aus fossilen Brennstoffen durch Methandampfreformierung gewonnen. Daher könnten die Umweltauswirkungen der NH3-Produktion durch den Einsatz von H2-Gas, das durch Wasserelektrolyse erzeugt wird, erheblich gemindert werden.3 NH3, das zu 17,8 Gew.–% aus Wasserstoff besteht, kann durch Kompression bei Raumtemperatur oder relativ niedrigen Temperaturen (−33 °C) im Vergleich zu H2-Gas (−253 °C) leicht verflüssigt werden und gilt als sicherer für Lagerung und Transport. Flüssiges NH3 weist im Vergleich zu flüssigem H2 oder komprimiertem H2-Gas auch eine deutlich höhere volumetrische Energiedichte auf, wobei die genauen Werte je nach Lagerbedingungen leicht variieren.4
Vielversprechende NH3-Nutzungstechnologien sind z. B., die direkte NH3-Brennstoffzelle (DAFC), wie die Niedertemperatur-DAFC oder die Hochtemperatur-DAFC, die auch als Festoxid-Brennstoffzellen (SOFC) bezeichnet werden.5 Allerdings schränken der niedrige Wirkungsgrad bei Niedertemperaturbetrieb oder der träge Start/Stopp aufgrund des Vorheizens und der Anforderungen an den Hochtemperaturbetrieb bei SOFC ihre Anwendung ein.6 Als vielversprechende Alternative zu DAFCs findet die elektrokatalytische Oxidation von NH3 in Elektrolyseuren immer mehr Beachtung als mögliche Niedertemperatur- und damit kosteneffiziente Methode zur NH3-Konvertierung. Die Ammoniak-Oxidationsreaktion (AmOR) kann als alternative Anodenreaktion betrachtet werden, da das thermodynamisch erforderliche Potenzial für die Wasserspaltung 1,23 V gegen RHE beträgt, während es für die Elektrooxidation von NH3 zu N2 nur 0,06 V beträgt.7 Aufgrund der Komplexität der AmOR werden hochaktive und selektive Elektrokatalysatoren benötigt. Die meisten AmOR-Arbeiten untersuchen alkalische Prozesse unter Bildung von N2.8 Zwei Hauptmechanismen für die AmOR wurden untersucht und diskutiert: der Oswin-Salomon-Mechanismus und der Gerischer-Mauerer-Mechanismus.9 Nach dem Oswin-Salomon-Mechanismus erfolgt die Reaktion durch eine vollständige schrittweise Dehydrierung des Stickstoffatoms und die Bildung von N2 durch zwei Nad-Spezies, während nach dem Gerischer-Mauerer-Weg auch teilweise dehydrierte Spezies an der N2-Bildung beteiligt sind. Beide AmOR-Mechanismen wurden vor allem unter Verwendung von Edelmetallelektrokatalysatoren, insbesondere Pt, untersucht, wobei der Schwerpunkt auf der Produktion von N2 lag, dem erwarteten und energetisch günstigsten Produkt.10 Anders als bei der DAFC wäre jedoch die Produktion von Nitrit (NO2−) und Nitrat (NO3−) während der AmOR in einem Elektrolyseuraufbau vorzuziehen, um nicht nur das wertvolle H2 zu erhalten, sondern auch höherwertige Produkte zu erzeugen. Dies würde teilweise eine Alternative zum energieaufwendigen und NOx-emittierenden Ostwald-Prozess darstellen, bei dem HNO3 durch sequentielle Oxidation von NH3 zu NO2− und NO3− erzeugt wird. Studien, die sich mit der Herstellung von NO2− und NO3− befassen, berichten jedoch von wesentlich komplizierteren Reaktionswegen, die auch die Bildung oxidierter Stickstoffspezies beinhalten und höhere Oxidationspotentiale erfordern, die in den Bereich der Sauerstoffentwicklungsreaktion (OER) vorstoßen.11, 12
Verschiedene Arbeiten, in denen AmOR zur Herstellung von NO2−/NO3− an Nichtedelmetallkatalysatoren erörtert wird, konzentrieren sich auf vergleichsweise einfache elektrochemische Zellen und Katalysatorsysteme, die häufig auf Co und/oder Cu basieren.13 Diese Elemente wurden ebenfalls umfassend untersucht14 und haben sich nach unserem bisherigen Kenntnisstand15 als hervorragende Kandidaten für die umgekehrte Reduktionsreaktion von NO3− zu NH3 erwiesen, wobei in einer Reihe von Studien die Bedeutung mehrerer aktiver Zentren hervorgehoben wurde. Dies deutet auf eine intrinsische Selektivität von Co und Cu bei der Umwandlung von NH3 zu NO3− hin. Elektroden auf der Basis von Ni-Schaum wurden für die elektrokatalytische AmOR als vielversprechendes Anodenmaterial beschrieben.16 Aufgrund des komplexen Bildungsweges von NO2−/NO3− könnten jedoch kompliziertere Multimetallkatalysatoren oder Hochentropie-Legierungen (HEA) mit einer Vielzahl von aktiven Zentren von Vorteil sein. HEAs, die als Legierungen beschrieben werden können, die aus mindestens fünf konstituierenden Hauptelementen in einem annähernd gleichwertigen Verhältnis von 5–35 % bestehen, sind eine Materialklasse, die auf dem Gebiet der Elektrokatalyse immer mehr an Popularität gewinnt.17 Sie zeigen vielversprechende Eigenschaften nicht nur bei grundlegenden elektrokatalytischen Reaktionen wie der OER,18 der Sauerstoffreduktionsreaktion (ORR)19 oder der Wasserstoffentwicklungsreaktion (HER),20 sondern auch bei hinsichtlich der Selektivität komplizierteren Reaktionen, z. B. bei der CO2-Reduktionsreaktion21 oder der Alkoholoxidationsreaktion.22 Liu et. al untersuchten auch Hochentropie-Spinelloxide für die AmOR und zeigten, dass die Aktivität und Selektivität bei Verwendung von MnFeCoNiCu3O4 im Vergleich zu CuO oder Co3O4 verbessert ist.[23]]
Gasdiffusionselektroden (GDE) werden häufig für Reaktionen eingesetzt, bei denen die Löslichkeit des Reaktionsgases begrenzt ist.24 Darüber hinaus können GDEs auch einen direkten Kontakt zwischen dem Reaktionsgas und dem katalytisch aktiven Material ermöglichen. Nach unserem Kenntnisstand wurde für eine Nicht-DAFC-Anwendung bisher nur über die elektrokatalytische Oxidation von gelöstem NH3 berichtet. Es könnte jedoch argumentiert werden, dass die direkte Oxidation von gasförmigem NH3, das als Wasserstoffträger erzeugt wird, den Prozess erheblich vereinfachen könnte, da keine wässrigen ammoniakhaltigen Elektrolytlösungen benötigt werden. Kurz gesagt (Abbildung 1) könnte NH3, das an einem geeigneten Standort mit einem auf grünem Wasserstoff basierenden Haber–Bosch-Verfahren erzeugt wird, zu einem modifizierten LNG-Terminal transportiert werden, wo das NH3 als Gas freigesetzt und entweder einer Pipeline oder GDE-basierten Elektrolyseursystemen zugeführt wird. Die Verwendung zusätzlicher grüner elektrischer Energie würde die gebildete H2-Menge bei einer niedrigeren Zellspannung als bei der Wasserspaltung verdoppeln, wobei gleichzeitig NO2− als Grundlage für Düngemittel gebildet würde. Um dieser Vision näher zu kommen, demonstrieren wir in dieser Studie ein Proof-of-Concept-System, in dem gasförmiges NH3 direkt an einer Gasdiffusionsanode in einem nicht-optimierten Modell-Durchflusselektrolyseur oxidiert wird. Dazu verwenden wir selbst hergestellte Gasdiffusionselektroden auf der Basis von Ni-Schaum mit großer Oberfläche, die mit Multimetall-Katalysatorzusammensetzungen beschichtet sind, und können zeigen, dass die Katalysatorzusammensetzung die AmOR-Selektivität bestimmt.
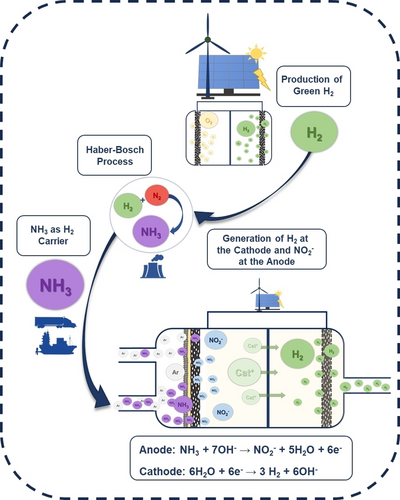
Konzeptionelles Schema der grünen Ammoniakverwertung in GDE-basierten Elektrolyseuren unter Bildung von NO2− und H2.
Ergebnisse und Diskussion
Die Oxidation von gasförmigem Ammoniak wurde mit Hilfe von GDEs in Modell-Durchflusselektrolyseursystemen untersucht. Abbildung 1 zeigt das konzeptionelle Prinzip des Elektrolyseurs, bei dem gasförmiges NH3, das für die grüne H2-Speicherung verwendet wird, auch zur Herstellung von höherwertigen Stoffen wie NO2− verwendet werden könnte.
Das Überspringen des thermodynamischen Tals der Bildung der N2-Dreifachbindung hin zur Produktion von NO2−/NO3− würde es ermöglichen, die energetisch und ökologisch anspruchsvollsten ersten Schritte des Ostwald-Prozesses zu ersetzen und gleichzeitig eine höhere Menge an H2 an der Kathode freizusetzen und in Summe zu erzeugen als bei der konventionellen Wasserelektrolyse. Die GDEs wurden nach einem zuvor beschriebenen Verfahren unter Verwendung einer Airbrush-Sprühbeschichtungsplattform hergestellt (Abbildung S1). Zunächst wurden Polyvinylpyrrolidon (PVP) und die gewünschte Zusammensetzung der Metallnitrat- oder Metallchloridpräkursorenlösung homogen auf ein erhitztes Ni-Schaumsubstrat gesprüht. Nach dem Verdampfen des Lösungsmittels ist der Ni-Schaum mit einer porösen Polymerschicht mit eingeschlossenen Metallpräkursoren bedeckt. Eine zweistufige Wärmebehandlung ermöglicht die Degradation des Polymers und die Entfernung der nichtmetallischen Metallsalzbestandteile und induziert die Legierung der Metallpartikel.25
Auf den modifizierten Ni-Schaum wurde ein PEEK-Netz gelegt und anschließend eine kohlenstoffhaltige PTFE-Suspension aufgesprüht.26 Der mit der Multimetallzusammensetzung modifizierte Ni-Schaum diente als Katalysatorschicht (CL) (Abbildung 2a) und das mit Kohlenstoff modifizierte PEEK-Netz und die PTFE-Suspension als hydrophobe Gasdiffusionsschicht (GDL) (Abbildung 2b). Das detaillierte Herstellungsverfahren ist in den Hintergrundinformationen beschrieben. Um einen ersten Hinweis auf möglicherweise vielversprechende Katalysatorzusammensetzungen zu erhalten, wurde ein Vorabscreening von 7 in ihrer Zusammensetzung unterschiedlichen, mit Multimetallkatalysatoren beschichteten GDEs durchgeführt. Aufgrund der Knappheit und des hohen Preises von Edelmetallen wurden nur unedle Metalle und das relativ billige Ag berücksichtigt. Das Screening erfolgte in einer Drei-Elektroden-Durchflusszelle (Abbildung S3), in der unmodifizierter Ni-Schaum als Gegenelektrode, eine Ag|AgCl|KCl (3 M) mit zwei getrennten Elektrolytkompartments mit 1 M KOH im äußeren Elektrolytkompartment als Referenzelektrode und die beschriebenen GDEs als Arbeitselektroden dienten. Als Elektrolyt wurde 1 M KOH verwendet, und die Kompartimente von Gegen- und Arbeitselektrode wurden durch eine Kationenaustauschermembran getrennt. Lineare Voltammogramme wurden unter zwei verschiedenen Bedingungen aufgezeichnet: (1) nur Ar-Gas, das der GDL der GDE zugeführt wurde, und (2) Ar- und NH3-Gemisch in einem Verhältnis von 1 : 1, das der GDL der GDE zugeführt wurde. In Abwesenheit von NH3-Gas kann bei steigenden angelegten Potentialen nur die OER initiiert werden (Abbildung S4a). In Anwesenheit von NH3 und unter Verwendung einer vielversprechenden Katalysatorzusammensetzung für AmOR in der GDE könnte es im Idealfall zu einer Potentialverschiebung hin zu niedrigeren Überpotentialen im Vergleich zur anspruchsvollen OER kommen. Darüber hinaus verringern niedrigere Potentialwerte während der AmOR auch die Konkurrenz mit der parasitären OER. Die vielversprechendsten Katalysatorzusammensetzungen Nif_AgCoCuNiZn (−324 mV) und Nif_AlCoCrFeNi (−90 mV) wurden durch den Vergleich der bei 30 mA cm−2 in Abwesenheit und Anwesenheit von NH3-Gas auftretenden Potentialverschiebung ermittelt (Abbildung 2c). Bei Nif_AgCoCuFeNi war in Gegenwart von NH3-Gas sogar ein höheres Potential (+9 mV) erforderlich. Nif CoCrFeMoNi (−9 mV), Nif_AgCeCoNiZn (−11 mV) und Nif CoCrMnMoNi (−12 mV) weisen ähnlich geringe negative Potentialverschiebungen auf, während eine zum Vergleich herangezogene unmodifizierte Ni-Schaum-GDE eine Potentialverschiebung von −27 mV zeigte, was auf eine mögliche Anwendbarkeit für AmOR hinweist (Abbildung 2d, Tabelle S1). Die Vorkonditionierung von Nif_AgCoCuNiZn in Abwesenheit von NH3 durch sequenzielle LSVs zeigte weniger signifikante Oxidationspeaks bei 1,22 V, 1,3 V und 1,55 V gegen RHE im Vergleich zu dem hohen Oxidationspeak bei etwa 1,2 V gegen RHE, der von einer oxidativen Katalysatorauflösung und/oder Oberflächenveränderungen nach Kontakt mit NH3 herrühren könnte (Abbildung 2c). Nif_AgCoCuNiZn weist die deutlichste negative Potentialverschiebung im Potentialbereich zwischen 1,35 V und 1,45 V gegen RHE auf, wo die Reaktion voraussichtlich stattfindet, wie der exponentielle Stromanstieg zeigt. Dementsprechend lag der Potentialwert bei 30 mA cm−2 bei 1,38 V gegen RHE, wie in Abbildung 2c dargestellt ist. Sowohl Nif_AgCoCuNiZn als auch Nif_AlCoCrFeNi wurden für weitere Untersuchungen als potenziell vielversprechende Katalysatoren für AmOR ausgewählt.
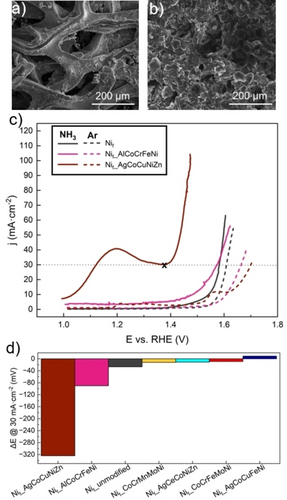
SEM-Aufnahmen einer typischen a) Katalysator- und b) Gasdiffusionsschicht der verwendeten GDEs. c) LSVs in Abwesenheit und Anwesenheit von NH3-Gas (Ar-/NH3-Gemisch im Verhältnis 1 : 1) für die aktivsten Katalysatorzusammensetzungen AgCoCuNiZn, AlCoCrFeNi und unmodifizierte Ni-Schaum-GDE als Vergleich. LSVs aufgezeichnet von 1,0 V bis 1,7 V gegen RHE, 10 mVs−1 in 1 M KOH, die x-Markierung für AgCoCuNiZn dient zur Hervorhebung des Potentialwerts, der für den Vergleich zwischen AmOR und OER ausgewählt wurde. d) Vergleich der Potentialdifferenz (mV) bei 30 mA cm−2 zwischen LSV-Messungen, die in Gegenwart und Abwesenheit von NH3-aufgezeichnet wurden.
Um zusätzliche Daten über die Reaktionsselektivität zu erhalten, wurde der Durchfluss-Modellelektrolyseur direkt an die Online-Gaschromatographie (GC) angeschlossen (Abbildung S5), und es wurde eine Chronopotentiometrie (CP) mit konstantem Strom von 50 mA cm−2 für 100 Minuten durchgeführt. Flüssigproben wurden nach 0, 20, 40, 60, 80 und 100 Minuten entnommen, um die gebildeten NO2− und NO3− mittels Ionenchromatographie (IC) zu quantifizieren. Gasförmige AmOR-Produkte wurden mittels GC analysiert, indem die Gasströme von der GDL-Seite der GDE und dem Gasvolumen des Anolytkompartments kombiniert und in denselben Zeitabständen wie die Flüssigprobenentnahme in den GC injiziert wurden. Die abgeleiteten Faraday-Effizienzen (FE) zeigen signifikante Unterschiede in der Selektivität der NH3-Oxidationsprodukte für GDEs auf Nif_AlCoCrFeNi- oder Nif_AgCoCuNiZn-Basis (Abbildung 3). Die zumindest teilweise fehlende FE kann auf die Bildung gasförmiger NOx-Spezies zurückzuführen sein. Über die Bildung gasförmiger Stickstoffoxide während der elektrokatalytischen AmOR wurde bereits früher berichtet.11, 27 Es ist bekannt, dass die Reaktion von N2O, NO2 oder NO in alkalischen wässrigen Lösungen zur Bildung von NO2− und NO3− führen kann.28 Obwohl die Quantifizierung von gasförmigem NOx mittels GC aufgrund der Reaktivität und Instabilität der Verbindungen problematisch ist, zeigte die ionenchromatographische Untersuchungen von Proben aus den mit 0.1 M NaOH gefüllten Gaswaschflaschen, die die Gase vor dem Eintritt in die GC durchliefen, Konzentrationen von 3,46 mmol L−1 NO2− und 2,16 mmol L−1 NO3− für Nif_AgCoCuNiZn und 0,14 mmol L−1 NO2− und 0,22 mmol L−1 NO3− für Nif_AlCoCrFeNi nach einer Elektrolysezeit von 100 min. Damit konnte die partielle Bildung von gasförmigen Stickoxid-Spezies bestätigt werden. Die nachgewiesenen NO3−-Konzentrationen sind wesentlich höher als die Endkonzentrationen im Anolyt nach 100 min CP-Messung, die nur 0,07 mmol L−1 NO3− für Nif_AgCoCuNiZn und 0,10 mmol L−1 NO3− für Nif_AlCoCrFeNi betrugen.
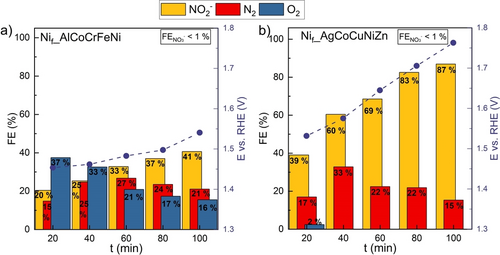
FE und entsprechende E vs. RHE-Werte, die während der CP AmOR-Messungen bei 50 mA cm−2 für 100 min in 1 M KOH mit a) Nif_AlCoCrFeNi und b) Nif_AgCoCuNiZn GDEs erhalten wurden. Die gestrichelten Linien sind Anhaltspunkte für die Augen.
Interessanterweise war die OER im Fall von Nif_AlCoCrFeNi (Abbildung 3a), das bei gleicher Stromdichte bei deutlich niedrigeren Potentialen arbeitet, wesentlich signifikanter. Bei der Verwendung von Nif_AgCoCuNiZn wurde eine hohe Selektivität für NO2− von bis zu 87 % und keine OER selbst bei Potentialen von bis zu 1,75 V gegen RHE gemessen (Abbildung 3b). Bei Nif_AlCoCrFeNi sank die Sauerstoffproduktion von 37 % nach 20 min auf 16 % nach 100 min, während sich die NO2− Produktionsrate von 20 % auf 41 % verdoppelte. Interessanterweise änderte sich die gebildete NO2− Menge für Nif_AlCoCrFeNi mit der Änderung der Stromdichte während der CP, als die CP bei 100 mA cm−2 und 10 mA cm−2 durchgeführt wurde (Abbildung S6a), während die NO3− Bildung unbeeinflusst blieb (Abbildung S6b). Dies deutet auf eine schlechte Selektivität des Katalysators oder auf die Notwendigkeit noch höherer Oxidationspotentiale hin, um NO3− zu erhalten. Da das Ziel dieser Studie darin bestand, die Anwendbarkeit von GDEs unter Verwendung von gasförmigem NH3 zu demonstrieren, wurde der Einfluss des NH3-Gasflusses nicht untersucht. Dies ist jedoch ein wichtiger Parameter für weiterführende Studien, die auf die Anwendung der vorgeschlagenen Technologie abzielen. Darüber hinaus könnten für mögliche künftige technische Anwendungen Reaktorkonzepte mit unter Druck stehendem NH3 hinter der GDE von Vorteil sein.
Die Morphologie und die Durchmischung der Elemente für Nif_AgCoCuNiZn (Abbildung S7) und Nif_AlCoCrFeNi (Abbildung S8) wurden mittels Rasterelektronenmikroskopie (SEM) und energiedispersiver Röntgenspektroskopie (EDX) untersucht. Bei Nif_AgCoCuNiZn bedecken alle Elemente den Ni-Schaum, jedoch scheint Zn in den Multimetall-Verbundwerkstoffen an der Oberfläche und in den Poren des Ni-Schaums zu fehlen. In den entsprechenden EDX-Spektren wurden nur sehr schwache Zn-Signale beobachtet, was darauf zurückzuführen ist, dass der atomare Anteil an Zn im Vergleich zu Ag, Co und Cu trotz des anfänglichen äquimolaren Verhältnisses der Ausgangsstoffe in der Syntheselösung deutlich geringer ist. Dies ist wahrscheinlich das Ergebnis der Zn-Verdampfung (Siedepunkt von Zn – 907 °C) während der Elektrodenglühung bei 800 °C. Die Abtrennung von kleinen Ag-Inseln in der Größe von einigen μm ist ebenfalls zu beobachten (Abbildung S7). Bei NifAlCoCrCuFe scheint der Ni-Schaum dichter mit den anhaftenden Multimetallpartikeln bedeckt zu sein und eine homogene Verteilung aller konstituierenden Elemente aufzuweisen (Abbildung S8). Um den Einfluss der Katalysatorzusammensetzung auf die AmOR-Selektivität weiter zu untersuchen, wurden zusätzliche GDEs auf der Basis von Elementen hergestellt, die die aktivsten Elemente aus dem Vorscreening enthielten, nämlich Al, Co, Cr, Fe, Ni, Ag und Cu. Zn wurde aufgrund seines niedrigen Siedepunkts ausgeschlossen. Die folgenden GDEs wurden hergestellt: Nif_AgAlCoCrCu, Nif_AlCoCrCuFe, Nif_AgAlCrFeNi, Nif CoCu.
Da die meisten der ausgewählten Zusammensetzungen Co und Cu als bekannte Elemente in der NO3−/NH3-Elektrokatalyse enthielten, wurde beschlossen, auch den bimetallischen Katalysator zu testen, um den Einfluss der zusätzlichen Bestandteile zu bewerten. Der gegenteilige Effekt wurde für AgAlCrFeNi erwartet, wenn Co und Cu ausgeschlossen werden. SEM-EDX Bilder für Nif_AgAlCoCrCu (Abbildung S9) und Nif_AgAlCrFeNi (Abbildung S10) zeigen die Bildung kleiner Ag-Inseln, wobei die Ag-Abscheidung bei Nif_AgAlCrFeNi deutlich stärker ausgeprägt ist. Im Fall von Nif_AlCoCrCuFe (Abbildung S11) waren alle Elemente miteinander vermischt, während Co und Cu in Nif CoCu nicht vermischt waren (Abbildung S12). Alle untersuchten Katalysatoren auf GDEs produzierten nur vernachlässigbare Mengen an NO3− (Abbildung S13). Interessanterweise produzierte Nif CoCu 0,25 mmol L−1 NO3− nach 100 min CP bei 50 mA cm−2, was mehr als das Doppelte im Vergleich zu Nif_AlCoCrFeNi (0,103 mmol L−1) und etwa das Fünffache im Vergleich zu allen anderen Katalysatoren ist. Dennoch blieben die FE-Werte für NO3− mit unter 1 % vernachlässigbar. Es ist bekannt, dass vergleichsweise hohe oxidative Potentiale notwendig sind, um die Bildung von NO2− und NO3− zu ermöglichen. Bei allen Katalysatoren korrespondierten steigende Potenzialwerte mit erhöhten FE-Werten für die NO2−Bildung (Abbildung S14). Am deutlichsten ist dies im Fall von Nif_AgCoCuNiZn, wo das höchste ΔE (229 mV) dem höchsten Anstieg der FE (40 %) entspricht (Abbildung S15).
Im Allgemeinen wurden hohe Selektivitätswerte für die NO2−Bildung erreicht (Abbildung 4). Aufgrund der komplizierten synergistischen Wechselwirkungen der quinären Zusammensetzung und der mehrstufigen AmOR-Kinetik kann die genaue Rolle der einzelnen Bestandteile nicht entschlüsselt werden, und es können nur einige Hinweise auf einen Zusammenhang zwischen Zusammensetzung und katalytischer Leistung abgeleitet werden. Beide Elektroden, die kein CoCu in ihrer Katalysatorschicht enthielten (Nif_AlCoCrFeNi und Nif_AgAlCrFeNi), zeigten die geringste NO2− Bildung. Die OER war bei Nif_AlCoCrFeNi im Vergleich zu anderen Katalysatoren deutlich ausgeprägter (Abbildung 3a), während Nif_AgAlCrFeNi mit 44–52 % N2 FE der selektivste Katalysator für die N2-Bildung war (Abbildung S16c).
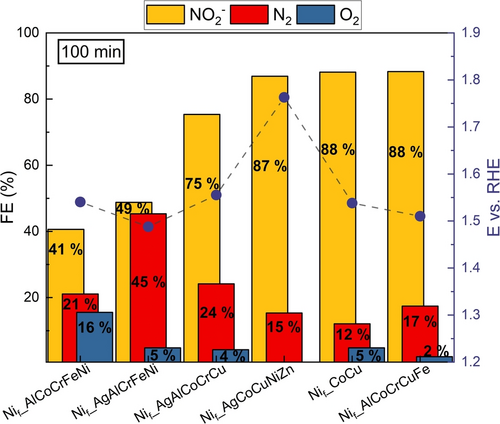
FE- und entsprechende E vs. RHE-Werte, gemessen nach 100 min CP-Messung bei 50 mA cm−2 für 6 untersuchte Katalysatorzusammensetzungen. Die gestrichelte Linie ist eine Orientierungshilfe für das Auge.
Obwohl Nif CoCu wie Nif_AgCoCuNiZn und Nif_AlCoCrCuFe vielversprechende Ergebnisse in Bezug auf die FE für NO2− (65–88 %) zeigte, wies letzterer die niedrigsten Potentialwerte bei der gleichen Stromdichte auf. Eine Zusammenstellung der FE-Werte für alle untersuchten Katalysatoren ist in Abbildung S16 zu finden. SEM-EDX-Messungen nach 100 min CP bei 50 mA cm−2 zeigen das Vorhandensein von Kalium, wie es nach längerem Kontakt mit dem Elektrolyten zu erwarten ist (Abbildung S17–S22). Bei den Zusammensetzungen Nif_AgCoCuNiZn (Abbildung S17), Nif_AgAlCoCrCu (Abbildung S18) und Nif_AgAlCrFeNi (Abbildung S19) wurden keine Ag-Inseln mehr beobachtet. Dies und insbesondere das geringe Ag-Signal im Fall von Nif_AgCoCuNiZn deutet darauf hin, dass Ag während der Reaktion teilweise ausgelaugt wird, was höchstwahrscheinlich auf die Bildung des löslichen [Ag(NH3)2]+-Komplexes zurückzuführen ist. Bei Nif_AlCoCrFeNi (Abbildung S20), Nif_AlCoCrCuFe (Abbildung S21) und Nif CoCu (Abbildung S22) sind nach den CP-Messungen keine signifikanten Änderungen der Zusammensetzungen zu beobachten.
Die ersten Katalysatortests zielten darauf ab, Trends hinsichtlich der Aktivität und Selektivität von AmOR an verschiedenen Katalysatoroberflächen aufzuzeigen, die als Grundlage für die Ermittlung der vielversprechendsten Katalysatorzusammensetzung für die Oxidation von gasförmigem NH3 dienen. Obwohl mehrere Katalysatorzusammensetzungen vielversprechende Ergebnisse zeigten, wählten wir Nif_AlCoCrCuFe, um die Reproduzierbarkeit und die Änderungen der Selektivität bei höheren Stromdichten, d. h. bei höheren Werten des Oxidationspotentials, zu bewerten. Bei der Modifizierung des Ni-Schaums mit dem Katalysator nach dem beschriebenen Polymersprühverfahren wurde gleichzeitig das entsprechende AlCoCrCuFe-Katalysatorpulver durch Sprühen der Polymer/Metallpräkursorsuspension direkt auf die beheizte Glasplatte des Sprühbeschichters gewonnen. Dieses Material wurde zusammen mit den modifizierten Ni-Schaum-Elektroden wärmebehandelt, so dass Katalysatorpulver mit der gleichen Zusammensetzung und Wärmebehandlungsgeschichte erhalten wurde. Um einen Einblick in die Katalysatorstruktur zu erhalten, wurde eine zusätzliche Charakterisierung des erhaltenen AlCoCrCuFe-Pulvers durchgeführt. Mittels induktiv gekoppelter Plasmamassenspektrometrie (ICP-MS) wurde das Elementverhältnis mit Al21Cr13Fe22Co21Cu23 bestimmt, was der erwarteten äquimolaren Zielzusammensetzung von Al20Cr20Fe20Co20Cu20 sehr ähnlich ist. Die EDX-Elementkartierung mittels TEM zeigte ein asymmetrisches Agglomerat oxidierter Nanopartikel unregelmäßiger Größe (Abbildung 5a).
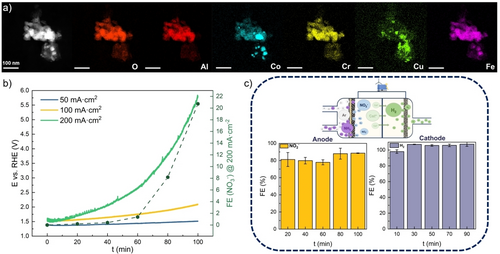
a) TEM-EDX des AlCoCrCuFe-Pulvers. b) E vs. RHE während der CP-Messungen bei 50 mA cm−2 (blau), 100 mA cm−2 (gelb) und 200 mA cm−2 (grün) für 100 min in 1 M KOH und FE-Werte für die NO3−-Bildung während der 200 mA cm−2 CP (dunkelgrün). c) FE-Werte für AmOR und HER unter Verwendung einer Nif_AlCoCrCuFe GDE bei 50 mA cm−2 für 100 min in 1 M KOH.
Obwohl in einigen Bereichen eine Vermischung von O, Al, Co, Cr und Fe erreicht wird, ist auch eine klare Trennung von Fe und insbesondere Co zu beobachten. Die inhomogene Vermischung der Elemente und die Bildung mehrerer Phasen wurden auch durch XRD bestätigt (Abbildung S23). Sowohl das Vorhandensein metallischer Phasen entsprechend Co0,7Fe0,3 (FCC, PDF 00-048-1818), Al0,13Co0,87 (BCC, PDF 01-071-9376) als auch von Mischoxiden mit spinellartiger Struktur entsprechend Al1,8Cr0,2FeO4 (PDF 01-078-4763), Al0,6CoFeO4 (PDF 01-083-4769) und AlCrFeO4 (PDF 1-078-4761) wurden bestätigt. Sowohl TEM-EDX als auch XRD (metallisches Cu (BCC, PDF 03-065-9026) und Cu2O (BCC, PDF 01-071-3645)) deuten auf eine Entmischung von Cu hin, über die bereits früher aufgrund seiner schlechten Mischbarkeit in Multimetallzusammensetzungen berichtet wurde.29
Um sicherzustellen, dass die gemessene NO2− Konzentration von AmOR und nicht von einer möglichen Verunreinigung durch die Umgebung stammt, wurde eine 100-minütige CP-Kontrollmessung bei 50 mA cm−2 durchgeführt, bei der nur Ar auf die Rückseite der Nif_AlCoCrCuFe GDE geleitet wurde. Die FE-Werte weisen darauf hin, dass nur OER stattfand (Abbildung S24). Bei der IC-Analyse der flüssigen Proben wurde kein NO2− nachgewiesen. Die Selektivität von Nif_AlCoCrCuFe für AmOR wurde weiter untersucht, indem die CP-Messungen bei 100 mA cm−2 und 200 mA cm−2 wiederholt wurden. Als zusätzliche Kontrolle wurde auch das bei der Gegenreaktion entstehende H2-Gas analysiert. Die Erhöhung der Stromdichte auf 100 mA cm−2 wirkte sich negativ auf die Selektivität aus, wobei die NO2− FE auf 44–48 % sank, während die OER mit einem Anstieg der O2 FE von 13 % nach 20 Minuten auf 28 % nach 100 Minuten deutlicher wurde (Abbildung S25a).
Signifikante Mengen an NO3− wurden jedoch nur während der CP-Messung bei 200 mA cm−2 (Abbildung S25b), d. h. bei vergleichsweise hohen angelegten Potentialen, produziert. Der Betrieb mit hoher Stromdichte über einen längeren Zeitraum führte zu einer Instabilität der GDEs, was sich in einem erheblichen Potentialanstieg zeigt. Da die Selektivität jedoch direkt vom angelegten Potential abhängt, führte dies zu nützlichen Erkenntnissen über AmOR auf Nif_AlCoCrCuFe. Wie in Abbildung 5b zu sehen ist, sind Potentiale bis zu 2,64 V vs. RHE notwendig, um die Bildung von NO3− zu initiieren, wobei nur 8 % FE bei 3 V vs. RHE erreicht werden. 100 min nach Beginn der CP-Messung erreichte das Potential 5,8 V vs. RHE - ein extrem hoher Wert für ein nicht optimiertes Modellelektrolyseursystem. Es wird vermutet, dass bei diesen extremen Bedingungen auch nicht-faradaysche Reaktionen abliefen. Die H2-Produktion (FE≈100 %) an einer unmodifizierten Ni-Schaumelektrode als Gegenreaktion zu AmOR wurde bei beiden CP-Messungen bei 100 mA cm−2 und 200 mA cm−2 erreicht (Abbildung S25c und d). Im Allgemeinen war die Nif_AlCoCrCuFe-Elektrode ein geeigneterer Kandidat für die NO2− Produktion, und die Katalysatorsuche für die NO3− Bildung sollte in Zukunft ausgeweitet werden. Dies wurde auch durch das Kontrollexperiment zur NO2− Oxidationsreaktion bestätigt, bei dem die kohlenstoffbasierte Seite der GDE, die normalerweise mit Ammoniakgas in Kontakt kommt, blockiert und 0,1 M NaNO2-Lösung in 1 M KOH als Anolyt während einer 50 mA cm−2 CP-Messung verwendet wurde (Abbildung S26). Vermutlich finden nur die NO2− Oxidation und die OER statt. Sehr niedrige NO3− FE-Werte (≈1–2 %) bestätigen jedoch, dass selbst in Abwesenheit von NH3 bei diesen Strom-/Potentialwerten eine Umwandlung von NO2− zu NO3− an Nif_AlCoCrCuFe nicht möglich ist (Abbildung S27). Nichtsdestotrotz ist die selektive Produktion von NO2− aufgrund der vielfältigen Anwendungsmöglichkeiten in der chemischen und pharmazeutischen Industrie sehr wünschenswert und reduziert die Notwendigkeit des Oswald-Prozesses, der für die großtechnische Produktion von NO2− verwendet wird.30 Da die CP-Messung bei 50 mA cm−2 die höchsten FE-Werte für NO2− ergab, wurden die Messungen wiederholt, um die Reproduzierbarkeit sowohl für AmOR als auch für HER zu bestätigen (Abbildung 5c). Es wurde eine hohe Selektivität für NO2− (81–89 % FE) und ≈100 % FE für H2 bestätigt, wodurch das Prinzip des gepaarten AmOR-HER-Elektrolyseursystems erfolgreich demonstriert wurde.
Zusammenfassung
Unsere Experimente belegen, dass in Gasdiffusionselektroden integrierte Multimetallkatalysatoren gasförmiges NH3 oxidieren können, wobei die thermodynamische Falle der N2-Bildung vermieden und hauptsächlich NO2− gebildet wird. Überraschenderweise wird bei dem angelegten Potential NO3− nur in vernachlässigbaren Mengen gebildet und OER kann vermieden werden. Die beobachteten Unterschiede in der FE der Bildung von NO2−, N2, O2 für die verschiedenen Katalysatorzusammensetzungen legen nahe, dass die synergetische Wirkung der verschiedenen Elemente, die den Multimetallkatalysator bilden, die Selektivität von AmOR bestimmt. Co und Cu in der Katalysatorschicht wirkte sich positiv auf die NO2− Bildungsraten aus, und Nif_AlCoCrCuFe zeigte vielversprechende FE für die NO2− Bildung von bis zu 88 % bei 50 mA cm−2. Zukünftige Arbeiten werden die Hochdurchsatzscreening-Techniken für multinäre Materialbibliotheken nutzen, um hochstabile und selektive Katalysatoren für die NO2− Bildung aus gasförmigem NH3 unter Verwendung speziell entwickelter Gasdiffusionselektroden in skalierbaren Elektrolyseursystemen zu erhalten.
Danksagung
Wir danken für die Förderung durch die Deutsche Forschungsgemeinschaft (DFG) im Rahmen der Forschungsgruppe 2982 [413163866] und der Exzellenzstrategie EXC 2033-390677874-RESOLV. Diese Arbeit wurde zum Teil vom Europäischen Forschungsrat (ERC) im Rahmen des Forschungs- und Innovationsprogramms Horizon 2020 der Europäischen Union (CasCat [833408]) und vom “Zentrum für Solvatationsforschung ZEMOS”, das vom Bundesministerium für Bildung und Forschung (BMBF) und vom Ministerium für Kultur und Forschung des Landes Nordrhein-Westfalen gefördert wird, finanziell unterstützt. Die Autoren danken Martin Trautmann für die Durchführung von ICP-MS-Messungen und Dr. Sabine Seisel für die Durchführung von XRD-Messungen. Die Autoren danken Dr. João R. C. Junqueira für seine Unterstützung bei der Entwicklung des Versuchsaufbaus und Soraya Moshtagh Ahmadi für ihre Hilfe bei der Vorbereitung der GDEs. Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Interessenkonflikt
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.
Open Research
Data Availability Statement
Die Daten, die die Ergebnisse dieser Studie unterstützen, sind auf begründete Anfrage beim Autor erhältlich.




