Nasschemische Bottom-up Synthese von Graphen-Nanostreifen mit atompräzisen Nanoporen
Abstract
Die Inkorporation von Nanoporen in Graphen-Nanostrukturen wurde als effiziente Methode zur Anpassung der Bandlücke und elektronischen Struktur dieser Materialien demonstriert. Allerdings ist die atomgenaue Einbettung uniformer Nanoporen in Graphen-Nanostreifen (GNS, engl. GNR) auf atomarer Ebene durch Mangel an effizienten Synthesestrategien bislang unterentwickelt. Wir berichten hier vom ersten lösungschemisch dargestellten, vollständig durch Scholl-Reaktion konjugierten porösen GNS (pGNS), welchen wir durch das atomgenau dargestellte Polyphenylen P1 mit vorinstallierten hexagonalen Makrozyklen zugänglich machen konnten. pGNS enthält periodische Poren im sub-Nanometerbereich (0.6 nm) mit einem Abstand von 1.7 nm zueinander. Um unsere Synthesestrategie zu untermauern, wurden zwei poröse Modellverbindungen (1 a, 1 b) mit einer zu pGNS identischen Pore erfolgreich dargestellt. Die chemische Struktur und photophysikalischen Eigenschaften von pGNS wurden durch verschiedene spektroskopische Methoden untersucht. Die eingebetteten periodischen Nanoporen vermindern die π-Konjugation und damit die Interaktion zwischen den Nanostreifen, verglichen mit nicht porösen GNS von ähnlicher Breite. pGNS zeigt demzufolge eine erhöhte Bandlücke und eine verbesserte nasschemische Prozessierbarkeit.
Einleitung
Poren in Graphen-Nanostrukturen spielen eine kritische Rolle zur Modifikation ihrer Geometrie, elektronischer und mechanischer Eigenschaften basierend auf der Form, Größe und Dichte der Poren.1 Insbesondere Graphen-Nanostreifen (GNS, engl. GNR) mit verschiedenen periodisch strukturierten Nanoporen erfuhren in den letzten Jahren einen Aufschwung durch Ihre einzigartige Topologie, ihre magnetischen und thermoelektrischen Transporteigenschaften sowie die daraus resultierende potenzielle Integration in Ionentransport, Gasdetektion, Thermoelektrika, usw.2 Poröse GNS mit atomgenau definierten Nanoporen wurden vor Kurzem ausgehend von ihren rational designten Monomeren durch oberflächenvermittelte Synthese auf Metallsubstraten im Ultrafeinvakuum dargestellt und durch in situ Rastersondenmikroskopie untersucht (Abbildung 1a). Zum Beispiel konnten N-gedopte GNS mit periodisch planaren Nanoporen durch silbervermittelte Ullmann-artige Polymerisation von Tetrabromophenazin auf Ag(111) dargestellt werden.3 Unabhängig von dieser Arbeit konnten nicht planare Poren durch Ullmann-artige Polymerisation und folgende Scholl-Reaktion von 10,21-dibromohexabenzo[a,c,fg,j,l,op]tetracen4a oder 5,8-dibromopicene4b auf Au(111) dargestellt werden. Trotz dieses Fortschritts in der oberflächenvermittelten Synthese enthalten die dargestellten GNS CC-Einfachbindungen (hervorgehoben in Rot, Abbildung 1a), was die Aufhebung der Konjugation zur Folge hat. Zusätzlich leiden die oben genannten GNS an niedrigen Ausbeuten und einem äußerst herausfordernden Transfer auf nichtleitende Oberflächen zum Zweck weiterer Charakterisierungen.
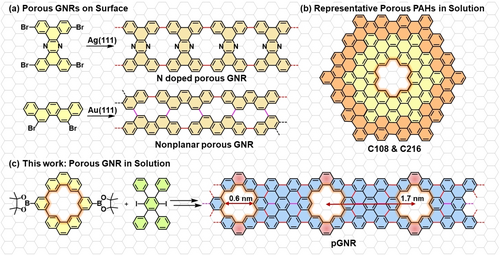
(a) Oberflächenvermittelt dargestellte poröse GNS, CC-Einfachbindungen in Rot hervorgehoben. (b) Nasschemisch dargestellte poröse Nanographene C108 (gelb) und C216 (gelb+orange) (c) In dieser Arbeit nasschemisch dargestellte poröse GNS (pGNS). Alkylketten zur besseren Übersichtlichkeit nicht dargestellt.
Um die intrinsischen Eigenschaften poröser GNS besser zu verstehen und ihre zukünftigen Anwendungen zu entdecken, ist eine effiziente, skalierbare nasschemische Synthesemethode von atomgenau dargestellten porösen und prozessierbaren GNS daher unerlässlich.5 In den letzten Jahren wurden nur wenige π-erweiterte polyzyklische aromatische Kohlenwasserstoffe (PAK oder Nanographene) ausgehend von dendritischen Oligophenylenen durch nasschemische Methoden dargestellt, z. B. die Moleküle C108 und C216, welche eine einzelne hexagonale Pore enthalten (Abbildung 1b).6 Allerdings bleibt die bottom-up Synthese von erweiterten porösen GNS mit periodischen, atomgenau definierten Nanoporen nach wie vor durch den Mangel an effizienten Synthesestrategien und rationalen Entwürfen von Präkursoren unerreicht. In dieser Arbeit demonstrieren wir den ersten nasschemisch dargestellten, vollständig konjugierten porösen GNS (pGNS) mittels A2B2-Suzuki-Polymerisation eines durch Boronester funktionalisierten Makrozyklus und eines weiteren dihalogenierten Präkursormoleküls, gefolgt von einer oxidativen Ringschlussreaktion (Scholl-Reaktion, Abbildung 1c). Das rational definierte Monomer mit Phenanthreneinheiten und der vorinstallierten hexagonalen Pore ist essenziell für die intakte Konjugation und präzise poröse Struktur von pGNS. Als Resultat dieses neuen Designs besitzt pGNS periodische hexagonale Poren mit einem Durchmesser von 0.6 nm (Kohlenstoff-Kohlenstoff) und einem Porenabstand von 1.7 nm (Abbildung 1c). Die chemische Identität von pGNS wurde unwiderlegbar durch Fourir-transform Infrarotspektroskopie (FT-IR), Ramanspektroskopie, Festkörper NMR-Spektroskopie und der Synthese zweier Modellverbindungen mit der zu pGNS identischen hexagonalen Nanopore (1 a und 1 b) bestätigt. Dichtefunktionaltheorie (DFT) indiziert eine effektive Modulation der elektronischen Struktur und Energielevel in pGNS durch die eingebetteten Nanoporen im Vergleich zu den entsprechenden nicht porösen GNS. pGNS zeigt eine gute Dispersibilität und einen gut aufgelösten Absorptionspeak bei 568 nm in Tetrahydrofuran (THF). Verglichen mit den Bandlücken bekannter, nasschemisch hergestellter nicht poröser GNS ähnlicher Breite (1.1–1.88 eV),7, 8 zeigt pGNS eine erhöhte Bandlücke von ∼2.0 eV, übereinstimmend mit dem vorhergesagten Trend. Unsere Untersuchungen ebnen den Weg für lösungsvermittelte Synthesen von porösen GNS mit atomgenau definierten Poren, anpassbaren Bandlücken und guter lösungschemischer Prozessierbarkeit, was potenziell die Integration in molekulare Filter, Sensorik und thermoelektrische Anwendungen ermöglicht.
Ergebnisse und Diskussion
Die porösen Modellverbindungen 1 a und 1 b, welche Fragmente von pGNS darstellen, wurden zur Evaluation der Synthesestrategie wie in Schema 1 illustriert synthetisiert. Zuerst wurde 1-(4-bromophenyl)dodecan-1-on (2) in guter Ausbeute (58 %) durch Friedel–Crafts Acylierung von kommerziell erhältlichem Brombenzen dargestellt. Danach wurde 2 durch McMurry-Reaktion in 4,4′-(tetracos-12-en-12,13-diyl)bis(4-bromobenzen) (3) überführt (55 % Ausbeute). Durch Bestrahlung von 3 mit 300 nm UV-Lampen konnte 3,6-dibromo-9,10-diundecylphenanthren (4) in hoher Ausbeute von 87 % erhalten werden. 1,3-bis(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)benzen (5) wurde ausgehend von 1,3-Dibromobenzen durch Miyaura-Borylierung in 89 % Ausbeute synthetisiert. Danach ergab eine Suzuki-Kupplung zwischen 4 und 5 in verdünnter Lösung den Makrozyklus 1,3(3,6)-diphenanthrena-2,4(1,3)-dibenzenacyclobutaphan (6) in einer niedrigen Ausbeute von 17 %. Die nachfolgende iridiumkatalysierte CH Borylierung ergab die Schlüsselkomponente 2,2′-(19,110,39,310-tetraundecyl-1,3(3,6)-diphenanthrena-2,4(1,3)-dibenzenacyclobutaphan-25,45-diyl)bis(4,4,5,5-tetramethyl-1,3,2-dioxaborolan) (7) in 81 % Ausbeute. Die pentasubstituierten Bromobenzene 8 a und 8 b wurden durch literaturbekannte Synthesewege9 dargestellt (Hintergrundinformationen). Suzuki-Kupplung zwischen 7 und 8 a bzw. 8 b ergab die Präkursoren 9 a und 9 b, mit der vorinstallierten hexagonalen Pore im Zentrum des Moleküls in hohen Ausbeuten von 90 % und 75 %. Die nachfolgende Scholl-Reaktion mit FeCl3 (2.5 Äq./H) als Lewissäure und Oxidationsmittel lieferte die Zielmoleküle 1 a und 1 b in exzellenten isolierten Ausbeuten (1 a, 94 %; 1 b, 89 %).
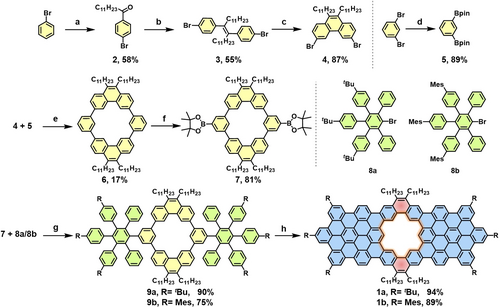
Syntheseschema von Verbindungen 1 a und 1 b. (a) Lauroylchlorid, AlCl3, 50 °C, 2 h; (b) TiCl4, Zn, Pyridin, THF, reflux, 24 h; (c) I2, Propylenoxid, hv, Toluen, r.t., über Nacht; (d) B2pin2, Pd(dppf)Cl2, KOAc, DMSO, 80 °C, über Nacht; (e) Pd2(dba)3, [(tert-Bu)3PH]BF4, NaHCO3, THF, H2O, 80 °C, 3 Tage; (f) B2pin2, [Ir(OMe)cod]2, 4,4′-di-tert-butyl-2,2′-bipyridin, Cyclohexan, 80 °C, über Nacht; (g) Pd(PPh3)4, K2CO3, Dioxan, H2O, 80 °C, 20 h, 9 a oder 9 b; (h) FeCl3, CH3NO2, CH2Cl2, 0 °C, 1 h für 1 a oder 15 min für 1 b.
Die Ausbildung der Strukturen 1 a und 1 b konnte zuerst durch MALDI-TOF-MS bestätigt werden. Die absolute Masse und das beobachtete Isotopenmuster stimmen gut mit den kalkulierten Werten überein (Abbildung 2a). Allerdings war die Charakterisierung der Modellverbindungen mit NMR-Spektroskopie durch starke π–π-Wechselwirkungen zwischen den Molekülen nicht möglich (Abbildung S1). Daher führten wir FT-IR (Abbildung 2b) und FT-Raman (Abbildung 2c) durch und verglichen experimentelle und DFT-simulierte Spektren, um die strukturelle Identität von 1 a zu bestätigen. Die experimentellen und theoretischen Daten von 1 a stimmen exzellent überein (Abbildung 2b). Die DFT-Simulation sagt für die intensive Bande bei 863 cm−1 eine out-of-plane Schwingung aller aromatischer Protonen, sowohl innerhalb als auch außerhalb der Pore, hervor. Diese Bande kann daher als vibronische Markierung der Pore verstanden werden. Diese Bande kann auch im IR-Spektrum von Nanographen C216 (857 cm−1) gefunden werden,6a welches die gleiche Pore besitzt. Das Signal um 809 cm−1 kann der DUO-Schwingung (zwei benachbarte aromatische Protonen) an der Sesselkante des Nanographens zugeordnet werden. Die experimentellen und simulierten Raman-Spektren von 1 a sind ebenfalls in guter Übereinstimmung (Abbildung 2c). Die simulierten D- und G-Banden wurden um 1340 cm−1 und 1611 cm−1 gefunden und reflektieren die experimentelle Lage (1331 cm−1 und 1619 cm−1) exakt. Besonders die D-Banden können mit den charakteristischen aromatischen ring breathings gekoppelt mit in-plane CH-bending und CH2-waggings assoziiert werden. Die G-Bande stellt eine Konvolution verschiedener CC-Streckungen entlang longitudinaler oder diagonaler Richtung gekoppelt mit in-plane CH-bending dar. Die gute Korrelierbarkeit zwischen den DFT-simulierten und experimentellen vibronischen Spektren unterstützt die erfolgreiche Synthese der Modellverbindungen (Tabelle S1, S2). Niedertemperatur Rastertunnelmikroskopie (NT-RTM) bestätigt die poröse Struktur von 1 a (Abbildung 2d, nicht maskierte Bereiche) nach drop-casting und annealing von Lösungen von 1 a auf Au(111)/mica Substraten unter Ultrafeinvakuum (siehe Hintergrundinformationen). Annealing über 200 °C desorbiert die meisten Verunreinigungen des Substrats. Während dieses Prozesses scheinen auch die Alkylketten von 1 a vom Kern des Moleküls abgespalten zu werden, was zuvor auch in cove-GNS auf BN/Cu(111)-Oberflächen beobachtet wurde.10 Die resultierenden Moleküle befinden sich daher in einer ungeordneten Adsorbatmatrix, welche wahrscheinlich aus Lösungsmittelmolekülen und abgespaltenen Alkylketten besteht. Das NT-RTM in Abbildung 2d zeigt sechs hell vorstehende Stellen pro Molekül, welche den t-Bu Gruppen zugeordnet werden können. Der Durchmesser der Nanoporen wurde zu ∼0.6 nm ermittelt, konsistent mit dem berechneten Durchmesser von 0.6 nm (Kohlenstoff-Kohlenstoff Abstand), im Trend mit bekannten RTM-Ergebnissen hexagonaler Nanoporen.3, 11 Um Informationen über die Selbstorganisation der porösen Modellverbindungen zu erhalten, wurde ein Dünnfilm von 1 b mittels grazing-incidence wide-angle X-ray scattering (GIWAXS) untersucht (Abbildung S2). Der Film von 1 b wurde von einer THF-Lösung (2 mg*mL−1) durch drop-casting und anschließendes langsames Verdampfen des Lösungsmittels präpariert, um eine optimale Selbstorganisation und einen homogenen Film zu ermöglichen. Rasterkraftmikroskopieaufnahmen (RKM) zeigen einen Film von 1 b mit glatter Oberflächenmorphologie (Abbildung S3). The GIWAXS-Analyse von 1 b zeigt zwei Reflexe, welche dem Abstand zwischen zwei Molekülen von 1 b in einer Schicht (29.2 Å) und den Abständen in einem Stapel von 1 b (3.9 Å) zugeordnet werden können (Abbildung S2). Die bestimmten Schichtabstände sind sowohl in guter Übereinstimmung mit dem im RTM beobachteten Abstand als auch dem Stapelabstand beobachtet zwischen den Säulen von erweiterten diskotischen Nanographenen.12
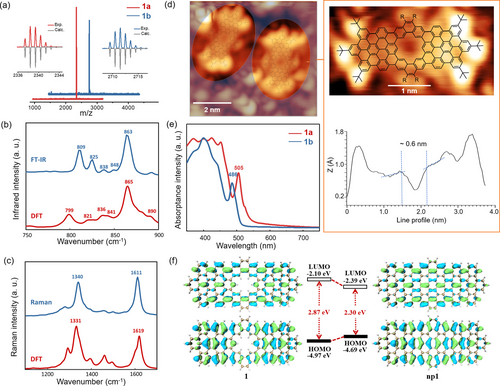
(a) Hochaufgelöste MALDI-TOF Massenspektren von 1 a und 1 b. Experimentelle and simulierte FT-IR- (b) und Raman- (c) Spektren von 1 a, normiert. Einige Peaks wurden mit ihrer Position in cm−1 betitelt. (d) NT-RTM von 1 a auf Au(111)/mica bei 5.1 K gefolgt von Glühen bei >200 °C des aus Lösung abgeschiedenen Materials (siehe Hintergrundinformationen). Tunnelstrom It=100 pA und Us=1 V. Der Hintergrund wurde zur besseren Erkennbarkeit von 1 a maskiert. Die vorstehenden Zonen in der Einzelaufnahme (hell) wurden den t-Bu Gruppen zugeordnet, das RTM-Profil identifiziert den Porendurchmesser als ∼0.6 nm (DFT: 0.59 nm C zu C; 0.37 nm H zu H). Die DFT-optimierte Struktur von 1a ist in Abb. 2d überlagert dargestellt. (e) UV/Vis Absorptionsspektren von 1 a und 1 b in CH2Cl2. (f) Molekülorbitale und deren Energiediagramme simuliert durch zeitabhängige DFT auf dem B3LYP/6-31G(d)-Level von 1 und np1.13
Die UV/Vis Absorptionsspektren von Modellverbindungen 1 a und 1 b in trockenem Dichlormethan sind in Abbildung 2e dargestellt. Das Spektrum von 1 a mit t-Bu Gruppen zeigt einen Absorptionspeak bei 505 nm mit einem onset bei 534 nm, was einer Energielücke von 2.32 eV entspricht. Im Gegensatz dazu zeigt 1 b eine verbesserte Löslichkeit durch verringerte π–π-Wechselwirkungen und hat damit einen hypsochrom verschobenen Absorptionspeak bei 486 nm und zeigt eine Energielücke von 2.42 eV (onset 512 nm). Zum Verständnis der durch die Poren hervorgerufenen Veränderungen der elektronischen Struktur wurden DFT-Simulationen auf B3LYP/6-31G(d)-Level für die poröse Modellverbindung 1 und für das nicht poröse Gegenstück np1 durchgeführt (Abbildung 2f, Substituenten wurden zur Reduktion des Rechenaufwands entfernt).11 In beiden Fällen (1 und np1) sind die höchsten besetzten Molekülorbitale (HOMO) und die niedrigsten unbesetzten Molekülorbitale (LUMO) über das gesamte Molekül delokalisiert, was für eine Erhaltung der Konjugation trotz der Präsenz der Nanopore spricht. Weiter wurden die HOMO- und LUMO-Level sowie die Energielücken berechnet und in Abbildung 2f dargestellt. Verglichen mit den Molekülorbitalenergien von np1 zeigt 1 ein höher liegendes LUMO und niedriger liegendes HOMO, was zu einer größeren Energielücke führt (2.87 eV für 1, 2.30 eV für np1). Diese Ergebnisse demonstrieren die Anpassbarkeit der Energielücken durch die Präsenz von Nanoporen. Des Weiteren zeigen die zeitabhängigen DFT-Berechnungen von 1 und np1 Absorptionsmaxima bei 415 nm und 526 nm, welche anteilig dem HOMO-1→LUMO und dem HOMO→LUMO+1 Übergang zugeordnet werden können (siehe Tabelle S7).
Nach der erfolgreichen Synthese der Modellverbindungen wandten wir uns der lösungsvermittelten Synthese von pGNS zu (Schema 2). Zuerst wurde 4,4′′-didodecyl-4′,5′-bis(4-dodecylphenyl)-3′,6′-diiodo-1,1′:2′,1′′-terphenyl (10) nach Literaturvorschrift dargestellt.14 Dann erfolgte die dreitägige A2B2-Suzuki-Polymerisation der Komponenten 7 und 10 unter Verwendung von Pd(PPh3)4 als Katalysator und K2CO3 als Base in Wasser und Dioxan, was Polyphenylen P1 in 90 % Ausbeute hervorbrachte. Die Reaktionsmischung wurde in Methanol ausgefällt und das farblose Rohprodukt P1 wurde gesammelt. Das MALDI-TOF Massenspektrum zeigt m/z-Intervalle der exakten Molmasse der erwarteten Wiederholeinheit (AB=2172 g*mol−1, Abbildung 3a). Weiter kann jedes Signal des Massenspektrums einem spezifischen Oligomer mit den Einheiten A und B zugewiesen werden. P1 wurde anschließend mit Hilfe von recycling Gelpermeationschromatografie (r-GPC) fraktioniert. Analytische Gelpermeationschromatografie (a-GPC) bestimmte anschließend die Molmassen der Fraktionen relativ zu Polystyren Standards und bestimmte das Zahlenmittel der Molmasse Mn von P1 als ∼25 kg*mol−1 mit einem Polydispersitätsindex von 1.32 (Abbildung S6). pGNS wurde durch Scholl-Reaktion unter Nutzung von FeCl3 (7.5 Äq./H) als Lewissäure und Oxidationsmittel in CH2Cl2 bei Raumtemperatur über eine Reaktionszeit von drei Tagen erhalten. pGNS besitzt periodisch eingelagerte hexagonale Poren mit einem Kohlenstoff-Kohlenstoff Abstand von 0.6 nm und einem Porenabstand von 1.7 nm (Schema 2a). Die Länge von pGNS beträgt etwa 20 nm, basierend auf Mn von Polymer P1. Weiter bestätigen DFT-Simulationen die planare Struktur von pGNS, welche durch die Spannung innerhalb der Nanoporen aufrecht erhalten wird, konsistent mit den planaren Modellverbindungen 1 a und 1 b (Schema 2b, Abbildung S7).
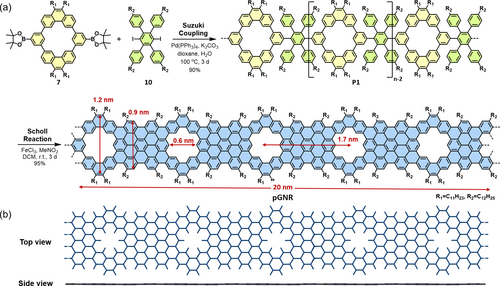
(a) Syntheseroute von pGNS. (b) Draufsicht und Seitenansicht von pGNS, optimiert durch DFT-Simulation. Alkylketten sind nicht gezeigt.
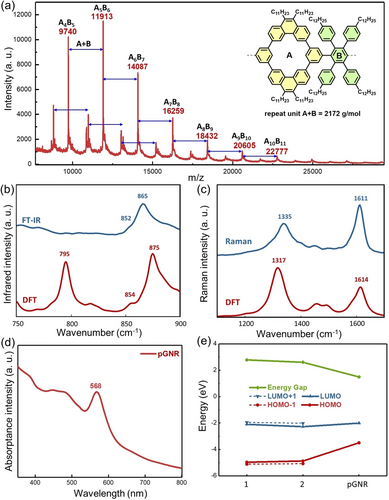
(a) MALDI-TOF Massenspektrum von Polymer P1 im linearen Modus. Experimentelles and simuliertes FT-IR- (b) und Raman- (c) Spektrum von pGNS, normiert. Das kalkulierte IR-Signal bei 795 cm−1 ist ein Artefakt der Simulation, siehe Hintergrundinformationen. (d) UV/Vis Absorptionsspektrum von pGNS in THF. (e) Vorhergesagte Energielevel von 1, dimer 2 und pGNS.
Die erfolgreiche Synthese von pGNS wurde zunächst durch FT-IR- und FT-Raman-Spektroskopie bestätigt (Abbildung 3b,c). DFT spiegelt die intensive IR-Bande um 865 cm−1 sehr gut wider, welche den out-of-plane CH-Schwingungen in der Pore und entlang der Sesselkante von pGNS zugewiesen werden kann. Weiter ist das Signal um 809 cm−1 der Modellverbindung 1 a nicht auffindbar, im Einklang mit den nicht vorhandenen DUO-Modi in pGNS. Eine gute Übereinstimmung von Theorie und Praxis ist auch im Raman-Spektrum sichtbar. Die breite D-Bande um 1335 cm−1 involviert mehrere gekoppelte Modi in verschiedenen Regionen des pGNS, wie etwa ring-breathing und in-plane CH-bending. Die G-Bande um 1611 cm−1 zeigt zwei degenerierte Streckungsmodi entlang der Diagonalen, mit nur einer kleinen Beteiligung entlang der longitudinalen Richtung des pGNS. Die grafische Repräsentation einiger IR- und Raman-Modi und deren Zuweisungen sind in den Hintergrundinformationen (Abbildung S7–S9, Tabelle S3, S4) dargestellt. Einen weiteren Strukturbeleg liefert das Festkörper NMR von P1 und pGNS (Abbildung S10–S12). Der Vergleich der 1H NMR magic-angle spinning Experimente (MAS, Abbildung S9) zeigt für pGNS eine deutliche Linienverbreiterung infolge der Graphitisierung verglichen mit dem Spektrum von P1. 2D 1H−1H double-quantum single-quantum Experimente zeigen wie erwartet Autokorrelationssignale der aliphatischen Protonen und Kreuzkorrelationssignale zwischen den aromatischen Protonen. Weiter erstreckt sich der Bereich der 1H−1H Autokorrelationen der aromatischen Protonen (7.7/14.4 ppm) nur bis 11.0/21.0 ppm (Abbildung S12). Die niedrige Spanne der 1H-shifts kann durch eine Verringerung der Ringstromeffekte erklärt werden, welche durch die Einbettung der Poren im Rückgrat des GNS zustande kommen.
Durch die Nanoporen und die Alkylseitenketten kann pGNS in herkömmlichen organischen Lösungsmitteln wie THF oder Toluen dispergiert werden. Verglichen mit den Modellverbindungen 1 a und 1 b zeigt eine pGNS-Dispersion in THF (0.1 mg*mL−1) eine signifikante bathochrome Verschiebung mit einem Peak bei 568 nm (Abbildung 3d). Die optische Bandlücke von pGNS wird ausgehend des onsets bei 620 nm zu 2.0 eV bestimmt, höher als nichtporöse GNS ähnlicher Breite, welche zwischen 1.1 eV und 1.88 eV liegen.7, 8 Zusätzlich sagt DFT eine Verringerung der Bandlücke von Verbindung 1 (2.87 eV) zu 2 (2.60 eV) zu pGNS (1.49 eV, Abbildung S14) aufgrund der Vergrößerung des π-Systems voraus (Abbildung 3e).
Um die Effekte der Nanoporen in den Graphen-Nanostreifen nachvollziehen zu können, wurden die Bandstrukturen und Grenzorbitale von pGNS und seinem nicht porösen Gegenstück npGNS durch das Perdew–Burke–Ernzerhof (PBE) Austauschkorrelationsfunktional mit verallgemeinerter Gradientennäherung (GGA) simuliert (Abbildung 4a,b). Verglichen mit der schmalen Bandlücke von 0.97 eV im Fall von npGNS besitzt pGNS aufgrund seiner eingebetteten Nanoporen ein niedrigeres Valenzband VB (−3.50 eV vs −3.13 eV) und ein höheres Leitungsband LB (−2.01 eV vs −2.16 eV), was in einer erhöhten Bandlücke (1.49 eV) resultiert, welche gut mit den experimentellen Tendenzen übereinstimmt. Abbildung 4b zeigt die Drauf- und Seitenansicht der simulierten VB und LB von pGNS und npGNS. In beiden Fällen sind die Grenzorbitale über die gesamte Struktur ohne Unterbrechung delokalisiert, was die vollständige Konjugation entlang des aromatischen Kerns von pGNS und in diesem Sinne die Überlegenheit gegenüber den oberflächenvermittelt dargestellten Beispielen mit CC-Einfachbindungen beweist.3, 4 Ähnliche Orbitalverteilungen wurden auch für die porösen und nicht porösen Modellverbindungen und Dimere gefunden (Tabelle S6).
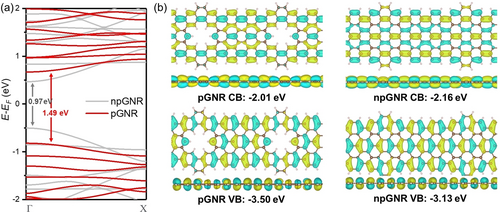
(a) Berechnete Bandstruktur von pGNS (rot) und dem nicht porösen Analogon npGNS (grau). (b) Drauf- und Seitenansicht der Valenz- (−3.50 eV) und Leitunsbandorbitale (−2.01 eV) von pGNS und npGNS (VB −3.13 eV; LB −2.16 eV), gelb und cyan stellen gegensätzliche Vorzeichen der Wellenfunktion dar.
Zusammenfassung
In dieser Arbeit demonstrierten wir die erste lösungsvermittelte Synthese eines bottom-up dargestellten vollständig konjugierten porösen Graphen-Nanostreifens, die periodisch hexagonale Nanoporen enthaltende Struktur pGNS. Schlüssel zu diesem Design ist der rational und atomgenau dargestellte Präkursor P1, welcher bereits die Nanoporen vorinstalliert enthält und Zugang zu pGNS mit intakter Konjugation und regelmäßigen Nanoporen mit einem Durchmesser von 0.6 nm und einem Porenabstand von 1.7 nm ermöglicht. Die Synthese von pGNS wurde eingehend durch verschiedene spektroskopische Methoden und Simulationen sowie der Synthese zweier Modellverbindungen untersucht. Simulationen durch Dichtefunktionaltheorie bestätigten die Modulierung der elektronischen Struktur von pGNS und die Feinabstimmung der Bandlücke ohne Unterbrechung der Konjugation im Nanostreifen durch die Anwesenheit der Nanoporen. Dank der periodischen Einbettung von Nanoporen zeigt pGNS eine erhöhte Dispersibilität und modulierte Bandlücke sowie eine skalierbare Synthese. pGNS zeigt dadurch großes Potenzial für zahlreiche Anwendungen wie etwa Thermoelektrika, Ionendetektion etc.
Danksagung
Diese Arbeit wurde finanziell durch die National Natural Science Foundation of China (22225501 und 52203268), dem EU Graphene Flagship (Graphene Core 3, 881603), H2020-MSCA-ITN (ULTIMATE, No. 813036), dem Center for Advancing Electronics Dresden (cfaed), H2020-EU.1.2.2. – FET Proactive Grant (LIGHT-CAP, 101017821), dem DFG-SNSF Joint Switzerland-German Research Project (EnhanceTopo, No. 429265950), dem Strategic Priority Research Program der Chinese Academy of Sciences (Grant Nos. XDB33000000 und XDB33030300), und dem DFG gesponsorten Cluster of Excellence “Matters of Activity” (No. 390648296) unterstützt. Die Autoren danken dem GWK für die Förderung dieses Projekts durch die Bereitstellung von Rechenzeit durch das Center for Information Services and HPC (ZIH) der TU Dresden. Die Autoren danken weiter dem Dortmund Electron Accelerator (DELTA) für die grazing-incidence wide-angle x-ray scattering (GIWAXS) Messungen. Z. Ling dankt dem China Scholarship Council NO. 202006890007. W. Pisula dankt dem National Science Centre, Polen, für die Förderung UMO-2019/33/B/ST3/1550. Die Autoren danken auch Dr. Tomasz Marszalek und Yichen Jin für seine experimentelle Hilfe und ergiebige Diskussionen. Dank gebührt des Weiteren Herrn Enrique Caldera Cruz für die GPC Messungen, Herrn F. Drescher und Prof. E. Brunner für die HR-MS Messungen und Herrn Dr. Hartmut Komber für die Hochtemperatur NMR Messungen. Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Interessenkonflikt
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.
Open Research
Data Availability Statement
Die Daten, die die Ergebnisse dieser Studie unterstützen, sind auf begründete Anfrage beim Autor erhältlich.




