Bor-Zentrierte Lewis-Supersäuren durch Redoxaktive Liganden: Anwendung in der C-F- und S-F-Bindungsaktivierung
Abstract
Eine Reihe redox-responsiver, Ferrocenyl-substituierter Borane und Boronsäureester wurde dargestellt. Oxidation der Ferrocenyl-Einheit zum entsprechenden Ferrocenium führte zu einer drastischen Erhöhung der Lewis-Acidität, wobei sogar die des SbF5 übertroffen wird. Dies wurde sowohl experimentell als auch durch quantenchemische Rechnungen untersucht. Die resultierenden, stark Lewis-aciden Borverbindungen wurden für katalytische C-F- und S-F-Aktivierung verwendet.
Die Fähigkeit von Hauptgruppenelementverbindungen molekularen Wasserstoff zu aktivieren hat neues Interesse an der Katalyse mit Lewis-Säuren und Lewis-Basen (LA/LB) geweckt.1 Stephan zeigte die heterolytische Spaltung von H2 mittels sogenannter frustrierter Lewis-Paare (FLP) sowie deren erste Anwendungen in Hydrierungsreaktionen.2 Obwohl B(C6F5)33 die am häufigsten verwendete Lewis-Säure ist,1, 4 ist sie nicht immer die beste Wahl, da die Reaktivität eines FLPs stark von der Lewis-Acidität und -Basizität der einzelnen Komponenten abhängt.2b, 5, 6 Während von Bor abgeleitete LAs, die schwächer als B(C6F5)3 sind, Hydrierungen funktionalisierter Moleküle ermöglichen,5, 7 haben stärkere LAs, hauptsächlich auf Basis von Phosphor, anspruchsvolle Bindungsaktivierungen ermöglicht.8 Obwohl kationische Phosphonium- oder Boreniumionen oft die Lewis-Acidität von SbF5 übertreffen und somit als Lewis-Supersäuren (LSA) zu klassifizieren sind, gibt es nur wenige Beispiele für Borane.9 Der Grund dafür ist deren hohe Reaktivität, welche die Synthese und Aufreinigung erschwert.9b, 9i Um diese Problemstellung zu umgehen, ist die Erzeugung von LSAs durch einen elektrochemischen Prozess ein vielversprechender Weg, da redoxaktive Gruppen bei der Veränderung chemischer Eigenschaften nützlich sein können.10 Weiterhin zeigen sowohl Borane mit peripheren kationischen Gruppen11 als auch kationische Borane12 eine deutlich erhöhte Lewis-Acidität. Es wurde angenommen, dass die Synthese und Handhabung potenzieller LSAs durch die Anwendung von Redoxprozessen in einem späten Stadium oder sogar erst kurz vor der katalytischen Anwendung enorm vereinfacht werden könnte.13 Die Ferrocenyl-Einheit (Fc)14 ist eine weithin bekannte, reversibel redoxaktive Gruppe und hätte das Potenzial, die von uns gesuchten Lewis-sauren Eigenschaften zu erzeugen. Es sind bereits mehrere Ferrocenylborane15 bekannt, darunter Fc−B(C6F5)2 (1 a)16 und Fc−B(C6Cl5)2 (1 b).17 Obwohl über das (quasi) reversible Redoxverhalten von 1 a berichtet wurde,16 liegen noch keine Studien zum Grad der Lewis-Acidität oder zu möglichen katalytischen Anwendungen vor. Nichtsdestotrotz berichtete Jäkle über die Erhöhung der Lewis-Acidität von Organoboranen durch die Oxidation von periphären Ferrocenyl-Einheiten.18 Wir berichten hier von der Synthese und Charakterisierung von Ferrocenyl/Ferrocenylium-Boranen und Boronsäureestern als Lewis-Supersäuren. Diese wurden in katalytischen Aktivierungen von C-F- und S-F-Bindungen eingesetzt und führten zu neuartigen C-C- und S-C-Bindungsbildungsreaktionen.
Die Synthese der vier Fc-Derivate 1 a–d erfolgte in ein bis zwei Stufen (Abbildung 1).
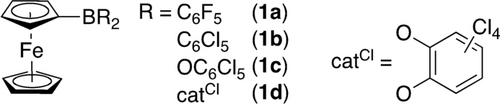
Bor-zentrierte Lewissäuren mit einer redox-aktiven Ferrocenyl-Einheit. Für Synthese und Charakterisierung, siehe Hintergrundinformationen.
Cyclovoltammetrische Untersuchungen zeigen quasi-reversibles Redoxverhalten für alle Verbindungen, mit Halbwellenpotentialen von E01/2=+450 mV (1 a),16, 17 +550 mV (1 b),17 +250 mV (1 c) and +270 mV (1 d) gegen das Fc/Fc+ Redoxpaar. Die C6Cl5 Gruppe zeigt damit den stärksten elektronenziehenden Effekt, was sich mit bekannten Beobachtungen deckt.19 Die entsprechenden Fc+-basierten, kationischen Spezies 2 a–d wurden durch Oxidation von 1 a–d mit Silbersalzen schwach koordinierender Anionen (wca), z. B. Ag[Al(OC4F9)4] oder Ag[SbF6], erhalten (Schema 1).
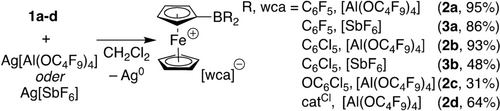
Synthese von Ferrocenium-basierten, Bor-zentrierten Lewissäuren.
Die neuartigen Verbindungen 1 c, 1 d and 2 a–d wurden mittels Einkristallröntgenbeugung charakterisiert. (Abbildung 2 und Hintergrundinformationen, ausgewählte Ergebnisse in Tabelle 1).
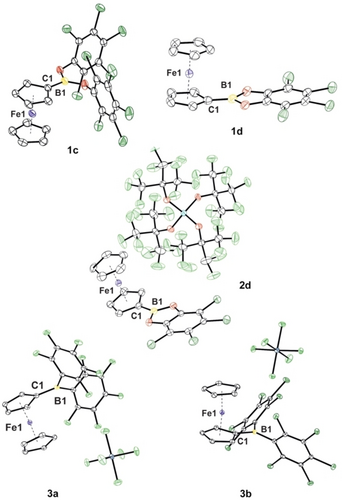
Molekülstrukturen der neutralen (1 c und 1 d) und kationischen (2 d, 3 a und 3 b) Verbindungen. Thermische Ellipsoide sind mit 30 % Wahrscheinlichkeit angegeben. Wasserstoffatome sind aus Gründen der Übersichtlichkeit nicht dargestellt.
|
d(Fe⋅⋅⋅B) [pm] |
d(B−Cp) [pm] |
α* [°][a] |
d(Fe−Cp) [pm] |
d(Fe−CpB) [pm] |
|---|---|---|---|---|---|
1 a16 |
292.4 |
150.1(4) |
16 |
n.a. |
n.a. |
2 a[b] |
315.8 |
154.7 |
6.2 |
171.2 |
171.5 |
3 a |
317.6 |
153.8(3) |
3.4 |
170.9 |
171.5 |
1 b17 |
318.5(3) |
151.4(4) |
2.6 |
165.4 |
164.7 |
2 b[b] |
333.9 |
155.2 |
6.2 |
171.5 |
171.8 |
3 b |
329.7 |
154.5(3) |
3.8 |
170.7 |
171.3 |
1 c |
316.69(62) |
152.22(67) |
3.1 |
165.2 |
165.5 |
2 c |
325.48(73) |
154.17(1) |
3.5 |
171.1 |
170.8 |
1 d |
304.82(42) |
149.58(7) |
7.9 |
164.2 |
163.5 |
2 d |
322.44(4) |
154.02(58) |
0.3 |
170.7 |
170.9 |
- [a] α*=180°−α, mit α=Winkel zwischen dem Zentroiden des Cp-Rings, ipso C-Atom und B-Atom; [b] durchschnittliche Strukturparameter von mehreren Molekülen der asymmetrischen Einheit.
Bekanntermaßen neigen Borylsubstituenten an Ferrocen dazu, aus der Cp-Ebene in Richtung des Eisenatoms abgewinkelt zu sein.20 Ein klarer Trend für diesen Winkel α* wurde nicht gefunden, da die Abwinklung nicht nur auf Fe⋅⋅⋅B-Wechselwirkungen, sondern auf mehreren Faktoren beruht, wie z. B. through-space-Wechselwirkungen mit dem zweiten Cp-Ring. Die einzige Tendenz, die für alle Borane beobachtet werden konnte, ist eine Vergrößerung der B-Cp-Bindungslänge um 2.1–4.6 pm im Zuge der Oxidation (Tabelle 1). Dies kann einer abgeschwächten π-Wechselwirkung zugeordnet werden, da das oxidierte FeIII-Atom mehr Elektronendichte aus dem Cp-Ring abzieht.20 Durch Vergleich der oxidierten Borane verschiedener Gegenionen, d. h. [SbF6]− und [Al{OC(CF3)3}4]−, kann beobachtet werden, dass Packungseffekte einen deutlichen Einfluss auf α* haben (siehe z. B. 2 a and 3 a). Um die Lewis-Acidität der Titelverbindungen einschätzen zu können,21 wurden Rechnungen zu Fluorid-Ionen-Affinitäten (FIA and FIAsolv), Hydrid-Ionen-Affinitäten (HIA and HIAsolv) und Bindungsenergien zu der neutralen Lewis-Base NH3 durchgeführt und mit Referenzsystemen wie B(C6F5)3 und SbF5 (Tabelle 2) verglichen.
Verbindung |
HIA [kJ mol−1] |
HIAsolv[c] [kJ mol−1] |
FIA [kJ mol−1] |
FIAsolv[c] [kJ mol−1] |
NH3 Affinität[c] [kJ mol−1] |
|---|---|---|---|---|---|
SbF5 |
– |
– |
492 |
315 |
– |
B(C6F5)3 |
507 |
297 |
444 |
216 |
113 |
1 a16 |
446 |
245 |
394 |
172 |
89 |
1 b17 |
444 |
240 |
382 |
157 |
71 |
1 c |
376 |
169 |
370 |
144 |
44 |
1 d |
368 |
181 |
372 |
164 |
32 |
2 a |
786 |
331 |
732 |
255 |
121 |
2 b |
767 |
326 |
701 |
238 |
109 |
2 c |
680 |
237 |
674 |
208 |
65 |
2 d |
703 |
236[c,d] |
691 |
226 |
49 |
- [a] Der Global Electrophilicity Index (GEI)22 erwies sich für die kationischen, offenschaligen Verbindungen als unzuverlässig (Details in den Hintergrundinformationen); [b] nur für kationische Verbindungen 2 a–d berechnet; [c] Solvatationsenthalpien wurden für CH2Cl2 unter Zuhilfenahme des “Conductor-like Polarizable Continuum Model” (CPCM) in Kombination mit der “Solvent Model Based on Density” (SMD) Methode, wie in ORCA 4.2.1 Paket implementiert, berechnet; [d] TPSS/TZVP/D3BJ.
Mit einer berechneten FIA von 492 kJ mol−1 (493 kJ mol−1, BP86/SVP, Krossing's Methode) ist SbF5 ist als Grenze für Lewis-Supersäuren etabliert.23 Die Lewis-Aciditäten der neutralen Fc-Borane 1 a–d sind niedriger als die von SbF5 oder B(C6F5)3 (444 kJ mol−1), was wahrscheinlich auf den elektronenreichen Fc-Rest zurückzuführen ist.20 Dies stimmt mit den berechneten HIAs in der Gasphase überein. Im Zuge der Oxidation überschreiten die berechneten Lewis-Aciditäten von 2 a und 2 b die von B(C6F5)3 um einen Faktor von 1.6 bis 1.7. Die geschätzten FIAs für 2 a und 2 b sind um 240 kJ mol−1 und 209 kJ mol−1 höher als die von SbF5. Damit können diese Borane als Lewis-Supersäuren klassifiziert werden. Die berechneten Lewis-Aciditäten in Lösung (HIAsolv and FIAsolv) weichen dabei stark von den Berechnungen in der Gasphase ab, was erwartungsgemäß auf eine größere Stabilisierung der ionischen Spezies durch das Lösemittelmodell zurückzuführen ist.9j Nichtsdestotrotz sind die oxidierten Fc+-Derivate 2 a, 2 b und 2 d anhand von FIAsolv stärkere Lewis-Säuren als B(C6F5)3. Anhand der berechneten Affinitäten für eine neutrale Lewis-Base,22 hat 2 a ebenfalls eine höhere Affinität zu NH3 (ΔG=121 kJ mol−1), verglichen mit nur 113 kJ mol−1 für B(C6F5)3 (109 kJ mol−1 für 2 b). Allerdings ist die FIAsolv für SbF5 um 60 kJ mol−1 bzw. 77 kJ mol−1 größer als die von 2 a bzw. 2 b. Unter Berücksichtigung der rechnerischen Ungenauigkeiten aufgrund des Vergleichs von neutralen und kationischen Verbindungen, scheinen die Lewis-Aciditäten allerdings in derselben Größenordnung zu sein. Um zu zeigen, dass 2 a und 2 b in Lösung stärkere LAs als SbF5 sind, wurden die entsprechenden [SbF6]−-Salze durch Reaktion von 1 a oder 1 b mit Ag[SbF6] (Schema 1) dargestellt. Die entstandenen [SbF6]−-Salze 3 a und 3 b erwiesen sich dabei als instabil und zersetzten sich unter Inertgas-atmosphäre bei Raumtemperatur (RT), vermutlich aufgrund der supersauren Eigenschaften. Als Kontrollexperiment wurden 2 a und 2 b mit einem Äquivalent [Ph4P][SbF6] in CD2Cl2 bei Raumtemperatur umgesetzt. Die 11B NMR-spektroskopischen Untersuchungen belegen die Bildung von paramagnetischen Verbindungen, die über tetragonale Bor-Atome verfügen; die chemischen Verschiebungen von δ=−11.0 ppm (3 a) und −9.6 ppm (3 b) deuten auf B-F-Resonanzen hin. Diese Befunde unterstützen die Annahme, dass die oxidierten Fc+-Borane in Lösung über eine höhere Lewis-Acidität verfügen als SbF5.
Schließlich wurden wurden die LSAs zur Aktivierung von C-F- und S-F-Bindungen getestet.8 Alle neutralen, Fc-basierten Lewis-Säuren waren in der Benzylierung mit 4 von aromatischen Verbindungen 5 bei RT inaktiv (Schema 2).
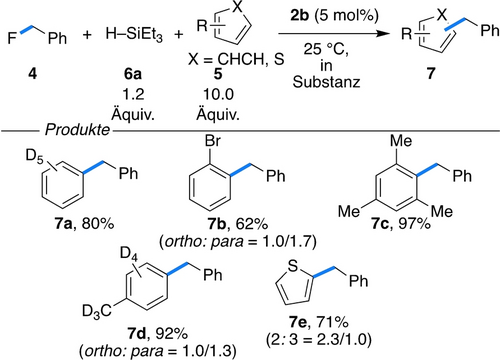
Katalytische C-F-Bindungsarylierung.
Allerdings konnte für alle vier kationischen Fc+-Derivate 2 a–d Reaktivität beobachtet werden, wobei 2 a und 2 b leicht erhöhte Ausbeuten zeigten (70 % gegen 60 %; siehe Hintergrundinformationen für Details). In Anwesenheit von 5 mol % 2 b wurden die aromatischen Verbindungen zu den benzylierten Produkten 7 a–e mit Ausbeuten von 62–97 % umgesetzt, wobei eine niedrige Regioselektivität für die Benzo- und Thiophen-Derivate 7 b und 7 e beobachtet wurde. Trifluortoluol (8 a) wurde in Anwesenheit des Lewis-acideren Borans 2 a und Triethylsilan (6 a) in weniger als 5 Minuten bei 25 °C quantitativ zu Toluol (9) reduziert (Schema 3a).
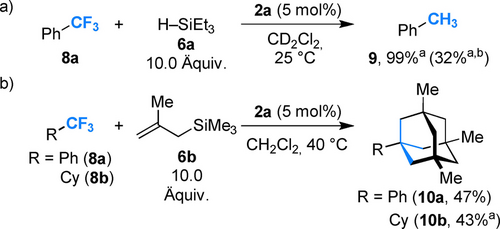
a) Reduktion und b) Alkylierung von C-F-Bindungen; a mittels 1H NMR-Spektroskopie bestimmt, Hexamethylbenzol als interner Standard. b 5 mol% 2 b.
Das Chloro-Derivat 2 b war weniger reaktiv und reduzierte 8 a in 32 % Ausbeute innerhalb von 22 h. Alle drei C-F-Bindungen von 8 a konnten für die C-C-Bindungsbildung mit dem Allylsilan 6 b unter katalytischen Bedingungen genutzt werden. Überraschenderweise wurde dabei nicht das dreifach allylierte Produkt, sondern das entsprechende Adamatylderivat 10 a in 47 % Ausbeute gebildet. Gleichermaßen wurde Trifluoromethylcyclohexan (9 b) zu dem Adamantylderivat 10 b in 43 % Ausbeute umgewandelt. Diese Produkte bilden sich vermutlich durch dreifache Allylierung der CF3-Gruppe und anschließender Lewis-Säure-katalysierter Trimerisierung über eine carbokationische Zwischenstufe.24
Wir untersuchten ebenfalls die Aktivierung der extrem stabilen Pentafluorosulfanyl-Gruppe (R−SF5).25 Bis jetzt konnten R−SF5 Gruppen nur unter drastisch reduktiven Birch-Bedingungen zu Thiolen umgesetzt werden.26 Unter den getesteten LAs erwies sich erneut die Stärkste auch als die Reaktivste. Bei milden Bedingungen mit 5 mol % 2 a konnten die Pentafluorosulfanylbenzol Derivate 11 a–c in die entsprechenden Thiole umgewandelt werden (Schema 4a).

S-F-Bindungsfunktionalisierung; a durch GC bestimmt; b in Toluol.
Die Produkte wurde als benzoylgeschützte Thiole 12 a–c in 78–89 % Ausbeute isoliert. Ein Kontrollexperiment mit 5 mol % des Silyliumsalzes [Et3Si][B(C6F5)4] zeigte vergleichbare Reaktivität in der Umwandlung von 11 a zu 12 a, weshalb angenommen werden kann, dass 2 a vermutlich als Initiator agiert (siehe Hintergrundinformationen).27 Die Silan-geschützten Thiole 13 a und 13 b konnten durch Verwendung des sterisch anspruchsvollen tert-Butyl-dimethylsilans (TBDMS 6 c, Schema 4b) in 93 % und 47 % Ausbeute erhalten werden. Weiterhin wurden die entsprechenden Diarylthioether 14 a–e gebildet, wenn die Reaktion in Anwesenheit einer aromatischen Verbindung, 5.5 Äquivalenten Triethylsilan und 5 mol % 2 a durchgeführt wurde (Schema 4c). Obwohl die Ausbeuten niedrig bis mittel waren, sind dies die ersten Beispiele für die katalytische Transformation von SF5-Gruppen zu neuen C-S-Bindungen. Der Mechanismus der SF5-Aktivierung wurde noch nicht näher untersucht, aber die Bildung dieser Produkte legt nahe, dass in situ kationische Organoschwefelverbindungen erzeugt werden.
Zusammenfassend konnten wir Lewis-Supersäuren ausgehend von redox-aktiven Ferrocenylboranen leicht zugänglich machen. Die Ferrocen-basierte Einelektronenoxidation erhöht die Lewis-Acidität um einen Faktor von 1.4 bis 1.5 (FIAsolv), wodurch Lewis-Supersäuren erhalten werden. Die Diarylferroceniumborane 2 a–b sind in der Lage, C-F- und S-F-Bindungen zu aktivieren und ermöglichen damit eine Vielzahl von Transformationen, wie Reduktionen, Alkylierungen und Arylierungen. Weiterhin wurden erstmalig organische SF5-Gruppen katalytisch zu Thiolen sowie zu Silyl-und Diarylthioethern umgewandelt. Der Mechanismus der Aktivierung der SF5-Gruppe wird gegenwärtig untersucht.
Danksagung
Der Deutschen Forschungsgesellschaft (DFG) wird für ihre finanzielle Unterstützung gedankt (PA 1562/18-1, INST 40/467-1 FUGG (JUSTUS cluster)). L.K. dankt dem Fonds der Chemischen Industrie für ein Kekulé Stipendium und der Universität Paderborn für ein Promotionsstipendium. Die High-Performance Computing Facility der Universität Paderborn (PC2) ist für Rechenressourcen gedankt. Diese Arbeit wurde vom Karlsruher Institut für Technologie (KIT) unterstützt. Wir danken der Unterstützung durch das Bundesland Baden-Württemberg durch das bwHPC Programm. Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Interessenkonflikt
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.
Open Research
Data Availability Statement
Die Daten, die die Ergebnisse dieser Studie unterstützen, sind in den Hintergrundinformationen zu diesem Artikel verfügbar.




