Eine chirale pentafluorierte Isopropylgruppe durch Iod(I)/(III)-Katalyse
In memoriam Prof. Dr. François Diederich (1952–2020)
Abstract
Eine durch Iod (I/III) Katalyse ermöglichte Strategie zur Konstruktion eines enantioangereicherten fluorierten Isoster der Isopropylgruppe wird beschrieben. Die in situ Generierung einer chiralen ArIF2-Spezies ermöglicht die Difluorierung von leicht zugänglichen α-CF3-Styrolen, um ein Stereozentrum mit den Substituenten F, CH2F und CF3 aufzubauen (bis zu 95 %, >20:1 vicinale:geminale Difluorierung). Der Austausch des metabolisch labilen benzylischen Protons führt zu einem stark präorganisierten Gerüst, welches durch Röntgenstrukturanalyse nachgewiesen werden konnte (π→σ* und stereoelektronische gauche σ→σ* Wechselwirkungen). Um die Basis für die vorläufige Validierung der Enantioselektivität zu bilden, wurde eine Katalysatoroptimierung durchgeführt.
Kurze, unfunktionalisierte aliphatische Gruppen (C1–C4) sind allgegenwärtige Strukturmerkmale im Naturstoffrepertoire und vor allem präsent in Polyketiden und Terpenen.1 Dies ist eine logische Konsequenz des iterativen Biosynthese-Algorithmus, in dem Fragmente mit niedrigem Molekulargewicht zu höheren Homologen verarbeitet werden.2 Diese Strukturmotive scheinen von Natur aus rudimentär zu sein, da sie durch die Verwendung von Acetyl- oder Propionyl-CoA,3 sowie über elektrophile Mechanismen mit S-Adenosylmethionin (SAM)4 eingeführt werden. Dennoch kodieren sie oft für hochspezifische Funktionen, so dass die Aufklärung ihrer biosynthetischen Ursprünge intensiv verfolgt wurde. So wird der Wert der Verwendung kleiner aliphatischer Gruppen zur Verbesserung der physikochemischen Profile von Wirkstoffkandidaten durch den “magischen Methyl Effekt” veranschaulicht.5
Die Aufklärung des stereochemischen Verlaufs enzymatischer Methylierungen hat eine lange Vergangenheit. Dabei stellte die achirale Natur des Motivs und das notwendige Design eines chiralen Bioisosters eine besondere Herausforderung dar, um die Übersetzung der stereochemischen Information verfolgen zu können.6, 7 Arigonis berühmte Synthese der chiralen Essigsäure bleibt eine tour de force in der stereokontrollierten Synthese und eine Meisterklasse der Orbitalsymmetrie zur Herstellung eines isotopisch orthogonalen Motivs (1H, 2H und 3H, Abbildung 1, oben).8 Während diese Isotopenstrategie im Bereich der mechanistischen Enzymologie noch immer oft verwendet wird, stützt sich der auf kleinen Fragmenten basierende Bioisosterismus im Wirkstoffdesign auf stabile Isotope, um die Pharmakokinetik und -dynamik von Wirkstoffkandidaten zu verbessern.9 Das Editieren von Molekülen mit Fluor (H→F) hat sich als besonders effektiv erwiesen,10 was sich vor allem in der zunehmenden Anzahl kleinerer, fluorierter Molekülen widerspiegelt, die bereits auf dem Markt erschienen sind.11 Dies ist sowohl eine Folge des geringen sterischen Anspruchs und der geringen Polarisierbarkeit von Fluor, als auch der Stabilität der C−F-Bindung. Angesichts des Erfolgs von achiralen Perfluoralkylgruppen in der Arzneimittelforschung, Katalyse und Agrochemie12 wären Routen zu kleinen, chiralen 3D- Fluoralkanmotiven von Vorteil, um weitere Bereiche des chemischen Raums erschließen zu können.
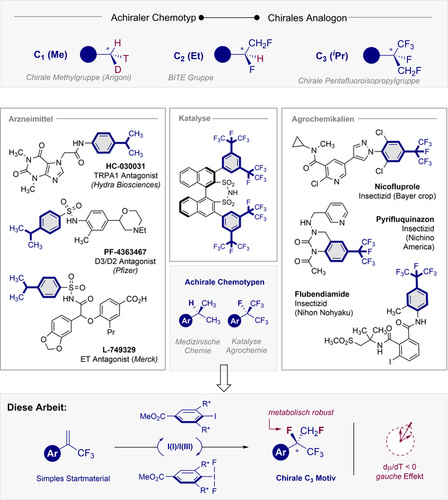
Oben: Chirale Bioisoster gängiger aliphatischer Gruppen. Mitte: Ausgewählte funktionelle niedermolekulare Verbindungen mit einer achiralen iPr und CF(CF3)2 Gruppe.12 Unten: Design eines Katalyseansatzes zur Bildung eines hybridischen, chiralen, fluorierten Analogon von iPr und CF(CF3)2.
Dazu gehört die BITE Gruppe (C2),13 welche ein bioisosterisches Hybrid aus der Ethyl- und Trifluormethylgruppe darstellt.14 In Anbetracht der Verbreitung von Isopropyleinheiten (C3) in bioaktiven Leitstrukturen und niedermolekularen Arzneimitteln (Abbildung 1, Mitte) wurde im Rahmen dieser Arbeit eine Katalyse-basierte Strategie für den Zugang zu einem differenziell fluorierten Analogon der iPr-Gruppe entwickelt. Mithilfe von Iod (I/III) Katalyse15 sollte eine formale 1,2-Addition von Fluor an das Alken16 simpler α-Trifluormethylstyrole zu einem stereogenen Zentrum führen, welches F, CH2F und CF3 trägt (Abbildung 1, unten).
Der Erfolg dieses Katalyse-basierten Ansatzes würde von der in situ Oxidation eines chiralen Aryliodid-Organokatalysators abhängen, um eine ArIF2-Spezies17 zu bilden, die ausreichend aktiv ist, um von einem elektronenarmen Alken angegriffen werden zu können. Das resultierende Pentafluoroisopropyl-Surrogat würde somit einen chiralen C3-Baustein darstellen, in dem das labile Proton der Methingruppe nicht mehr präsent ist.18 Darüber hinaus würden sich die intrinsischen hyperkonjugativen Wechselwirkungen des vicinalen Difluoromotivs19 in seiner Konfiguration manifestieren. Um Reaktionsbedinungen zu finden, die das gewünschte fluorierte Isopropylmotiv ausgehend von simplen α-Trifluoromethylstyrolen generieren, wurde eine Reaktionsoptimierung durchgeführt (Abbildung 2, 1 a→2 a). Zu diesem Zweck wurden einfache Aryliodide als kostengünstige Katalysatoren in Verbindung mit Selectfluor® als Oxidationsmittel untersucht, um die Schlüsselspezies ArI(III)F2 zu erzeugen.17 Erste Untersuchungen wurden bei Raumtemperatur in Chloroform mit einem Amin:HF Verhältnis von 1:7.5 durchgeführt und mittels 19F-NMR Spektroskopie unter Verwendung eines internen Standards analysiert. Iodbenzol erwies sich dabei als wirksamer Katalysator um (±)-2 a und 3 a in einem Verhältnis von 2.5:1 zu erzeugen (86 % kombinierte Ausbeute). Das letztgenannte Produkt entsteht durch die Bildung eines Phenonium-Ions, welches bereits zuvor in einer Reihe von Katalyse-basierten geminalen Difluorierungsprozessen verwendet wurde.20 Die Wiederholung dieser Reaktion mit p-Iodotoluol (5) führte zu einer deutlichen Verbesserung der Ausbeute (>95 %) bei vergleichbarer Regioselektivität zugunsten des gewünschten vicinalen Produkts 2 a (2.2:1).
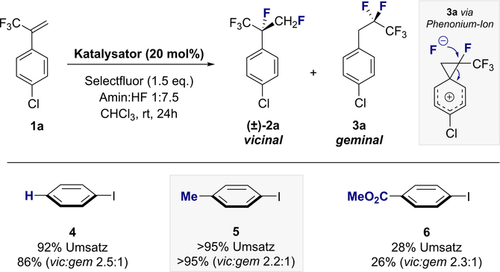
Identifizierung eines geeigneten Katalysators. Reaktionsbedingungen: α-CF3-p-Chlorostyrol 1 a (0.2 mmol), Katalysator (20 mol %), Selectfluor® (1.5 Äquiv.), Amin:HF 1:7.5 (0.5 mL), CHCl3 (0.5 mL), Raumtemperatur, 24 h. Die Ausbeute ist die Summe der geminal und vicinal fluorierten Produkte. Das Regioselektivitätsverhältnis (vic:gem) und die Ausbeute wurden mittels 19F-NMR Spektroskopie unter Verwendung von α,α,α-Trifluortoluol als interner Standard bestimmt. Ein Kontrollexperiment ohne Katalysator führte zu <5 % Ausbeute.
Die Veränderung der elektronischen Information wurde weniger toleriert, wobei sich das Esterderivat 6 unter vergleichbaren Bedingungen als weniger aktiver Katalysator erwies (26 %).
Kontrollexperimente in Abwesenheit des Katalysators führten zu <5 % Ausbeute und zeigen die stark deaktivierende Natur der Trifluormethylgruppe, welche Hintergrundreaktionen hemmt, wie sie von Lal und Mitarbeitern unter Verwendung von HF und Selectfluor® berichtet wurden.21
Um die Anwendbarkeit und Limitierungen dieser Katalyse-basierten Difluorierung von α-CF3 Styrolen zu untersuchen, wurde der Effekt der Brønsted Acidität22 als Funktion des Amin:HF Verhältnisses untersucht.16b Dies führte zur Etablierung der Methoden A, B und C, welche die Amin:HF Verhältnisse von 1:4.5, 1:6 bzw. 1:7.5 widerspiegeln (Abbildung 3 und 4). Methode A erwies sich als sehr effektiv bei der Bildung der elektronenreichen Produkte 2 b–2 d einhergehend mit hoher Regioselektivität, welche die Bildung des gewünschten vicinalen Produkts begünstigte (>20:1, bis zu 86 %). Die Präsenz der CF3-Gruppe unterscheidet diese Substratklasse deutlich von den bisher verwendeten Styrolen, welche sich zum geminalen Produkt umlagern.20 Kontrollexperimente bestätigten erneut die Notwendigkeit des Katalysators. Die scheinbar subtile Änderung zur Methode B erwies sich für die Substrate 2 e–2 k als optimal und ermöglichte die Bildung der Alkylderivate (2 e–2 h, bis zu >20:1 vic:gem) sowie des elektronenarmen Anilinderivats 2 i (74 %, 15.5:1). Auch für das biphenylische System 2 j und dessen Addukt 2 k wurde eine vergleichbare Effizienz und Selektivität festgestellt. Die weitere Erhöhung des Amin:HF Verhältnisses in Methode C lieferte optimierte Bedingungen für den Zugang zu den Produkten 2 a,l–2 q. Während der Einsatz höherer HF Verhältnisse/ Brønsted Aciditäten unter den von diesem Labor entwickelten Bedingungen die 1,1-Difluorierung20f tendenziell begünstigt, erwiesen sich die elektronenarmen α-CF3 Styrole als deutlich robuster gegenüber dieser Umlagerung und es wurden durchweg hauptsächlich die vicinalen Produkte gebildet. In Anbetracht der großen Bedeutung von Arylbromiden in der modernen medizinischen Chemie, in der das C(sp2)-Br den Ausgangspunkt für Kreuzkupplungen darstellt, wurde die Synthese von 2 l im 1 mmol-Maßstab durchgeführt. Trotz der Flüchtigkeit dieses Produktes konnte das vicinale Produkt in 43 % Ausbeute isoliert werden. Die Produkte 2 m, 2 n und 2 o verhielten sich ähnlich und wurden in einem vicinal:geminal Verhältnis von ca. 3:1 gebildet. Angesichts der Bedeutung von Anilinfragmenten mit Isopropyleinheiten bei der Entwicklung von Medikamenten und Agrochemikalien (siehe Abbildung 1) wurde das Phtalimid 2 p in 61 % isoliert. Des Weiteren wurde der Zugang zum disubstituieren Aryl 2 q geschaffen, einhergehend mit einer Verbesserung der Regioselektivität (5.0:1). Nach der Etablierung von Bedingungen, die die vicinale Difluorierung von α-CF3 Styrolen durch I(I)/I(III) Katalyse ermöglichen, wurde das Augenmerk auf die vorläufige Validierung einer enantioselektiven Variante gerichtet. Während p-Iodtoluol 5 zwar ein hochkompetenter Katalysator ist, fehlen Stellen zur Eingliederung von Gruppen zur Stereokontrolle. Um dies zu gewährleisten, wurde die Reaktion mit den Resorcinolderivaten 7–9 wiederholt, bei denen proximale Stereozentren Enantioselektivität induzieren könnten. Während sich die Katalysatoren 7 und 8 als mäßig effektiv erwiesen, führte der Ausgleich der elektronischen Effekte des Resorcinols durch die Etablierung von p-CO2Me im Katalysator 9 zu einer deutlich verbesserten Katalyse (87 % Ausbeute, vicinal:geminal 3:1).
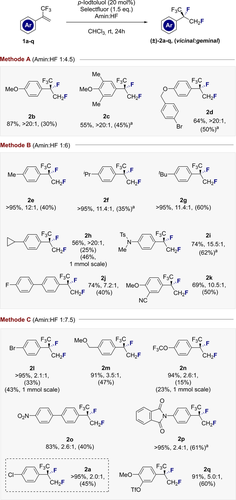
Anwendungsbereich der vicinalen Difluorierung von α-CF3- Styrolen zur Generierung der fluorierten Isopropylgruppe. Die Ausbeute ist die Summe der geminal und vicinal fluorierten Produkte. Das Regioselektivitätsverhältnis (vic:gem) und die Ausbeute wurden mittels 19F-NMR Spektroskopie unter Verwendung von α,α,α-Trifluortoluol als interner Standard bestimmt. Isolierte Ausbeuten der vicinalen Produkte in Klammern. a Reaktionszeit verlängert zu 48 h. Willkürliches Enantiomer der Produkte ist abgebildet. Bemerkung: Die Produkte sind meist sehr flüchtig und besondere Vorsicht während der Isolierung ist geboten.
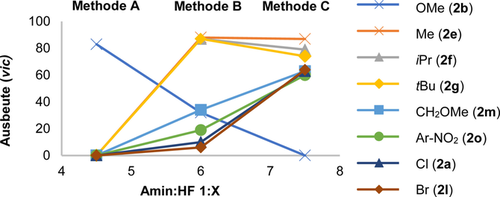
Der Effekt der Brønsted Acidität auf die Katalyse.
Als logischer nächster Schritt wurden C2-symmetrische Resorcinolderivate untersucht, wie in Abbildung 5 zusammengefasst.23, 24 Die Reaktionen wurden unter Standardbedingungen mit einem Amin:HF Verhältnis von 1:7.5 in Chloroform bei Raumtemperatur durchgeführt. Zunächst wurde der Effekt der Modifizierung des Substituenten X anhand der Metyhlester 10–13 untersucht. Kontraintuitiv hatte die Vergrößerung des sterischen Anspruchs an der Stelle X einen nachteiligen Effekt auf die Selektivität. Der Katalysator 10 (X=Me) erwies sich als am effektivsten und erzeugte Verbindung 2 a mit 86:14 e.r. (>95 % Umsetzung, 88 % kombinierte Ausbeute). Strukturelle Veränderungen an der Stelle Y wurden nicht toleriert, wie die Katalysatoren 14–16 zeigen. Als Kontrollreihe wurden die C1-symmetrischen Katalysatoren 17–19 untersucht (Abbildung 5, unten). Der direkte Vergleich von 17 mit dem vielversprechendsten Gerüst 10 bestätigte die Bedeutung der C2-Symmetrie (72:28 versus 86:14 e.r.). Interessanterweise führte die Substitution des Methylesters durch Benzyl (Katalysator 18) nicht zu einer Verschlechterung der Selektivität, wenngleich die Effizienz abnahm.
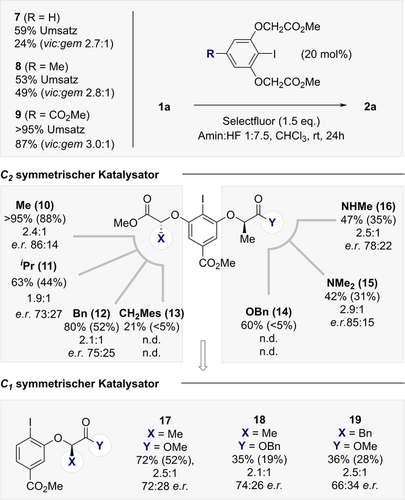
Katalysatoroptimierung, um die vorläufige Validierung der Enantioselektivität zu ermöglichen. Umsatz und kombinierte Ausbeute (in Klammern) wurde mittels 19F-NMR Spektroskopie der unaufgearbeiteten Reaktionsmischung unter Verwendung von α,α,α-Trifluorotoluol als interner Standard bestimmt. Enantioselektivität durch chirale HPLC bestimmt. Standard Reaktionsbedingungen: α-CF3-p-Chlorostyrol 1 a (0.2 mmol), Katalysator (20 mol %), Selectfluor® (1.5 Äquiv.), Amin:HF 1:7.5 (0.5 mL), CHCl3 (0.5 mL), Raumtemperatur, 24 h.
Weiterhin erwies sich der α-Bn-Katalysator (19) als weniger effizient als das C2-symmetrische Derivat 12. Nachdem Katalysator 10 als das vielversprechendste Gerüst für die Validierung eines enantioselektiven Prozesses identifiziert wurde (weitere Details siehe ESI), wurde eine repräsentative Auswahl von α-CF3 Styrolen den allgemeinen Katalysebedingungen unter Verwendung von 10 unterzogen (Abbildung 6).
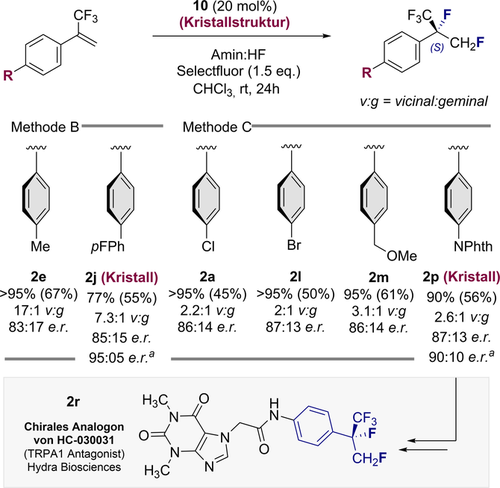
Die Ausbeute ist die Summe der geminalem und vicinal fluorierten Produkten. Das Regioselektivitätsverhältnis (vic:gem) und die Ausbeuten wurden mittels 19F NMR Spektroskopie unter Verwendung von α,α,α-Trifluortoluol als interner Standard bestimmt. Isolierte Ausbeuten der vicinalen Produkte in Klammern. Enantioselektivität durch chirale HPLC bestimmt. a Nach Umkristallisation. Bemerkung: Die Produkte sind meist sehr flüchtig und besondere Vorsicht während der Isolierung ist geboten.
Erfreulicherweise wurde das Methylderivat reibungslos difluoriert und führte zur Bildung von 2 e (>95 %, 17:1 vicinal:geminal, 83:17 e.r.). Das fluorierte Biarylsystem 2 j wurde ebenfalls unter den Reaktionsbedingungen toleriert und konnte mit einer Regioselektivität von 7:1 vicinal:geminal und 85:15 e.r. (95:05 e.r. nach Umkristallisation) hergestellt werden. Die p-Cl und p-Br-Derivate 2 a und 2 l wurden mit 86:14 bzw. 87:13 e.r. hergestellt, 2 m in 86:14 e.r. und das geschützte Amin 2 p in 87:13 e.r. (90:10 e.r. nach Umkristallisation). Angenehmerweise waren die Verbindungen 2 j und 2 p kristallin, so dass die (S)-Konfiguration dem neuen Stereozentrum zugeordnet werden konnte (vide infra).25 Schließlich wurde das Phtalimid-Derivat 2 p in einer kurzen synthetischen Sequenz in ein Analogon des TRPA1-Antagonisten HC-030031 2r überführt. (Abbildung 6, unten. Vollständige Details in der ESI).
Um das breite Spektrum an verfügbaren Methoden zur Konstruktion kurzer, nichtfunktionalisierter aliphatischer Gruppen für die Wirkstoffforschung zu erweitern, wurde in dieser Studie eine Katalyse-basierte Strategie für den Zugang zu einem chiralen Hybrid aus Isopropyl- und CF(CF3)2-Gruppen entwickelt. Dies dient der Erweiterung des aktuellen Portfolios an fluorierten Wirkstoffmodulen für die Wirkstoffforschung (Abbildung 7, Mitte).13, 26 Trotz der intrinsischen sterischen und elektronischen Herausforderungen, die mit der Erzeugung fluorierter Stereozentren verbunden sind, ermöglicht diese I(I)/(III)-Katalyseplattform eine reibungslose Difluorierung von α-CF3 Styrolen (bis zu >20:1 vicinal:geminal).
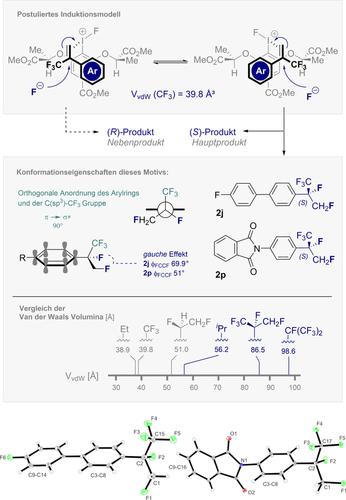
Vorläufiges Induktionsmodell und Kristallstruktur der Verbindungen 2 j und 2 p. Die thermischen Ellipsoide repräsentieren eine Aufenthaltswahrscheinlichkeit von 15 %. CCDC 2044630 (2 j) und 2044631 (2 p).
Bemerkenswert dabei ist, dass die CF3-Gruppe die mit elektronenreichen Styrolen assoziierte Phenonium-Ionen Umlagerung effektiv hemmt, so dass Produkte wie 2 b mit einem ausgezeichneten Grad an Regiokontrolle (>20:1) erstmals gebildet werden können. Schließlich wird die vorläufige Validierung einer enantioselektiven Variante berichtet. Obwohl die sterisch anspruchsvollen Phenyl- und Trifluormethylsubstituenten (VvdW (CF3)=39.8 Å3)10e, 27 diesen intermolekularen Prozess zu einer Herausforderung machen, ist es umso erfreulicher, vielversprechende Werte der Enantioselektivität zu beobachten. Dazu wird ein vorläufiges Induktionsmodell vorgeschlagen, in dem die faziale Differenzierung des enantiobestimmenden Fluorid-Angriffs eine Voraussetzung für die Selektivität ist. Da Röntgenstrukturanalysen von 2 j und 2 p bestätigen, dass das Hauptenantiomer (S)-konfiguriert ist (Abbildung 7), ist es denkbar, dass stabilisierende elektrostatische Wechselwirkungen (RCF2δ−F⋅⋅⋅δ+H-CH2R),28 die Katalysator-Substrat-Präorganisation beeinflussen können.29 Eine einfache sterische Diskriminierung (CF3 vs. Ph) ist nicht konsistent mit den beobachteten Selektivitäten der C1-symmetrischen Katalysatoren. Die Festkörperanalyse zeigt weiterhin einen stereoelektronischen gauche Effekt (σ→σ*; φFCCF=69.9° und 51° für 2 j und 2 p) sowie Orthogonalität der CF3-Gruppe zur Ebene des π-Systems (π→σ*).30 Die Untersuchungen des physikochemischen Profils dieses neuen Motivs im Zusammenhang mit der Entwicklung von Arzneimitteln und Agrochemikalien ist der Schwerpunkt laufender Studien und soll zu gegebener Zeit veröffentlicht werden.
Acknowledgements
Wir bedanken uns für die großzügige finanzielle Unterstützung durch die Westfälische Wilhelms-Universität Münster, den European Research Council (ERC Consolidator Grant – Project Number 818949-RECON, für RG), die Deutsche Forschungsgemeinschaft (Cluster of Excellence “Cells in Motion – CiM” (FF-2013-10) und SFB 858) und der Alexander von Humboldt Stiftung (Humboldt-Forschungsstipendium für JJM). Wir bedanken uns bei M.Sc. Tomáš Neveselý (WWU Münster) für hilfreiche Diskussionen. Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Conflict of interest
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.




