Teerfarben-basierte Koordinationskäfige und -helikate
In memoriam Professor François Diederich
Abstract
Wir berichten über den Einbau klassischer Teerfarben (Michlers Keton, Methylen Blau, Rhodamin B und Kristallviolett) in selbstassemblierte Strukturen der Formel [Pd2L4]. Die Chromophore wurden unter Verwendung von Piperazin-Linkern in bis-monodentate Liganden integriert. Dies erlaubt die Erhaltung der für die intensive Farbgebung verantwortlichen auxochromen Dialkylamin-Funktionen. Liganden mit Pyridin-Donoren bilden laternenförmige dinukleare Käfige, während Chinolin-Donoren stark gewundene [Pd2L4]-Helikate ergeben. In einem Fall konnte mittels Röntgenstrukturanalyse eine [Pd3L6]-Ringstruktur im Festkörper nachgewiesen werden. Für neun untersuchte Derivate, in Farben von Gelb bis Dunkelviolett, konnte mittels CD-Spektroskopie chirale Induktion durch einen enantiomerenreinen Gast gezeigt werden. Ionenmobilitäts-Massenspektrometrie erlaubt die Unterscheidung zweier Bindungsmodi. Nanostrukturen basierend auf dieser neuen Ligandenklasse versprechen Anwendungen in chiropitscher Erkennung, Photo-Redox-Katalyse und funktionalen Materialien.
Der Einbau organischer Chromophore in supramolekulare Strukturen, um diese mit vielfältigen Funktionen auszustatten, ist gut untersucht. Beispielsweise nutzen künstliche Systeme zur Umwandlung von Solarenergie häufig aus mehreren Porphyrinen zusammengesetzte Lichtsammelkomplexe, welche Energietransfer und Ladungstrennung ermöglichen.1 Organische Materialien basierend auf einer nicht-kovalenten Anordnung photoaktiver Bausteine werden als Komponenten für Displays, Lichtquellen und optoelektronische Schaltkreise eingesetzt.2 Zahlreiche Beispiele für Rezeptoren mit optischer Auslesefunktion, photoschaltbare Nanostrukturen und Licht-kontrollierte molekulare Maschinen wurden bereits publiziert.3 In letzter Zeit begann die Photoredoxchemie die Vorteile der supramolekularen Organisation organischer oder Metall-basierter Chromophore in funktionalen Systemen, z. B. für die katalytische Oxidation von Alkoholen4 oder die Cycloaddition an Anthracene,5 zu nutzen. Farbstoff-basierte selbstassemblierte Strukturen wurden weiterhin im Bereich Bioimaging6 und in medizinischen Anwendungen wie der photodynamischen Therapie untersucht.7
Hinsichtlich einzelner Koordinationskäfige mit zugänglicher Kavität (beispielsweise den bekannten [Pd2L4]-Systemen)8 konnten Radikalreaktionen in Wirten realisiert werden, deren Seitenwände durch Einstrahlen von Licht in angeregte Zustände überführt wurden.9 Käfige wurden weiterhin als Photosensibilisatoren für die Bildung von Singulett-O210 und als Reagenzien für photochemische Wasserstoff-Bildung genutzt.11 Allerdings basieren die meisten dieser Systeme auf Chromophoren, die im UV- bzw. Kurzwellenbereich absorbieren, was in farblosen oder gelblichen Substanzen resultiert. Ausnahmen umfassen Verbindungen, die auf stark farbigen Charge-Transfer-Komplexen12 oder Metallo-Liganden beruhen,13 sowie Architekturen, die auf photochromen Diarylethenen (schaltbar zwischen Blassgelb und Dunkelblau),14 Perylenen,15 Porphyrinen,16 Triarylaminen17 und BODIPY basieren.18
Die so genannten “Teerfarbstoffe” (insbesondere aminierte Triarylmethan-, Xanthen- und Phenotiazin-Derivate, gewonnen aus dem Steinkohlenteer) gehörten zu den ersten “Block-Buster”-Chemikalien der aufstrebenden chemischen Industrie des 19. Jahrhunderts. Bis heute werden sie in großen Margen produziert und finden weitreichende Anwendung als Redox- und pH-Indikatoren,19 Photosensibilisatoren,20 Farbstoff-basierte Lasermaterialien,21 zur Gewebefärbung in der Biologie22 und weiteren Bildgebungszwecken.23 Ihr industrieller Einsatz umfasst das Färben von z. B. Stoffen, Polymeren, Papier, Haaren und Lebensmitteln. Indessen scheinen sie im Kontext selbstassemblierter Systeme als integrale Strukturelemente unterrepräsentiert und wurden lediglich als Additive, z. B. als Photosensibilisatoren für 1O2-Bildung,24 genutzt. Nicht-kovalent eingeschlossen in einem metallvermittelten Wirt wurden derartige Farbstoffe des Weiteren zur Protonenreduktion in Kombination mit Cobalt-Zentren genutzt.25
Eine vollständige Integration dieser Chromophore in verbrückenden Positionen metallo-supramolekularer Strukturen erfordert allerdings die Funktionalisierung mit mindestens zwei koordinierenden Komponenten. Betrachtet man die generelle Struktur der hier studierten Farbstoffe (Box in Abbildung 1), wird deutlich, dass eine Verknüpfung über typischerweise als Linker eingesetzte Alkine oder Arene keine Anwendung finden kann. Speziell eine Entfernung der auxochromen Dialkylamine würde nicht toleriert werden, da sie fundamentaler Bestandteil des delokalisierten π-Systems sind, welches für die intensive Färbung verantwortlich ist.
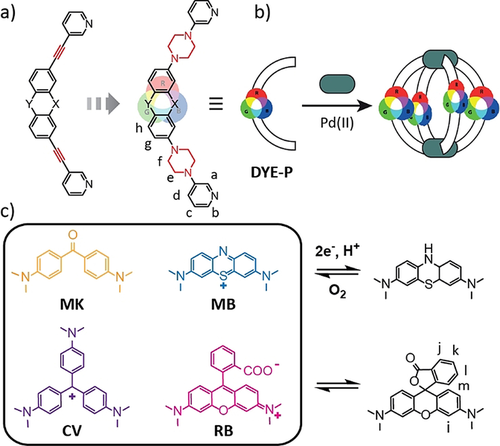
a) Design der farbstoffbasierten, bis-monodentaten Liganden (DYE-P) im Gegensatz zu Liganden mit Alkin-Verbrückung; b) Bildung des [Pd2L4]-Käfigs; c) ausgewählte organische Chromophore für diese Studie: Michlers Keton MK, Kristallviolett CV, Methylen-Blau MB (im blauen/oxidierten/kationischen und farblosen/reduzierten/ungeladenen Zustand) und Rhodamin B RB (in seiner pinken/zwitterionischen und farblosen Lacton-Form).
Hier zeigen wir, wie die Einführung von Piperazin-Linkern zwischen Teerfarben-basierten Rückgraten (Michlers Keton MK, Kristallviolett CV, Methylen-Blau MB, Rhodamin B RB) und Metall-koordinierenden Donorgruppen die Erhaltung der typischen Chromophor-Charakteristika garantiert (Abbildung 1 a).26 Außerdem sollten Piperazine, als aliphatische Linker, das Rückgrat elektronisch von der Donorregion entkoppeln und gleichzeitig die Koordination an das Metallzentrum nicht beeinträchtigen, trotz ihrer Ethylendiamin-ähnlichen Struktur. Zwei verschiedene Donorgruppen (3-Pyridyl P und 8-Isochinolinyl Q) wurden untersucht, wobei acht (plus ein Derivat) Liganden erhalten werden konnten, die alle intensiv gefärbte PdII-vermittelte Käfige oder Helikate bilden (Namen der Liganden bestehen aus Rückgrat- und Donorgruppen-Benennung; vgl. Abbildung S1 in der SI für die Struktur aller Liganden). Weiterhin zeigen wir, wie ein chiraler anionischer Gast seine konfigurative Information auf die selbstassemblierten Strukturen überträgt und zwischen laternenförmigen Pyridyl-Käfigen und verdrillten Isochinolinyl-Helikaten unterscheidet.
Ligand RB-P wurde in nur zwei Schritten mittels Buchwald-Hartwig-Aminierung ausgehend von literaturbekanntem, tosyliertem Fluorescein und kommerziell verfügbarem 3-Piperazylpyridin synthetisiert. Dem gleichen Synthesemuster folgend wurde Ligand MK-P aus 4,4′-Dihydroxybenzophenon erhalten. Ligand CV-P wurde über eine Grignard-Reaktion von 4-MgBr-N,N-Dimethylanilin an Ligand MK-P synthetisiert. Die Synthese von MB-P erfolgte nach literaturbekanntem Verfahren27 für substituierte MB-Derivate. Sowohl CV-P als auch MB-P tragen eine positive Ladung, wobei ihre Halogen-Gegenanionen in einem finalen Syntheseschritt mittels Metathese unter Verwendung der entsprechenden Silbersalze gegen nicht-koordinierende Anionen (BF4− oder NO3−) ausgetauscht wurden.
Eine quantitative Bildung der Käfige [Pd2(RB-P)4], [Pd2(MK-P)4], [Pd2(MB-P)4] und [Pd2(CV-P)4] wurde erreicht, indem eine Mischung der jeweiligen Liganden RB-P, MK-P, MB-P und CV-P in einem 2:1-Verhältnis mit den Palladium(II)-Salzen [Pd(CH3CN)4](BF4)2 oder Pd(NO3)2 in [D6]DMSO bei 70 °C für 15 min erhitzt wurde. In vollständiger Übereinstimmung mit von uns bereits publizierten PdII-Käfigen28 zeigte sich bei Koordination der Liganden an das Metallzentrum eine Tieffeld-Verschiebung der Pyridin-1H-NMR-Signale (besonders Ha and Hb, siehe SI und Abbildung 2 a für [Pd2(RB-P)4]). Des Weiteren stützen 1H-DOSY-NMR-Ergebnisse und hochaufgelöste ESI-Massenspektrometrie die Bildung des gewünschten Produktes (SI und Abbildung 2 b). Langsame Diffusion von Toluol in eine Lösung von [Pd2(MK-P)4] in DMSO (Abbildung 2 c), von EtOAc in eine Lösung von [Pd2(RB-P)4] in DMSO (Abbildung 2 d) und von MTBE in eine Lösung von [Pd2(CV-P)4] in DMF (Abbildung 2 e) führte zur Bildung von für die Röntgenstrukturanalyse geeigneten Einkristallen. In der Struktur von [Pd2(MK-P)4] zeigen alle Piperazine eine Fehlordnung bezüglich der Ringinversion ihrer Sesselkonformation auf (Besetzung ca. 50:50), was auf eine gewisse Flexibilität der Linker hindeutet. Die Struktur im Festkörper von [Pd2(RB-P)4] offenbart zwei mögliche Orientierungen der Spirolacton-Gruppe in jedem Liganden, was zur Bildung von vier unterschiedlichen Isomeren führt (Abbildung S46). Diese Beobachtung ist konsistent mit breiten Signalen im 1H-NMR-Spektrum dieses Käfigs.
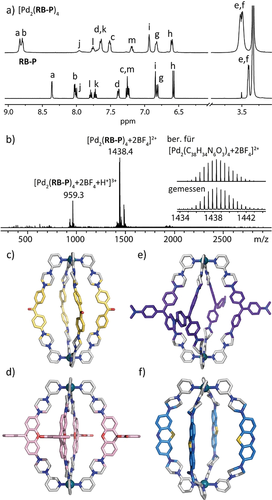
a) 1H-NMR-Spektren in [D6]DMSO von Ligand RB-P und Käfig [Pd2(RB-P)4]; b) ESI-MS-Spektrum von Käfig [Pd2(RB-P)4]. Seitenansicht der Röntgenstruktur33 im Festkörper von c) [Pd2(MK-P)4], d) [Pd2(RB-P)4] (nur eine Form des fehlgeordneten Rückgrats gezeigt) und e) [Pd2(CV-P)4]; f) DFT-Modell (B3LYP/def2-SV(P)) von [Pd2(MB-P)4]. Gegenionen und Lösungsmittelmoleküle nicht dargestellt.
MB ist bekannt dafür, sich relativ einfach in seine farblose Leukoform überführen zu lassen, was uns dazu veranlasste, zu untersuchen, ob dieses Verhalten in Käfig [Pd2(MB-P)4] erhalten bleibt. In der Tat führte die Behandlung von [Pd2(MB-P)4] mit Zn-Pulver zu einer teilweisen Entfärbung. Weiterhin zeigte die Analyse mittels ESI-MS eine statistische Verteilung von oxidierten (MB-P) und reduzierten (MBR-P) Liganden, wobei die beobachteten Signale mit der Formel {[Pd2(MB-P)x(MBR-P)4−x](BF4)4+x−z}z+ (x=1–3; z=2–4; Abbildung S63) beschrieben werden können.
Als Nächstes haben wir Isochinolin-Donoren eingeführt, um die [Pd2L4]-Strukturen mit einem helikalen Twist auszustatten (Abbildung 3). Gemäß vorstehend genanntem Verfahren wurden die Liganden MK-Q, RB-Q, MB-Q, CV-Q unter Verwendung von 8-(Piperazin-1-yl)isochinolin synthetisiert. Zugehörige [Pd2(DYE-Q)4]-Helikate wurden assembliert, wie bereits für die Pyridin-Derivate beschrieben, unterscheiden sich jedoch hiervon durch ihr charakteristisches dynamisches Verhalten. Wie bereits beschrieben,29 nehmen [Pd2L4]-Koordinationskäfige mit nach innen zeigenden Isochinolinyl-Donoren eine helikale Struktur an, bei welcher die Liganden um die Pd2-Achse gewunden sind, was in M- und P-konfigurierten Konformeren resultiert. Abbildung 3 b zeigt das 1H-NMR-Spektrum von [Pd2(MB-Q)4] bei unterschiedlichen Temperaturen in [D6]DMSO. Bei Raumtemperatur spalten die CH2-Protonen der Piperazin-Einheiten in acht breite Signale auf, was durch ihre diastereotope Natur in chiraler Umgebung bei langsamer Ringinversion bedingt ist. Bei 75 °C koaleszieren alle acht Signale zu zwei stark verbreiterten Signalen, was zu erwarten war, da dann sowohl die Piperazin-Ringinversion als auch der globale Twist des Käfigs in Bezug auf die NMR-Zeitskala stark beschleunigt erfolgen. Wir postulieren, dass diese Dynamiken Lösungsmittel-abhängig sind. In der Tat zeigt das 1H-NMR-Spektrum von [Pd2(MB-Q)4] in D2O bei Raumtemperatur lediglich zwei Signale (Abbildung S99), was auf eine schnellere Austauschdynamik im wässrigen Medium hindeutet.
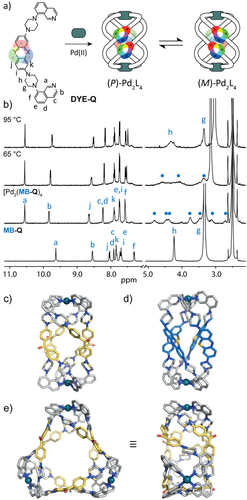
a) Bis-Isochinolinyl-Liganden (DYE-Q) bilden helikale Strukturen mit zwei enantiomeren Konformeren; b) 1H-NMR-Spektren in [D6]DMSO von MB-Q und [Pd2(MB-Q)4] bei angegebenen Temperaturen. DFT-Modelle (B3LYP/def2-SV(P) von c) [Pd2(MK-Q)4] und d) [Pd2(MB-Q)4]; e) Drauf- und Seitenansicht der Röntgenstruktur im Festkörper von [Pd3(MK-Q)6].33 Gegenionen und Lösungsmittelmoleküle nicht dargestellt.
Für [Pd2(MK-Q)4] wurde ein ähnliches NMR-Verhalten beobachtet (Abbildung S94). Durch langsame Diffusion von Toluol in eine Lösung von [Pd2(MK-Q)4] in DMSO konnten kleine gelbe Kristalle für Synchrotron-Röntgenbeugungsexperimente gewonnen werden. Während ESI-MS und DOSY-NMR klar die Bildung einer dinuklearen [Pd2(MK-Q)4]-Stöchiometrie zeigen (Abbildung S90–S93; Modell Abbildung 3 c), offenbarte die erhaltene Struktur im Festkörper überraschenderweise die Bildung eines dreigliedrigen Rings [Pd3(MK-Q)6] (Abbildung 3 e). Wir vermuten, dass während des Kristallisationsprozesses eine strukturelle Reorganisation stattfindet, welche durch die Flexibilität des MK-Rückgrats begünstigt wird.
Nachfolgend analysierten wir den Käfig [Pd2(RB-Q)4]. Aufgrund eines ausgeprägten Koaleszenzverhaltens liegen dessen 1H-NMR-Signale bei Raumtemperatur stark verbreitert vor. Bei höheren Temperaturen werden einige Signale schärfer, während bei niedrigeren Temperaturen ebenfalls Signale schärfer werden, jedoch ein komplexeres Aufspaltungsmuster zeigen. Da die ESI-MS-Analyse die exklusive Bildung von [Pd2(RB-Q)4] zeigte, ordneten wir dieses komplexe NMR-Verhalten der Isomerisierung der Spirolactone (wie bereits für [Pd2(RB-P)4] diskutiert) in Verbindung mit der dynamischen Umwandlung zweiter chiraler Konformere zu (Abbildung S97). Eine hochinteressante Eigenschaft von RB ist seine Transformation zwischen farblosem Spirolacton und intensiv pink gefärbter zwitterionischer Form, welche von der Polarität des Lösungsmittels abhängt (Abbildung 1). Die Exposition einer farblosen Lösung von [Pd2(RB-P)4] in DMSO (Lösungsmittelpolarität nach Reichardt ETN=0.44)30 führt durch zunehmende Mengen Acetonitril (ETN=0.46), Methanol (ETN=0.76) oder Wasser (ETN=1.00) zu einer schrittweisen Zunahme der typisch pinken Farbgebung (Abbildung 4 a). Da die zugehörigen NMR-Spektren starke Signalverbreiterung zeigten, was die Quantifizierung der Anteile offener Chromophore beeinträchtigt, haben wir Ligand RB-P in Ligand RE-P konvertiert. In diesem liegt die farbige offene Form mittels Veresterung der Carboxylat-Einheit arretiert vor. Der zugehörige Käfig [Pd2(RE-P)4] konnte so gebildet und eindeutig charakterisiert werden (siehe Abschnitt 3.2.5 der SI).
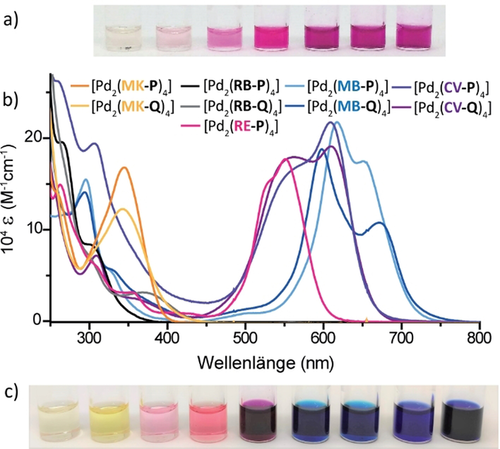
Fotos von 0.7 mm Lösungen von a) [Pd2(RB-P)4] in reinem DMSO bis zu DMSO/D2O-Mischungen im Verhältnis 9:1 (von links nach rechts). b) UV/Vis-Absorptionsspektren aller neun farbigen Käfige/Helikate in DMSO; c) 0.7 mm DMSO-Lösungen (Reihenfolge wie Kennzeichnung in (b)).
Im Folgenden haben wir 1H-DOSY-NMR-Spektren der farbigen DYE-P- und DYE-Q-Liganden und der korrespondierenden Käfige und Helikate aufgenommen, um ihre Dimensionen in Lösung zu vergleichen. Interessanterweise ist der hydrodynamische Radius der [Pd2(DYE-Q)4]-Helikate etwas kleiner als der aus den DYE-P-Liganden gebildeten Analoga (Tabelle S2), obwohl die DYE-Q-Systeme bedingt durch ihre größere Donorgruppe eine höhere Masse besitzen als die DYE-P-Konstrukte. Diese Beobachtung ist in Einklang mit den Ergebnissen aus Einkristallröntgenstrukturanalysen und DFT-Berechnungen, welche zeigen, dass [Pd2(DYE-P)4]-Käfige eine eher kugelförmige Gestalt mit größerer Kavität aufweisen, wohingegen die [Pd2(DYE-Q)4]-Helikate eine schraubenförmige Struktur mit kleineren, weniger zugänglichen Kavitäten aufweisen (Abbildungen 2, 3 und S115).
Bedingt durch die dreidimensionale Chromophor-Anordnung und die starke Absorption im sichtbaren Spektrum (Abbildung 4 b,c) untersuchten wir eine Anwendung in der chiralen Erkennung kleiner Moleküle. Zunächst konnte die Bindung von (R)-Camphersulfonat (CSA) in den Käfigen [Pd2(RB-P)4] und [Pd2(RE-P)4] in DMSO mittels 1H-NMR-Spektroskopie (Verschiebung der nach innen zeigenden Protonen) und ESI-Massenspektrometrie nachgewiesen werden. Jedoch zeigte keiner der Wirt-Gast-Komplexe eine CD-Signatur in der Region 250–800 nm, welche auf einen Chiralitätstransfer zwischen Wirt und Gast hinweisen würde. Da vergleichbare Beobachtungen für alle anderen sieben Käfige gemacht wurden (siehe SI bzgl. ESI-MS- und CD-Spektren), vermuten wir, dass das relativ kleine, monoanionische (R)-CSA-Molekül nicht in der Lage ist, eine bevorzugte Orientierung der diastereomeren Wirt-Gast-Komplexe zu induzieren.31 Wir testeten darauffolgend das größere, zweifach negativ geladene (R)-1,1′-Binaphthyl-2,2′-disulfonat (BINSO3). Äquimolare Lösungen aller neun farbigen Koordinationskäfige zusammen mit (R)-BINSO3 wurden in DMSO angesetzt, und eine Auswahl der CD- und UV/Vis-Absorptionsspektren ist in Abbildung 5 a gezeigt. In den spektralen Regionen, wo die Käfige (nicht aber der Gast) absorbieren, zeigen induzierte CD-Signale einen Gast-zu-Wirt-Chiralitätstransfer (weitere Spektren siehe SI).
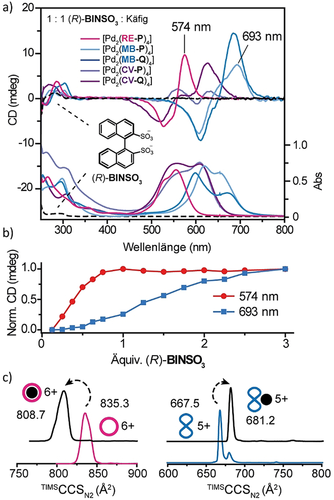
a) CD- und UV/Vis-Absorptionsspektren einer Lösung von 18.75 μm Käfig (siehe Legende) mit 1 Äquiv. Gast (R)-BINSO3 in DMSO bei 25 °C. b) CD-Intensitäten bei 574 und 693 nm einer 18.75 μm 1:1-Mischung der Käfige [Pd2(RE-P)4] und [Pd2(MB-Q)4] bei steigender Menge (R)-BINSO3 in DMSO bei 25 °C. c) Ionenmobilitätsexperimente zeigen Gas-Einlagerung für Käfig [Pd2(RE-P)4] im Vergleich zu außenseitiger Anlagerung für Helikat [Pd2(MB-Q)4].
Hiernach studierten wir unterschiedliche Gastbindungspräferenzen, indem (R)-BINSO3 zu einer kinetisch stabilen, narzisstischen 1:1-Mischung von laternenförmigem [Pd2(RE-P)4] und helixförmigem [Pd2(MB-Q)4] gegeben wurde. Es zeigte sich, dass der Gast bevorzugt mit dem kugelförmigen, pinken gegenüber dem helikalen, blauen Gebilde interagiert. Die deutlich unterscheidbaren CD-Signaturen beider Käfige erlaubten es, diesen Prozess in einem Titrationsexperiment zu verfolgen: Während die induzierte CD-Bande bei 574 nm steigt, bis ein Äquivalent des Gastes hinzugegeben wurde, zeigt die Bande bei 693 nm ihren steilsten Anstieg, nachdem die 1:1-Stöchiometrie erreicht ist (Abbildung 5 b). Wir schreiben dies der Neigung von (R)-BINSO3 zu, innerhalb der Kavität des eher kugelförmigen [Pd2(DYE-P)4]-Käfigs zu binden (wie durch 1H-NMR-Titrationen bestätigt), während wir im Fall der Chinolinyl-basierten Helikate eine schwache Bindung von außen annehmen. Tatsächlich zeigt eine Titration von (R)-BINSO3 zu einer Lösung von [Pd2(MB-Q)4] eine einfache Abnahme der Intensität aller NMR-Signale, was auf eine Anionen-induzierte Aggregation der kationischen Strukturen hinweist. Ferner zeigen ESI-MS-Spektren von (R)-BINSO3 mit den Käfigen [Pd2(DYE-P)4] lediglich Signale der Wirt-Gast-Komplexe, während diese im Falle der Helikate [Pd2(DYE-Q)4] entweder gar nicht (für [Pd2(MK-Q)4] und [Pd2(RB-Q)4]) oder sehr klein und in Verbindung mit zahlreichen Peaks des freien Wirts nachzuweisen sind. In diesem Fall erwies sich Massenspektrometrie, gekoppelt mit Ionenmobilitätsmessungen (TIMS), als hilfreich bei der Unterscheidung der vorgeschlagenen Bindungsmodi: Während Bindung innerhalb des Käfigs zu einer Kontraktion der Käfig-Gast-Komplexes führte, erhöhte außenseitige Assoziation stattdessen den Kollisionsquerschnitt (collisional cross section; CCS; Abbildung 5 c und SI).
Zusammenfassend stellen wir neun [Pd2L4]-Strukturen basierend auf einer neuartigen Familie funktionaler, bis-monodentater Liganden vor, welche aus den Strukturen klassischer Teerfarben entwickelt wurden. Diese wurden über auxochrome Piperazine zu zwei verschiedenen Typen von N-Donoren verbrückt. Pyridin-basierte Liganden bilden dabei laternenförmige Käfige mit zugänglichen Kavitäten, während isochinolinbasierte Liganden racemische Mischungen stark verdrillter Helikate bilden. Für alle Verbindungen konnte die Erhaltung der elektronischen Struktur des zugrundeliegenden Farbstoffes nachgewiesen werden, was zur chiralen Erkennung kleiner Anionen genutzt wurde. NMR- und CD-Titrationen sowie mit Ionenmobilitätsuntersuchungen gekoppelte Massenspektrometrie zeigen, dass die chiralen Anionen einerseits über Gast-Bindung innerhalb der Käfige interagieren, andererseits über externe Assoziation an die Helikate. Diese neue Klasse Farbstoff-funktionalisierter Strukturen, welche ein Farbspektrum von Gelb bis Blau/Violett abdeckt, basiert auf Chromophoren mit einem gut etablierten Anwendungsfeld. Damit bietet sich eine Grundlage für die Entwicklung von Photo-Redox-Katalysatoren mit nanometergroßen Reaktionsvolumina, künstlichen Lichtsammeleinheiten sowie diagnostischen Hilfsmitteln für die chiroptische Erkennung von Biomolekülen und -polymeren.
Acknowledgements
I.R. dankt dem FCI für ein Kekulé-Doktorandenstipendium. Wir danken dem ERC für Unterstützung durch ERC Consolidator Grant 683083 (RAMSES). Diese Arbeit wurde finanziert von der DFG unter dem Programm Exzellenzstrategie – EXC 2033–390677874 – RESOLV. Wir danken Jerome Günes, Chuan Dong, Lorenz Hündgen, Laura Schneider und André Platzek für ihre Hilfe bei Synthese und Analyse und Prof. Lars Schäfer, Ruhr-Universität Bochum, für seine Hilfe bei Berechnungen. Diffraktionsdaten von [Pd2(RB-P)4], [Pd2(CV-P)4] und [Pd3(MK-Q)6] wurden am PETRA III, DESY (Hamburg, Deutschland), einem Mitglied der Helmholtz-Gemeinschaft, erhalten. Wir danken Eva Crosas, Sofiane Saouane und Anja Burkhardt für ihre Hilfe an der Beamline P11 (I-20180412, I-20191452, I-20180990).32 Ferner danken wir Kristina Ebbert und Dr. Gabriele Trötscher-Kaus für die Übersetzung ins Deutsche. Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Conflict of interest
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.




