Ameisensäure-unterstützte selektive Hydrogenolyse von 5-Hydroxymethylfurfural zu 2,5-Dimethylfuran über bifunktionale Pd-Nanopartikel auf N-dotiertem mesoporösem Kohlenstoff als Träger
Abstract
Aus Biomasse gewonnenes 5-Hydroxymethylfurfural (HMF) gilt als vielversprechende Plattformchemikalien zur Herstellung von 2,5-Dimethylfuran (DMF) als flüssigen Transportkraftstoff. Pd-Nanopartikel auf N-haltigen und N-freien mesoporösen Kohlenstoffmaterialien wurden hergestellt, charakterisiert und bei der Hydrogenolyse von HMF zu DMF unter milden Reaktionsbedingungen eingesetzt. Die quantitative Umwandlung von HMF zu DMF wurde in Gegenwart von Ameisensäure (FA) und H2 über Pd/NMC innerhalb von 2 h erreicht. Der Reaktionsmechanismus wurde durch Variation der Wasserstoffquelle, des Additivs und des Substrats sowie durch In-situ-ATR-IR-Spektroskopie erforscht. Die Hauptrolle von FA besteht darin, den dominanten Reaktionsweg von der Hydrierung der Aldehydgruppe zur Hydrogenolyse der Hydroxymethylgruppe über die Protonierung durch FA an der C-OH-Gruppe zu verlagern, wodurch die Aktivierungsbarriere der C-O-Bindungsspaltung gesenkt und somit die Reaktionsgeschwindigkeit deutlich erhöht wird. XPS-Ergebnisse und DFT-Berechnungen zeigten, dass Pd2+-Spezies, die mit pyridinartigen N-Atomen interagieren, die selektive Hydrogenolyse der C-OH-Bindung in Anwesenheit von FA aufgrund ihrer hohen Fähigkeit zur Aktivierung von FA und zur Stabilisierung von H− deutlich verbessern.
Einleitung
Die Nutzung von erneuerbaren Biomasse-Rohstoffen für die Produktion von Biokraftstoffen und Grundchemikalien hat große Aufmerksamkeit erregt.1, 2 5-Hydroxymethylfurfural (HMF) wird als eine der wichtigsten Plattformchemikalien bei der Biomassetransformation angesehen.3, 4 Verschiedene Chemikalien und Biokraftstoffe wie Lävulinsäure,5 2,5-Dimethylfuran,6 2,5-Furandicarbonsäure,7 und Ethyl-Lävulinat,8 können aus HMF hergestellt werden. Die selektive Hydrogenolyse von HMF zu DMF ist ein vielversprechender Verwertungsweg zur Gewinnung von Biokraftstoff aus erneuerbaren Rohstoffen.9 DMF wird als potentieller flüssiger Biokraftstoff für den Transport betrachtet, der eine höhere Oktanzahl als Ethanol, eine höhere Energieintensität, einen nahezu idealen Siedepunkt, eine ausgezeichnete Mischbarkeit mit Benzin und eine Unmischbarkeit mit Wasser aufweist.10 Darüber hinaus ist DMF auch eine erneuerbare Quelle für die Herstellung von p-Xylol über die Diels–Alder-Reaktion.11
Der übliche Weg zur Herstellung von DMF ist die Hydrogenolyse von Kohlenhydraten oder HMF mit Wasserstoff, wofür eine große Vielfalt an Katalysatoren untersucht wurde. Im Jahr 2007 berichteten Dumesic et al. über einen zweistufigen katalytischen Prozess, der zu einer 71 %igen Ausbeute von DMF aus Fructose über HMF als Zwischenprodukt über Cu/C bei 220 °C und 6.8 bar H2 führte.6, 12 Im Jahr 2010 berichteten Bell et al. über einen zweistufigen Ansatz für die Umwandlung von Glucose zu DMF, wobei sie eine 15 %ige DMF-Ausbeute auf Basis von Pd/C in ionischer Flüssigkeit unter hohem H2-Druck (62 bar) erzielten.13 Kürzlich synthetisierten Abu-Omar et al. einen bimetallischen Katalysator, der Lewis-saure Zn- und Pd/C-Spezies enthält, und setzten ihn bei der Hydrogenolyse von HMF zu DMF ein, was zu 99 % Umsatz und 85 % DMF-Selektivität führte. Allerdings litt der bimetallische Katalysator unter Desaktivierung nach dem vierten Recycling.14 Yang et al. berichteten, dass Ru-MoOx/C zu einer DMF-Ausbeute von 79 % bei 180 °C und 15 bar H2 führte.15 Im Allgemeinen wurden aufgrund der geringen Löslichkeit von H2 relativ harsche Reaktionsbedingungen, insbesondere hohe Drücke von H2, eingesetzt, um einen angemessenen Umsatz zu erzielen.16 Eine weitere zentrale Herausforderung bei der Aufwertung von HMF ist die Erzielung einer hohen Produktselektivität. Die chemische Umwandlung von HMF zu DMF ist ein mehrstufiger Prozess, der die Hydrogenolyse der Hydroxymethylgruppe und die Hydrierung der Aldehydgruppe umfasst (Schema 1). Wichtig ist, dass die wichtigste Nebenreaktion, die Furan-Ring-Hydrierung, vermieden wird. Insgesamt ist die hochselektive vollständige Umsetzung von HMF zu DMF unter milden Reaktionsbedingungen noch eine Herausforderung.
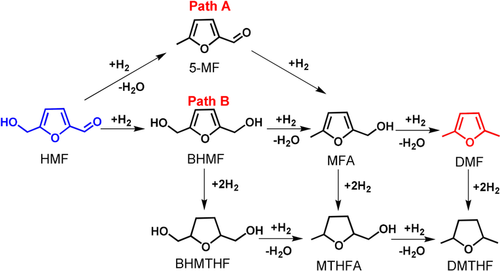
Reaktionsnetzwerk für die Hydrogenolyse von HMF zu DMF.
Molekularer Wasserstoff wird aufgrund seiner hohen Verfügbarkeit und leichten Aktivierung an Metalloberflächen häufig in Hydrierungs-/Hydrogenolyseprozessen eingesetzt. Ameisensäure (FA), die aus lignozellulosehaltiger Biomasse oder durch elektrochemische Reduktion von CO2 hergestellt werden kann, wird sowohl für die reversible Wasserstoffspeicherung als auch als Wasserstoffdonor für die katalytische Hydrierung in Betracht gezogen.17 Im Vergleich zu H2 hat FA nicht nur eine höhere Energiedichte von 6.4 MJ L−1,18 sondern auch eine ausgezeichnete Stabilität und geringe Toxizität, was für die sichere Lagerung und den Transport wünschenswert ist.19 Rauchfuss et al. berichteten über die Umwandlung von HMF mit FA unter milden Bedingungen über Pd/C, wobei 95 % DMF in 15 h erhalten wurden.20, 21 Die Schlüsselstrategie ist die Verwendung von FA, die mehrere Rollen als saurer Katalysator, Wasserstoffspender und Katalysatormoderator spielt, der die Decarbonylierung und Ringhydrierung hemmt, und als Vorläufer für Formiatester dient, die wichtige Zwischenprodukte sind, die zur selektiven Hydrogenolyse der C-OH-Bindung aktiviert werden. Tao et al. berichteten auch über eine DMF-Ausbeute von 98 % aus HMF und FA über 1 % Au^Pd0.2/t-ZrO2.22 Dennoch sind die verschiedenen Rollen von FA noch nicht im Detail aufgeklärt.
Pd zeigt eine hohe katalytische Aktivität bei der Hydrogenolyse von HMF zu DMF unter Verwendung von FA als Wasserstoffquelle und wird in der Regel als optimales Metall für die Zersetzung von FA angesehen.23 N-dotierte Kohlenstoffmaterialien haben sich als vielversprechende Träger erwiesen.24 Die Dotierung mit elektronenreichen N-Atomen modifiziert die Oberflächenstruktur von Kohlenstoffmaterialien und verleiht eine verbesserte π-Bindungsfähigkeit und erhöhte Basizität,25 was die katalytische Aktivität von geträgerten Metallkatalysatoren erhöht.26-28 So wurden z. B. isolierte Pd2+-Kationen, die auf N-dotiertem Kohlenstoff geträgert wurden, als aktive Zentren für die H2-Produktion aus FA identifiziert, die eine erhöhte Reaktionsgeschwindigkeit von 2–3 mal im Vergleich zu Pd zeigten, das auf N-freiem Kohlenstoff geträgert wurde.29 Es wurde auch gezeigt, dass die Pd2+-Spezies durch pyridinisches N koordiniert sind, wie XPS-, NEXAFS- und STEM-Studien belegten.29 Arrigo et al. berichteten über eine detaillierte Studie der Metall-Träger-Wechselwirkungen von N-dotierten Kohlenstoff-Nanoröhren mit Pd2+-Spezies.30 In unserer früheren Studie konnten wir das Vorhandensein von bifunktionalen Pd-Nanopartikeln (NPs) nachweisen, die auf N-dotiertem mesoporösem Kohlenstoff (NMC) geträgert sind und sowohl aktive Pd0- als auch Pd2+-Zentren enthalten.31
Unsere vorliegende Arbeit zielt darauf ab, die quantitative Umwandlung von HMF zu DMF unter milden Reaktionsbedingungen zu entwickeln, ein umfassendes Verständnis der vielseitigen Rollen von FA zu erhalten und den Einfluss der Bifunktionalität der Pd NPs auf die Reaktion aufzudecken. So wurde eine systematische Vergleichsstudie durch Variation des Katalysatorträgers (N-reicher vs. N-freier mesoporöser Kohlenstoff (CMC)) und des Wasserstoffdonors (H2, FA, sowohl H2 als auch FA) durchgeführt. In-situ-ATR-IR-Spektroskopie wurde eingesetzt, um den Reaktionsfortschritt zu überwachen und die Reaktionswege zu untersuchen. Die Dichtefunktionaltheorie (DFT) wurde angewandt, um tiefere Einblicke in die bifunktionalen elektronischen Eigenschaften von Pd/NMC und seine Wechselwirkung mit FA zu erhalten.
Ergebnisse und Diskussion
Charakterisierung
Die tatsächlichen Pd-Beladungen der Katalysatoren, die mittels AAS bestimmt wurden, lagen mit ca. 1.0 Gew.-% nahe an den erwarteten Werten (Tabelle S1). Die Isothermen können als Typ IV mit H3-Hystereseschleifen für CMC und NMC klassifiziert werden, die auf typischen Mesoporen beruhen (Abbildung S1). CMC zeigt eine große spezifische Oberfläche von 997 m2 g−1, während die Oberfläche von NMC kleiner ist, aber immer noch eine Oberfläche von 657 m2 g−1 aufweist (Tabelle S1). Die ähnlichen Porenvolumina und durchschnittlichen Porengrößen dieser beiden Kohlenstoffmaterialien weisen eindeutig auf vergleichbare mesoporöse Strukturen hin. Nach der kolloidalen Abscheidung von Pd nahmen die BET-Oberflächen, Porengrößen und Porenvolumina beider geträgerter Pd-Katalysatoren im Vergleich zu denen der Ausgangsmaterialien leicht ab. Die Eigenschaften von Aktivkohle (AC) und Pd/AC sind ebenfalls in Tabelle S1 aufgeführt.
Pd NPs im Bereich von 2 bis 5 nm sind in den TEM-Aufnahmen von Pd/NMC und Pd/CMC deutlich zu erkennen (Abbildung S3). Die mittleren Pd-Partikelgrößen für Pd/NMC und Pd/CMC sind relativ ähnlich und liegen bei 2.8 bzw. 3.6 nm. Dennoch zeigen die HAADF-STEM-Bilder, dass es einige sub-1 nm Pd NPs oder Cluster in Pd/NMC gibt, während diese sub-1 nm NPs in Pd/CMC nur selten entdeckt werden (Abbildung 1). Das Vorhandensein von sub-1 nm NPs deutet auf eine Fragmentierung hin, die während der kolloidalen Abscheidung stattfindet. Die Netzebenenabstände beider Katalysatoren werden mit 0.22 nm bestimmt, was Pd(111)-Netzebenen entspricht. Im Vergleich dazu hat Pd/AC eine größere mittlere Pd-Partikelgröße von 4.4 nm sowie eine deutlich größere Anzahl von NPs über 5 nm (Abbildung S4).
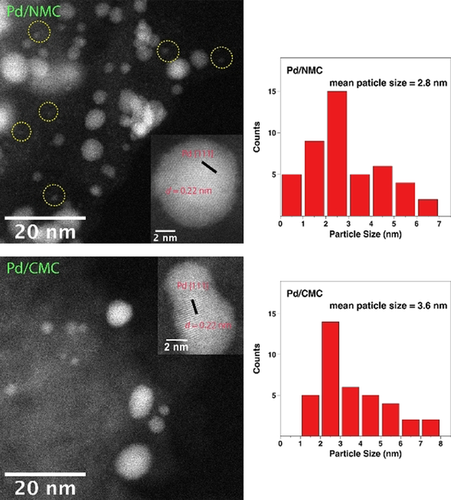
HAADF-STEM-Bilder und Pd-Partikelgrößenverteilungen für Pd/NMC und Pd/CMC. Die gelben Kreise beziehen sich auf sub-1 nm Pd NPs oder Cluster.
Die XPS-Ergebnisse zeigen, dass die Oberflächen-Pd-Konzentration von Pd/NMC (0.61 Gew%) (Abbildung 2) viel niedriger ist als die von Pd/CMC (1.83 At%) (Tabelle 1, Abbildung S6). Da beide Katalysatoren ähnliche Volumen-Pd-Beladungen aufweisen und Pd/NMC gemäß den STEM-Messungen eine kleinere Partikelgröße und eine höhere Dispersion als Pd/CMC aufweist, impliziert der signifikante Unterschied in der Oberflächen-Pd-Konzentration, dass Pd vermutlich aufgrund des Einbaus von N-Atomen sowohl auf der äußeren als auch auf der inneren Oberfläche von NMC homogen dispergiert ist, während Pd bevorzugt mit den O-funktionalisierten Gruppen interagiert und sich auf der äußeren CMC-Oberfläche ablagert. Darüber hinaus zeigen die N 1s-Rumpfniveau-XP-Spektren von NMC das Vorhandensein von pyridinischen (45 %), pyrrolischen (46 %), quaternären (6 %) und oxidierten oder NO-ähnlichen N-Atomen (3 %) (Abbildung S7).31 Für Pd/NMC wurde eine bessere Anpassung des N 1s-Spektrums erzielt, wenn man die Anwesenheit einer weiteren N-Spezies annimmt, die mit Pd-NPs interagiert (N-Pd-Komponente).
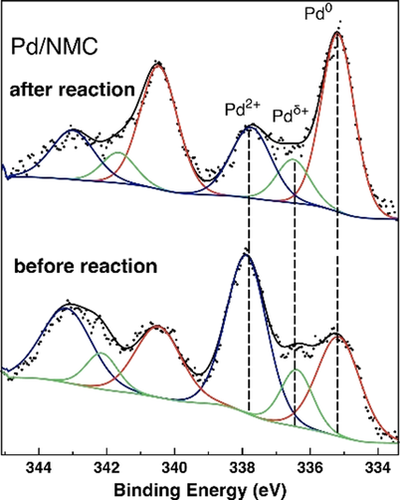
Pd 3d-Bereiche der entfalteten XPS-Ergebnisse für Pd/NMC vor und nach der Reaktion in Gegenwart von FA und H2.
Probe |
Pd [Gew/At%] |
|
N [Gew/At%] |
|
O [At%] |
||
|---|---|---|---|---|---|---|---|
bulk[a] |
surf.[b] |
|
bulk[c] |
surf.[b] |
|
surf.[b] |
|
NMC |
– |
– |
|
13.4 |
10.6 |
|
6.3 |
CMC |
– |
– |
|
– |
– |
|
11.0 |
Pd/NMC |
0.95 |
0.61 |
|
13.3 |
10.9 |
|
7.4 |
Pd/CMC |
0.98 |
1.83 |
|
– |
– |
|
11.5 |
- Bestimmt durch [a] AAS, [b] XPS und [c] Elementaranalyse.
In unseren früheren Studien konnten wir einen tiefen Einblick in die Metall-Träger-Wechselwirkungen von Pd/CMC und Pd/NMC gewinnen.31, 36 Kurz zusammengefasst interagieren Pd NPs über gerichtete und teilweise kovalente Pd-C-Wechselwirkungen mit dem Kohlenstoffträger.36 Abbildung 3 a zeigt die stabilste Struktur eines Pd21-Clusters mit einem berechneten Durchmesser von 0.85 nm auf NMC, die durch Grundzustandsgeometrieoptimierung bestimmt wurde. Zwei pyridinische N-Atome wechselwirken mit einem Pd-Atom, was auf pyridinische N-Atome als bevorzugte Adsorptionsstellen für Pd-Cluster hindeutet. Der relevante Teil der entsprechenden Elektronendichte-Differenz ist in Abbildung 3 b wiedergegeben. Die komplizierte Struktur kann mit Hilfe einer intrinsischen Bindungsorbitalanalyse erklärt werden, die zeigt, dass die pyridinischen N-Atome ein nichtbindendes Elektronenpaar (LP) besitzen, das sich in einem in der Trägerebene liegenden sp2-Orbital befindet. Bei der Adsorption eines Pd-Clusters an pyridinischem N wechselwirken zwei N-Atome mit einem Pd-Atom über einen N-LP—Pd dσ und einen N-LP—Pd s sowie einen Pd dπ–π* Ladungstransfer. Die Wechselwirkung der N-LP-Orbitale mit dem Pd-Atom führt zu einem Dichteverlust im N-LP-Orbital, während die Pd dπ–π*-Wechselwirkung die Dichte im N π-Orbital erhöht und zu einer Änderung der Pd-Oxidationsstufe zu Pd2+ führt. Tatsächlich werden nur Pd0 und Pdδ+ durch XPS für Pd/CMC (Abbildung S8) beobachtet, während ein zusätzliches Signal, das einer zweiwertigen Pd-Spezies zugeschrieben werden kann, die durch die starke Wechselwirkung mit pyridinartigen N-Atomen30 stabilisiert wird, für Pd/NMC beobachtet wird (Abbildung 2). Pd0 (68 %) ist die dominante Spezies für Pd/CMC, während Pd2+ (50 %) die Hauptspezies für Pd/NMC ist (Tabelle S2). Diese Ergebnisse belegen das Vorhandensein von bifunktionalen Pd-NPs, die sowohl Pd0- als auch aktive Pd2+-Zentren enthalten, die durch pyridinische N-Atome in NMC unterstützt werden.31 Darüber hinaus unterstützen die XAS-Ergebnisse der präparierten Proben das Strukturmodell von kleinen Pd-Clustern, die oxidierte Pdδ+- oder Pd2+-Zentren an ihren Kanten enthalten, die über O- oder N-Atome an den Träger gebunden sind (siehe detaillierte XAS- und TPR-Analyse in den unterstützenden Informationen). Die höhere Oxidationsstufe von Pd in Pd/NMC im Vergleich zu Pd/CMC wird auch durch TPR-Experimente verifiziert.
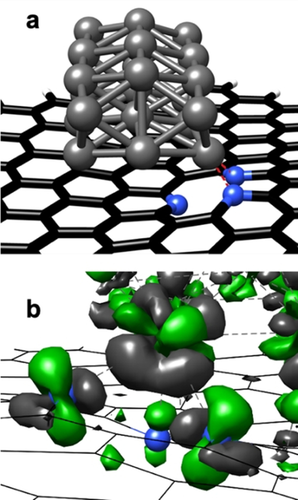
DFT-Berechnungen für das Pd/NMC-Modell: (a) stabilste Struktur von Pd21 auf einem pyridinischen Kohlenstoffträger (zwei pyridinische N verbunden mit Pd21); (b) Änderung der Elektronendichte induziert durch die Wechselwirkung zwischen dem Pd21-Cluster und den pyridinischen N-Atomen (grün: Dichtegewinn; grau: Dichteverlust).
Katalytische Umwandlung von HMF zu DMF
Die Umsetzung von HMF kann über zwei Wege erfolgen, abhängig von der Reihenfolge der Hydrogenolyse der Hydroxymethylgruppe und der Hydrierung der Aldehydgruppe (Schema 1). Diese beiden Wege führen zu unterschiedlichen Zwischenprodukten: 5-Methylfurfural (5-MF) für Weg A und 2,5-Bis(hydroxymethyl)furan (BHMF) für Weg B. Beide Wege führen weiter zu einem gemeinsamen Zwischenprodukt 2-(Hydroxymethyl)-5-methylfuran (MFA) mit anschließender Hydrogenolyse zu DMF. Die Hydrierung des Furanrings führt zu unerwünschten Nebenprodukten. Die Hydrogenolyse von HMF zu DMF wurde mit verschiedenen Wasserstoffquellen über Pd-basierten Katalysatoren untersucht und ist in Tabelle 2 zusammengefasst.
Eintrag |
Katalysator |
Wasserstoff Quelle |
Umsatz [%] |
DMF Selektivität [%] |
Ausbeute [%] |
||||
|---|---|---|---|---|---|---|---|---|---|
|
|
|
|
|
DMF |
BHMF |
5-MF |
MFA |
Andere[e] |
1 |
– |
H2[b] |
4.6 |
– |
– |
2.2 |
2.4 |
– |
– |
2 |
Pd/NMC |
H2[b] |
>99.9 |
35.3 |
35.3 |
– |
— |
42.0 |
22.7 |
3 |
Pd/CMC |
H2[b] |
78.8 |
49.2 |
38.8 |
- |
6.6 |
18.3 |
15.1 |
4 |
Pd/AC |
H2[b] |
19.4 |
38.3 |
7.4 |
1.9 |
8.4 |
0.6 |
1.0 |
5 |
Pd/NMC |
FA[c] |
60.8 |
64.3 |
39.1 |
– |
11.5 |
10.2 |
– |
6 |
Pd/CMC |
FA[c] |
21.4 |
62.9 |
13.5 |
– |
7.9 |
– |
– |
7 |
Pd/NMC |
FA+H2[d] |
>99.9 |
>97.0 |
97.1 |
– |
2.9 |
– |
– |
8 |
Pd/CMC |
FA+H2[d] |
90.1 |
80.0 |
72.1 |
– |
18.0 |
– |
– |
- [a] Reaktionsbedingungen: 1.5 mmol HMF, 50 mg Katalysatoren, 160 °C, 3 h; [b] 5 bar H2; [c] 45 mmol FA (30 Äquiv.) bei 5 bar N2 und [d] H2; [e] hauptsächlich ringhydrierte Produkte einschließlich 2,5-Bis(hydroxymethyl)tetrahydrofuran, 5-Methyltetrahydrofurfurylalkohol und 2,5-Dimethyltetrahydrofuran.
Bei Verwendung von H2 führte das Blind-Experiment nur zu einem Umsatz von 4.6 % und DMF wurde nicht beobachtet (Tabelle 2, Eintrag 1). Die Experimente mit NMC und CMC führten zu ähnlichen Umsätzen wie das Blind-Experiment. Die HMF-Umsatzgrade über den Pd-basierten Katalysatoren betrugen 99.9 %, 78.8 % und 19.4 % für Pd/NMC, Pd/CMC bzw. Pd/AC (Tabelle 2, Einträge 2–4). Die Ausbeuten von DMF waren für die Pd-Katalysatoren mit mesoporösem Kohlenstoff ähnlich und betrugen 35.3 % für Pd/NMC und 38.8 % für Pd/CMC, während die Ausbeute für Pd/AC deutlich geringer war. Die schlechte katalytische Aktivität von Pd/AC ist auf die größere Pd-Partikelgröße und die geringere Pd-Dispersion zurückzuführen. Außerdem wurden hauptsächlich Furan-Ring-Hydrierungsprodukte als Nebenprodukte erhalten. Die Hydrogenolyse von HMF über Pd/NMC als Funktion der Zeit wurde weiter untersucht (Abbildung 4 a). Die Umwandlung von HMF verlief sehr schnell und erreichte eine vollständige Umwandlung innerhalb von 2 h. BHMF und 5-MF waren die primären Zwischenprodukte, die eine maximale Ausbeute innerhalb von 1 h erreichten und dann allmählich auf Null nach 4 h abfielen. Im Vergleich war die maximale Ausbeute von BHMF viel höher als die von 5-MF, was darauf hindeutet, dass der BHMF-Reaktionsweg (Weg B) den 5-MF-Weg (Weg A) für die HMF-Hydrogenolyse in H2 übertrifft. MFA wurde als sekundäres Zwischenprodukt gefunden, das nach 3 h eine maximale Ausbeute von 42 % erreichte und dann allmählich auf 17.8 % abfiel, begleitet von einem Anstieg der DMF-Ausbeute auf 59.6 % nach 5 h. Zusätzlich stiegen die Ring-Hydrierungsprodukte kontinuierlich auf 20 % an, was üblicherweise in H2 beobachtet wird.37, 38 Im Vergleich dazu sind die Produktentwicklungsprofile über Pd/CMC ziemlich ähnlich zu denen über Pd/NMC, jedoch mit etwas geringerer Aktivität (Abbildung S13).
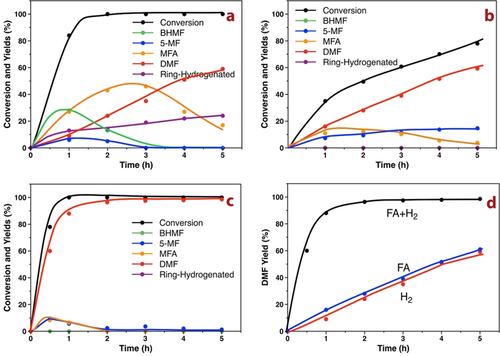
Zeitlicher Verlauf der Hydrogenolyse von HMF zu DMF über Pd/NMC mit (a) 5 bar H2; (b) FA und 5 bar N2; (c) FA und 5 bar H2. (d) Vergleich der DMF-Ausbeuten bei Verwendung verschiedener Wasserstoffdonoren über die Zeit.
Wenn FA als Wasserstoffdonor verwendet wurde, änderten sich die Umsatzgrade und Produktverteilungen sowohl für Pd/NMC als auch für Pd/CMC signifikant (Tabelle 2, Einträge 5, 6). Die Umsatzgrade nahmen stark ab, und die Selektivitäten zu DMF stiegen um 13–29 %. Letztendlich ergab sich eine ähnliche DMF-Ausbeute (39 % vs. 35 %) über Pd/NMC nach 3 h im Vergleich zu der in H2-Atmosphäre. Bemerkenswert ist, dass die Hydrierung des Furanrings, die üblicherweise auftritt und mit H2 schwer zu vermeiden ist, in Gegenwart von FA vollständig unterdrückt wird. Dies lässt sich durch die sterisch behinderte Adsorption des Furanrings erklären, da die aktiven Pd-Zentren bevorzugt von den stärker gebundenen Formiatanionen bedeckt werden. Im Gegensatz zur Reaktion in H2 zeigt der Reaktionsverlauf in FA über Pd/NMC, dass BHMF nicht detektiert wurde, während nur 5-MF mit ähnlicher Konzentration (10 %) beobachtet wurde (Abbildung 4 b). Dieses Ergebnis legt nahe, dass die Hydrogenolyse der Hydroxymethylgruppe (Weg A) vor der Hydrierung der Aldehydgruppe (Weg B) in FA stattfindet. Nach 5 h wurde ein Umsatz von 78.1 % und eine DMF-Ausbeute von 60 % erhalten. Durch Verlängerung der Reaktionszeit auf 12 h erhöhte sich die DMF-Ausbeute auf fast 90 %. Bemerkenswert ist, dass die Ausbeute des primären Zwischenprodukts 5-MF langsam, aber kontinuierlich anstieg, während das sekundäre Zwischenprodukt MFA zunächst ein Plateau erreichte und dann nach 3 h allmählich abnahm. Diese Beobachtung deutet darauf hin, dass die Hydrierung von 5-MF zu MFA aufgrund der relativ schlechten Hydrieraktivität von Pd/NMC in FA der geschwindigkeitsbestimmende Schritt (rds) ist.
Um die Reaktionsgeschwindigkeit des rds zu erhöhen, wurde die Umsetzung von HMF mit FA auch in Gegenwart von zusätzlichem externen H2 durchgeführt. Die Ausbeuten von DMF über Pd/NMC und Pd/CMC stiegen stark auf 97.5 % bzw. 73.9 % an (Tabelle 2, Einträge 7, 8).
Ähnlich wie beim Reaktionsverlauf in FA zeigt Abbildung 4 c, dass BHMF nicht detektiert wurde und Weg A (5-MF) der Hauptreaktionsweg in Gegenwart von externem H2 ist. Der Unterschied besteht darin, dass die Änderung der MFA-Ausbeute gleichzeitig mit der von 5-MF auftrat, was darauf hinweist, dass die Reaktionsgeschwindigkeit der Hydrierung von 5-MF zu MFA deutlich erhöht war. Schließlich wird die quantitative Umwandlung von HMF zu DMF innerhalb von 2 h über Pd/NMC erreicht (Schema 2). Im Vergleich zu Pd/CMC zeigt Pd/NMC eine überlegene katalytische Aktivität mit verdoppelten TOF-Werten sowohl in FA als auch in H2+FA (Tabelle S4), was auf starke fördernde Effekte von FA und der N-Spezies in Pd/NMC hinweist. Darüber hinaus übertrifft Pd/NMC andere berichtete Katalysatoren in Bezug auf TOF (Tabelle S4), was auf kleinere Pd-NPs, starke Metall-Träger-Wechselwirkungen und modifizierte elektronische Eigenschaften durch die N-Spezies zurückgeführt werden kann. Im Vergleich dazu steigert die Kombination von FA und H2 die Hydrogenolyse von HMF zu DMF stark, wodurch eine ausgezeichnete HMF-Konvertierung und DMF-Ausbeute in kurzer Reaktionszeit erzielt wird (Abbildung 4 d). Die Zugabe von FA verändert den Reaktionsweg von Weg B zu Weg A, verbessert die Hydrogenolyseaktivität und hemmt die Ringhydrierung, während die Anwesenheit von H2 den schnellen Hydrierschritt gewährleistet.
Quantitative Umsetzung von HMF zu DMF mit FA und H2 über Pd/NMC.
Die Stabilität und die Wiederverwendbarkeit von Pd/NMC wurden ebenfalls untersucht. Der verwendete Katalysator behielt seine hohe katalytische Aktivität nach drei Durchläufen bei, und die Ausbeute an DMF sank nur leicht von 97.5 % auf 95.1 % (Abbildung 5 a). Der geringe Grad der Pd-Auslaugung, der nur 0.06 % (0.9 ppm) des gesamten Pd beträgt, deutet auf eine effiziente Stabilisierung der Pd-NPs durch den NMC-Träger hin. Außerdem wurde der recycelte Katalysator durch XRD, TEM und XPS charakterisiert (Abbildungen 5 b, S5 und 2). Der Pd(111)-Reflex im gebrauchten Katalysator ist im Vergleich zum frischen Katalysator immer noch kaum sichtbar ohne signifikante Veränderungen. Die mittlere Pd-Partikelgröße erhöhte sich leicht von 2.8 auf 2.9 nm und die sub-1 nm Pd NPs sind immer noch sichtbar. Nach der Reaktion stieg die relative Häufigkeit von Pd0 in Pd/NMC von 36 auf 59 %, während Pd2+ von 50 auf 30 % abnahm (Tabelle S2). Zum Vergleich: Pd/CMC war nach der Reaktion fast vollständig zu Pd0 (91 %) reduziert. Die moderate Reduktion von Pd/NMC auch in Gegenwart von FA und H2 ist auf die starke Verankerung durch pyridinische N-Spezies zurückzuführen. Insgesamt ist Pd/NMC sehr stabil und weist eine ausgezeichnete Wiederverwendbarkeit auf.
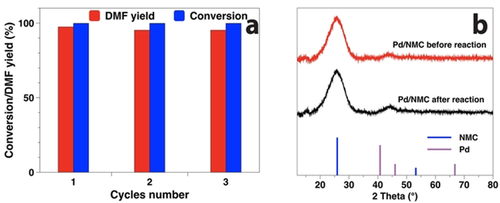
Wiederverwendbarkeit von Pd/NMC bei der Hydrogenolyse von HMF zu DMF in Gegenwart von FA und H2 (a), und Diffraktogramme von Pd/NMC vor und nach der Reaktion (b).
Reaktionsmechanismus
Die In-situ-ATR-IR-Spektroskopie wurde eingesetzt, um den Reaktionsweg und die Produktverteilungen mit verschiedenen Wasserstoffdonoren zu untersuchen. Abbildung 6 a und 6 b zeigen die zeitaufgelösten ATR-IR-Spektren, die während der Hydrogenolyse von HMF zu DMF über Pd/NMC bei 160 °C in H2 bzw. in H2+FA aufgenommen wurden. Die Referenzspektren der Hauptverbindungen sind in Abbildung S14 dargestellt.
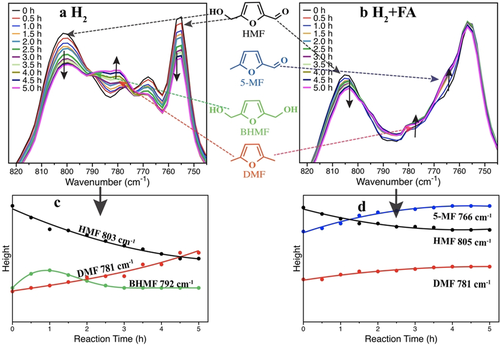
In-situ-ATR-IR-Spektren und qualitative Trends der Bandenhöhen während der HMF-Umwandlung über Pd/NMC in (a) (c) 10 bar H2 nach Subtraktion des Hintergrunds von THF; (b) (d) 15 mL FA bei 10 bar H2 nach Subtraktion des Hintergrunds von THF und FA. Reaktionsbedingungen: 45 mmol HMF, 500 mg Katalysatoren, 120 mL THF, 10 bar H2, 160 °C, 500 rpm.
Die Zuordnung der charakteristischen Banden zum Reaktanden und zu den Intermediaten ist in Tabelle S5 zusammengefasst. Aufgrund der Ähnlichkeit der Zwischenprodukte und des Reaktanden ist die Differenzierung von C=O- und C=C-Streckschwingungen nicht möglich, daher wurden die Banden der out-of-plane-C-H-Biegeschwingung im Detail verglichen, wobei die charakteristischen C-H-Biegeschwingungen für HMF (805, 779, 767 und 756 cm−1), DMF (781 cm−1), 5-MF (796 und 765 cm−1) und BHMF (792 cm−1) verwendet wurden.
Bei Verwendung von H2 als Wasserstoffdonor nahm die Intensität der IR-Banden bei 805 und 756 cm−1 (HMF) kontinuierlich ab, während die Intensität der IR-Bande bei 781 cm−1 (DMF) allmählich zunahm. Die IR-Bande von 5-MF wurde wahrscheinlich aufgrund der geringen Konzentration nicht detektiert, während die Bande bei 792 cm−1 (BHMF) zunächst zu- und dann abnahm. Die zeitaufgelöste Entwicklung dieser Banden ist in Abbildung 6 c dargestellt, was einmal mehr die Schlussfolgerung bestätigt, dass Pd/NMC dazu neigt, die Hydrierung der Aldehydgruppe (Weg B) im Vergleich zur Hydrogenolyse der Hydroxymethylgruppe (Weg A) in H2 zu katalysieren.
Im Falle von FA und H2 als Wasserstoffdonoren wurde weiterhin der Verbrauch von HMF und die Bildung von DMF beobachtet (Abbildung 6 b). Dennoch stiegen die Intensitäten der IR-Banden bei 765 und 796 cm−1 (5-MF) ohne die Bildung von BHMF in guter Übereinstimmung mit den GC-Ergebnissen deutlich an (Tabelle 2, Abbildung 4). Diese Banden wurden entfaltet und in Abbildung 6 d aufgetragen. Die Abnahme von HMF sowie die Zunahme von DMF und dem primären Zwischenprodukt 5-MF (Weg A) sind in Gegenwart von FA+H2 deutlich zu beobachten.
In Bezug auf den Mechanismus ändert FA nicht nur den dominanten Reaktionsweg von Weg B zu Weg A, sondern verbessert auch signifikant die Umwandlung von HMF zu DMF über Pd/NMC, vermutlich über die Verbesserung der Hydrogenolyse der C-OH-Bindung (Weg A). Im Gegensatz dazu wurde in einem früheren Bericht Weg B als Hauptreaktionsweg über Pd/C in Gegenwart von FA und H2 identifiziert,21 was impliziert, dass Pd/NMC auch eine Rolle bei der Verschiebung des Reaktionsweges spielen kann.
FA werden mehrere Rollen zugeschrieben: Sie fungiert als milde Wasserstoffquelle, als Katalysator-Moderator, der die Ringhydrierung hemmt, und als Vorstufe zu Formiatestern als Schlüsselintermediaten, die zur selektiven Hydrogenolyse von C-OH-Bindungen aktiviert werden.20, 21 Die Rolle von FA als Wasserstoffquelle in Abwesenheit von externem H2 ist ziemlich klar. Die Unterdrückung der Ring-Hydrierung, die zu einer verbesserten Selektivität führt, wurde in der vorliegenden Studie deutlich beobachtet, aber die Differenzierung oder Klärung anderer Rollen, die die katalytische Aktivität beeinflussen, wurde noch nicht untersucht. Daher wurden weitere Experimente durchgeführt, um den Einfluss von FA auf die durch Pd/NMC katalysierte Hydrogenolyse und Hydrierung furanischer Substrate mit zusätzlichem externen H2 zu untersuchen (Tabelle 3). Bei einer starken Verringerung des molaren Verhältnisses von FA zu HMF von 30 über 3 auf 0.3 wurde nur eine geringe Abnahme des HMF-Umsatzes und der DMF-Ausbeute beobachtet (Tabelle 3, Einträge 3–5), was bedeutet, dass FA nur eine begrenzte Rolle als Wasserstoffquelle in Gegenwart von externem H2 hat. Darüber hinaus konnte durch die Zugabe von nur 0.3 Äquiv. FA die Ausbeute an DMF signifikant von 35.3 % auf 76.0 % gesteigert werden. Obwohl die Esterbildung bei einer so geringen FA-Konzentration eingeschränkt war, wurde dennoch eine ausgezeichnete DMF-Ausbeute erzielt. Dieses Ergebnis deutet darauf hin, dass der Ameisensäureester-Weg unter den verwendeten Reaktionsbedingungen möglicherweise nicht der Hauptweg für die HMF-Hydrogenolyse ist. Um die Rolle des Ameisensäureesters weiter zu verifizieren, wurde die Umsetzung von 5-[(Formyloxy)methyl]furfural (FMF) zu DMF untersucht (Tabelle 3, Einträge 8–10). Verglichen mit der Umsetzung von HMF wurden in allen Fällen niedrigere Umsatzgrade und DMF-Ausbeuten erzielt. Daraus kann gefolgert werden, dass der Reaktionsweg des Ameisensäureesters als Zwischenprodukt ein untergeordneter Weg für die Hydrogenolyse von HMF zu DMF ist. Man beachte, dass FMF nicht in allen Experimenten nachgewiesen wurde, wahrscheinlich weil die Umwandlung von FMF zu DMF viel schneller ist als die Bildung von FMF unter den vorliegenden Reaktionsbedingungen.
Eintrag |
Katalysator |
Reaktand |
Zusatzstoff[b] |
Gasphase |
Umsatz [%] |
DMF Ausbeute [%] |
|---|---|---|---|---|---|---|
1 |
Pd/NMC |
HMF |
– |
H2 |
>99.9 |
35.3 |
2 |
Pd/NMC |
HMF |
FA |
N2 |
60.8 |
39.1 |
3 |
Pd/NMC |
HMF |
FA |
H2 |
>99.9 |
>97.0 |
4 |
Pd/NMC |
HMF |
FA (3 Äquiv.) |
H2 |
92.0 |
89.3 |
5 |
Pd/NMC |
HMF |
FA (0.3 Äquiv.) |
H2 |
82.1 |
76.0 |
6 |
Pd/NMC |
HMF |
AcOH[c] |
N2 |
10.6 |
Trace |
7 |
Pd/NMC |
HMF |
AcOH[c] |
H2 |
95.1 |
85.5 |
8 |
Pd/NMC |
FMF |
– |
H2 |
66.1 |
46.0 |
9 |
Pd/NMC |
FMF |
FA |
N2 |
34.2 |
20.5 |
10 |
Pd/NMC |
FMF |
FA |
H2 |
83.1 |
67.3 |
- [a] Reaktionsbedingungen: 1.5 mmol HMF oder FMF, 50 mg Katalysatoren, 160 °C, 5 bar H2 oder N2, 3 h; [b] 45 mmol FA (30 Äquiv.); [c] 45 mmol Essigsäure (30 Äquiv.).
Außerdem führte die Zugabe von Essigsäure (pKa 4.7 vs. 3.8 für FA) anstelle von FA zu nur 10.6 % HMF-Umsatz und Spuren von DMF (Tabelle 3, Eintrag 6), was zeigt, dass Essigsäure nicht als Wasserstoffdonor verwendet werden kann. Dennoch wurden in Gegenwart von Essigsäure und zusätzlichem externen H2 ein hervorragender HMF-Umsatz und eine DMF-Ausbeute von 85.5 % erzielt (Tabelle 3, Eintrag 7). Darüber hinaus wurde 5-MF als primäres Zwischenprodukt nachgewiesen und BHMF wurde in guter Übereinstimmung mit dem Ergebnis unter Verwendung von FA nicht nachgewiesen. Diese Ergebnisse legen nahe, dass die Säuren wahrscheinlich die Hydrogenolyse der RCH2-OH-Bindung über einen säurekatalysierten Weg verstärken. Assary et al.39 schlugen den Reaktionsmechanismus der Dehydratisierung von Fructose zu HMF mit Hilfe von quantenchemischen Methoden auf hohem Niveau vor. Es konnte gezeigt werden, dass die Acidität der Lösung wesentlich zur Senkung der Aktivierungsenergiebarriere beiträgt, indem die anfängliche Protonierung einbezogen wird. Außerdem berichteten Lercher et al.40 über einen katalytischen Weg für die Spaltung der C-O-Bindung in Benzylphenylether. DFT-Berechnungen legten nahe, dass der Ether anfangs protoniert wird und nicht die direkte Spaltung der Etherbindung in den vorgeschlagenen C-O-Bindungsspaltungsmechanismen aufgrund der niedrigeren Aktivierungsenergie erfolgt. In Kombination mit unseren experimentellen Beobachtungen und diesen Literaturberichten schlagen wir vor, dass die Hydrogenolyse von RCH2-OH in Gegenwart von Säuren ebenfalls zunächst über einen ähnlichen Protonierungsprozess abläuft, der die Aktivierungsbarriere der C-O-Bindungsspaltung senken kann.
Insgesamt erfüllt FA mehrere Funktionen bei der Hydrogenolyse von HMF zu DMF: 1) Unterdrückung der Ringhydrierung zur Verbesserung der DMF-Selektivität, 2) Funktion als milde Wasserstoffquelle, 3) Bildung der Formiatester als Zwischenprodukte, 4) Bildung eines protonierten Zwischenprodukts und damit Senkung der Aktivierungsbarriere der C-O-Bindungsspaltung. Die Funktionen 2–4 tragen gemeinsam zur Aktivitätsverbesserung bei, wobei der Protonierungsmechanismus zu einer Verschiebung des Reaktionsweges von Weg B zu Weg A führt, was der Hauptgrund für die signifikante katalytische Aktivitätsverbesserung ist.
Die katalytische HMF-Hydrogenolyseaktivität über Pd/NMC und Pd/CMC mit verschiedenen Wasserstoffdonoren ist in Abbildung 7 dargestellt. Ein signifikanter Unterschied in der Reaktionsgeschwindigkeit der Hydrogenolyse der C-O-Bindung wurde für N-reiche und N-freie Kohlenstoff-geträgerte Pd-Katalysatoren beobachtet. Bei Verwendung von H2 führten Pd/NMC und Pd/CMC zu ähnlichen DMF-Ausbeuten, was ihre vergleichbaren katalytischen Aktivitäten für die Hydrogenolyse von HMF in H2 impliziert. Bei Verwendung von FA als Wasserstoffquelle führte Pd/NMC sowohl zu einer höheren Aktivität als auch zu einer höheren DMF-Ausbeute im Vergleich zu Pd/CMC. In FA und H2 wurden ebenfalls deutlich höhere Umsätze und Ausbeuten über Pd/NMC erzielt. Da der Hauptreaktionsweg der Hydrogenolyseweg A in Gegenwart von FA oder FA+H2 ist, kann die höhere katalytische Aktivität von Pd/NMC auf die verbesserte Aktivität der C-OH-Bindungshydrogenolyse zurückgeführt werden. Da Pd/NMC und Pd/CMC ähnliche Pd-Partikelgrößen und mesoporöse Strukturen aufweisen, sollten die Art der N-Atome und die unterschiedlichen Oxidationsstufen der Pd-Spezies, die durch starke Metall-Träger-Wechselwirkungen verursacht werden, einen Anhaltspunkt liefern.
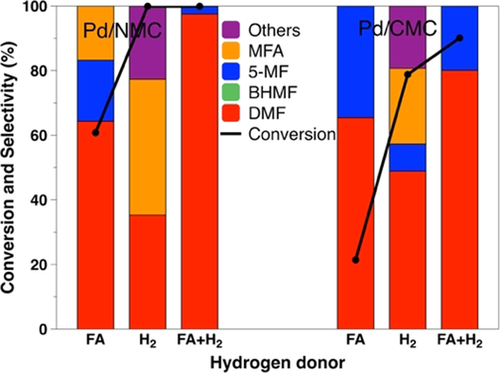
Vergleich von Pd/NMC und Pd/CMC in Bezug auf die Umsetzung von HMF zu DMF unter Verwendung verschiedener Wasserstoffquellen nach 3 h.
Um den Effekt von FA und der N-Dotierung des Trägers auf die Hydrogenolyse der C-O-Bindung weiter zu identifizieren, wurde eine DFT-Studie von H2 und FA an Pd/CMC und Pd/NMC durchgeführt (siehe detaillierte Verfahren und Ergebnisse in den unterstützenden Informationen). Die DFT-Berechnungen unterstützen die Hypothese, dass FA nicht nur als milde Wasserstoffquelle fungiert (Funktion 2), sondern auch protonierte Zwischenprodukte bilden kann (Funktion 4), da es mit kohlenstoffgestützten Pd NPs auf zwei Arten interagiert: a) FA bindet über das C-Atom (Abbildung 8 a) und zerfällt anschließend in H2 und CO2; b) FA bindet über die C=O-Gruppe (Abbildung 8 b) und zerfällt anschließend in das Formiat-Anion und H+.
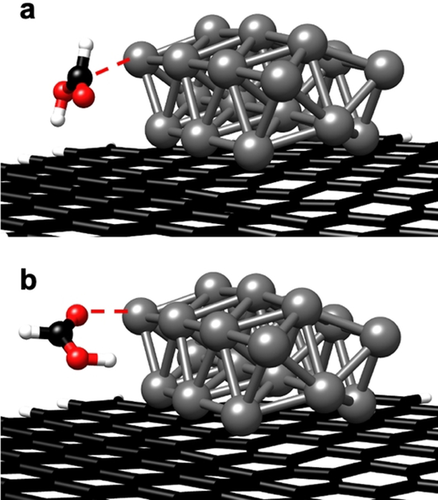
Zwei verschiedene Bindungskonfigurationen von FA an kohlenstoffgeträgertem Pd21 (Modell für Pd/CMC): (a) FA bindet über das C-Atom; (b) FA bindet über die C=O-Gruppe.
An dem an NMC gebundenen Pd21-Cluster zeigt sich, dass FA an den Pd2+-Zentren ausschließlich über die C=O-Bindung bindet und mit einer geringen Aktivierungsenergie (ΔE=5.3 kJ mol−1, unter Vernachlässigung von Solvatationseffekten) in das Formiat-Anion und H+ zerfällt. Sowohl die Adsorption über das C-Atom als auch der Reaktionsweg zur Bildung von H2 und CO2 sind ungünstig (Tabelle S6). Demnach erhöht die Bindung an das positiv geladene Zentrum die Acidität von FA, was die Hydrogenolyse der C-OH-Bindung von HMF erleichtert.
Dies stimmt mit früheren Studien überein, in denen Pd2+-Spezies als die aktiven Zentren für die selektive Zersetzung von FA identifiziert wurden.29 Zum Beispiel zeigten Pd2+-Spezies, die auf N-reichem Kohlenstoff geträgert wurden, eine dreimal höhere katalytische Aktivität bei der FA-Zersetzung im Vergleich zur Aktivität von Pd, das auf N-freiem Kohlenstoff geträgert wurde.29 Die isolierten Pd2+-Spezies, die durch die pyridinischen N-Atome stabilisiert wurden, wurden als die aktiven Zentren identifiziert.
Darüber hinaus bindet das durch heterolytische H2-Dissoziation auf dem Pd-Nanopartikel gebildete H− signifikant stärker an Pd/NMC im Vergleich zu Pd/CMC, wobei es Positionen nahe dem Pd2+ -Zentrum bevorzugt (Tabelle S7). Dies lässt sich durch die höhere positive Ladung der Pd NPs auf NMC erklären, insbesondere in der Nähe des Pd2+-Zentrums. Die Stabilisierung von H− auf Pd/NMC erhöht die Nukleophilie und damit auch die Selektivität von H2 als Reduktionsmittel.
Zusammenfassend kann die bemerkenswerte katalytische Aktivität von Pd/NMC für die HMF-Umwandlung in FA auf die Verschiebung zum Reaktionsweg A und auf die Anwesenheit von Pd2+-Spezies zurückgeführt werden, die eine höhere katalytische Aktivität bei der FA-Dissoziation zum Formiat-Anion und H+ sowie bei der H−-Stabilisierung zeigen, die gemeinsam die Hydrogenolyse der C-OH-Bindung deutlich verbessern.
Basierend auf den kinetischen, spektroskopischen und rechnerischen Ergebnissen wird der folgende Reaktionsweg über das bifunktionale Pd/NMC in FA vorgeschlagen (Schema 3). Zunächst wird FA über Pd2+ -Spezies und Pd NPs aktiviert. Die reversible Reaktion zwischen HMF und FMF findet in Gegenwart von FA statt, aber der HMF-Weg ist der Hauptweg anstelle des Ameisensäureesterweges. Dann binden Pd2+-Spezies das Sauerstoffatom der C-OH-Gruppe, die durch FA protoniert wird. Die Hydrogenolyse der Hydroxymethylgruppe erfolgt über die Spaltung der C-OH-Bindung unter Bildung von 5-MF. Während des Prozesses kooperieren Pd2+-Spezies und FA synergistisch bei der Hydrogenolyse der C-OH-Bindung. Darüber hinaus koordinieren Pd0 NPs die C=O-Doppelbindung, was zu einer schnellen Hydrierung von 5-MF zu MFA führt. Anschließend wird MFA über einen ähnlichen Prozess wie bei der Hydrogenolyse von HMF zu 5-MF direkt zu DMF umgesetzt. Im Falle von FA und H2 als Wasserstoffdonoren wird H2 durch die auf NMC geträgerten Pd0 NPs aktiviert, die für Hydrierschritte wie 5-MF zu MFA und HMF zu BHMF aktiver sind. H2 kann auch direkt zu den Hydrogenolysereaktionen beitragen, spielt aber wahrscheinlich in Gegenwart von FA eine untergeordnete Rolle.
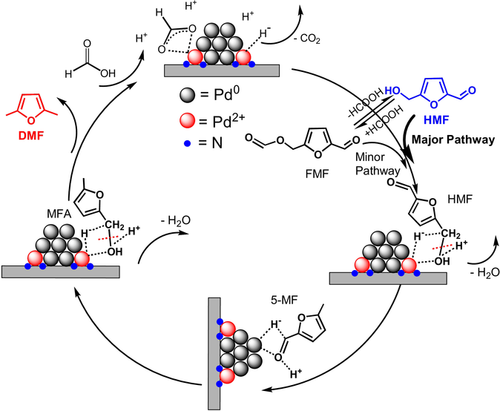
Vorgeschlagener Reaktionsweg für die Umsetzung von HMF zu DMF über Pd/NMC in FA.
Schlussfolgerung
Pd NPs geträgert auf N-dotierten und N-freien mesoporösen Kohlenstoffmaterialien wurden erfolgreich über die Immobilisierungsmethode synthetisiert und systematisch charakterisiert. Diese Katalysatoren weisen ähnliche mittlere Pd-Partikelgrößen auf, aber sub-1 nm Pd-Cluster wurden nur in Pd/NMC beobachtet. DFT-Berechnungen und XPS-Messungen belegten die starken Metall-Träger-Wechselwirkungen zwischen Pd2+-Spezies und pyridinartigen N-Atomen für Pd/NMC. Die Hydrogenolyse von HMF zu DMF über den Pd-basierten Katalysatoren wurde mittels verschiedener Wasserstoffquellen untersucht. Ein günstiger HMF-Vollumsatz, eine DMF-Ausbeute von >97 % und eine höhere TOF von 150 h−1 wurden über Pd/NMC in Gegenwart von FA und H2 nach 2 h erreicht.
Detaillierte Vergleichsstudien, hauptsächlich durch Variation der Wasserstoffquelle, des Additivs und des Reaktanten sowie durch Anwendung von In-situ-ATR-IR-Spektroskopie und DFT-Berechnungen wurden durchgeführt, um den Reaktionsmechanismus zu erforschen. FA beeinflusst nicht nur die Reaktivität von HMF, sondern auch die Reaktionswege, indem sie mehrere Funktionen erfüllt, wie z. B. die Unterdrückung der Ringhydrierung, die Funktion als mildes Reduktionsmittel, die Bildung von Ameisensäureestern als Zwischenprodukte und die Bildung eines protonierten Zwischenprodukts, wodurch die Aktivierungsbarriere der C-OH-Bindungsspaltung gesenkt wird. Die Protonierung führt zu einer Verschiebung des Reaktionsweges von der Hydrierung der C=O-Bindung (Weg B) zur Hydrogenolyse der C-OH-Bindung (Weg A) und ist der Hauptgrund für die deutliche Steigerung der katalytischen Aktivität. Darüber hinaus wurde ein synergistischer Effekt zwischen FA und der Pd2+-Spezies von Pd/NMC für die Hydrogenolyse der C-OH-Bindung beobachtet, wobei Pd2+ eine höhere katalytische Aktivität für die Aktivierung von FA und die Stabilisierung von H− zeigt.
Acknowledgements
Die Autoren bedanken sich für die finanzielle Unterstützung durch die Deutsche Forschungsgemeinschaft (Grant MU 1327/10-1 und Ha 2588/9-1) und DESY (Hamburg), einem Mitglied der Helmholtz-Gemeinschaft HGF, für die Bereitstellung von experimentellen Einrichtungen. Teile der Forschung wurden an PETRA III durchgeführt und wir danken E. Welter für die Unterstützung bei der Nutzung von P65 (I-20191191). Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Conflict of interest
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.




