Photoangeregte Anionen in organischen Reaktionen
Professor Ilhyong Ryu zum 70. Geburtstag gewidmet
Abstract
Die Durchführung chemischer Reaktionen mit Licht erlaubt es, die eingestrahlte Energie selektiv auf bestimmte Moleküle zu fokussieren. Viele Reaktionen, an denen elektronisch angeregte Spezies beteiligt sind, verlaufen über radikalische Zwischenstufen, die neue, einzigartige Reaktionswege ermöglichen und somit bekannte Syntheserouten zur Umwandlung organischer Moleküle erweitern. Der direkte Einsatz nicht funktionalisierter bzw. reaktionsträger Verbindungen ist ein erstrebenswertes Ziel, um chemische Prozesse nachhaltiger und atomökonomischer gestalten zu können. Es wurde gezeigt, dass angeregte Anionen mit gepaarten Elektronen enorme Potentiale in Elektronentransferreaktionen überwinden können und dass häufig ungewöhnliche Reaktivitäten im angeregten Zustand beobachtbar sind. In diesem Aufsatz fassen wir kurz die Eigenschaften der anionischen Photochemie zusammen, heben die wegweisenden Arbeiten auf diesem Gebiet hervor und diskutieren aktuelle Entwicklungen, die durch photoangeregte anionische Spezies in der organischen Synthese erzielt wurden.
1 Einleitung
Die vielseitigen Reaktionsmodi photoangeregter organischer Anionen und deren spezielles spektroskopisches Verhalten erlangten bereits Aufmerksamkeit durch die frühen Arbeiten von Fox1 und Tolbert.2 Seitdem folgten weitere hervorragende Veröffentlichungen über die Photochemie angeregter organischer Anionen mit besonderem Augenmerk auf deren photoreduktive Eigenschaften sowie Besonderheiten organischer Anionen in photochemischen Prozessen.3, 4 Im Vergleich zu ungeladenen Molekülen ist das Absorptionsspektrum eines organischen Anions normalerweise bathochrom verschoben, was eine selektive Anregung in komplexen Gemischen erleichtert und häufig die Verwendung von sichtbarem Licht erlaubt. Aufgrund der ladungsbedingten, stärkeren Abstoßung zwischen Elektronen in anionischen Molekülen sollten negativ geladene Spezies in ihren elektronisch angeregten Zuständen starke Elektronendonor-Eigenschaften besitzen. Des Weiteren verursacht ein Elektronentransfer ausgehend von einem Donor-Anion auf einen neutralen Akzeptor ein neutrales Radikal und ein Radikalanion. Die resultierenden Spezies sind frei von Coulomb-Kräften und können daher ungehindert auseinander diffundieren, wodurch Rückelektronentransferreaktionen (RET) unterdrückt werden, was schließlich zu effizienteren Reaktionen führt. Organische Anionen können leicht in Gegenwart einer geeigneten Base gebildet werden. Die vergleichsweise langen Lebensdauern im jeweiligen angeregten Zustand unterscheiden sie von radikalischen Anionen.
Angeregte Anionen treten auch in wichtigen photochemischen Schritten in der Biologie auf. Beispielsweise erzeugt das angeregte Oxyluciferin-Anion in einem ATP-getriebenen Prozess die Biolumineszenz von Glühwürmchen.5 Darüber hinaus stimulieren Lichtreize den lokomotorischen Apparat von phototrophen Organismen. Das photoaktive gelbe Protein umschließt dabei das Anion der trans-para-Cumarsäure und wirkt als Photorezeptor für blaues Licht. Die durch Lichtanregung verursachte trans-cis-Isomerisierung des angeregten Chromophors induziert eine Konformationsänderung des Proteins, die eine biologische Signalübertragung einleitet.6 Die enzymvermittelte Reparatur von lichtgeschädigter Desoxyribonucleinsäure (DNA) ist ein weiteres bekanntes Anwendungsbeispiel für angeregte Anionen in Organismen. Ein entscheidender Schritt ist dabei der photoinduzierte Elektronentransfer vom angeregten Cofaktor Flavinadenindinukleotid (FADH−), der Elektronen für die durch Photolyasen katalysierte lichtgetriebene Reparatur liefert.7, 8
Durch den bemerkenswerten Fortschritt, der im Bereich der Photochemie innerhalb des letzten Jahrzehnts gemacht wurde, konnten viele neuartige Reaktionen entwickelt werden, die das bestehende Repertoire an bis dahin bekannten chemischen Umwandlungen erweitern. Wir sind davon überzeugt, dass die Photochemie geschlossenschaliger Anionen, durch Inspirationen von natürlichen Prozessen und den hier beschriebenen Beispielen, maßgeblich zur Entwicklung von immer stärker reduzierenden, photoangeregten Spezies und neuartigen Reaktionen beitragen wird. In diesem Aufsatz fassen wir daher kurz die wesentlichen spektroskopischen und elektrochemischen Eigenschaften von organischen Anionen zusammen und geben anschließend einen Einblick in die vielseitige Photochemie dieser Verbindungen. Ein spezielles Augenmerk wird dabei auf kürzlich veröffentlichte Beispiele von anionischen Photokatalysatoren und durch Licht aktivierte anionische Reagenzien gelegt.
1.1 Spektroskopische Eigenschaften organischer Anionen
Die Chemie der durch Licht angeregten Moleküle wird durch die Absorption eines Photons eingeleitet. Wir werden daher zunächst die Besonderheiten der Absorptionsspektren von Anionen mit geschlossenen Elektronenschalen diskutieren. Im Vergleich zu ihren elektronisch neutralen Formen weisen organische Anionen häufig eine signifikante bathochrome Verschiebung in den Absorptionsspektren auf, worin intensive Absorptionsbanden auf π,π*-Übergänge zurückgeführt werden können. Die Rotverschiebung der Spektren geht auf die verringerte Energie zwischen dem höchsten besetzten Orbital (HOMO) und dem niedrigsten unbesetzten Orbital (LUMO, Abbildung 1) zurück. Dieses Phänomen wird im Wesentlichen durch eine stärkere Abschirmung des Kerns erklärt, die durch das Ungleichgewicht der Ladungen verursacht wird. Die Abschirmung verringert die Stärke des elektrischen Feldes zwischen positivem Kern und negativer Elektronenhülle, wodurch Elektronen im HOMO schwächere Anziehungskräfte erfahren. Infolgedessen wird die räumliche Verteilung der Elektronen diffuser, vergleichbar mit der Verlängerung eines konjugierten Systems.1, 9 Die Absorption gelöster organischer Anionen wird auch von Art und Größe des Gegenions, der Lösungsmittelpolarität und den unterschiedlichen Paarungsmöglichkeiten von Ionen beeinflusst. In unpolaren oder schwach polaren Lösungsmitteln werden vorzugsweise interne Ionenpaare (IP) gebildet, wobei die Eigenschaften der anionischen Spezies aufgrund der Nähe stark vom Charakter des Kations beeinflusst werden.
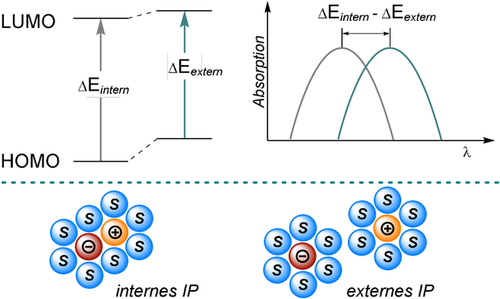
Energetische Destabilisierung des Grundzustands eines externen Ionenpaars verglichen mit einem internen Ionenpaar in einem nicht-polaren Lösungsmittel und der Einfluss auf das Absorptionsspektrum.
Im Gegensatz dazu führt die bessere Löslichkeit von Ionen in polaren Lösungsmitteln aufgrund der Ausrichtung molekularer Dipole zur Ausbildung von externen bzw. vollkommen solvatisierten Ionenpaaren, wodurch die gegenseitige ionische Wechselwirkung vermindert wird. Im Allgemeinen führt eine Zunahme der Lösungsmittelpolarität und/oder des Ionenradius des Gegenions zu einer bathochromen Verschiebung des Absorptionsspektrums, die auf eine Destabilisierung des Ionenpaars im Grundzustand zurückgeht. Dieser destabilisierende Effekt ist jedoch im angeregten Zustand weniger stark ausgeprägt.1, 4
In ähnlicher Weise wird die Emission von organischen Anionen gewöhnlich von der Lösungsmittelpolarität und dem Gegenion beeinflusst. Beispielsweise wurde die Fluoreszenzabnahme von Natrium-2-naphtholat in verschiedenen Lösungsmitteln untersucht.10 In polar protischen und polar aprotischen Lösungsmitteln wurde dabei ein monoexponentielles Abklingverhalten beobachtet. Das Experiment in polar protischem MeOH lieferte jedoch eine deutlich kürzere Fluoreszenzlebensdauer, und zudem wurde eine Blauverschiebung des Emissionsspektrums verglichen mit Messungen in polar aprotischem DMF oder DMSO beobachtet. Die Autoren begründeten diese Beobachtung mit der Stabilisierung des Grundzustands durch die Ausbildung starker Wasserstoffbrückenbindungen in MeOH. Im Gegensatz dazu koexistieren im wenig polarem THF interne und externe Ionenpaare zwischen 2-Naphtholat und Na+, was zu einem biexponentiellen Abklingverhalten, verursacht durch verschiedene Fluoreszenzlebensdauern der unterschiedlichen Ionenpaare, führt. Nach Zugabe von Kronenether wurde jedoch eine monexponentielle Abnahme der Fluoreszenz gemessen, was auf die Komplexierung der Natrium-Kationen und die damit verbundene ausschließliche Ausbildung von externen Ionenpaaren zurückzuführen ist. Aufgrund der fehlenden Stabilisierungsmöglichkeit des Ionenpaars im Grundzustand durch die Ausbildung von externen bzw. vollkommen solvatisierten Ionenpaaren werden in Gegenwart von komplexierendem Kronenether auch in THF Fluoreszenzlebensdauern beobachtet, die vergleichbar mit Experimenten in polar aprotischen Lösungsmitteln (DMF, DMSO) sind.
Unterschiedliche Arten von Ionenpaaren können sich auf die Effizienz von bimolekularen Elektronentransferprozessen auswirken. Tamaoki und Mitarbeiter untersuchten die Quantenausbeute der Photodissoziation einer Aryldiazoniumverbindung 1 in Gegenwart von 9,10-Dimethoxyanthracen-2-sulfonat (2) als lichtabsorbierendes Gegenion (Schema 1).11 Dabei wurde eine sechsfach höhere Photodissoziation des Aryldiazonium-Kations 1, verursacht durch den photoinduzierten Elektronentransfer (PET) des angeregten Anions 2, in CHCl3 verglichen mit derselben Reaktion in MeCN festgestellt. Der Reaktivitätsunterschied wurde durch die Ausbildung unterschiedlicher Ionenpaare abhängig vom gewählten Lösungsmittel erklärt. Im wenig polaren CHCl3 liegen bevorzugt interne Ionenpaare vor, und es wird eine schnelle Reaktion aufgrund der unmittelbaren Nähe von Akzeptor 1 und Donor 2 beobachtet. Die Gegenwart von externen bzw. vollkommen solvatisierten Ionenpaaren in polarem MeCN wirkt sich demgegenüber negativ auf die Effizienz der betrachteten Photodissoziation aus, da die geladenen Spezies nahezu frei beweglich vorliegen. Aufgrund der geringeren Reaktivität konnte die Fluoreszenzlebensdauer von 2 bestimmt werden. Um die Photozersetzung der Aryldiazoniumverbindung 1 in polarem Medium auszulösen, müssen dissoziierter anionischer Donor 2 und kationischer Akzeptor 1 unmittelbar nach Anregung mit Licht aufeinander treffen, was zu messbaren Fluoreszenzlebensdauern führt. Für eine detailliertere Diskussion hinsichtlich Ionenpaarungs- und Lösungsmitteleffekte möchten wir an dieser Stelle auf hervorragende Übersichts- und Originalartikel verweisen.4, 10, 12-14
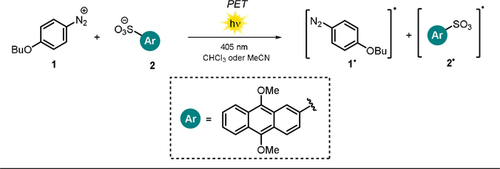
Die Rate des photoinduzierten Elektronentransfers wird durch die Lösungsmittelpolarität beeinflusst: schnell in CHCl3 (enge ionische Bindung), langsam in MeCN (lockere ionische Bindung).
1.2 Photoinduzierter Elektronentransfer
Elektronentransferreaktionen von elektronisch angeregten Molekülen gehören zu den frühesten Beobachtungen in der Photochemie.15 Verglichen mit ihren Grundzuständen weisen photoangeregte Moleküle ein höheres Reduktions- und Oxidationspotential auf, wobei die resultierenden Potentiale im angeregten Zustand mittels der Änderung der freien Enthalpie eines PET durch die Bestimmung der Potentiale im Grundzustand E1/2 und der Übergangsenergie E0,0 (Abbildung 2) abgeschätzt werden können.16 Dabei wird der Term für die bei der Ladungstrennung geleistete elektrostatische Arbeit in polaren organischen Lösungsmitteln häufig vernachlässigt, da die Auswirkung auf die Änderung der freien Enthalpie für gewöhnlich gering ist.17
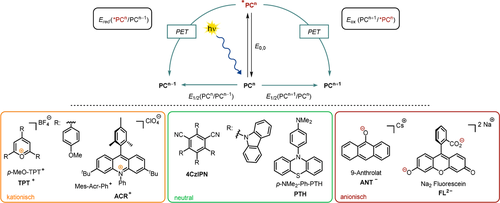
Schematische Darstellung des Grund- und des angeregten Zustands eines Photokatalysators (PC, oben). Ausgewählte Vertreter von kationischen, neutralen und anionischen organischen Photokatalysatoren (unten).
Ein PET von einem neutralen Donor im angeregten Zustand (*D) auf einen ungeladenen Akzeptor im Grundzustand (A) führt zur Ladungstrennung und einem Paar radikalischer Ionen. Im Gegensatz dazu kann ein PET von einem angeregten anionischen Donor auf einen neutralen Akzeptor im Grundzustand als Ladungsverschiebung beschrieben werden, wobei Produkte entstehen, die frei von elektrostatischer Anziehung sind und somit ungehindert auseinander diffundieren können (Schema 2). Die ungehinderte Diffusion der Produkte bei einer photoinduzierten Ladungsverschiebung erschwert daher den Rückelektronentransfer, der die Ausgangsmaterialen wiederherstellen würde.18

Ladungstrennung mit ungeladenem Donor (links) und Ladungsverschiebung mit negativ geladenem Donor (rechts).
Verglichen mit den jeweiligen neutralen Verbindungen können Anionen als bessere Elektronendonoren betrachtet werden, denn sowohl die Abstoßung unter den Valenzelektronen als auch die Abschirmung vom Kern sind erhöht. Konsequenterweise erleichtert die überschüssige negative Ladung die Abgabe eines Elektrons. Im Experiment wird dies vor allem deutlich, wenn organische Anionen mit energiereicher UV-Strahlung19 in glasartigen Matrizes (77 K) oder mit gepulsten Hochenergie-Lasern20, 21 in alkalisch wässriger Lösung bestrahlt werden. Dabei werden in einem biphotonischen Prozess solvatisierte Elektronen generiert. Werden jedoch weniger leistungsstarke, sichtbares Licht emittierende Dioden (LED) in Verbindung mit gängigen organischen Lösungsmitteln für Photoreaktionen genutzt, so ist die Wahrscheinlichkeit einer Photoionisierung sehr gering, und unter diesen milderen Bedingungen finden vorzugsweise Elektronentransferreaktionen statt. Wir haben kürzlich gezeigt, dass 9-Anthron und dessen Derivate in Gegenwart von Alkalimetallcarbonaten deprotoniert und farbige Anionen gebildet werden (z. B. ANT−, Abbildung 2). Bei Anregung mit sichtbarem Licht entstehen auf diese Weise bemerkenswert stark reduzierende Spezies.22 Cyclovoltammetrische Messungen in alkalischem DMSO ergaben, dass der negativ geladene Grundzustand bereits eine starke Reduktionskraft aufweist, da die überschüssige Ladung aufgrund des entstehenden resonanzstabilisierten Radikals leicht abgegeben werden kann. Im Gegensatz dazu neigen die Dianionen des Fluorescein FL2− bzw. Eosin Y (EY2−) deutlich weniger zur elektrochemischen Oxidation in alkalischem MeOH. Die resultierenden Oxidationspotentiale im angeregten Zustand sind daher nur moderat (vgl. Tabelle 1, Einträge 5–7).23
Eintrag |
PCn |
E1/2(PCn/PCn−1) [eV] |
Ered(*PCn/PCn−1) [eV] |
E1/2(PCn+1/PCn) [eV] |
Eox(PCn+1/*PCn) [eV] |
E0,0 [eV] |
|---|---|---|---|---|---|---|
117 |
TPT+ |
−0.50[a] |
+1.84 |
– |
– |
2.34[b] |
230 |
ACR+ |
−0.59[c] |
+2.08 |
– |
– |
2.67 |
331 |
4CzIPN |
−1.24[d] |
+1.43 |
+1.49[d] |
−1.18 |
2.67 |
432 |
PTH |
– |
– |
+0.57[d] |
−2.5 |
3.1 |
522 |
ANT− |
– |
– |
−0.34[d,e] |
−2.65 |
2.31 |
623 |
FL2− |
– |
– |
+0.87[f] |
−1.55 |
2.42 |
717 |
EY2− |
−1.06 |
+1.23[g,h] |
+0.76 |
−1.58[g,h] |
2.31[g] |
|
|
+0.83[i,h] |
−1.08[i,h] |
1.91[h] |
||
872 |
PhPH− |
– |
– |
−0.10[e] |
−3.16 |
3.06 |
979 |
BIA-H.1− |
– |
– |
+0.06[j] |
−2.71 |
2.77[k] |
1086 |
TMA− |
– |
– |
−0.51[d,e] |
−2.92 |
2.41 |
- Angegebene Potentiale beziehen sich auf die gesättigte Kalomel-Elektrode (SCE) als Referenz. Die Übergangsenergie E0,0 wurde anhand des Schnittpunkts zwischen normiertem Absorptions- und Emissionsspektrum bestimmt. [a] Potential wurde gegenüber der Standard-Wasserstoffelektrode (NHE) gemessen und auf die SCE durch abziehen von 0.141 V referenziert. [b] Zur Bestimmung wurde das Emissionsmaximum mit niedrigster Energie berücksichtigt. [c] Potential wurde gegenüber der Silber-Silberchlorid-Elektrode (Ag/AgCl) gemessen und durch Abziehen von 0.03 V auf die SCE referenziert. [d] Potential wurde gegenüber dem Ferrocen-Redox-Paar (Fc+/Fc) gemessen und durch Addieren von 0.38 V auf die SCE referenziert. [e] Potential wurde in wasserfreiem, entgastem DMSO in Gegenwart von einem Überschuss an Cs2CO3 gemessen. [f] Potential wurde in einer alkalischen MeOH-Lösung (NaOH, 0.1 mm) gegenüber der Ag/AgCl gemessen und durch Umrechnung auf die SCE referenziert. [g] Werte beziehen sich auf den angeregten Singulett-Zustand. [h] Potential wurde gegenüber der Ag/AgCl gemessen und durch Abziehen von 0.039 V auf die SCE referenziert. [i] Werte beziehen sich auf den angeregten Triplett-Zustand. [j] Potential wurde in MeCN in Gegenwart eines Überschusses an tBuOK gemessen. [k] Wert wurde anhand des Absorptionsspektrums abgeschätzt, wobei die zugehörige Wellenlänge bei einer Extinktion von 0.02 und einer Konzentration von 4.0×10−5 m genommen wurde.
Obwohl FL2− und EY2− in ihrem Grundzustand bereits als Dianionen vorliegen, ist darüber hinaus bekannt, dass beide Verbindungen im angeregten Zustand in alkalischer Lösung und in Gegenwart von Triethanolamin oder Phenol reduziert werden und die entsprechenden Radikaltrianionen bilden (Schema 3, oben).24-28 Walt und Mitarbeiter stellten in diesem Zusammenhang ein Fluorescein-Derivat NH2-FL2− her, dass am Benzoat-Ring eine zusätzliche Aminogruppe aufweist. Fluoreszenzmessungen zeigten, dass die Quantenausbeute im Falle des aminosubstituierten Derivats fast sechzigfach zurückging. Als Erklärung für diese Beobachtung wurde ein intramolekularer PET vom freien Elektronenpaar des Stickstoffs auf die Fluorescein-Struktur postuliert (Schema 3, unten). Eine ähnliche Quantenausbeute der Fluoreszenz hinsichtlich des nicht modifizierten FL2− wurde jedoch gemessen, nachdem der pH der Lösung auf einen Wert nahe des pKs-Werts des aromatischen Amins eingestellt wurde. Das Ansäuern der Lösung führt zur Protonierung der Aminogruppe, wodurch das Elektronenpaar am Stickstoff für einen intramolekularen PET nicht mehr zur Verfügung steht und folglich Fluoreszenz beobachtet wird.29 Des Weiteren zeigten Soumillion et al. 1991, dass die Fluoreszenz des anionischen Xanthenfarbstoffs Resorufin in Gegenwart von 2-Naphtholat gelöscht wird, wobei die Bildung des Resorufin-Radikaldianions via PET angenommen wird.18 Die lediglich moderate Reduktionskraft der angeregten anionischen Xanthenfarbstoffe (z. B. EY2−, FL2−) lässt sich durch einen überwiegenden Beitrag des elektronenarmen konjugierten Systems zur Gesamtheit der elektronischen Eigenschaften erklären. Ausschlaggebend für die Beobachtung stark reduzierender angeregter Anionen ist daher die Eigenschaft, wie leicht ein Elektron abgegeben werden kann. (Tabelle 1, Einträge 5 und 6 weisen ähnliche Werte für E0,0 auf, aber unterscheiden sich signifikant hinsichtlich der Oxidationspotentiale im Grund- und angeregten Zustand.)

Bildung des Eosin-Y-Radikaltrianions durch PET in Gegenwart von Triethanolamin (oben). Intramolekularer PET ausgehend von der Aminogruppe verursacht die Selbstlöschung der Fluoreszenz (unten).
2 Anionen als Photokatalysatoren
2.1 Photoredox-Katalyse
Innerhalb des letzten Jahrzehnts wurden bemerkenswerte Fortschritte im Bereich der synthetischen Photoredox-Katalyse gemacht, wodurch viele neue Umsetzungen entwickelt wurden, die bislang nicht möglich waren. Die Anregung eines Moleküls mit Licht führt zu Änderungen der Elektronenverteilung in den Molekülorbitalen, welche die Redox-Eigenschaften beeinflussen. Im Vergleich zum Grundzustand besitzen elektronisch angeregte Moleküle eine höhere Oxidationskraft, aber gleichzeitig auch eine gesteigerte Reduktionskraft (siehe Abbildung 2). Die Redox-Eigenschaften einer Verbindung können dabei häufig mit dem Einführen von elektronenschiebenden oder -ziehenden Substituenten angepasst werden.30-33 Heutzutage ist eine Vielzahl an Photokatalysatoren bekannt, die bezüglich ihrer Zusammensetzung in Polypyridyl-Übergangsmetallkomplexe34 organische Farbstoffe17 oder Polyoxometallate35 (POMs) eingeteilt werden. Darüber hinaus wurden heterogene organische Halbleiter erfolgreich als Photokatalysatoren eingesetzt.36 Ihre intrinsischen photophysikalischen Eigenschaften wie Redox-Potentiale im angeregten Zustand, die Absorption von Licht oder die Lebendsauer des angeregten Zustands legen dabei Anwendungsbereich und Grenzen für katalytische Umsetzungen fest. Ausgewählte Vertreter organischer Photokatalysatoren sind in Abbildung 2 dargestellt. Die Photochemie des ungeladenen organischen Donor-Akzeptor Farbstoffs 4CzIPN deckt eine große elektrochemische Bandbreite ab (siehe Tabelle 1, Eintrag 3). Aufgrund seiner vielfältigen Chemie aus dem angeregten Zustand stellt 4CzIPN eine interessante Alternative zu teuren und giftigen Ru- oder Ir-Polypyridyl-Komplexen dar.31, 37 Um jedoch weniger aktivierte Startmaterialien mittels photoinduzierten Elektronenübertragungen umsetzen zu können, müssen die Potentialgrenzen hin zu extremeren Werten verschoben werden. Erst kürzlich wurde gezeigt, dass angeregte, elektronenreiche Derivate des N-Arylphenothiazins (z. B. PTH) als außerordentlich starke Elektronendonoren wirken. Allerdings absorbieren sie nicht im sichtbaren Bereich, weshalb UV-Licht nötig ist, was eine selektive Anregung in Gegenwart anderer Reagenzien erschwert. Für die N-Arylphenothiazine wurden große Stokes-Verschiebungen gemessen, was sich in einem vergleichsweise hohen Wert der Übergangsenergie wiederspiegelt (vgl. Tabelle 1, Eintrag 4).32
Neben den häufig verwendeten ungeladenen organischen Farbstoffen konnte die Reichweite an umsetzbaren Ausgangsmaterialien mithilfe von geladenen, radikalischen oder radikalionischen Photokatalysatoren deutlich gesteigert werden, da in den jeweiligen angeregten Zuständen signifikant höhere Potentiale für Elektronentransferreaktionen erreicht wurden (Schema 4). Einige organische Farbstoffe bilden unter Belichtung und in Gegenwart von geeigneten Elektronendonoren stabile, farbige Radikalanionen, die erneut mittels Licht angeregt werden können (siehe Schema 4 A).38-41 Die vielseitige Photochemie angeregter Radikalanionen wurde unter anderem für die radikalische Kupplung verschiedener (Hetero-)Arylhalogenide genutzt und ist Gegenstand einiger Aufsätze.42-45 Darüber hinaus wurde vor kurzem gezeigt, dass mithilfe von angeregten Radikalanionen metallfreie Birch-Reduktionen von Benzolderivaten mit sichtbarem Licht möglich sind.46 Andererseits wurden angeregte, superoxidierende Phenothiazin-Radikalkationen genutzt, die vorher chemisch generiert wurden (siehe Schema 4 B).47 Elektronentransferreaktionen von angeregten Dublett-Zuständen neutraler Verbindungen wurden ebenfalls untersucht.48-52 Seit kurzem ist bekannt, dass mittels Schwarzlicht ein äußerst starkes Photoreduktionsmittel aus dem Acridin-Radikal ACR. generiert werden kann (siehe Schema 4 C).53 Obwohl angeregte radikalische Verbindungen sehr hohe Potentiale für Elektronentransferreaktionen ermöglichen, bleibt festzuhalten, dass die Lebenszeiten der angeregten Zustände häufig nur im Bereich von Pikosekunden liegen.53-55 Da die Photochemie radikalischer Spezies jedoch über den Umfang dieses Aufsatzes hinaus geht, verweisen wir den interessierten Leser auf die zitierte Literatur.

Diskutierte Ansätze, um extreme Redox-Potentiale mittels angeregten Photokatalysators (rot) zu erreichen, um nicht-aktivierte Substrate (S) umzusetzen. Die anfängliche Aktivierung via Protonierung/Deprotonierung (siehe D, E) fällt weg, wenn direkt das Salz des jeweiligen Photokatalysators eingesetzt wird.
Der Einsatz von katalytischen Mengen geschlossenschaliger Kationen für Photoreaktionen stellte sich als synthetisch äußerst nützlich heraus (Schema 4 D). Die Pionierarbeit von Fukuzumi und Mitarbeitern56 ebnete den Weg für eine Vielzahl von Publikationen, in denen auf der Acridinium-Struktur basierende Donor-Akzeptor-Farbstoffe als stark oxidierende Photokatalysatoren eingesetzt wurden.17, 57-60 Darüber hinaus wurden mit den außerordentlich starken Photooxidantien wie Pyrylium-, Chinolinium- oder Diazapyreniumsalzen neue Maßstäbe hinsichtlich erreichter Potentiale im angeregten Zustand gesetzt. Neben anderen Vertretern wurden vor allem Derivate aus den Gruppen der Pyrylium- und Acridinium-Salze (z. B. TPT+ und ACR+, Abbildung 2) aufgrund ihrer starken photooxidierenden Eigenschaften vielfach für Syntheseanwendungen genutzt.17, 61-68 Betrachtet man die Vielzahl an Veröffentlichungen über die Chemie photoangeregter Kationen, ist es daher überraschend, dass die Photochemie nichtradikalischer Anionen weitaus weniger betrachtet wurde, obwohl sie das logische Gegenstück darstellt (Schema 4 E).
Im folgenden Abschnitt soll daher die Leistungsfähigkeit anionischer Photokatalysatoren anhand ausgewählter, bemerkenswerter Transformierungen diskutiert werden. Aufgrund ihrer nur moderaten Redox-Potentiale und der Vielzahl an veröffentlichten Aufsätzen werden die Reaktionen der Xanthenfarbstoffe wie Eosin Y, Bengalrosa oder Fluorescein – obwohl ebenfalls negativ geladen – in diesem Aufsatz nicht diskutiert.17, 69-71 Des Weiteren haben wir keine Beispiele berücksichtigt, in denen anionische Gruppen lediglich zur besseren Löslichkeit des Sensibilisators in polaren Medien installiert wurden (z. B. Na-Salz der 9,10-Anthrachinon-2-sulfonsäure), wodurch dessen Reaktivität aber nicht merklich beeinflusst wird.
2.2 Phenolat-katalysierte Oxyarylierung von Olefinen mit Arylhalogeniden
Der niedrige pKs-Wert von Phenol, basierend auf der ladungsstabilisierenden Wirkung des Benzolrings, ermöglicht die Deprotonierung zum Phenolat in Gegenwart von Basen. Abhängig von den gewählten Substituenten am Phenolat können photochemische Reaktionen bereits mit sichtbarem Licht durchgeführt werden. Kürzlich untersuchten Xia und Mitarbeiter verschiedene 4-Phenylphenol-Derivate hinsichtlich ihrer potentiellen Wirkung als Photokatalysatoren für die Oxyarylierung von Olefinen, vermittelt durch die Photoreduktion von Arylhalogeniden und initiiert durch sichtbares Licht (Schema 5).72 Das sterisch anspruchsvolle 4-Phenylphenol mit zwei tert-Butylgruppen in Nachbarschaft zum phenolischen Alkohol (siehe Schema 6) zeigte dabei die höchste katalytische Aktivität, und die entsprechenden oxyarylierten Produkte 5, die in Gegenwart von Arylhalogeniden 3, Olefinen 4 und TEMPOH entstehen, konnten in moderaten bis guten Ausbeuten isoliert werden. Dabei erreicht der angeregte Photokatalysator *PhPH− ein bemerkenswert starkes Oxidationspotential ( =−3.16 V vs. SCE), wodurch der Umsatz von reaktionsträgeren und elektronenreicheren Arylbromiden und Arylchloriden in Gegenwart von 4-Methoxystyrol möglich ist. Die entwickelte Katalysevorschrift toleriert dabei ein breites Spektrum an Arylhalogeniden wie (Hetero-)Arylbromide und -iodide, polyaromatische Verbindungen, Pyridine, Indole, Chinoline Thiophen, Thianaphthen und Benzofuran.
=−3.16 V vs. SCE), wodurch der Umsatz von reaktionsträgeren und elektronenreicheren Arylbromiden und Arylchloriden in Gegenwart von 4-Methoxystyrol möglich ist. Die entwickelte Katalysevorschrift toleriert dabei ein breites Spektrum an Arylhalogeniden wie (Hetero-)Arylbromide und -iodide, polyaromatische Verbindungen, Pyridine, Indole, Chinoline Thiophen, Thianaphthen und Benzofuran.

Produktumfang der Oxyarylierungsreaktion von Olefinen mit Arylhalogeniden und TEMPOH. [a] Mit 3 Äquiv. Cs2CO3. [b] Mit 3 Äquiv. Olefin.
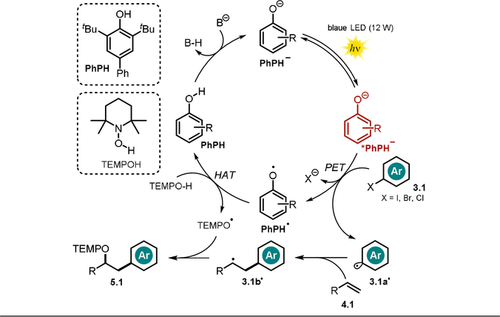
Postulierter Mechanismus für die Phenolat-katalysierte Oxyarylierung von Olefinen via Bildung eines Arylradikals.
Verschiedene Styrole, aliphatische Olefine, allylische Sulfonamide und Alkohole, Enolether sowie 1,1- und 1,2-disubstituierte Olefine werden als Alkene toleriert. Zusätzlich erlaubt die Methode intramolekulare Cyclisierungsreaktionen mit Aryliodiden oder die Modifikation von Pharmazeutika in einer späten Phase der Synthese. Der Einsatz von TEMPOH als H-Atom-Donor bzw. Radikalfänger scheint aufgrund der geringen O-H-Bindungsstärke und der hohen Stabilität des intermediär gebildeten Aminoxyl-Radikals wesentlich zu sein. Der vorgeschlagene Reaktionsmechanismus umfasst die basenvermittelte Deprotonierung des Phenols PhPH und den PET vom photoangeregten Zustand *PhPH− auf das Arylhalogenid 3.1. Nach Abspaltung des Halogenids wird das resultierende Arylradikal vom Olefin 4.1 abgefangen, wobei das kohlenstoffzentrierte Radikal 3.1 b. entsteht. Nach Abstraktion eines H-Atoms von TEMPOH durch den oxidierten Katalysator wird die neutrale PhPH-Form regeneriert und das persistente TEMPO.-Radikal gebildet. Das Oxyarylierungsprodukt 5.1 wird anschließend durch eine Radikal-Radikal-Kupplung (Schema 6) erhalten. UV/Vis-Messungen sprechen gegen die Ausbildung eines Elektronen-Donor-Akzeptor-Komplexes (EDA) zwischen Phenolat-Anion und Arylhalogenid. Zudem unterstützen Fluoreszenzlöschungsexperimente sowie isolierte TEMPO-Addukte des Aryl-Radikal-Intermediats aus Abfangexperimenten die mechanistische Hypothese. Ein Radical-Clock-Experiment liefert zudem Hinweise auf die Entstehung eines benzylischen Radikals, wohingegen die Ergebnisse aus intramolekularen Abfangexperimenten gegen die Beteiligung eines benzylischen Carbokations sprechen, welches durch Oxidation des Radikals 3.1 b. entstehen könnte.
2.3 Naphtholat-katalysierte Dehalogenierung und Detosylierung
Die ersten Untersuchungen bezüglich des photochemischen Verhaltens des 2-Naphtholat-Anions NA− reichen zurück bis ins Jahr 1989, als der Einfluss des Gegenions, der Reaktionstemperatur und des Lösungsmittels systematisch hinsichtlich der Lumineszenzlebenszeit sowie Absorptions- und Emissionsmaxima ausgewertet wurde.10 Im gleichen Jahr berichteten Soumillion und Mitarbeiter die photokatalysierte Defunktionalisierung von 2-Chlornaphthalin und 4-Chlorbiphenyl (6.2–3) mithilfe von NA− als Photokatalysator in entgastem alkalischem MeOH (Schema 7, links).73
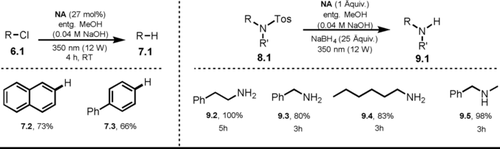
Produkte der NA−-katalysierten Dechlorierung (links) und Desulfonierung (rechts).
Die entwickelte Methode konnte ebenfalls in einem heterogenen System realisiert werden, wobei 2-Hydroxynaphtholsäure mittels Amidierung kovalent auf der Kieselgeloberfläche immobilisiert wurde. Die Effizienz der Dechlorierung war jedoch deutlich geringer.74 Mit Mono- und Dichlornitrobenzol konnten etwas später weitere Substrate umgesetzt werden.75 Darüber hinaus wurde gezeigt, dass NA− die Detosylierung von Sulfonamiden in Gegenwart eines Überschusses an NaBH4 als terminales Reduktionsmittel katalysiert (Schema 7, rechts).76 Durch Anwenden dieser Methode konnten 2-Phenylethylamin (9.2) und N-Methylbenzylamin (9.5) ausgehend von den jeweiligen Sulfonamiden in quantitativer Ausbeute erhalten werden. Trotz Einsatz einer stöchiometrischen Menge an Katalysator (NA) zeigten die Autoren, dass eine effiziente Rückgewinnung möglich ist. Als Reaktionsmechanismus wird die Deprotonierung zum NA− vorgeschlagen, welches mit Schwarzlicht in den photoangeregten Zustand *NA− überführt werden kann und Elektronentransferreaktionen mit Arylchloriden oder Sulfonamiden eingeht. Dabei werden die oxidierte Form des Katalysators NA. sowie das reduzierte Arylradikalanion gebildet. Nach Abspaltung der entsprechenden anionischen Abgangsgruppe (Cl− oder 4-Me(C6H4)SO2−) wird entweder ein Aryl- oder ein stickstoffzentriertes Radikal gebildet. Das defunktionalisierte Aren entsteht via Abstraktion eines H-Atoms vom Lösungsmittel durch das reaktive Arylradikal. Das N-zentrierte Radikal wird via H-Atom-Abstraktion von NaBH4 oder Lösungsmittel in das jeweilige Amin überführt. Der Katalysezyklus wird ebenfalls durch einen H-Atom-Transfer geschlossen, wobei NA. mit dem Lösungsmittel oder NaBH4 reagiert und somit NA regeneriert (Schema 8).
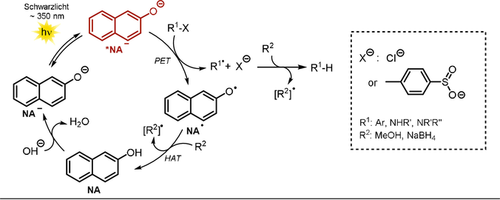
Vorgeschlagener photokatalytischer Mechanismus des Naphtholat-Anions.
Vor kurzem wurde gezeigt, dass ein zwitterionisches Benzimidazolium-Naphtholat BINA im Zusammenspiel mit einem kombinierten Elektronen- und Wasserstoffatomdonor 10 und sichtbarem Licht erfolgreich in Deiodierungs- und Desulfonylierungsreaktionen eingesetzt werden konnte (siehe Schema 10).77 Dabei kann die kationische Benzimidazolium-Einheit als elektronisch getrennt von dem Naphtholat-Gerüst angesehen werden, da durch die verdrillte Struktur keine Überlappung der π-Systeme möglich ist. Die photokatalytische Aktivität wurde in verschiedenen, anhand ihrer Donor- und Akzeptorzahlen in Lewis-basisch bzw. Lewis-sauer eingeteilte Lösungsmittel getestet. Aus den erhaltenen Ergebnissen schlossen die Autoren, dass Lewis-basische Lösungsmittel feste Wechselwirkungen mit der Lewis-sauren Benzimidazolium-Einheit eingehen, wohingegen die elektronischen Eigenschaften des Lewis-basischen anionischen Naphtholats weitaus weniger vom Lösungsmittel beeinflusst werden. Daraus resultiert in Lewis-basischen Lösungsmitteln eine ausgeprägtere Fähigkeit, Elektronen zu donieren. Die besten Ergebnisse (Schema 9) wurden mit DMF als Lösungsmittel erhalten. Mit 10 mol % des Katalysators BINA und 1.2 Äquiv. von 10 konnte das Cyclisierungsprodukt 12 in 82 % Ausbeute erhalten werden. Der Einsatz einer geringeren katalytischen Menge von nur 1 mol % Katalysator ergab vollen Umsatz hinsichtlich des Aryliodids 11, wobei eine geringere Menge 12 (69 %) gebildet wurde. Zusätzlich zur Cyclisierung von Aryliodid 11 wurde die photokatalytische Reaktivität anhand der reduktiven Desulfonylierung von tertiären Sulfonamiden 13 und β-Ketosulfonen 15 demonstriert. Die entsprechenden sekundären Amine konnten dabei in guten Ausbeuten erhalten werden. Der angenommene Photokatalysezyklus ist in Schema 10 dargestellt.
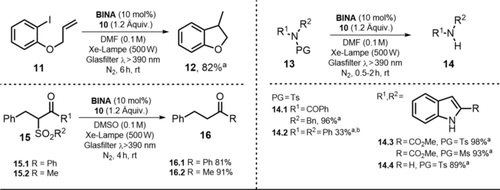
Cyclisierung von Aryliodid und Substratbreite der Desulfonylierung. [a] NMR-Ausbeuten. [b] In DMSO, 6 h.
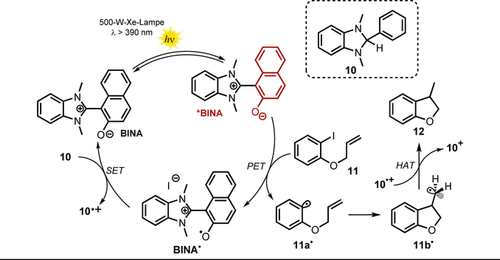
Vorgeschlagener Katalysezyklus für die radikalische Cyclisierung eines Aryliodids mithilfe eines photoangeregten Benzimidazolium-Naphtholat-Katalysators.
Nach Photoanregung (λ>390 nm) reduziert der zwitterionische Katalysator *BINA ( =−2.08 vs. SCE) das Aryliodid 11 via PET. Die anschließende Abspaltung von Iodid, gefolgt von einer schnellen 5-exo-trig-Cyclisierung, liefert das primäre Radikal 11 b.. Der oxidierte Photokatalysator BINA. wird in Gegenwart eines Elektronendonors 10 (E1/2=+0.34 V vs. SCE) via Elektronentransfer regeneriert, wobei 10.+ entsteht, das wiederum als H-Atom-Donor fungiert und unter Bildung von 12 zu 10+ umgesetzt wird. In Gegenwart anderer Elektronendonoren wie Hantzsch-Ester (E1/2=+0.93 V vs. SCE) wurde kein Produkt gebildet, da aufgrund des höheren Oxidationspotentials im Grundzustand ein Elektronentransfer mit BINA. endergonisch wäre.
=−2.08 vs. SCE) das Aryliodid 11 via PET. Die anschließende Abspaltung von Iodid, gefolgt von einer schnellen 5-exo-trig-Cyclisierung, liefert das primäre Radikal 11 b.. Der oxidierte Photokatalysator BINA. wird in Gegenwart eines Elektronendonors 10 (E1/2=+0.34 V vs. SCE) via Elektronentransfer regeneriert, wobei 10.+ entsteht, das wiederum als H-Atom-Donor fungiert und unter Bildung von 12 zu 10+ umgesetzt wird. In Gegenwart anderer Elektronendonoren wie Hantzsch-Ester (E1/2=+0.93 V vs. SCE) wurde kein Produkt gebildet, da aufgrund des höheren Oxidationspotentials im Grundzustand ein Elektronentransfer mit BINA. endergonisch wäre.
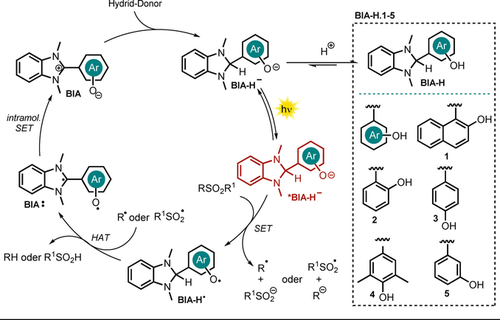
Aus einer früheren Arbeit ist bekannt, dass photoangeregtes 1,3-Dimethyl-2-hydroxynaphthylbenzimidazolin (BIA-H.1) N-Sulfonamide und N-Sulfonylamine in die jeweiligen desulfonylierten Produkte umsetzt.78 Basierend auf diesem Konzept entwickelten Hasegawa et al. das in Schema 10 gezeigte katalytische System weiter, wobei die In-situ-Reduktion von Benzimidazolium-gekuppelten Aryloxiden (BIA) mittels herkömmlicher Borhydrid-Reagenzien die Bildung der anionischen Spezies BIA-H− erlaubte (siehe Schema 11).79
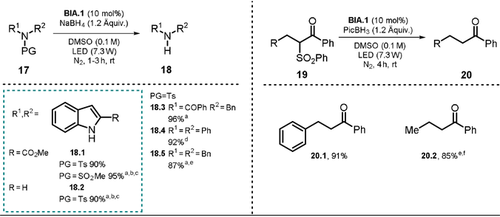
Neben den diskutierten Elektron- und H-Atom-donierenden Eigenschaften des Benzimidazolin-Gerüstes (vgl. Schema 10, 10) ist das entstehende Benzimidazolin-Aryloxid BIA-H− zusätzlich mit einer photoredoxaktiven Einheit, der Aryloxid-Struktur, ausgestattet. Reduktionsmittel, H-Atom-Donor und Photokatalysator sind somit in einem Molekül vereint. Verschiedene Aryloxide des Benzimidazolins BIA-H.1–5 (Schema 11) wurden synthetisiert und bezüglich ihrer spektroskopischen und elektronischen Eigenschaften charakterisiert.79 Das berechnete Oxidationspotential von BIA-H.1− aus dem angeregten Zustand ( =−2.71 V vs. SCE) stellte sich dabei als deutlich verstärkt gegenüber dem Betain BINA heraus, was den Umsatz von reaktionsträgeren Substraten erlaubte. Das ausgearbeitete Protokoll wurde für die reduktive Desulfonylierung von N-Sulfonylindolen, -amiden, -aminen und α-Sulfonylketonen angewendet und lieferte die ungeschützten sekundären Amine sowie die α-defunktionalisierten Ketone in guten bis sehr guten Ausbeuten (Schema 12).
=−2.71 V vs. SCE) stellte sich dabei als deutlich verstärkt gegenüber dem Betain BINA heraus, was den Umsatz von reaktionsträgeren Substraten erlaubte. Das ausgearbeitete Protokoll wurde für die reduktive Desulfonylierung von N-Sulfonylindolen, -amiden, -aminen und α-Sulfonylketonen angewendet und lieferte die ungeschützten sekundären Amine sowie die α-defunktionalisierten Ketone in guten bis sehr guten Ausbeuten (Schema 12).
Postulierter Photokatalysezyklus für die von Hasegawa et al. berichtete Desulfonylierung.
Getestete Substrate für die Desulfonylierung. [a] NMR-Ausbeute. [b] DMF. [c] Xe-Lampe (500 W), Glasfilter λ>390 nm. [d] 24 h. [e] 2×LED (10.8 W), 48 h. [f] Cs2CO3 (1 Äquiv.).
Für die Desulfonylierung von α-Carbonylen wurde das mildere Hydrid-Reagenz PicBH3 genutzt, um die direkte Reduktion der Carbonylgruppe zu verhindern. Die entwickelte photokatalytische Methode erlaubte unter anderem den Umsatz von Diphenylsulfonamid (17.4) und Dibenzylsulfonamid (17.5) innerhalb von 24 bzw. 48 Stunden in nahezu quantitativer Ausbeute, obwohl für die Reduktion beider Substrate herausfordernde Potentiale (E1/2<−2 V vs. SCE) überwunden werden müssen. Alle hergestellten Katalysatoren BIA.1–5 stellten sich als geeignet für die Desulfonylierung von N-Tosylindol 17.1 heraus. BIA.1 (oder BINA, vgl. Schema 10) lieferte dabei die vielversprechendsten Ergebnisse. Wird eine weiße LED (7.3 W) anstelle einer Hochleistungs-Xenon-Lampe (500 W, λ>390 nm) eingesetzt, konnten vergleichbare Ausbeuten erhalten werden, allerdings verlängerte sich die Reaktionszeit. Ohne Photokatalysator wurde kein Produkt gebildet, und in Abwesenheit des Hydrid-Donors oder Lichts wurden lediglich Spuren des Produkts gebildet. Bezüglich des Reaktionsmechanismus schlagen die Autoren die In-situ-Bildung von BIA-H− über einen nukleophilen Angriff eines Hydrids auf die Benzimidazolium-Struktur von BIA vor. Die Anregung mit Xenonlampe oder weißer LED wandelt den Katalysator in eine stark reduzierende Spezies um, die die ausgeprägten Fähigkeit besitzt, Elektronen auf Substrate zu übertragen. Anschließend kommt es zum Bindungsbruch zwischen der N-S- bzw. C-S-Bindung, und das entstehende radikalische Fragment abstrahiert ein H-Atom vom oxidierten Katalysator BIA-H., welcher daraufhin als Biradikal BIA: vorliegt. Durch einen intramolekularen SET, wird BIA wieder regeneriert. Schließlich aktiviert ein Hydrid-Transfer den Katalysator für einen weiteren Katalysezyklus (Schema 11). Die saure Hydroxygruppe des Aryloxids ist leicht deprotonierbar, was den direkten Einsatz von Benzimidazolin BIA-H anstelle des Betains BIA als Katalysator erlaubt. In diesem Fall konnte gezeigt werden, dass durch Zusatz von Base (Natriumcarbonat oder Natrium-tert-butanolat) die Effizienz der Reaktion deutlich gesteigert werden konnte.
2.4 Anthrolat-katalysierte Erzeugung von solvatisierten Elektronen
Goez und Mitarbeiter untersuchten umfangreich den Einsatz des 9-Anthrolat-Anions (ANT−) als potentielle, nachhaltige Quelle für die Erzeugung von solvatisierten Elektronen, welche unter Einwirkung von Laserstrahlung ausgestoßen werden.20 Solvatisierte Elektronen gehören zu den stärksten bekannten Reduktionsmitteln80-82 und können Distickstoff83 oder Kohlendioxid84 direkt reduzieren. Frühere Methoden zur photoinduzierten Freisetzung von solvatisierten Elektronen nutzten häufig schädliches, hochenergetisches UV-C-Licht. Daher ist es bemerkenswert, dass bereits mit gepulster UV-A-Laserstrahlung (355 nm) mittels eines biphotonischen Ionisierungsprozesses die Freisetzung von solvatisierten Elektronen durch ANT− in alkalischer Lösung möglich ist. Dabei erzeugt das erste Photon den elektronisch angeregten Zustand (S1), und die Absorption eines zweiten Photons innerhalb der Lebenszeit des S1-Zustands *ANT− stimuliert die Freisetzung eines solvatisierten Elektrons durch Photoionisierung. Ein katalytischer Kreislauf wird in Gegenwart des Dianions der Ascorbinsäure Asc2− ermöglicht, welches als Opfer-Elektronendonor agiert und den Katalysator aus der oxidierten Form ANT. regeneriert (Schema 13). Die Abfolge von Photoionisierung und Regeneration des Katalysators konnte vielfach wiederholt werden, bis das System erschöpft war. In diesem Zusammenhang konnte gezeigt werden, dass die Anfangskonzentration des Katalysators während der Abfolge konstant blieb, was auf eine hohe Stabilität der 9-Anthrolat-Struktur gegenüber stark reduzierenden solvatisierten Elektronen hindeutet. Obwohl der molare Absorptionskoeffizient von Asc2− bei der eingestrahlten Wellenlänge äußerst gering ist, konnte nachgewiesen werden, dass die direkte Anregung von Asc2− in geringem Maße zur Freisetzung von solvatisierten Elektronen beiträgt.
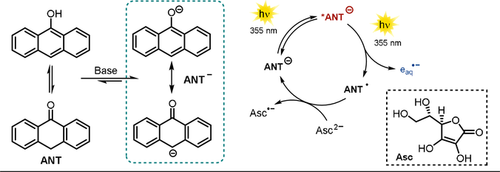
Photokatalytische Erzeugung von solvatisierten Elektronen, entwickelt von Goez und Mitarbeitern.
In einer darauf aufbauenden Arbeit21 der Goez-Gruppe konnte gezeigt werden, dass die direkte Photoionisierung von Asc2− in Abwesenheit eines zusätzlichen Katalysators mithilfe von gepulster Laserstrahlung (355 nm) möglich ist. Eine Anwendungsmöglichkeit von solvatisierten Elektronen für die Abwasserdetoxifizierung wurde anhand der effizienten Dechlorierung von Chloracetat als einem exemplarischen Schadstoff demonstriert.
2.5 Aktivierung von Arylchloriden mittels 9-Anthrolat
Die photochemischen Eigenschaften und Syntheseanwendungen von 9-Anthron und einer Reihe seiner Derivate wurden kürzlich von König und Mitarbeitern untersucht, wobei auffiel, dass die jeweiligen anionischen Spezies bemerkenswerte Oxidationspotentiale im photoangeregten Zustand ermöglichen.22
In Lösung liegt Anthron ANT im Gleichgewicht mit der Enolform vor. Die Deprotonierung zum Anthrolat ANT−, das eine ausgedehnte Absorptionsbande im sichtbaren Bereich aufweist, gelingt leicht. Die effizientesten Katalysatoren im Zusammenhang mit dieser Studie sind in Abbildung 3 dargestellt.
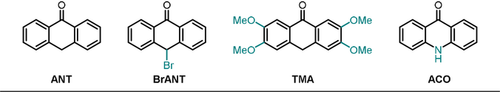
Ausgewählte, auf der 9-Anthron-Struktur basierende Photokatalysatoren, die von König und Mitarbeitern untersucht wurden.
Die gezeigten Photokatalysatoren konnten erfolgreich für die katalytische C-H-Arylierung verschiedener (Hetero)Arylchloride mit elektronenreichen (Hetero-)Arenen, Isocyaniden, Phosphit und B2pin2 eingesetzt werden (Schema 14). In Gegenwart einer Base wird ANT deprotoniert, was eine Rotverschiebung des Absorptionsspektrums, begleitet von neuen, intensiven Absorptionsbanden im sichtbaren Bereich, verursacht. Nach Photoanregung mit blauem LED-Licht entsteht eine sehr stark reduzierende Verbindung *ANT− (vgl. Tabelle 1, Eintrag 5 für ANT−), wobei das Reduktionspotential vieler Arylchloride überschritten wird und somit ein Elektronentransfer vom angeregten Katalysator stattfinden kann, der letztlich das Radikalanion des Arylchlorids 21.1.− sowie die ungeladene, radikalische Form des Katalysators ANT. erzeugt. Nach Abspaltung des Chlorid-Ions entsteht das reaktive Arylradikal 21.1 a., das bevorzugt von elektronenreichen Arenen 22 abgefangen wird. Das resultierende bicyclische, radikalische Zwischenprodukt wird im basischen Medium zum Radikalanion 21.1 b.− deprotoniert. Der katalytische Kreislauf wird mittels Elektronentransfer von 21.1 b.− auf ANT. geschlossen (Schema 15). Die zeitaufgelöste Lumineszenzlöschung des angeregten Katalysators ANT− zeigte, dass verschiedene tolerierte Arylchloride die Lebenszeit des angeregten Zustands verkürzten, während bei nicht umsetzbaren Arylchloriden keine Änderung der Lebenszeit beobachtet wurde.
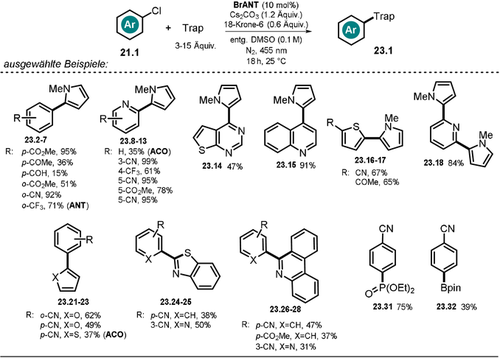
Substratbreite der C-H-Arylierung von (Hetero-)Arenen mittels Pyrrolen, Isocyaniden, Phosphit und B2pin2 als Abfangreagenz (Trap). Der Einsatz von anderen Katalysatoren als BrANT ist in Klammern angegeben.
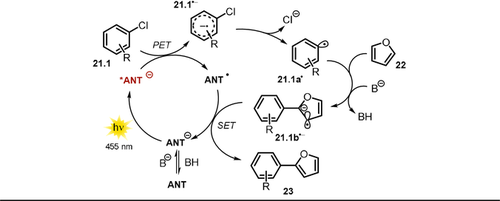
Postulierter Mechanismus der photokatalysierten C-H-Arylierung mittels 9-Anthron.
Durch Radikalabfang-Experimente mit dem persistenten Radikal TEMPO konnte die Bildung des Arylradikals 21.1 a. und des bicyclischen Radikals 21.1 b. nachgewiesen werden. Bemerkenswert an dieser Methode: Im Vergleich zu anderen photokatalytischen Strategien zur Aktivierung von Arylhalogeniden38-41, 53, 85 wird in dem hier diskutierten Fall kein zusätzlicher Opfer-Elektronendonor (z. B. DIPEA) benötigt. Darüber hinaus konnte die Substratbreite an Arylchloriden vergrößert und eine erweiterte Palette an Abfangreagenzien eingesetzt werden. Die Menge an eingesetztem Katalysator konnte in der Modellreaktion auf 5 mol % (92 % Ausbeute) verringert werden, was einer katalytischen Produktivität (TON) größer 18 entspricht. Im Einklang mit früher berichteten photokatalysierten C-H-Arylierungen38-41, 85 wurde gezeigt, dass ein großer Überschuss an Abfangreagenz notwendig für hohe Ausbeuten ist, da bei stöchiometrischer Verwendung von Pyrrol in Bezug auf das Arylchlorid deutlich geringere Ausbeuten resultierten. Anthrolate reagieren in Gegenwart von Sauerstoff zu den entsprechenden Anthrachinonen, weshalb sämtliche Reaktionen unter Inertgas durchgeführt wurden. 9-Acridanon (ACO) hingegen scheint deutlich stabiler und weniger anfällig für Oxidationen in Gegenwart von Luftsauerstoff zu sein, da das gewünschte Arylierungsprodukt 23.2 in guter Ausbeute (83 %) in nicht-entgastem Lösungsmittel und in Gegenwart von Luft erhalten wurde.
2.6 Anthrolat-katalysierte C-H-Carboxylierung von (Hetero-)Arenen und Styrolen mittels CO2
Erst kürzlich wurde gezeigt, dass das stark reduzierende und im sichtbaren Bereich absorbierende Tetramethoxyanthrolat TMA− ( =−2.92 V vs. SCE) genutzt werden kann, um (Hetero-)Arene und Styrole mit blauem Licht direkt in die entsprechenden Radikalanionen umzusetzen.86 Der mit solchen elektronenreichen Spezies verbundene nukleophile Charakter wurde für C-H-Carboxylierungen mit CO2-Gas genutzt, um die entsprechenden aromatischen Carbon- bzw. Zimtsäurederivate in moderaten bis sehr guten Ausbeuten zu erhalten. Unter anderem konnten Naphthaline, Thiophene, Furane, Indole, Pyrazole und Styrole ohne vorherige Funktionalisierung und unter ausgesprochen milden Reaktionsbedingungen in ihre Carbonsäurederivate konvertiert werden (Schema 16). Anhand einer Carboxylierungsreaktion von 2-Cyanthiophen 26.9 im Gramm-Maßstab wurde eine prinzipiell einfache Maßstabsvergrößerung der Reaktion demonstriert. Des Weiteren konnte ein Boc-geschütztes Thiophen-Analog des Wirkstoffs Propranolol 26.31 carboxyliert werden, was die Möglichkeit der Modifizierung komplexerer Moleküle in einer späten Phase der Synthese durch die vorgestellte Methode unterstreicht. Neben CO2 konnten auch verschiedene Ketone als Elektrophile eingesetzt werden, was zu den entsprechenden tertiären Alkoholen (26.32–33) führte. Dabei sollte berücksichtigt werden, dass herkömmliche Methoden zur Herstellung solcher Produkte stöchiometrische Mengen an reaktiven Lithiumorganylen benötigen und gewöhnlich bei sehr niedriger Temperatur (−78 °C) durchgeführt werden. Durch den Einsatz von stark nukleophilen Organometall-Reagenzien müssen funktionelle Gruppen vorab häufig geschützt werden, was mehrstufige Reaktionen zur Folge hat.87-89
=−2.92 V vs. SCE) genutzt werden kann, um (Hetero-)Arene und Styrole mit blauem Licht direkt in die entsprechenden Radikalanionen umzusetzen.86 Der mit solchen elektronenreichen Spezies verbundene nukleophile Charakter wurde für C-H-Carboxylierungen mit CO2-Gas genutzt, um die entsprechenden aromatischen Carbon- bzw. Zimtsäurederivate in moderaten bis sehr guten Ausbeuten zu erhalten. Unter anderem konnten Naphthaline, Thiophene, Furane, Indole, Pyrazole und Styrole ohne vorherige Funktionalisierung und unter ausgesprochen milden Reaktionsbedingungen in ihre Carbonsäurederivate konvertiert werden (Schema 16). Anhand einer Carboxylierungsreaktion von 2-Cyanthiophen 26.9 im Gramm-Maßstab wurde eine prinzipiell einfache Maßstabsvergrößerung der Reaktion demonstriert. Des Weiteren konnte ein Boc-geschütztes Thiophen-Analog des Wirkstoffs Propranolol 26.31 carboxyliert werden, was die Möglichkeit der Modifizierung komplexerer Moleküle in einer späten Phase der Synthese durch die vorgestellte Methode unterstreicht. Neben CO2 konnten auch verschiedene Ketone als Elektrophile eingesetzt werden, was zu den entsprechenden tertiären Alkoholen (26.32–33) führte. Dabei sollte berücksichtigt werden, dass herkömmliche Methoden zur Herstellung solcher Produkte stöchiometrische Mengen an reaktiven Lithiumorganylen benötigen und gewöhnlich bei sehr niedriger Temperatur (−78 °C) durchgeführt werden. Durch den Einsatz von stark nukleophilen Organometall-Reagenzien müssen funktionelle Gruppen vorab häufig geschützt werden, was mehrstufige Reaktionen zur Folge hat.87-89
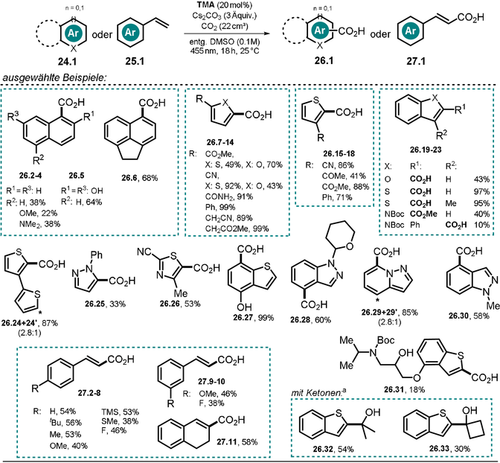
Photokatalysierte C-H-Carboxylierung von (Hetero-)Arenen und Styrolen sowie Hydroxyalkylierung von Thianaphthen. [a] Reaktion mit Keton (10 Äquiv.) unter Stickstoffatmosphäre in Abwesenheit von CO2.
Die Regioselektivität der Carboxylierungsreaktion kann durch Berechnungen gut vorhergesagt werden. Im Gegensatz zu Carboxylierungen mittels Organometall-Reagenzien weist die photokatalysierte, redox-neutrale Insertion von CO2 in nicht-aktivierte sp2-hybridisierte C-H-Bindungen eine höhere Regioselektivität auf, was häufig zur Bildung eines Regioisomers führt (siehe 26.18 und 26.25). In Gegenwart von Base liegt TMA im Gleichgewicht mit der deprotonierten, anionischen Form vor, welche im Unterschied zur ungeladenen Spezies intensive Absorptionsbanden im sichtbaren Bereich des Spektrums aufweist. Die Anregung des anionischen Katalysators mit blauem LED-Licht führt zur Bildung eines bemerkenswert starken Photoreduktionsmittels *TMA−. Ein PET in Gegenwart von Benzothiophen 24.20 erzeugt das resonanzstabilisierte Radikal-Anion 24.20.−. Der darauffolgende nukleophile Angriff auf CO2 führt zum radikalischen Carboxylat 24.20 a.−. Um den katalytischen Zyklus zu schließen, wird ein SET ausgehend vom elektronenreichen Radikal-Dianion-Intermediat 24.20 b.2− vorgeschlagen, welches durch Deprotonierung von 24.20 a.− entsteht. Dadurch wird der anionische Photokatalysator regeneriert und das Carboxylat des Produkts 24.20 c− freigesetzt. Die saure Aufarbeitung führt schließlich zur Carbonsäure 26.20 (Schema 17). Ein alternativer Reaktionsweg via H-Atom-Abstraktion von 24.20 a.−, eingeleitet durch den radikalischen Photokatalysator TMA., ist ebenfalls denkbar. In beiden Fällen wird der Energiegewinn aufgrund der Rearomatisierung des Systems als Triebkraft für den Schluss des Katalysezyklus angenommen.
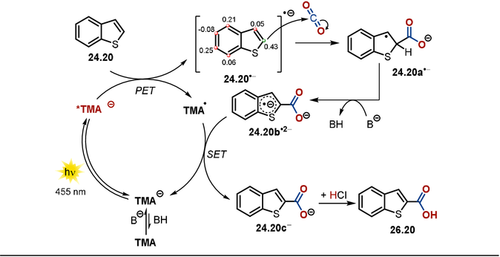
Vorgeschlagener Reaktionsmechanismus für die redox-neutrale, photokatalysierte Carboxylierung von (Hetero-)Arenen und Styrolen mit dem stark reduzierenden Photokatalysator TMA. Berechnete Mulliken-Spin-Besetzung für 24.20.− ermöglicht eine Vorhersage der Regioselektivität der Carboxylierung.
Die mechanistische Hypothese wurde durch zeitaufgelöste Experimente zur Lumineszenzlöschung des Katalysators *TMA− in Gegenwart von (Hetero-)Arenen und Styrolen bekräftigt. Tolerierte Substrate führten zu einer Verkürzung der Lebensdauer des angeregten Zustands des Photokatalysators, und lineare Stern-Volmer-Plots wurden aus den gemessenen Daten erhalten. Obwohl eine direkte Reduktion von CO2 (E1/2=−2.21 V vs. SCE)90 durch den angeregten Katalysator thermodynamisch möglich wäre, zeigte ein Experiment in CO2-gesättigtem DMSO kaum eine Änderung der Lumineszenz-Lebenszeit. Bei Substraten die den angeregten Zustand des Katalysators effizient löschen, jedoch nicht zum gewünschten Carboxylierungsprodukt führen, wurde ein zu geringer nukleophiler Charakter des Radikal-Anion-Intermediats angenommen, welches letztlich nicht mit CO2 als Elektrophil reagiert. Zusätzlich konnte anhand der Isotopenmarkierung von 24.21 in Gegenwart von D2O oder tBuOD gezeigt werden, dass eine basische, nukleophile Zwischenstufe auftritt.
2.7 Katalytische Reaktionen anionischer Metallkomplexe
Übergangsmetallkomplexe wie RuII-Polypyridine oder das cyclometallierte IrIII finden vielfältige Anwendung in photokatalytischen Reaktionen, da sie eine hohe Photostabilität aufweisen, ihre Redox-Potentiale leicht modifizierbar sind und ihre angeregten Zustände gewöhnlich langlebig sind. Im Gegensatz zu neutralen Komplexen wie fac-Ir(ppy)3 oder kationischen metallbasierten Sensibilisatoren [z. B. Ru(bpy)32+, Ir(ppy)2(dtbbpy)+] sind anionische Übergangsmetallkomplexe kaum untersucht worden, was unter anderem an der geringen Photostabilität untersuchter Metallkomplexe mit einzähnigen anionischen Liganden91 sowie dem Mangel an stabilen dianionischen Liganden liegt. Godbert und Mitarbeitern war es möglich, den anionischen Iridium-Komplex 28.1 zu synthetisieren und zu charakterisieren, wobei ein dianionischer Orotat-Ligand eingesetzt wurde (Schema 18, oben).92 In einer darauf basierenden Arbeit wurde der Komplex weiter modifiziert, indem der 2-Phenylpyridin-Ligand durch einen auf der Cumarin-Struktur basierenden Liganden getauscht wurde (28.2), was eine Erhöhung der Absorption im sichtbaren Bereich zur Folge hatte. Die Autoren konnten den Katalysator 28.2 erfolgreich für die H2-Erzeugung mit sichtbarem Licht verwenden, was als erstes Anwendungsbeispiel für einen PET eines anionischen IrIII-Sensibilisators gilt.93
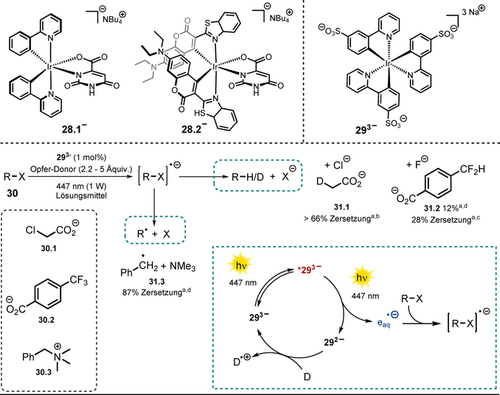
Anionische Iridium-Komplexe (oben); von Irsppy (293−) katalysierte Zersetzung von Schadstoffen (mittig). [a] Umsetzung wurde anhand von Roh-NMR-Daten bestimmt. [b] Reaktionsbedingungen: Chloracetat 30.1 (12.5 mM), NaHAsc (2.2 Äquiv.) in D2O (3 mL), 4 h. [c] Reaktionsbedingungen: Trifluormethylbenzoat 30.2 (15 mm), TEOA (5 Äquiv.) in H2O (16 mL), 4 h. [d] Reaktionsbedingungen: Benzyltrimethylammonium-Salz 30.3 (10 mm), TEOA (5 Äquiv.) in D2O (3 mL), 3 h. Vorgeschlagener katalytischer Zyklus zur Erzeugung von solvatisierten Elektronen (unten rechts).
Um solvatisierte Elektronen mit sichtbarem Licht freizusetzen, nahmen Wenger und Mitarbeiter den bewährten Komplex fac-Ir(ppy)3 als Vorbild und stellten ein trisulfonyliertes Derivat 293− (Schema 18, oben) her, welches wasserlöslich und negativ geladen ist.94 Als Anwendungsmöglichkeit solvatisierter Elektronen wurde die Zersetzung von häufig auftretenden Schadstoffen (z. B. Schema 18, Chloracetat 31.1 oder Benzyltrimethylammonium-Salz 31.3) in Abwässern demonstriert. Zusätzlich konnte Trifluormethylbenzoat in Gegenwart solvatisierter Elektronen defluoriert werden (vgl. 31.2). Der Katalysezyklus ist in Schema 18 (unten rechts) dargestellt. Dabei wird der Photokatalysator mit einer gebündelten 447-nm-Laser-Diode angeregt. Innerhalb der Lebenszeit des angeregten Zustands (ca. 1.6 μs) stimuliert die Absorption eines zweiten Photons die Freisetzung eines solvatisierten Elektrons vom Sensibilisator. Dieser wird in Gegenwart von Opfer-Elektronendonoren wie Natriumascorbat oder Triethanolamin regeneriert. Verglichen mit dem neutralen fac-Ir(ppy)3 wurde ein leicht erhöhtes Oxidationspotential vom angeregten Zustand des anionischen Sensibilisators 293− ( =−1.89 V vs. SCE) gemessen.
=−1.89 V vs. SCE) gemessen.
Der trianionische, Metallkomplex Hexachlorocerat(III) [CeIIICl6]3− mit dem zu den seltenen Erde zählenden Cer als Zentralatom stellte sich als effektiv in reduzierenden Dehalogenierungen von Arylhalogeniden 32.1, stimuliert durch UVA-Licht, heraus (Schema 19).95 Dabei ist der Metallkomplex luft- und feuchtigkeitsbeständig und kann in situ durch Mischen von CeCl3 und NEt4Cl in Acetonitril hergestellt werden. Belichtung mit Schwarzlicht verursacht einen metallzentrierten angeregten Zustand mit bemerkenswert starkem Potential ( ≈−3 V vs. SCE),96, 97 wobei der PET mit Arylhalogeniden 32.1 zu einer CeIV-Spezies führt. Darüber hinaus wurde gezeigt, dass die komplementäre oxidative Photochemie von [CeIVCl6]2− den katalytischen Einsatz von CeCl3 erlaubt (Schema 19, rechts).98 Durch Zugabe von Toluol (34) als Opfer-Elektronendonor konnte der katalytische Kreislauf geschlossen werden, wobei Toluol durch H-Atom-Abstraktion und Reaktion mit Cl2.− zu Benzylchlorid 34 b umgesetzt wird.
≈−3 V vs. SCE),96, 97 wobei der PET mit Arylhalogeniden 32.1 zu einer CeIV-Spezies führt. Darüber hinaus wurde gezeigt, dass die komplementäre oxidative Photochemie von [CeIVCl6]2− den katalytischen Einsatz von CeCl3 erlaubt (Schema 19, rechts).98 Durch Zugabe von Toluol (34) als Opfer-Elektronendonor konnte der katalytische Kreislauf geschlossen werden, wobei Toluol durch H-Atom-Abstraktion und Reaktion mit Cl2.− zu Benzylchlorid 34 b umgesetzt wird.
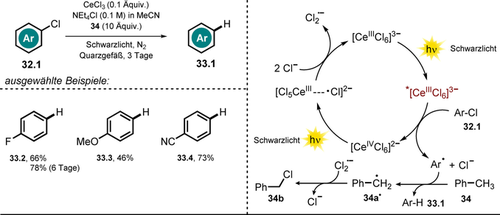
Substratumfang der CeCl3-katalysierten Defunktionalisierung von Arylhalogeniden über In-situ-Bildung von [CeIIICl6]3− sowie ein denkbarer Reaktionsmechanismus.
In einer darauf aufbauenden Veröffentlichung wurde das entwickelte photokatalytische Protokoll für die Miyaura-Borylierung von Arylbromiden und -chloriden genutzt. Schelter und Mitarbeiter nutzten Boronsäureester als Borylierungsreagenz sowie als Opfer-Elektronendonor, um den Katalysezyklus zu schließen.99 Unter Einsatz von substituierten (Hetero-)Arylchloriden konnten verschiedene Arylboronsäureester in moderaten bis guten Ausbeuten erhalten werden (Schema 20). Dabei wurde anhand von Stern-Volmer-Löschungs-Experimenten gezeigt, dass elektronenarme sowie elektronenreiche Substrate die Lumineszenz des angeregten Cer-Katalysators löschen. Des Weiteren demonstriereten die Autoren, dass eine sequentielle Borylierung und anschließende Pd-katalysierte Kreuzkupplung möglich ist, ohne den intermediär gebildeten Boronsäureester vorab isolieren zu müssen. Basierend auf spektroskopischen Untersuchungen und experimentellen Befunden wurde ein Reaktionsmechnismus vorgeschlagen (vgl. Schema 19). Dabei wird der in situ gebildete Komplex [CeIIICl6]3− mit Schwarzlicht angeregt. Anschließend an den PET auf das Arylchlorid 35.1 und der Abspaltung von Cl− entsteht ein Arylradikal, dass mit dem Borsäureester 36.1 reagiert und zum aromatischen Borsäureester 37.1 sowie dem Bor-Radikal B(OR2). umgesetzt wird. Der oxidierte Katalysator wird in Gegenwart eines Überschusses an Cl− über einen photoinduzierten Ligand-zu-Metall-Ladungstransfer regeneriert, wobei das Radikalanion Cl2.− entsteht. Der durch Aktinometrie bestimmte Wert für die Quantenausbeute (Φ>1) der Reaktion deutet auf einen Radikalkettenmechanismus hin. Allerdings konnte keine Produktbildung innerhalb der Dunkelperioden in einem Experiment mit unterbrochener Belichtung festgestellt werden. Die Autoren vermuten die Beteiligung des Bor-Radikals, welches in Gegenwart von Chlorid stabilisiert wird, am Umsatz eines weiteren Substratmoleküls via Chlorabstraktion und somit an einer Radikalkettenreaktion.
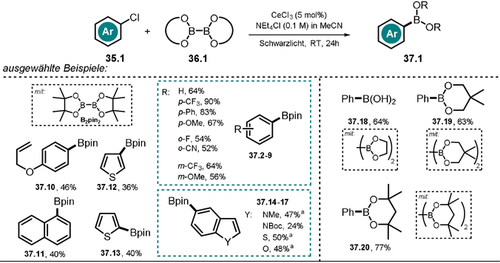
Substratbreite der [CeIIICl6]3−-katalysierten Miyaura-Borylierung. [a] Arylbromid wurde eingesetzt.
2.8 Polyoxometallate als Photokatalysatoren
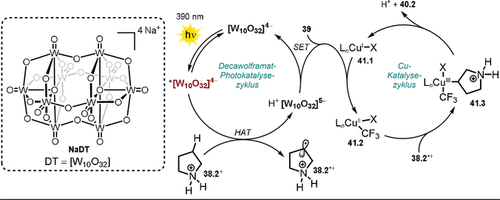
Polyoxometallate (POM) stellen eine Klasse molekularer Metalloxid-Anionen dar, die vielfach untersucht wurden. Die außerordentlich hohe Photostabilität von POM löste ein breites Interesse für deren photokatalytische Anwendungen aus. In diesem Aufsatz wollen wir die Diskussion der POM-Photochemie auf ausgewählte, kürzlich veröffentlichte Arbeiten beschränken, worin das Decawolframat-Anion (DT) – gewöhnlich verwendet als Natrium- (NaDT) oder Tetrabutylammoniumsalz (siehe Schema 22, TBADT) – verwendet wurde. Für eine umfassendere Studie der POM möchten wir den interessierten Leser an dieser Stelle auf exzellente Aufsätze verweisen.100-104 Trotz seiner hohen negativen Ladung besitzt das Decawolframat-Anion im angeregten Zustand stark oxidierende Eigenschaften. Dieses ungewöhnliche Verhalten kann analog zur Diskussion von Eosin Y oder Fluorescein (siehe Abschnitt 2.1) erklärt werden. Im DT-Gerüst liegt Wolfram in seiner höchsten Oxidationsstufe (+VI) vor, und die negativen Ladungen sind auf den Sauerstoff-Atomen verteilt. Dadurch wirken die elektronenarmen Wolframzentren elektronenziehend. Nach Anregung mit Licht wird ein schneller Ligand-zu-Metall-Ladungstransfer (O→M) vermutet, der zu einem relaxierten angeregten Zustand des Metalloxid-Gerüsts *[W10O32]4− führt und sehr leicht zu reduzieren ist ( =+2.44 V vs. SCE).100 Neben dem Einsatz für Elektronentransferreaktionen findet Decawolframat vor allem Anwendung als H-Atom-Transferreagenz, da es im angeregten Zustand Wasserstoffatome von nicht-aktivierten C(sp3)-H-Bindungen abstrahieren kann. Fagnoni, Ryu und Mitarbeiter fassten kürzlich die regioselektiven C-H-Funktionalisierungen an Alkanen, Alkoholen, Ethern, Ketonen, Amiden, Estern, Nitrilen und alkylierten Pyridinen durch photoangeregtes *DT zusammen und erklärten die beobachtete Selektivität anhand der Bindungspolarität und sterischen Effekten.105 Im Jahr 2018 demonstrierten MacMillan und Mitarbeiter eindrucksvoll, wie Decawolframat-Photokatalyse und übergangsmetallkatalysierte Kreuzkupplungsreaktionen miteinander kombiniert werden können.106 Basierend auf diesem Konzept wurde kürzlich eine Kupfer/Decawolframat-dualkatalytische Methode entwickelt, die die Trifluormethylierung an C(sp3)-H-Bindungen in verschiedenen biologisch relevanten Verbindungen inklusive Naturstoffen und Wirkstoffen in moderaten bis guten Ausbeuten ermöglicht (Schema 21).107 Die Einführung von CF3-Gruppen in bestehende Wirkstoffe führt häufig zu verbesserten pharmakokinetischen Eigenschaften und ist daher von großem Interesse. Im Falle von Pyrrolidin (40.2) wird die Selektivität der Funktionalisierung mit CF3 durch Protonierung des Amins und die damit einhergehende Stärkung der α-C-H-Bindung sowie Herabsetzung deren hydridischen Charakters erreicht, wodurch die weiter entfernte C-H-Bindung bevorzugt umgesetzt wird. Regioselektive Umsetzungen wurden darüber hinaus in benzylischen Positionen (40.5–40.6, 40.9) oder an elektronenreichen C(sp3)-H-Bindungen mit geringem sterischem Anspruch (40.3, 40.7) beobachtet. Die Reaktionen werden durch 390-nm-Licht initiiert, welches den elektrophilen angeregten Zustand des Oxometallats erzeugt. Im Falle der protonierten Pyrrolidinium-Spezies 38.2+ liegen nach erfolgreicher H-Atom-Abstraktion in β-Amino-Position der reduzierte Decawolframat-Katalysator H+[W10O32]5− sowie das aliphatische Radikal-Kation 38.2.+ vor. Der darauffolgende SET auf das Togni-Reagenz II 39 regeneriert die aktive Form des HAT-Katalysators und ermöglicht die Bildung einer Kupfer(II)-CF3-Spezies 41.2. Das Pyrrolidinium-Radikal 38.2.+ wird anschließend unter Ausbildung einer Alkyl-Kupfer(III)-CF3-Zwischenstufe 41.3 von dem Kupfer(II)-Komplex abgefangen. Nach reduktiver Eliminierung werden schließlich das Produkt 40.2 gebildet und der CuI-Katalysator 41.1 regeneriert (Schema 22).
=+2.44 V vs. SCE).100 Neben dem Einsatz für Elektronentransferreaktionen findet Decawolframat vor allem Anwendung als H-Atom-Transferreagenz, da es im angeregten Zustand Wasserstoffatome von nicht-aktivierten C(sp3)-H-Bindungen abstrahieren kann. Fagnoni, Ryu und Mitarbeiter fassten kürzlich die regioselektiven C-H-Funktionalisierungen an Alkanen, Alkoholen, Ethern, Ketonen, Amiden, Estern, Nitrilen und alkylierten Pyridinen durch photoangeregtes *DT zusammen und erklärten die beobachtete Selektivität anhand der Bindungspolarität und sterischen Effekten.105 Im Jahr 2018 demonstrierten MacMillan und Mitarbeiter eindrucksvoll, wie Decawolframat-Photokatalyse und übergangsmetallkatalysierte Kreuzkupplungsreaktionen miteinander kombiniert werden können.106 Basierend auf diesem Konzept wurde kürzlich eine Kupfer/Decawolframat-dualkatalytische Methode entwickelt, die die Trifluormethylierung an C(sp3)-H-Bindungen in verschiedenen biologisch relevanten Verbindungen inklusive Naturstoffen und Wirkstoffen in moderaten bis guten Ausbeuten ermöglicht (Schema 21).107 Die Einführung von CF3-Gruppen in bestehende Wirkstoffe führt häufig zu verbesserten pharmakokinetischen Eigenschaften und ist daher von großem Interesse. Im Falle von Pyrrolidin (40.2) wird die Selektivität der Funktionalisierung mit CF3 durch Protonierung des Amins und die damit einhergehende Stärkung der α-C-H-Bindung sowie Herabsetzung deren hydridischen Charakters erreicht, wodurch die weiter entfernte C-H-Bindung bevorzugt umgesetzt wird. Regioselektive Umsetzungen wurden darüber hinaus in benzylischen Positionen (40.5–40.6, 40.9) oder an elektronenreichen C(sp3)-H-Bindungen mit geringem sterischem Anspruch (40.3, 40.7) beobachtet. Die Reaktionen werden durch 390-nm-Licht initiiert, welches den elektrophilen angeregten Zustand des Oxometallats erzeugt. Im Falle der protonierten Pyrrolidinium-Spezies 38.2+ liegen nach erfolgreicher H-Atom-Abstraktion in β-Amino-Position der reduzierte Decawolframat-Katalysator H+[W10O32]5− sowie das aliphatische Radikal-Kation 38.2.+ vor. Der darauffolgende SET auf das Togni-Reagenz II 39 regeneriert die aktive Form des HAT-Katalysators und ermöglicht die Bildung einer Kupfer(II)-CF3-Spezies 41.2. Das Pyrrolidinium-Radikal 38.2.+ wird anschließend unter Ausbildung einer Alkyl-Kupfer(III)-CF3-Zwischenstufe 41.3 von dem Kupfer(II)-Komplex abgefangen. Nach reduktiver Eliminierung werden schließlich das Produkt 40.2 gebildet und der CuI-Katalysator 41.1 regeneriert (Schema 22).
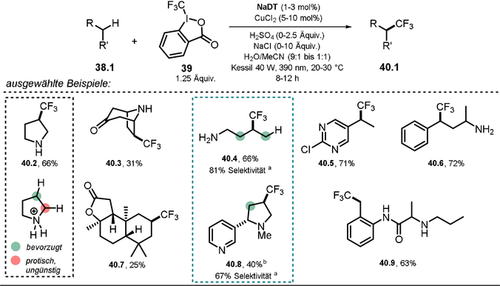
Ausgewählte Beispiele für die direkte C(sp3)-H-Trifluormethylierung durch die Kombination von Decawolframat- und Kupfer-Katalyse. [a] Die Selektivität ist als Prozentsatz des Hauptisomers gegenüber allen anderen Regioisomeren angegeben. [b] Haupt-Diastereomer abgebildet.
Vorgeschlagener dualkatalytischer Mechanismus für die direkte C(sp3)-H-Trifluormethylierung.
Mittels einer ähnlichen Kombination bestehend aus Decawolframat-HAT-Photokatalyse und Cobaloxim-Katalyse veröffentlichten Wu und Mitarbeiter die oxidationsmittelfreie, regio- und E-selektive dehydrierende Alkenylierung von Alkanen oder Aldehyden mit Alkenen.108 Diese dualkatalytische Strategie ermöglicht die effiziente und direkte Alkenylierung von C-H-Bindungen, wobei Wasserstoffgas als einziges Nebenprodukt entsteht. Ein breites Spektrum an Alkanen und Aldehyden konnte mittels der beschriebenen Methode alkenyliert werden. Interessanterweise sind Arylhalogenide (Cl, Br, I), Alkylbromide, Alkene und Alkine kompatible Substrate, die eine darauffolgende orthogonale Funktionalisierung mittels Übergangsmetallkatalyse erlauben. Moderate bis gute Regioselektivitäten wurden für Alkane 42.13–14 und 42.19 beobachtet. Darüber hinaus konnte die Methode für die Alkenylierung von Naturstoffen eingesetzt werden (Schema 23).
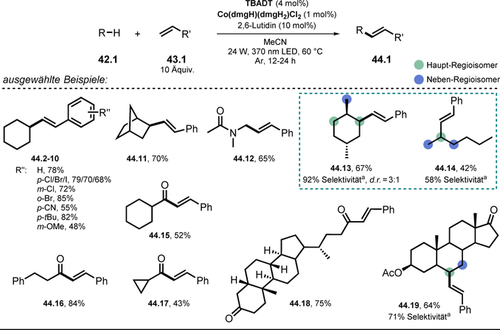
Ausgewählte Beispiele für die Alkenylierung von Alkanen und Aldehyden mittels Styrol-Derivaten unter Freisetzung von Wasserstoff. [a] Die Selektivität stellt den Prozentsatz des Haupt-Regioisomers gegenüber allen gebildeten Regioisomeren dar.
Dabei ermöglicht die Anregung des Metalloxid-Gerüsts [W10O32]4− (TBADT) die Abstraktion von H-Atomen von Alkanen oder Aldehyden 42.1. Das entstehende kohlenstoffzentrierte Radikal 42.1 a. wird von einem Alken 43.1 abgefangen und generiert das radikalische Zwischenprodukt 42.1 b.. Es wird angenommen, dass 42.1 b. reversibel an den CoII-Komplex 45.1 bindet und das Alkyl-CoIII-Intermediat 45.2 bildet.
Nach formaler, lichtvermittelter β-Wasserstoff-Eliminierung wird das Produkt 44.1 gebildet, und die entstehende CoIII-H-Spezies 45.3 reagiert mit einem Proton unter H2-Freisetzung, wodurch der CoIII-Komplex 45.4 entsteht. Schließlich werden der Decawolframat- und Cobalt(II)-Katalysator via SET regeneriert (Schema 24).
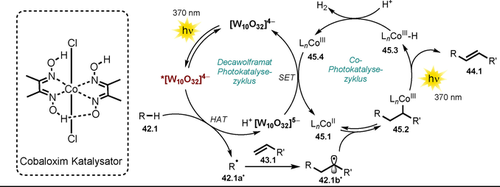
Vorgeschlagener dualkatalytischer Mechanismus für die Alkenylierung von Alkanen und Aldehyden mit Alkenen unter Wasserstofffreisetzung.
Wang et al.109 publizierten kürzlich die TBADT/Ni-dualkatalytische, asymmetrische, intramolekulare Acyl-Carbamoylierung an Alkenen zur Herstellung von Oxindolen mit quartärem Stereozentrum 49.2–5 (Schema 25), wofür ein chiraler Ni-Katalysator eingesetzt wurde.
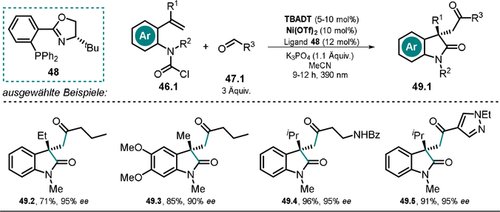
Ausgewählte Beispiele für die asymmetrische Acyl-Carbamoylierung mithilfe eines chiralen Ni-Katalysators.
Die Reaktion beginnt mit der Abstraktion eines H-Atoms vom Aldehyd 47.1 durch das photoangeregte Decawolframat *[W10O32]4−, wobei das gebildete Acyl-Radikal 47.1 a. durch das in situ gebildete Ni0 abgefangen wird und eine Acyl-NiI-Zwischenstufe 50.2 erzeugt. Die darauffolgende oxidative Addition des Carbamoylchlorids 46.1 führt zu einer NiIII-Spezies 50.3. Im enantioselektiven Schritt wird die am Aren gebundene vinylische Gruppe unter Ausbildung eines Oxindol-Gerüsts (50.4) eingeschoben, und die darauffolgende reduktive Eliminierung setzt das cyclisierte Produkt 49.1 zusammen mit NiI-Chlorid 50.5 frei. Beide Katalysezyklen werden mittels SET geschlossen, der vermutlich zwischen dem reduzierten Decawolframat [W10O32]6− und NiICl 50.5 stattfindet (Schema 26).
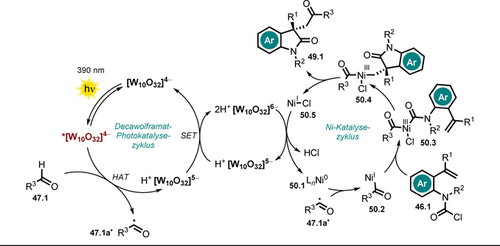
Postulierter Mechanismus für die asymmetrische Acyl-Carbamoylierung mithilfe eines chiralen Ni-Katalysators.
Ein weiteres Beispiel für eine lichtvermittelte, asymmetrische C-H-Funktionalisierung wurde kürzlich von Pu-Sheng Wang und Mitarbeitern entwickelt.110 Nach erfolgter H-Atom-Abstraktion durch *TBADT addiert ein Alkyl-, Benzyl oder Allylradikal an ein exocyclisches α,β-ungesättigtes Keton, und das resultierende α-Carbonylradikal regeneriert den Photokatalysator via HAT. Im enantioselektiven Schritt wird das Enol-Zwischenprodukt von einem chiralen, spirocylischen Phosphorsäurederivat protoniert, wodurch ein Stereozentrum in α-Position zur Carbonylverbindung entsteht.
Darüber hinaus demonstrierten Wang und Mitarbeiter die Acylierung von Arylhalogeniden und α-bromierten Carbonsäureestern mit aromatischen und aliphatischen Aldehyden. Basierend auf dem Zusammenspiel von Decawolframat-HAT-Photokatalyse und Nickel-Katalyse konnten die entsprechenden aromatischen Ketone und 1,3-Dicarbonyle in moderater bis guter Ausbeute erhalten werden.111 Auf ähnliche Weise gelang der Gruppe von Zheng vor kurzem die direkte C-H-Arylierung von Aldehyden durch das Zusammenspiel von Wolframat-HAT-Photokatalyse und Palladium-katalysierter Kreuzkupplung.112 Die Anwendung der entwickelten Methode erlaubte die effiziente Verknüpfung verschiedener (Hetero-)Arylbromide, -iodide und -triflate mit aromatischen und aliphatischen Aldehyden. Darüber hinaus wurde gezeigt, dass mittels *TBADT H/D-Austauschreaktionen an der Formyl-C-H- sowie einer Vielzahl hydridischer C(sp3)-H-Bindungen durchgeführt werden können. Dabei wurde ein dualkatalytisches System bestehend aus HAT-Photokatalysator und Thiol-Katalysator verwendet. In Gegenwart von D2O konnte mithilfe der publizierten Methode Deuterium regioselektiv in pharmazeutisch wichtige Moleküle und Vorstufen von Wirkstoffen eingeführt werden.113 Ebenfalls bekannt sind DT-vermittelte CO2-Aktivierungen oder die H2-Erzeugung in Gegenwart von DT. Dazu werden Polyoxometallate, deren Gerüstoberfläche mit Bindungsstellen modifiziert wurde, oder weitere Co-Katalysatoren eingesetzt.35
3 Angeregte anionische Verbindungen als Reagenzien
Neben dem Einsatz von lichtabsorbierenden anionischen Photokatalysatoren, wie in Abschnitt 2 gezeigt, können die Reagenzien auch direkt angeregt und somit Reaktionen angetrieben werden. Diese Art der Umsetzung wird im folgenden Abschnitt diskutiert.
3.1 Angeregte Phenolate als Photoreduktionsmittel
Xia und Mitarbeiter machten kürzlich Gebrauch von dem stark reduzierenden Potential des angeregten Phenolat-Anions 52.2 ( =−2.48 V vs. SCE) in Heck-artigen Arylierungsreaktionen, die durch blaues LED-Licht angetrieben werden.114
=−2.48 V vs. SCE) in Heck-artigen Arylierungsreaktionen, die durch blaues LED-Licht angetrieben werden.114
Der synthetische Nutzen wurde anhand der Arylierung von 4-Hydroxyzimtsäuremethylester 52.2 mit verschiedenen (Hetero-)Arylhalogeniden 51.1 (Schema 27) demonstriert. Zusätzlich zeigten andere Zimtsäurederivate (52.2–13, 52.19), und Flavonoide (52.16–18, 52.20) gute Reaktivität gegenüber dem gebildeten Aryl-Radikal, und die entsprechenden Arylierungsprodukte (53.1 und 54.1) konnten in moderaten bis guten Ausbeuten erhalten werden. Der vorgeschlagene Mechanismus verläuft redox-neutral, das heißt, es ist kein Zusatz von Opfer-Elektronendonoren nötig. Die Substratbreite der Reaktion umfasst neben elektronenarmen Aryliodiden auch elektronenreiche sowie elektronisch neutrale aromatische Derivate. Von den reaktionsträgeren Arylbromiden und -chloriden werden jedoch nur Beispiele mit elektronenarmen, akzeptorsubstituierten Arenen gezeigt. Für die meisten isolierten Produkte konnten hohe E/Z-Verhältnisse beobachtet werden. Zudem erlaubten die milden Reaktionsbedingungen den Umsatz von komplexen, biologisch aktiven Substanzen wie Chlorogensäure, Aesculin oder Scutellarin. Durch die Deprotonierung der phenolischen OH-Gruppe wird das Absorptionsspektrum von 52.2 in DMSO rotverschoben, was die direkte Anregung des Phenolats 52.2− mit blauem Licht ermöglicht. Aus dem photoangeregten Zustand *52.2− (Schema 28) ist ein Elektronentransfer auf das Arylhalogenid 51.2 möglich, was die unmittelbare Abspaltung des Bromids zur Folge hat. Das dadurch gebildete reaktive Aryl-Radikal 51.2 a. wird vorzugsweise durch elektronenreiche Verbindungen wie Vinylphenolat 52.2− abgefangen.
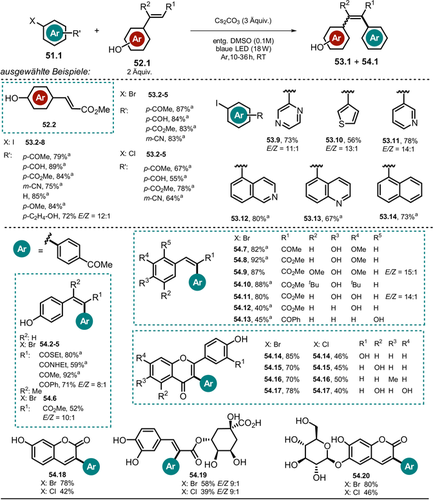
Substratbreite der Heck-artigen Arylierung, veröffentlicht von Xia und Mitarbeitern. [a] E/Z>19:1.
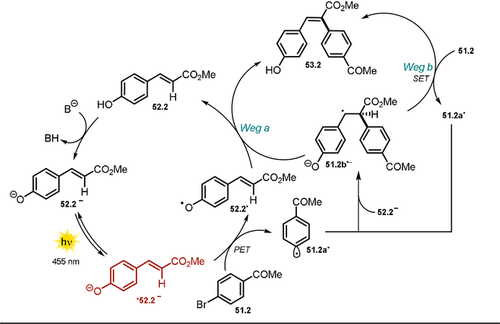
Vorgeschlagener Reaktionsmechanismus für die lichtvermittelte Heck-artige Arylierung von Vinylphenolen.
Es wird angenommen, dass das entstehende Radikal-Anion 51.2 b.− entweder eine Radikalkette durch SET auf ein weiteres Substrat-Molekül 51.2 auslöst, was zu dem gewünschten Heck-Arylierungsprodukt 53.2 (Weg b) führt, oder in das Letztere in Gegenwart des Phenoxy-Radikals 52.2. via H-Atom-Transfer oder Elektrontransfer, gefolgt von einer Protonenumlagerung, umgesetzt wird (Weg a).
Melchiorre und Mitarbeiter haben kürzlich gezeigt, wie Phenolate für die Erzeugung von Perfluoralkyl-Radikalen via SET genutzt werden können.115 Mit der entwickelten Methode konnten Phenole mit elektronenziehenden Gruppen direkt perfluoralkyliert oder trifluormethyliert werden, 57.2–15 (Schema 29). In Gegenwart der nicht-nukleophilen Base 1,1,3,3-Tetramethylguanidin (TMG) wird das Absorptionsspektrum des Salicylaldehyds (55.2) rotverschoben, jedoch wurde keine Änderung des Absorptionsverhaltens bei Zugabe Perfluoralkyliodid 56.1 beobachtet, was gegen die Bildung eines EDA-Komplexes im Grundzustand spricht. Durch die basenvermittelte bathochrome Verschiebung kann die Reaktionslösung mit einer Fluoreszenzlampe (CFL) belichtet werden. Der Gebrauch einer 300-W-Xe-Lampe mit Sperrfilter (λ>385 nm) führte ebenfalls zum gewünschten alkylierten Produkt, jedoch in etwas geringerer Ausbeute. Der postulierte Mechanismus dieser Reaktion (Schema 30) beginnt mit einem SET vom photoangeregten Phenolat *55.1− auf das Perfluoralkyliodid 56.1. Eine darauffolgende reduktive Abspaltung des Iodid-Anions erzeugt das reaktive Perfluoralkyl-Radikal 56.1 a..
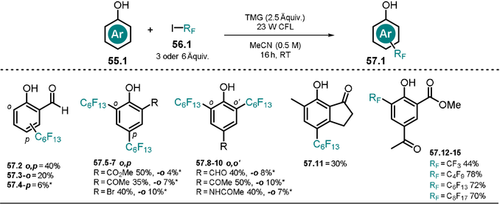
Substratbreite der Perfluoroalkylierung von substituierten Phenolen. Neben-Konstitutionsisomere wurden mittels Roh-19F-NMR-Daten bestimmt und mit (*) markiert; 6 Äquiv. des Alkylierungsmittels 56.1 wurden für die Produkte 57.7–10 genutzt.
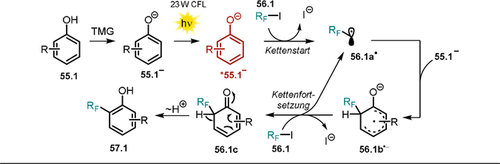
Lichtvermittelte Perfluoralkylierung von Phenolen mit elektronenziehenden Substituenten, publiziert von Melchiorre und Mitarbeitern. Der Einfachheit halber ist nur der zum ortho-Alkylierungsprodukt führende Mechanismus gezeigt.
Im bindungsbildenden Schritt wird das erzeugte Radikal vom Phenolat im Grundzustand abgefangen und ein Cyclohexadienyl-Radikalanion 56.1 b.− entsteht, das die Radikalkettenreaktion durch SET auf ein weiteres Alkyliodid 56.1 fortsetzt. Die folgende Protonenumlagerung führt zum alkylierten Phenol 57.1. Im Einklang mit dem postulierten Mechanismus zeigten Experimente zur Stern-Volmer-Lumineszenzlöschung, dass die Lumineszenz des angeregten Phenolats in Gegenwart des Alkyliodids gelöscht wird. Die Reaktion verläuft mit o-substituierten Phenolen mit moderater Regioselektivität, wobei o-,p-monoalkylierte und o,p-dialkylierte Produkte entstehen. p-Substituierte Phenole führen zu o,o′-dialkylierten Produkten.
Bei der Verfolgung der Produktverteilung über die Zeit konnte festgestellt werden, dass o- und p-alkylierte Produkte als Zwischenprodukte gebildet und dann weiter zu difunktionalisierten o,p-Addukten umgesetzt werden. Unsubstituierte oder methoxysubstituierte Phenole sowie Nitrophenole konnten jedoch nicht mit dieser Methode umgesetzt werden. Die Verwendung des Phenols 55.12, das mit zwei elektronenziehenden Substituenten in ortho- und para-Position ausgestattet ist, führte selektiv zum monoalkylierten, isomerenreinen Produkt. In der Reaktion können Perfluoralkyliodide mit C8-, C6-, C4- und C1-Ketten (57.12–15) umgesetzt werden.
3.2 Arylierung von Azaallyl-Anionen mit sichtbarem Licht
Chruma und Mitarbeiter zeigten, dass die Belichtung des farbigen Azaallyl-Anions 58.1− dessen Oxidationspotential im angeregten Zustand signifikant steigert.116 In Gegenwart starker Basen (pKS(konjugierte Säure)>32) liegt das 2-Azaallyl-Anion vor, das superelektronendonierende Eigenschaften im Grundzustand besitzt117 und erfolgreich für die Funktionalisierung von nicht-aktivierten Aryliodiden und tertiären Alkylhalogeniden eingesetzt werden konnte.
Die Substratbreite der Reaktion konnte durch den Einsatz von sichtbarem Licht gesteigert werden, da ein höheres Oxidationspotential im angeregten Zustand erreicht wird. Dadurch konnten reaktionsträge (Hetero-)Arylbromide und -chloride 59.1 umgesetzt werden, die jedoch im großen Überschuss bezogen auf 58.1 eingesetzt werden. Die Regioselektivität der Arylierungsreaktion ist moderat, und gewöhnlich werden Produktgemische (60.1 und 61.1) beobachtet (Schema 31).
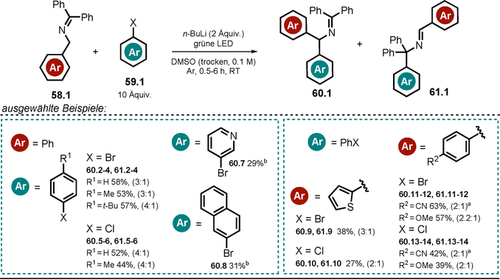
Substratbreite der lichtvermittelten Kupplung von Azaallylanionen mit (Hetero-)Arylhalogeniden. Verhältnis (60/61) der gebildeten Regioisomere ist angegeben. [a] Blaues Licht. [b] Das andere Regioisomer wurde nicht isoliert.
Als Mechanismus schlagen die Autoren einen PET vom angeregten Zustand des Azaallyl-Anions *58.1− auf das Arylhalogenid 59.1 vor. Nach Bruch der Kohlenstoff-Halogen-Bindung wird ein transientes, reaktives Aryl-Radikal 59.1 a. gebildet, welches mit dem stabilisierten Azaallyl-Radikal 58.1. zum Arylierungsprodukt reagiert (Schema 32).
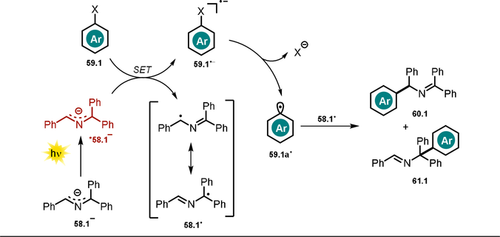
Arylierung des 2-Azaallyl-Anions mit reaktionsträgen (Hetero-)Arylhalogeniden.
3.3 Synthese von Pyrazolen über ein photoangeregtes α,β-ungesättigtes Hydrazon-Anion
Zhu und Mitarbeiter setzten verschiedene, substituierte Hydrazone 62.1 in Gegenwart von Base und Sonnenlicht in Cyclisierungsreaktionen zu Pyrazol-Derivaten 63.1 um.118 Dabei weist das UV/Vis-Spektrum des anionischen Hydrazons eine signifikante Rotverschiebung im Gegensatz zur neutralen Ausgangsverbindung auf, was den Einsatz von sichtbarem Licht für die Cyclisierung erlaubt. Ausgewählte Beispiele von hergestellten Pyrazolen sind in Schema 33 dargestellt.
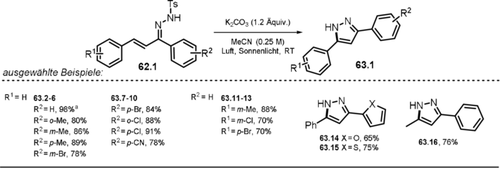
Ausgewählte Beispiele der isolierten Pyrazole mittels Belichtung von α,β-ungesättigten Hydrazon-Anionen. [a] Maßstab skaliert auf 20 mmol.
Die Autoren schlagen zwei plausible Reaktionsmechanismen vor (Schema 34): Das deprotonierte Hydrazon 62.1− wird durch Licht angeregt und geht entweder einen direkten Ringschluss via *62.1 a− (Weg a) ein oder wird in Gegenwart von Luftsauerstoff zum N-zentrierten Radikal 62.1. oxidiert (Weg b), welches durch einen intramolekularen radikalischen Ringschluss (62.1 a.), gefolgt von der Abspaltung des Tosyl-Radikals, das gewünschte Pyrazol 63.1 bildet. Geringere Produktausbeuten bei einer Reaktionsführung unter N2-Atmosphäre oder in Gegenwart des Radikalfängers TEMPO deuten auf eine hauptsächlich radikalisch ablaufende Reaktion hin (Weg b). Interessanterweise konnte zudem gezeigt werden, dass der Pyrazol-Ringschluss auch in Wasser durchgeführt werden kann, wobei jedoch geringere Ausbeuten erhalten wurden.

Vorgeschlagener Reaktionsmechanismus für die lichtvermittelte Bildung von Pyrazolen ausgehend von α,β-ungesättigten Hydrazonen.
3.4 Nutzung des Phthalimid-Anions zur H-Atom-Abstraktion
Bereits im Jahr 1988 erkannte man die besonders ausgeprägte Fähigkeit des angeregten Phthalimid-Anions *64−, H-Atome aus alkoholischen Lösungen zu abstrahieren.119 In den darauffolgenden Jahren wurde diese Methode weiterentwickelt und konnte auf Ether, Alkylbenzole und Amine ausgeweitet werden, wobei die Additionsprodukte des Phthalimids isoliert wurden (Schema 35).120 Der Einsatz von 4-Methylanisol führte zu einem Produktgemisch (66.8 a–b) da die Abstraktion eines H-Atoms sowohl an der Methoxygruppe als auch in benzylischer Position möglich ist. In alkalischer Lösung liegt Phthalimid 64 im Gleichgewicht mit der konjugierten Base 64− vor. Der PET ausgehend vom angeregten *64− auf Phthalimid im Grundzustand ist dabei ein thermodynamisch möglicher Prozess. Die Autoren schlagen daher das Phthalimid-Radikal 64. als das H-Atom-Transferreagenz vor, welches durch PET vom angeregten Anion *64− auf das ungeladene Phthalimid 64 entsteht.
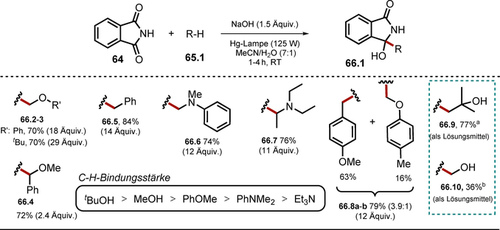
Lichtvermittelte, reduktive Alkylierung von Phthalimid. Ausbeuten beziehen sich auf umgesetztes Phthalimid. Eingesetzte Menge an H-Atomdonor ist in Klammern angegeben. Abweichung von Standard-Reaktionsbedingungen: [a] 64 (13.6 mmol), NaOH (16 mL, 1 m), tBuOH (150 mL), Hg-Lampe (125 W), 5 h. [b] 64 (13.6 mmol), NaOH (10 mL, 1 m), MeOH (160 mL), Hg-Lampe (125 W), 1 h.
Die Bildung des elektrophilen Radikals 64. erlaubt unter anderem die Aktivierung von C-H-Bindungen mit bemerkenswert hohen Bindungsenergien (z. B. tBuOH, Ediss=100±2 kcal mol−1).121 Nach erfolgreicher H-Atom-Abstraktion liegen Phthalimid 64 und das Alkyl-Radikal 65.9. vor. Eine Radikal-Radikal-Kupplung zwischen dem Phthalimid-Radikalanion 64.− und dem Kohlenstoff-zentrierten Radikal 65.9. liefert schließlich das Additionsprodukt 66.9 (Schema 36).
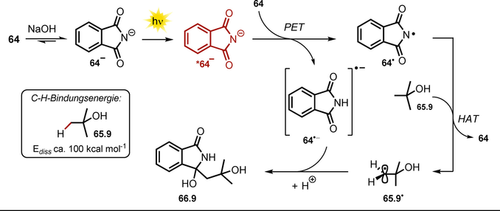
Lichtvermittelte H-Atom-Abstraktion und radikalische Addition an das Phthalimid-Radikalanion 64.− über das Phthalimid-Radikal 64..
3.5 Photocycloadditionen von Phthalimid- und Saccharin-Anionen
Die Bildung von [2]Benzazepin-1,5-dion-Derivaten 68.1 über eine [2+2]-Photocycloaddition ausgehend von Phthalimid 64 war aufgrund konkurrierender Elektronentransferreaktionen aus dem angeregten Zustand zunächst beschränkt auf elektronenarme acyclische Alkene.122, 123
Suau und Mitarbeiter123 konnten dieses Problem elegant umgehen, indem sie die abgeschwächte Oxidationskraft des anionischen Natriumphthalimids 64− ausnutzten. Dadurch konnten effiziente und regiokontrollierte Photocyloadditionen mit erweiterter Substratbreite hinsichtlich der eingesetzten Alkene durchgeführt werden (Schema 37). Im Gegensatz zur neutralen Verbindung ist 64− stark fluoreszierend. Eine deutliche Löschung der Fluoreszenz wurde nach Zugabe des Alkens beobachtet, was auf das angeregte Phthalimid-Anion *64− als reaktive Spezies hindeutet. Die [2+2]-Cycloaddition des angeregten Phthalimid-Anions mit Doppelbindungen ist eine stereospezifische Reaktion, die das ringerweiterte Produkt cis-68.1 liefert. Aufgrund des alkalischen Milieus findet jedoch eine Epimerisierung zum cis- und trans-68.1-Gemisch statt (Schema 38).
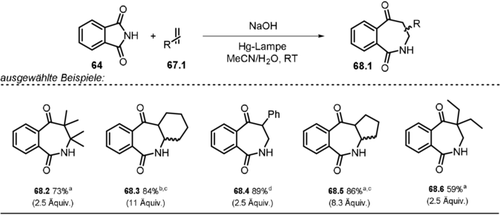
[2+2]-Photocycloaddition des angeregten Phthalimid-Anions mit Alkenen. [a] 64 (6.8 mmol), NaOH (8 mL, 1 m, 1.2 Äquiv.), MeCN/H2O (160 mL, 7:1), 0.5 h, 125-W-Hg-Lampe. [b] 64 (6.8 mmol), NaOH (pH≈10), MeCN/H2O (7:1), 0.5 h, 125-W-Hg-Lampe. [c] Produktgemisch aus cis- und trans-68 wurde erhalten. [d] 64 (6.8 mmol), NaOH (10.2 mL, 1 m, 1.5 Äquiv.), MeCN/H2O (7:1), 2 h, 400-W-Hg-Lampe.
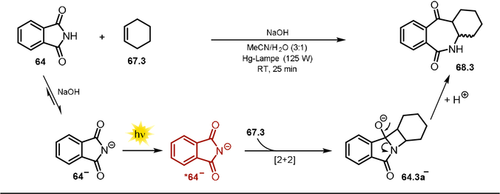
Vorgeschlagener Mechanismus der [2+2]-Photocycloaddition des Phthalimid-Anions mit Cylohexen.
Vor kurzem wurde gezeigt, dass das photoangeregte Saccharin-Anion *69− eine sehr ähnliche Reaktivität gegenüber Alkenen aufweist, was in der regioselektiven Ringerweiterung zu Benzosultam-Derivaten 71.2–6 (Schema 39), ausgehend vom billigen, kommerziell erhältlichen Süßstoff Saccharin, ausgenutzt wurde.124
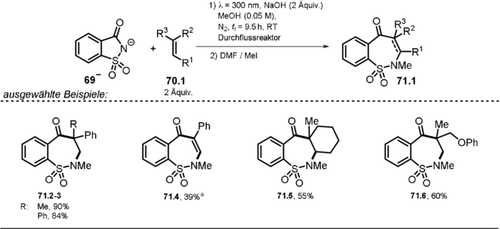
Ausgewählte Beispiele isolierter Benzosultame, die durch eine lichtvermittelte Ringerweiterung ausgehend von Saccharin und Alken hergestellt wurden. Reaktionsbedingungen: Durchflussreaktor 0.75 mm Innendurchmesser. [a] Phenylacetylen wurde eingesetzt.
Bisherige Methoden zur Synthese von siebengliedrigen Benzosultam-Derivaten verlaufen über mehrere Stufen und in Gegenwart von giftigen Organozinnhydriden125 oder teuren Palladium-Katalysatoren.126 Der vorgeschlagene Reaktionsmechanismus wurde anhand von experimentellen Beobachtungen und computergestützten Berechnungen ausgearbeitet. Die Anregung des Saccharin-Anions 69− mit Licht erfolgt demnach hauptsächlich in den S2-Zustand. Die berechneten Daten weisen jedoch auf eine schnelle Relaxation in den S1-Zustand hin. Der Schlüsselschritt bei der Bildung des Benzosultams ist vermutlich ein nukleophiler Angriff des Stickstoffs von *69− an das Alken. Im Einklang mit Berechnungen konnte auch experimentell keine Azetidin-Zwischenstufe (vgl. 64.3 a−, Schema 38), die aus einer [2+2]-Cycloaddition des Sacchrin-Anions mit dem Alken resultieren würde, nachgewiesen werden. Bei der entstehenden C-C-Bindung zwischen Carbonylgruppe und Alken wird eine Reaktion aus dem Grundzustand angenommen. Die beobachtete Regioselektivtät geht auf den kinetisch bevorzugten Angriff des nukleophilen Stickstoffatoms an die terminale bzw. sterisch weniger gehinderte Seite des Alkens zurück (Schema 40).
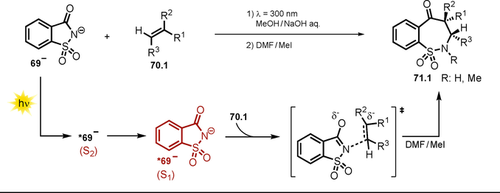
Vorgeschlagener Reaktionsmechanismus der lichtvermittelten Bildung von Benzosultam-Derivaten.
3.6 Donor-Akzeptor-Komplexe organischer Anionen
Organische Anionen können sich auch an der Bildung von Elektronen-Donor-Akzeptor (EDA)-Grundzustandskomplexen zusammen mit elektronenarmen Spezies beteiligen, was gewöhnlich mit der Entstehung einer rotverschobenen Ladungstransfer-Absorptionsbande einhergeht. Während der letzten Jahre erfreute sich die auf EDA-Komplexen basierende Photochemie zunehmender Beliebtheit. Daher möchten wir an dieser Stelle das Konzept anhand von drei Beispielen, in denen organische Anionen an der EDA-Komplexbildung beteiligt sind, vorstellen. Für eine umfassendere Auseinandersetzung mit der Thematik verweisen wir auf kürzlich veröffentlichte Aufsätze.127, 128 Die aromatische Perfluoralkylierung von α-Cyanarylacetaten 72.1, veröffentlicht von Melchiorre und Mitarbeitern,129 wird durch sichtbares Licht (CFL 23 W) vermittelt, obwohl weder das Enolat 72.1− noch das Perfluoralkyliodid 56.1 bzw. TMG in diesem Bereich des elektromagnetischen Spektrums absorbieren. Beim Zusammenmischen der Reagenzien beobachtet man jedoch eine farbige Lösung und eine bathochrome Verschiebung des Absorptionsspektrums, was charakteristische Indizien für die Bildung eines EDA-Komplexes sind. Die Belichtung von p-substituierten α-Cyanarylacetaten in Gegenwart von TMG und Alkylierungsreagenz erlaubte deren selektive Perfluoralkylierung in ortho-Position.
Mit unsubstituierten bzw. meta- oder ortho-substituierten α-Cyanarylacetaten wurden jedoch Gemische aus verschiedenen Regioisomeren und dialkylierten Produkten erhalten. Als Reaktionsmechanismus schlagen die Autoren eine homolytische aromatische Substitution (HAS) vor, was im Einklang mit den geringen Produktausbeuten bei Verwendung von elektronenarmen Arenen steht. Optimierte Reaktionsbedingungen erlaubten den Umsatz weiterer Substrate inklusive Heteroarenen (73.11–13) und α-Cyanphenylketon 73.14 (Schema 41). Kontrollexperimente zeigten, dass die Bildung des Produkts die weitere Reaktion inhibiert, da das Produkt-Enolat 73.1− wesentlich stärker absorbiert als der EDA-Komplex. Mithilfe eines Zweiphasensystems bestehend aus Tetradecafluorhexan und MeCN konnte das Problem der Produktinhibierung jedoch eingedämmt werden, wobei zugleich höhere Ausbeuten und kürzere Reaktionszeiten erreicht wurden.
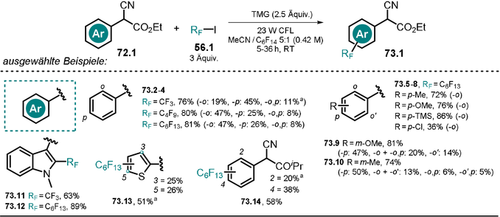
Ausgewählte Beispiele für die lichtvermittelte Perfluoralkylierung von (Hetero-)Arenen via EDA-Komplexbildung. [a] Ausbeute wurde mittels 19F-NMR bestimmt.
Die Radikalkettenreaktion wird eingeleitet durch die basenvermittelte Bildung des EDA-Komplexes 72.1−-EDA und durch Absorption von sichtbarem Licht. Im angeregten EDA-Komplex findet ein Elektronentransfer statt, und nach Abspaltung von Iodid liegt ein Radikalpaar bestehend aus Benzylradikal 72.1. und Perfluorradikal 56.1. vor. Das elektronenreiche Enolat 72.1− reagiert via HAS mit dem Alkylradikal zum radikalanionischen Zwischenprodukt 72.1 a.−. Es wird angenommen, dass die Radikalkette ausgehend von 72.1 a.− entweder durch SET und über 72.1 b oder über eine Atomtransfer-Radikaladdition (ATRA, 72.1 c−) mit darauffolgender Abspaltung von HI fortgesetzt wird. Das perfluoralkylierte Produkt 73.1 wird nach Aufarbeitung der Reaktion erhalten. Ein Kettenabbruch ist durch eine direkte Radikal-Radikal-Kupplung von 72.1. und 56.1. möglich (Schema 42).
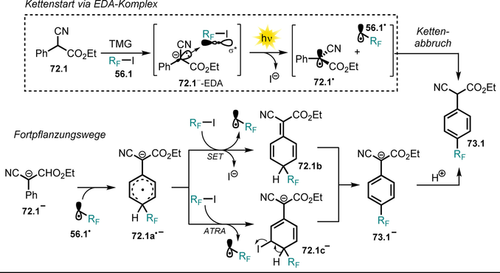
Vorgeschlagener Reaktionsmechanismus der Perfluoralkylierung von α-Cyanarylacetat über die Bildung eines EDA-Komplexes mit sichtbarem Licht.
Die Gruppe von Miyake machte sich die Bildung eines EDA-Komplexes zwischen elektronenreichen Thiophenolat Anionen 74.1− und Arylhalogeniden 75.1 zunutze, um aromatische Thioether 76.1 zu bilden.130 Die Methode erlaubte den Umsatz von elektronenreichen und elektronenarmen Thiophenolen in Gegenwart von Caesiumcarbonat und mittels sichtbaren Lichts (Schema 43). Darüber hinaus war der Einsatz von Arylhalogeniden nicht beschränkt auf reaktive, elektronenarme Arene, da der entsprechende Thioether auch aus Iodbenzol und Toluol gebildet werden konnte. Allerdings war dafür eine längere Reaktionszeit nötig (20–24 h).
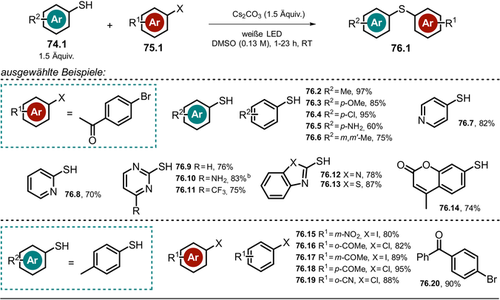
Ausgewählte Beispiele der lichtvermittelten Bildung von Thioethern zwischen Thiophenol und Arylhalogeniden. [a] 50-mmol-Ansatz. [b] Cs2CO3 (2 Äquiv.).
Bemerkenswert schnelle Kupplungsreaktionen (1 h) wurden zwischen elektronenarmen Arylhalogeniden und elektronreichen Thiophenolen beobachtet. Zusätzlich wurde gezeigt, dass Benzylhalogenide auf gleiche Weise umgesetzt werden können. Die Anwendung der Methode ermöglicht zudem die milde und effiziente Funktionalisierung von Wirkstoffen in späten Phasen der Syntheseroute.
Die Bildung eines EDA-Komplexes 74.2−-EDA zwischen Thiophenolat 74.2− und Arylhalogenid 75.2 wurde durch UV/Vis-Spektroskopie und TD-DFT-Berechnungen bestätigt. Die durch Komplexbildung entstehende CT-Absorptionsbande ermöglicht den Einsatz von sichtbarem Licht, um die Reaktion einzuleiten. Dabei findet ein Elektronentransfer innerhalb des angeregten Komplexes 74.2−-EDA vom Thiolat auf das Aryhalogenid statt, wodurch es zur Abspaltung des Halogenid-Ions und der Bildung eines reaktiven Aryl-Radikals sowie eines Thiyl-Radikals kommt. Beide radikalischen Intermediate kombinieren unter Ausbildung einer C-S-Bindung zum Kreuzkupplungsprodukt 76.2 (Schema 44).
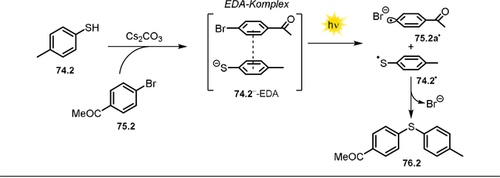
Vorgeschlagener Reaktionsmechanismus für die lichtvermittelte C-S-Kreuzkupplung von Thiophenolen und Arylhalogeniden über die Bildung eines EDA-Komplexes.
Anhand der Perfluoralkylierung von Alkenen und Alkinen wurde vor kurzem gezeigt, dass das anionische Gegenstück eines EDA-Komplexes auch katalytisch eingesetzt werden kann.131 2-Bromphenol (BrPhOH) stellte sich dabei als effektiver Katalysator für die mit sichtbarem Licht vermittelte 1,2-Addition von perfluorierten Alkyliodiden an Alkene bzw. Alkine heraus. In Abwesenheit des Phenol-Katalysators wird eine nicht unerhebliche Menge an Produkt in der Reaktion von Allylbenzol 77.2 mit Difluoriodessigsäureethylester 56.6 gebildet, jedoch konnte die Ausbeute durch den katalytischen Einsatz von BrPhOH verdoppelt werden. Bei Verwendung eines polaren Lösungsmittels wurden Heck-artige Produkte anstelle der Additionsprodukte erhalten. Allylphenole, die ebenfalls katalytische Wirkung zeigten, konnten abhängig von den gewählten Reaktionsbedingungen und ohne Zusatz von BrPhOH in die entsprechenden Additionsprodukte 79.1 oder Kupplungsprodukte 80.1 überführt werden.
Zu Beginn der Reaktion wird die Bildung eines EDA-Komplexes zwischen Phenolat BrPhO− und Alkylierungsreagenz 56.6 angenommen. Durch Photoanregung des EDA-Komplexes wird das Alkylradikal 56.6. freigesetzt, welches mit dem Olefin 77.1 reagiert und das radikalische Zwischenprodukt 77.1 a. bildet. Abhängig vom gewählten Reaktionsmedium findet entweder die Abstraktion eines Iod-Atoms von 56.6 zum Additionsprodukt 79.1 statt, oder die Reaktion verläuft über einen SET auf 56.6, der zur Bildung einer carbokationischen Zwischenstufe 77.1 a+ und nach Deprotonierung schließlich zum Heck-Kupplungsprodukt 80.1 führt (Schema 45).
Ausgewählte Beispiele der Alkylierung von Alkenen und Alkinen mit perfluorierten Alkylierungsreagenzien, die Additions- oder Heck-Kupplungsprodukte ergeben (oben). [a] Mit KOAc (2 Äquiv.) in DCE. [b] Ohne BrPhOH in Dioxan. [c] Cs2CO3 anstatt von KOAc. [d] K2CO3 anstatt von KOAc. [e] Mit K2CO3 (2 Äquiv.) in DMSO. Vorgeschlagener Reaktionsmechanismus für die lichtvermittelte Alkylierung von Alkenen und Alkinen mit 2-Bromphenol als Initiator (unten).
3.7 Radikal-nukleophile Substitutionsreaktion (SRN1) mit organischen Anionen
Im Zuge von SRN1-Reaktionen werden Radikale und Radikalanionen als reaktive Intermediate erzeugt, und häufig finden Radikalkettenreaktionen statt. Die Reaktion wurde erstmals in den 1960er Jahren132, 133 beschrieben und ermöglicht die nukleophile Substitution an aromatischen und aliphatischen Verbindungen. Dabei wird ein breites Spektrum an Nukleophilen sowie Substraten toleriert.134 Angestoßen wird die Reaktion häufig mittels PET eines elektronenreichen anionischen Nukleophils auf einen elektronenarmen Akzeptor, wodurch das radikalische Nukleophil Nu. und ein Radikalanion [R-X].− entstehen. Vorherige EDA-Komplexbildung zwischen Nukleophil und Substrat wurde beobachtet und begünstigt das Auslösen der SRN1-Reaktion mit Licht geringerer Energie.127 Das gebildete Radikalanionen zerfällt unter Abspaltung einer anionischen Abgangsgruppe in das reaktive Radikal R., das vom Nukleophil abgefangen wird, wodurch [R-Nu].− entsteht. Ein SET aus dem Grundzustand des Radikal-Anions [R-Nu].− auf den Akzeptor R-X liefert das gewünschte Substitutionsprodukt zusammen mit dem ursprünglich gebildeten Radikal-Anion [R-X].−. Ist der Elektronentransfer von [R-Nu].− auf [R-X] ein thermodynamisch begünstigter Prozess, ist eine Radikalkettenreaktion möglich (Schema 46).
Allgemeiner Reaktionsmechanismus der radikalisch-nukleophilen Substitutionsreaktion (SRN1) und der durch Licht angestoßenen, basenvermittelten homolytischen aromatischen Substitutionsreaktion (Photo-BHAS).
Im engen Zusammenhang mit dem Konzept der durch Licht angestoßenen SRN1-Reaktion steht die photoinitiierte basenvermittelte homolytische aromatische Substitutionsreaktion (Photo-BHAS), die C-H-arylierte Produkte ausgehend von Aryl- oder Alkylhalogeniden in Gegenwart starker Basen (z. B. KOtBu oder NaH) liefert. Dabei wird angenommen, dass das erzeugte reaktive Intermediat R. mit dem Aren zu einem Cyclohexadienyl-artigen Radikal reagiert, das durch Deprotonierung in das entsprechende Radikal-Anion überführt wird. Letztlich wird das arylierte Produkt durch SET auf R-X gebildet, wodurch gleichzeitig die Radikalkette fortgesetzt wird. Erst kürzlich wurde gezeigt, dass in Abwesenheit weiterer Additive Dimsyl-Anionen mit sichtbarem Licht angeregt werden können und eine entscheidende Rolle beim Auslösen der Reaktion spielen (siehe Schema 46).135 Darüber hinaus wurde gezeigt, dass die BHAS-Reaktion auch durch anderer lichtabhängige Aktivierungsmethoden gestartet werden kann, wie zum Beispiel via PET auf R-X in Gegenwart eines Iridium-Sensibilisators oder als Folge der Belichtung eines in situ gebildeten Komplexes zwischen KOtBu und Phenanthrolin.136, 137 Gewöhnlich werden nicht-nukleophile Basen eingesetzt, um die konkurrierende SRN1-Reaktion zu unterdrücken. Lichtvermittelte Substitutionsreaktionen, die nach dem SRN1-Mechanismus verlaufen, wurden weitreichend untersucht und sind Gegenstand von Buchkapiteln und neueren Aufsätzen, weshalb wir hier nicht weiter auf sie eingehen.4, 134, 138-142
3.8 Direkte Photodecarboxlierung von Carboxylaten
Über einige organische Carboxlyate weiß man, dass sie bei Belichtung zur Photodecarboxylierung (PDC) neigen, wodurch CO2 und entweder ein Carbanion-Intermediat (heterolytische Spaltung) oder ein Alkyl-Radikal in Verbindung mit einem solvatisierten Elektron (homolytische Spaltung) entsteht. Meiggs et al.143 untersuchten die Photodecarboxylierung von Natriumphenylacetat mittels Laser-Flash-Photolyse und konnten die Bildung eines Benzyl-Radikals mittels transienter Absorptionsspektroskopie nachweisen. Bei diesem Prozess konnte neben der Bildung von Polysäuren und 1,2-Diphenylethan auch Toluol nachgewiesen werden, was auf einen konkurrierenden heterolytischen Spaltmechanismus hindeutet. Reaktionswege, die über energetisch ungünstige carbanionische oder radikalische Stufen verlaufen, sind in Verbindungen mit stabilisierenden Substituenten begünstigt. Daher wird PDC vor allem bei Belichtung von dissoziierten Arylessigsäuren 81.1 beobachtet, da das entstehende Zwischenprodukt von der benzylischen Stabilisierung profitiert (Schema 47). Die lichtvermittelte Zersetzung von Carbonsäuren und deren Carboxylaten wurde detailliert in verschiedenen Aufsätzen und Buchkapiteln diskutiert und geht über den Rahmen dieser Arbeit hinaus.144-146
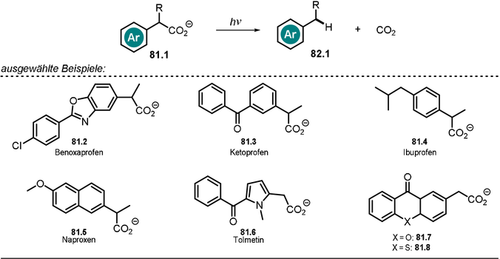
Allgemeine Reaktionsgleichung der Photodecarboxylierung von dissoziierten Arylessigsäuren und bekannte Beispiele.
Photobasen stellen wichtige Verbindungen zum Starten von Photopolymerisationsprozessen dar. Die Carbonsäuren von Xanthon und Thioxanthon (siehe Schema 47, 81.7–8) bilden bei Belichtung und anschließender Decarboxylierung Carbanionen, die eine Amin-freie und effiziente Alternative zu gängigen Initiierungsmethoden für die Thiol-Epoxy-Polymerisierung darstellen und deshalb zunehmend Interesse erlangen.147, 148
3.9 Sulfit-Anionen in Photoreaktionen
Eine interessante Methode zur Erzeugung von solvatisierten Elektronen stellt die Belichtung von billigen und kommerziell erhältlichen Sulfit-Anionen dar (Schema 48). In kürzlich erschienenen Veröffentlichungen konnte das Konzept erfolgreich für die Photozersetzung von halogenierten Schadstoffen wie Monochloressigsäure149 83 oder Perfluoroctansulfonat150 angewendet werden. Allerdings ist für die Anregung von Sulfit-Anionen schädliches, hoch-energetisches UV-Licht (254 nm) nötig. Zudem leidet die Effizienz der Reaktion in komplexen Lösungen aufgrund von Lichtstreuung oder konkurrierender Absorption durch andere Bestandteile oder dem Lösungsmittel.
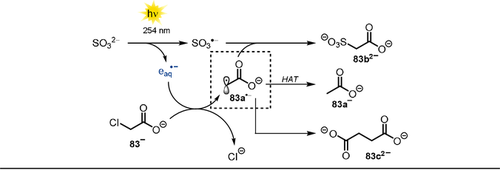
Dechlorierung von Monochloressigsäure mit solvatisierten Elektronen durch UV-Anregung von Sulfit-Anionen.
4 Zusammenfassung und Ausblick
Die Kombination aus organischen Anionen – entweder als Reagenz oder als Katalysator – und Licht eignet sich perfekt, um ansonsten schwierige Umsetzungen zu ermöglichen. Verglichen mit der zugehörigen neutralen Verbindung ist das Absorptionsspektrum des Anions gewöhnlich bathochrom verschoben, und häufig tritt Fluoreszenz nur in geladenen Spezies auf. Dadurch werden photochemische Umsetzungen mit energiearmem, oftmals sichtbarem Licht möglich, und anhand von Experimenten zur Fluoreszenzlöschung lassen sich Wechselwirkungen zwischen Substrat und angeregtem Chromophor untersuchen. Die wegweisende Arbeit von Soumillion und Mitarbeitern auf diesem Gebiet und deren ausgezeichneter Aufsatz4 zeigten bereits frühzeitig das Potential stark reduzierender organischer Anionen in der Dechlorierung von Arenen sowie der Desulfonylierung von Sulfonamiden mittels 2-Naphtholat auf. Die sauerstoffzentrierten Radikale des angeregten anionischen Decawolframats ermöglichen den Bruch starker C(sp3)-H-Bindungen von nicht-funktionalisierten Alkanen, wodurch neue Kohlenstoffbindungen erzeugt werden können. Die Kombination von HAT und Übergangsmetall-Katalyse weckte zuletzt breites Interesse und ermöglichte asymmetrische Umsetzungen. Neben dem Einsatz als Katalysatoren nutzt man stark reduzierende, angeregte Anionen auch zur Aktivierung von Reaktionspartnern via PET, wodurch radikalische reaktive Intermediate erhalten werden. Beispiele dafür sind die Arylierung von Azaallylanionen oder die Heck-artige Arylierung von Vinylphenolen. Zudem erlauben photoangeregte organische Anionen Ringschlussreaktionen zum Pyrazol oder ermöglichen Ringerweiterungen. Organische Anionen agieren darüber hinaus als wirkungsvolle, elektronenreiche Donoren bei der Ausbildung von lichtabsorbierenden EDA-Komplexen.
Abschließend lässt sich festhalten, dass photoangeregte Anionen ein enormes Potential für Anwendungen in der organischen Synthesechemie besitzen. Wir beobachten ein zunehmendes Forschungsinteresse bezüglich der Nutzung photoangeregter Anionen als Photokatalysatoren oder Photo-Reagenzien und hoffen, dass dieser Aufsatz zu weiteren Beiträgen auf diesem noch wenig erforschten, aber aufstrebenden Gebiet mit interessanten Anwendungen in der organischen Synthese anregt.
Acknowledgements
Diese Arbeit wurde durch die Deutsche Forschungsgemeinschaft (DFG, KO 1537/18-1) unterstützt und vom European Research Council (ERC) im Rahmen des Forschungs- und Innovationsprogramms Horizon 2020 der Europäischen Union (Finanzierungsvereinbarung Nr. 741623) finanziert. Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Conflict of interest
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.
Biographical Information
Matthias Schmalzbauer absolvierte 2016 das M.Sc.-Studium der Chemie an der Universität Regensburg. Im Zuge der Masterarbeit schloss er sich der Gruppe von Prof. B. König an und brach zu einem Forschungsaufenthalt an die UNC (Córdoba, Argentinien) unter der Betreuung von Dr. J. I. Bardagí und Prof. R. A. Rossi auf. Er promovierte bei Prof. B. König an der Universität Regensburg und ist aktuell Postdoktorand in der König-Gruppe mit Forschungsinteresse an organischer Photoredox-Katalyse.
Biographical Information
Michela Marcon schloss 2019 ihren Master in Chemie an der Universität von Padua (Italien) unter Betreuung von Dr. X. Companyó und Dr. L. Dell′Amico ab. Anschließend trat sie als Erasmus-Studentin in die Gruppe von Prof. B. König ein und arbeitete an der photokatalytischen Erzeugung von Carbanionen. Aktuell ist sie Doktorandin in der Gruppe von Prof. B. König.
Biographical Information
Burkhard König promovierte an der Universität Hamburg und setzte seine wissenschaftliche Ausbildung als Postdoktorand bei Prof. M. A. Bennett, Australian National University, Canberra und bei Prof. B. M. Trost, Stanford University fort. Seit 1999 ist er ordentlicher Professor für organische Chemie an der Universität Regensburg. Seine aktuellen Forschungsinteressen sind Synthesemethoden in der organischen Synthese unter Verwendung von sichtbarem Licht und die Anwendung photochromer Moleküle.







