Salze von HCN-Cyanid-Aggregaten: [CN(HCN)2]− und [CN(HCN)3]−
Abstract
Obwohl reiner Cyanwasserstoff spontan polymerisieren oder sogar explodieren kann, was durch geringe Mengen an Basen (z. B. CN−) ausgelöst wird, wurde die Reaktion von flüssigem HCN mit [WCC]CN (WCC=schwach koordinierendes Kation=Ph4P, Ph3PNPPh3=PNP) untersucht. Abhängig vom Kation konnten aus flüssigem HCN Salze, welche die formalen Dihydrogentricyanid- [CN(HCN)2]− und Trihydrogentetracyanid-Ionen [CN(HCN)3]− enthalten, isoliert werden, wenn die Kristallisation schnell und bei niedrigen Temperaturen durchgeführt wurde. Die Röntgenstrukturaufklärung ergab wasserstoffverbrückte lineare [CN(HCN)2]− und Y-förmige [CN(HCN)3]− Molekülionen im Kristall. Beide Anionen können als Vertreter hochlabiler Cyanid-HCN-Solvate vom Typ [CN(HCN)n]− (n=1, 2, 3…) sowie als formale Polypseudohalogenidionen betrachtet werden.
Seit der Entdeckung von Cyanwasserstoff (HCN) durch Scheele im Jahr 1782 steht die Chemie des HCN im Blick der organischen, anorganischen und industriellen Chemie.1-9 Scheele erzeugte HCN durch Erhitzen von Berliner Blau mit Schwefelsäure.10, 11 Moderne industrielle Prozesse basieren auf Methan und Ammoniak, die entweder mit oder ohne Sauerstoff an einem Pt-Kontakt (BMA, Andrussow-Verfahren) umgesetzt werden.12-15 Aufgrund seiner industriellen und biologischen16-20 Bedeutung wurden zahlreiche theoretische21-28 und experimentelle22, 23, 37-44, 29-36 Studien über HCN und dessen Aggregate (HCN)n durchgeführt, jedoch meist in der Gasphase (Mikrowellen-Rotationsspektroskopie, IR oder Matrix-IR). Das kleinste Pseudohalogenid,45 das Cyanidion, CN−, wurde als erstes mit den Halogeniden verglichen. Gay-Lussac synthetisierte 1815 NC-CN ausgehend von Hg(CN)2 und führte den Namen Cyanwasserstoff für HCN im Vergleich mit Chlorwasserstoff ein.46 Letztendlich definierte Birckenbach47 molekulare Einheiten als ein Pseudohalogen, wenn deren Chemie große Ähnlichkeiten mit der von Halogenen zeigte, wie die Bildung einer Säure (HCN), eines Dimers (NC-CN), schwer löslicher Silbersalze (AgCN) und der Disproportionierung in Wasser (NC-CN+2 OH−→CN−+OCN−+H2O). Diese Gruppe von chemischen Merkmalen für ein Pseudohalogen48, 49 kann z. B. auf die Bildung der kationischen bzw. anionischen Aggregatreihe [H(HX)n]+ und [X(HX)n]− (X=Halogen oder Pseudohalogen) erweitert werden. Zum Beispiel sind [H(HF)n]+ (n=1, 2)50 und [F(HF)n]− (n=1–4)51-54 sowie die Pseudohalogenanaloga wie [H(HN3)]+[55] und [N3(HN3)]−[56] bekannt. Kürzlich konnten Salze, die die Polypseudohalogenide [SCN(HSCN)]− enthalten, isoliert werden.57, 58 Der erste Syntheseversuch von [CN(HCN)]− wurde von Salthouse und Waddington veröffentlicht, die [nPr4N]CN mit reinem HCN versetzten und nach dem Entfernen des Überschusses an HCN eine ölige Flüssigkeit erhielten.59 Der erste experimentelle Bericht über [H(HCN)n]+ (n=1–4) Aggregate in der Gasphase wurde von Meot-Ner veröffentlicht, der eine gepulste Hochdruck-Massenspektrometrietechnik verwendete, um thermochemische Daten dieser Spezies zu ermitteln.60 Zehn Jahre später berichteten Meot-Ner, Scheiner und Liebman von thermochemischen Messungen und Berechnungen für HCN-Cyanid-Aggregate in der Gasphase unter Verwendung der gleichen massenspektrometrischen Methode.61 Es wurde festgestellt, dass die Aggregatreihe [CN(HCN)n)]− (n=1–7) bei jedem HCN-Additionsschritt exotherm gebildet wird (ΔH° zwischen −20.7 und −7.6 kcal mol−1). Auch durch CN−/HCN-Austauschgleichgewichtsprozesse konnte die Wasserstoffbrückenbindungsenergie in [CN(HCN)]− mittels Ionenzyklotronresonanz-Massenspektrometrie bestimmt werden.62 Die Gruppe von Fehlhammer isolierte [M-CN⋅⋅⋅H⋅⋅⋅NC-M]−-Komplexe (M=Cr(CO)5) durch Reaktion von [Ph4As][Cr(CN)(CO)5] mit [Cr(CO)5CNH].63 Erst kürzlich berichtete die Gruppe von Riedel über die Isolierung von Pseudohalogen-Halogeniden des Typs [Br(BrCN)]− und [Br(BrCN)3]−.64 Da wir in jüngster Zeit die Stabilisierung von HCN-Dimeren durch starke Lewis-Säuren beobachtet haben, untersuchten wir anschließend die Reaktion zwischen Lewis-Basen wie CN− und HCN, um Salze mit HCN-Cyanid-Aggregaten des Typs [CN(HCN)n]− (n=1, 2, 3 …) zu isolieren. Die größten Probleme bei der Verwendung von reinem polarem HCN(l) (μ=2.98 D)65 sind seine hohe Toxizität (180–270 ppm sind tödlich),66 der niedrige Siedepunkt (Sdp.: 25.6 °C)67 und der relativ hohe Schmelzpunkt (Schmp.: −13.4 °C),67 wodurch nur ein kleines Temperaturfenster (−12–+25 °C, 1 atm) für das Arbeiten in der flüssigen Phase bleibt. Zusätzlich besteht eine Tendenz zur spontanen Polymerisation oder sogar zur Explosion, die durch geringe Spuren von Basen ausgelöst werden kann. Im Folgenden berichten wir über die Reaktion von Cyanid-Ionen in reinem flüssigen HCN und die zu lösenden Probleme, die schließlich zur Isolierung von Salzen mit den [CN(HCN)n]−-Ionen (n=2, 3) führten. Da alle Reaktionen ohne weiteres Lösungsmittel durchgeführt wurden, kann das Reaktionsmedium als eine Mischung mit den Eigenschaften einer ionischen Flüssigkeit betrachtet werden.68
Wir haben dieses Projekt mit der Synthese reiner Cyanide vom Typ [WCC]CN ([WCC]+=[Et3NMe]+, [nPr3NMe]+, [Ph3PMe]+) begonnen,69 die dann mit einem Überschuss an flüssigem HCN (synthetisiert aus NaCN und Stearinsäure (Schmp.: 69 °C) bei 80–100 °C im Vakuum) versetzt wurden.70-72 Durch die Zugabe eines Überschusses an HCN zu reinem [WCC]CN bei −10 °C löste sich das Cyanidsalz sofort und es wurde eine umgehend einsetzende Polymerisation beobachtet, die ein tiefbraunes, hochviskoses Öl ergab. Um eine schnelle Polymerisierung zu vermeiden, haben wir [Ph4P]CN und [Ph3PNPPh3]CN (=[PNP]CN) verwendet, die sperrigere und symmetrischere Kationen enthalten (vgl. [Et3NMe]+ 0.20, [nPr3NMe]+ 0.30, [Ph3PMe]+ 0.38, [Ph4P]+ 0.46, [PNP]+ 0.70 nm3). Zunächst führte die Reaktion von [Ph4P]CN mit flüssigem HCN bei −10 °C zu einer Suspension. Nachdem sich diese Mischung jedoch auf 0 °C erwärmt hatte, wurde die sofortige Auflösung des Cyanidsalzes und die Farbveränderung der flüssigen Phase von farblos zu leicht gelb beobachtet. Als das Cyanidsalz vollständig aufgelöst war, wurde die Mischung schnell auf −10 °C abgekühlt und für maximal 3 h in einen Kühlschrank gestellt, um Kristalle zu erhalten, die für die Röntgenstrukturaufklärung geeignet waren. Dasselbe Verfahren wurde bei der Behandlung von [PNP]CN mit flüssigem HCN angewendet, was ebenfalls zur Bildung von farblosen Kristallen nach 15 Minuten führte. Eine schnelle Kristallisation ist wichtig, da ansonsten der Zersetzungsprozess zu schnell voranschreitet. Deshalb mussten wir mehrmals versuchen, innerhalb dieser Zeitspanne geeignete Kristalle zu erhalten. Interessanterweise zeigten Röntgenstrukturuntersuchungen eindeutig die Anwesenheit von wasserstoffverbrückten linearen [CN(HCN)2]−-Ionen im Fall des [Ph4P]+-Salzes (1), während Y-förmige [CN(HCN)3]−-Anionen mit dem [PNP]+-Kation (2) als Gegenion gefunden wurden (Abbildungen 1 und 2). Zusätzlich wurden auch [WCC]CN ([WCC]+=[nPr3PMe]+, [Ph4P]+]) in TMS-CN suspendiert und anschließend Methanol hinzugegeben um HCN in situ zu Erzeugen. In beiden Fällen konnte keine Bildung von HCN-Cyanid-Aggregaten beobachtet werden. Jedoch konnte im Falle des [Ph4P]CN die Bildung eines schwarzen amorphen Niederschlags beobachtet werden, der wahrscheinlich aufgrund einer Polymerisation von HCN gebildet wurde.
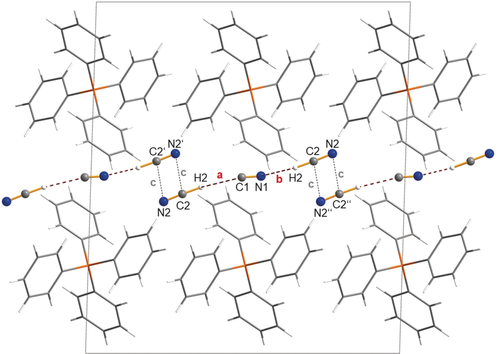
Kugel-Stab-Darstellung (Anionen) und Drahtgitter-Modell (Kationen) der molekularen Struktur von [Ph4P][CN(HCN)2] (1) im Kristall. Blick entlang [010]. Das lineare molekulare Anion wird durch zwei Wasserstoffbrücken gebildet (a und b). Eine Kette wird gebildet, wenn kurze Kontakte (c) berücksichtigt werden. Ein Ausschnitt einer solchen Kette wird gezeigt. Ausgewählte Abstände in Å, Nicht-Wasserstoffatom-Abstand in den H-Brücken: C1-C2 3.32(1), N1-C2 2.95(1); a=2.27, b=1.90. Kurze interionische Abstände c: C2-N2′ 3.713(9). Fehlordnung wird nicht gezeigt (siehe Abbildung S2). Nur das Hauptisomer, das thermodynamisch günstigste Isomer, wird dargestellt.87
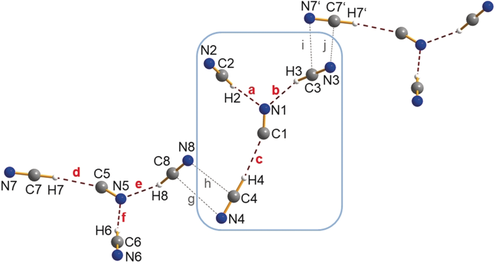
Kugel-Stab-Darstellung des [CN(HCN)3]−-Ions im Kristall von [PNP][CN(HCN)3]. Das Y-förmige Molekülanion wird durch drei Wasserstoffbrücken (a–c und d–f) gebildet. Eine Kette wird gebildet, wenn die kurzen Kontakte (g–j) berücksichtigt werden. Ein Ausschnitt einer solchen Kette wird gezeigt, wobei die Kationen aus Gründen der Übersichtlichkeit weggelassen werden. Ausgewählte Abstände in Å, Nicht-Wasserstoffatom-Abstand in den H-Brücken: N1-C2 3.082(3), N1-C3 3.074(2), C1-C4 3.148(3), N5-C6 3.082(3), N5-C8 3.083(3), C5-C7 3.141(3). a=2.15, b=2.16, c=2.20, d=2.20, e=2.16, f=2.14. Interionische Abstände: i C3-N7′ 3.477(3), j N3-C7′ 3.575(3), g C8-N4 3.504(3), h N8-C4 3.602(3).87
Beide Salze, sowohl [Ph4P][CN(HCN)2] (1) als auch [PNP][CN(HCN)3] (2), sind sehr labil, d. h. sie zersetzen sich sofort, wenn sie aus der HCN-Lösung entfernt werden. Selbst im HCN-Lösungsmittel bei −10 °C wurde eine zunehmende Zersetzung beobachtet, die schließlich zu hochviskosem, schwarzem Material führte.73, 74 Daher war es sehr schwierig, weitere analytische Daten zu erhalten. NMR-Daten in flüssiger Phase (mit reinem HCN als Lösungsmittel) bei −12 °C zeigten eine Resonanz im 13C-NMR-Spektrum für das solvatisierte [CN(HCN)n]− bei −169.2 ppm, während im 1H-NMR-Spektrum nur ein sehr breites Signal bei 4.66 ppm (Halbwertsbreite: Δν1/2=1160 Hz; vgl. 4.00 ppm mit Δν1/2=1000 Hz für HCN in CD2Cl2, Abbildungen S11–S12 in den Hintergrundinformationen) beobachtet wurde. Raman-Daten beider Salze wurden sowohl aus den für die Röntgenstrukturaufklärung verwendeten Kristallen als auch aus dem Reaktionsgemisch als HCN- (und DCN-)Lösung gewonnen. Neben experimentellen Problemen ist es aufgrund der hochdynamischen Systeme bezüglich der Wasserstoffbrückenbindung und der Position des zentralen CN−-Ions (siehe unten), sehr schwierig, aussagekräftige Spektren für die protonierten als auch für die deuterierten Systeme zu erhalten. Nur sehr schwache und breite Banden konnten für die deuterierten Spezies bei 2519 ([PPh4]+) und 2504 cm−1 ([PNP]+) (vgl. 2575 cm−1 DCN⋅⋅⋅DCN-B(C6F5)3)72 für die νC-D Streckschwingung beobachtet werden, die nicht weiter aufgelöst werden konnten.75-77 Im erwarteten Bereich bei 2081/ 2057(br) ([CN(HCN)2]−) und 2073/ 2055(br) cm−1 ([CN(HCN)3]−) befinden sich breite Banden für νCN, die zu niedrigeren Wellenzahlen durch den H/ D-Austausch verschoben werden (2071/ 1906(br) und 2070/ 1906(br) cm−1, vgl. 2097 cm−1 reines HCN, 1895 cm−1 reines DCN, beide Referenzsubstanzen bei 233 K gemessen).
Kristalle von [Ph4P][CN(HCN)2] (1) und [PNP][CN(HCN)3] (2) wurden bei −20 °C bzw. −10 °C aus einer HCN-Lösung selektiert (Hinweis: Die Entnahme der Kristalle aus flüssigem HCN muss unter einem Abzug erfolgen, da hochtoxisches HCN auch bei dieser Temperatur einen relativ hohen Dampfdruck hat). 1 kristallisierte in der monoklinen Raumgruppe C2/c mit vier Formeleinheiten pro Zelle. Wie in Abbildung 1 dargestellt, enthält die Zelle gut separierte Kationen und Anionen. Interessanterweise gibt es zwischen den nahezu linearen [CN(HCN)2]−-Anionen eine Kopf-Schwanz-Anordnung der beiden terminalen CN−-Gruppen, die zu einem 4-gliedrigen zentrosymmetrischen Dimer (N2⋅⋅⋅C2′/ C2⋅⋅⋅N2′) führt, allerdings mit ziemlich großen Abständen (d(N2⋅⋅⋅C2′)=d(C2⋅⋅⋅N2′)=3.713 Å=c). Dies könnte auf sehr schwache van-der-Waals-Wechselwirkungen zurückzuführen sein, die zur Bildung von {[CN(HCN)2]−}∞-Ketten entlang der a-Achse führen. Tatsächlich kann dieser Effekt als sekundär betrachtet werden, da die Anordnung der sperrigen Kationen der primäre Effekt zu sein scheint, der für die Größe der Hohlräume, in denen sich die Anionen befinden, verantwortlich ist. Zudem zeigten auch sämtliche Strukturstudien von HCN, dass HCN in allen seinen Phasen lineare H-gebundene Aggregate bildet.41, 78, 79 Zum Beispiel gibt es in HCN-Kristallen unendliche, parallele und lineare H-verbrückte Ketten.80 Das auffälligste Strukturmerkmal ist die Topologie der nahezu linearen [CN(HCN)2]−-Anionen. Aufgrund von Fehlordnungen können verschiedene Konnektivitäten diskutiert werden: NC-H⋅⋅⋅NC⋅⋅⋅H-CN (73 %), NC-H⋅⋅⋅NC⋅⋅⋅H-NC (12 %)/ NC-H⋅⋅⋅CN⋅⋅⋅H-NC (12 %) und CN-H⋅⋅⋅CN⋅⋅⋅H-NC (3 %), deren Häufigkeit sich in Übereinstimmung mit der berechneten relativen thermodynamischen Stabilität dieser Isomere in der Gasphase befindet (siehe Abbildung S2, Abbildung 3 und 4, Isomere LD1–LD3). Darüber hinaus konnten alle Wasserstoffatome unter Bildung eines molekularen [CN(HCN)2]−-Anions mit einem formalen zentralen CN−-Ion (C1-N1) lokalisiert werden, das über je eine CN⋅⋅⋅H-C (a, d(N1⋅⋅⋅C2)=2.95(1) Å) und eine NC⋅⋅⋅H-C Wasserstoffbrückenbindung (b, d(C1⋅⋅⋅C2)=3.32(1) Å) durch je ein HCN-Molekül endständig koordiniert ist. Ein (Nicht-Wasserstoffatom) Wasserstoffbrückenbindungsabstand von 2.95(1) Å im Vergleich zu 3.18 Å in festem HCN80 oder 3.04(3) Å in HCN⋅⋅⋅HCN-B(C6F5)372 deutet auf eine Bindung von vergleichbarer Stärke hin. Die C-H⋅⋅⋅CN-Wasserstoffbrückenbindung mit 3.32(1) Å liegt im Bereich einer mittelstarken C-H⋅⋅⋅C-Wechselwirkung81 und ist vergleichbar mit der, die in einem von Arduengo et al. berichteten Bis-Carben-Protonen-Komplex gefunden wurde (3.20(5) Å).82 Schließlich kann das Disolvation [CN(HCN)2]− auch als Monosolvation betrachtet werden (Abbildung 3), das durch eine schwache Koordination eines zweiten HCN-Moleküls weiter stabilisiert wurde.

Berechnete Isomere des Monosolvations [CN(HCN)]− mit den relativen Energien (pbe0/aug-cc-pvtz, Tabelle S5 in den Hintergrundinformationen).
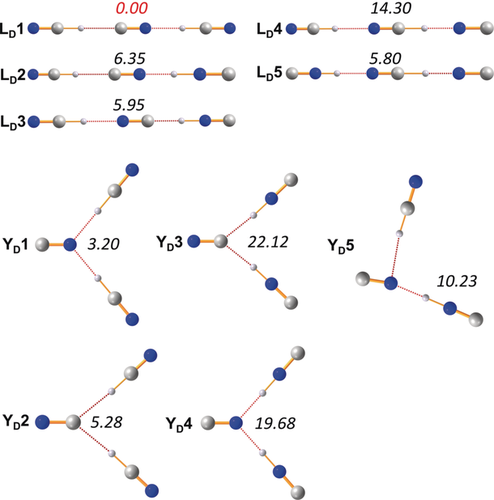
Berechnete Isomere des Disolvations [CN(HCN)2]− mit den relativen Energien (pbe0/aug-cc-pvtz, kursiv) in kcal mol−1 (Tabelle S6 in den Hintergrundinformationen).
[PNP][CN(HCN)3] (2) kristallisierte in der triklinen Raumgruppe P mit vier Formeleinheiten pro Zelle. Da die [PNP]+-Kationen deutlich größer sind als die [Ph4P]+-Ionen (0.70 vs. 0.46 nm3), werden größere Hohlräume im Kristall gebildet, die nun mit größeren wasserstoffbrücken-gebundenen, Y-förmigen [CN(HCN)3]−-Ionen besetzt sind. Erneut werden gut separierte Kationen und Anionen gefunden, jedoch zeigen die Y-förmigen, wasserstoffverbrückten Trisolvationen vier sehr schwache Kopf-Schwanz-Wechselwirkungen (i/j und g/h) auf, die zur Bildung von anionischen Strängen führen (Abbildung 2 und S4). Das [CN(HCN)3]−-Anion kann auch so aufgefasst werden, als ob es aus dem Disolvation [CN(HCN)2]− durch Anlagerung eines weiteren HCN-Moleküls (wegen des größeren Hohlraums) zum zentralen Stickstoffatom des formalen CN−-Ions gebildet worden wäre. In Übereinstimmung mit dem berechneten, thermodynamisch bevorzugten Isomer (siehe unten) hat jedes dieser Solvatanionen drei koordinierte HCN-Moleküle mit drei kovalenten C-H-Bindungen, die drei Wasserstoffbrücken bilden, zwei C-H⋅⋅⋅NC (a/b und e/f) und eine C-H⋅⋅⋅CN (c und d). Die Nicht-Wasserstoffatomabstände in den beiden C-H⋅⋅⋅NC-Wasserstoffbrücken mit 3.07(1)–3.08(1) Å sind im Vergleich zu denen im [CN(HCN)2]−-Ion etwas vergrößert, was auf die Erhöhung der Koordinationszahl am zentralen N-Atom des Cyanidion zurückzuführen ist. Interessanterweise verringerte sich der C-H⋅⋅⋅C-Abstand auf 3.14(1) Å. Im Gegensatz zur berechneten Gasphasenstruktur zeigen beide Strukturen leichte Abweichungen bezüglich der Linearität für die [CN(HCN)2]−-Ionen in 1 und den formalen [CN(HCN)3]−-Einheiten in 2 sowie von der Planarität für die [CN(HCN)3]−-Ionen, was auf sehr flache Energiepotentiale62 für kleineste Winkel- und Diederwinkeländerungen zurückzuführen ist. Erwähnenswert ist, dass für die flüssige HCN-Phase auch eine lineare Struktur mit einem Assoziationsgrad von n=3 experimentell bestimmt wurde. Darüber hinaus belegten Dichte- und Wärmekapazitätsmessungen von HCN-Gas die Anwesenheit von (HCN)n-Oligomeren, insbesondere von dimerem und trimerem (HCN)n bei 25 °C und 1 atm, die mittels Rotationsspektroskopie stets als wasserstoffgebundene lineare Spezies charakterisiert wurden.23-25, 34, 35, 41, 77-79, 83
mit vier Formeleinheiten pro Zelle. Da die [PNP]+-Kationen deutlich größer sind als die [Ph4P]+-Ionen (0.70 vs. 0.46 nm3), werden größere Hohlräume im Kristall gebildet, die nun mit größeren wasserstoffbrücken-gebundenen, Y-förmigen [CN(HCN)3]−-Ionen besetzt sind. Erneut werden gut separierte Kationen und Anionen gefunden, jedoch zeigen die Y-förmigen, wasserstoffverbrückten Trisolvationen vier sehr schwache Kopf-Schwanz-Wechselwirkungen (i/j und g/h) auf, die zur Bildung von anionischen Strängen führen (Abbildung 2 und S4). Das [CN(HCN)3]−-Anion kann auch so aufgefasst werden, als ob es aus dem Disolvation [CN(HCN)2]− durch Anlagerung eines weiteren HCN-Moleküls (wegen des größeren Hohlraums) zum zentralen Stickstoffatom des formalen CN−-Ions gebildet worden wäre. In Übereinstimmung mit dem berechneten, thermodynamisch bevorzugten Isomer (siehe unten) hat jedes dieser Solvatanionen drei koordinierte HCN-Moleküle mit drei kovalenten C-H-Bindungen, die drei Wasserstoffbrücken bilden, zwei C-H⋅⋅⋅NC (a/b und e/f) und eine C-H⋅⋅⋅CN (c und d). Die Nicht-Wasserstoffatomabstände in den beiden C-H⋅⋅⋅NC-Wasserstoffbrücken mit 3.07(1)–3.08(1) Å sind im Vergleich zu denen im [CN(HCN)2]−-Ion etwas vergrößert, was auf die Erhöhung der Koordinationszahl am zentralen N-Atom des Cyanidion zurückzuführen ist. Interessanterweise verringerte sich der C-H⋅⋅⋅C-Abstand auf 3.14(1) Å. Im Gegensatz zur berechneten Gasphasenstruktur zeigen beide Strukturen leichte Abweichungen bezüglich der Linearität für die [CN(HCN)2]−-Ionen in 1 und den formalen [CN(HCN)3]−-Einheiten in 2 sowie von der Planarität für die [CN(HCN)3]−-Ionen, was auf sehr flache Energiepotentiale62 für kleineste Winkel- und Diederwinkeländerungen zurückzuführen ist. Erwähnenswert ist, dass für die flüssige HCN-Phase auch eine lineare Struktur mit einem Assoziationsgrad von n=3 experimentell bestimmt wurde. Darüber hinaus belegten Dichte- und Wärmekapazitätsmessungen von HCN-Gas die Anwesenheit von (HCN)n-Oligomeren, insbesondere von dimerem und trimerem (HCN)n bei 25 °C und 1 atm, die mittels Rotationsspektroskopie stets als wasserstoffgebundene lineare Spezies charakterisiert wurden.23-25, 34, 35, 41, 77-79, 83
Um zusätzlich zu den thermodynamischen Daten konsistente Strukturdaten aller möglichen Isomere aus den isolierten HCN-Cyanid-Aggregaten zu erhalten, wurden DFT-(pbe0+Dispersionskorrekturen) und CCSD(T)-Berechnungen unter Verwendung eines aug-cc-pvtz-Basissatzes durchgeführt (siehe Hintergrundinformationen). Im Folgenden werden nur die Ergebnisse der DFT-Berechnungen besprochen. In Übereinstimmung mit anderen theoretischen Studien61, 62, 84-86 gibt es drei stabile lineare Isomere des Monosolvats [CN(HCN)]− (Abbildung 3). Wie in Abbildung 3 dargestellt, ist das Isomer L1 mit einer kovalenten C-H- und einer H⋅⋅⋅N-Brücke das thermodynamisch bevorzugte Isomer, jedoch ist der Energieunterschied zwischen L1 und L2 mit 0.72 kcal mol−1 eher gering. Für die Disolvatisomere (Abbildung 4) ist das lineare, C∞v-symmetrische Isomer LD1, das von der besten Monosolvatstruktur L1 abgeleitet werden kann, die thermodynamisch bevorzugte Struktur. Interessanterweise sind alle anderen linearen Strukturen deutlich weniger begünstigt (>5.8 kcal mol−1). Es wurde jedoch eine nicht-lineare, zweite Struktur als stabiles Minimum gefunden, die entweder eine C2v- oder Cs-symmetrische, wasserstoffverbrückte Y-förmige Spezies darstellt. Das beste Y-förmige Isomer (YD1) ist nur um 3.20 kcal mol−1 weniger begünstigt, was bei den Trisolvatstrukturen wichtig wird, wo eine solche Y-förmige Struktur (YT1) nun die energetisch beste Minimumstruktur unter allen (32 gefundenen) Isomeren darstellt, was in Übereinstimmung mit den erhaltenen Röntgenstrukturdaten (Abbildungen 4 und 5) steht. Die beste lineare Struktur (LT3) ist jedoch nur 1.39 kcal mol−1 weniger begünstigt. Außerdem wurde ein weiterer, nicht-planarer Strukturtyp (C) gefunden, der nur 3.65 kcal mol−1 weniger begünstigt ist (C1). Aus diesen thermodynamischen Überlegungen lassen sich zwei Dinge verallgemeinern: (i) Das energetisch bevorzugte Isomer ist immer dasjenige mit der maximalen Anzahl kovalenter NC-H-Bindungen, der größten Anzahl an C-H⋅⋅⋅N-Wasserstoffbrückenbindungen und der geringsten Anzahl an Isonitrilgruppen. (ii) Alle bevorzugten Isomere sind diejenigen, die auch in den Röntgenstrukturaufklärungen gefunden wurden. Bezüglich des Nicht-Wasserstoffatom-Abstandes der Wasserstoffbrücke sind die N-H⋅⋅⋅N-Wasserstoffbrücken in der Regel kürzer (d(N⋅⋅⋅N)=2.53–2.76 Å) als die C-H⋅⋅⋅N-Wasserstoffbrücken (d(C⋅⋅⋅N)=2.72–3.14 Å), während die C-H⋅⋅⋅C-Abstände in der Regel am längsten sind (d(C⋅⋅⋅C)=2.90–3.20 Å).
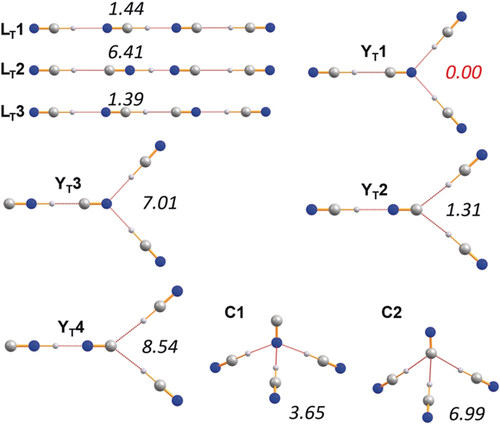
Eine Auswahl von berechneten Isomeren des Trisolvations [CN(HCN)3]− mit den relativen Energien (pbe0/aug-cc-pvtz, kursiv) in kcal mol−1. Es werden nur die Isomere aufgeführt, die ausschließlich H-CN-Bindungen enthalten, da sie immer die energetisch tiefst liegenden Isomere darstellen (Tabelle S8 in den Hintergrundinformationen).
Bereits Meot-Ner, Scheiner und Liebman61 zeigten durch Ab-initio-Berechnungen von [CN(HCN)n]−-Ionen, dass sehr flache Potentiale bei geringen Änderungen der Struktur wie Winkel und Diederwinkel sowie für die Wanderung eines Protons angenommen werden können. Wir haben das Rotationspotential des zentralen CN−-Ions in einem flexiblen (HCN)n-System (n=2, 3, siehe Abbildung S14 und S15) genauer untersucht. Die Berechnungen zeigen, dass eine 360°-Drehung mit einer Aktivierungsbarriere von 7.0 (n=2) bzw. 3.7 kcal mol−1 (n=3) verbunden ist. Das bedeutet, dass die zentralen Cyanidionen in den [CN(HCN)n]−-Aggregaten bei Raumtemperatur fast frei rotieren, was auf einen nahezu sphärischen Charakter des Anions innerhalb dieser Komplexe hindeutet und somit einer der Hauptgründe für die beobachtete Fehlordnung in der Festkörperstruktur von [Ph4P][CN(HCN)2] sein könnte. Die Berechnungen der stufenweise gebildeten HCN-Solvate [CN(HCN)n]− für n=1–3 zeigten, dass es sich bei allen Anlagerungsschritten um exotherme und exergone Prozesse handelt (Tabelle S10). Jedoch werden die Werte für ΔnH°298/ ΔnG°298 umso weniger negativ, umso größer n ist (ΔnH°298: −23.6, −18.7, und −13.0; ΔnG°298: −15.9, −11.1, und −7.0 kcal mol−1; vgl. mit massenspektroskopisch ermittelten Werten: Δ1H°298=−20.1±1.684 und −20.761 sowie Δ2H°298=−16.4 und Δ3H°298=−12.6 kcal mol−1).61
Zusammenfassend haben wir die ersten Beispiele von HCN-Cyanid-Aggregaten, [CN(HCN)n]− (n=2, 3), im festen Zustand isoliert und strukturell charakterisiert. Aufgrund der Wasserstoffbrückenbindung innerhalb der Anionen der Titelverbindungen können diese bei (teilweiser) Deprotonierung auch als Fragmente der Festkörperstruktur von HCN betrachtet werden. In Übereinstimmung mit den Berechnungen kann das lineare [CN(HCN)2]− als ein durch zwei wasserstoffgebundene HCN-Moleküle stabilisiertes Cyanidion betrachtet werden, während das Y-förmige [CN(HCN)3]− energetisch leicht gegenüber einem analogen linearen Isomer bevorzugt wird. Es gibt immer nur eine geringe Änderung bezüglich der Stabilität, wenn CN− und HCN keinen linearen Komplex bilden, was auf ein hochdynamisches System bei Raumtemperatur hinweist und durch Berechnungen der Rotationspotentiale entweder innerhalb eines linearen oder Y-förmigen HCN-Systems belegt werden konnte. Mit dieser Studie wollen wir eine Lücke in der HCN-Hauptgruppen-Pseudohalogenchemie schließen, die mit der Entdeckung des HCN vor über zwei Jahrhunderten begann.
Experimentelles
Vorsicht! HCN ist hochgiftig und kann sich unter verschiedenen Bedingungen explosionsartig zersetzen! Entsprechende Sicherheitsvorkehrungen (HCN-Detektor, Gasmaske, niedrige Temperaturen) sind zu treffen.
Acknowledgements
Die Autoren danken der Deutschen Forschungsgemeinschaft (DFG SCHU 1170/9-2), insbesondere dem Schwerpunkt-programm SPP 1708 für die finanzielle Unterstützung. Außerdem danken wir der Universität Rostock für den Zugang zum Clusterrechner und insbesondere Malte Willert für die technische Unterstützung.
Conflict of interest
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.




