Parallele homochirale und antiparallele heterochirale Wasserstoffbrücken-Interaktionsflächen in multihelikalen abiotischen Foldameren
Abstract
Eine Wasserstoffbrücken-Interaktionsfläche zwischen helikalen aromatischen Oligoamidfoldameren wurde gezielt entworfen, um die Bildung eines Helix-Turn-Helix-Motivs mit einer Kopf-zu-Schwanz-Anordnung zweier Helices unterschiedlicher Händigkeit zu ermöglichen. Dieses Design ist komplementär zu einem früheren Helix-Turn-Helix-Motiv mit einer Kopf-zu-Kopf-Anordnung zweier Helices identischer Händigkeit. Beide Motive zeigen eine vergleichbare Stabilität und führen, wenn sie miteinander kombiniert werden, zu einer unimolekularen Tetra-Helix-Anordnung, welche die bisher größte abiotische tertiäre Struktur darstellt.
Die Forschung an Foldameren hat gezeigt, dass sekundäre Strukturen wie isolierte Helices oder β-Faltblätter in einer Vielzahl von synthetischen Grundgerüsten vorkommen.1 Im Gegensatz dazu ist das Entwerfen einer tertiären Struktur eine erhebliche Herausforderung. Diese Herausforderung ist es wert weiter verfolgt zu werden, da erst mit Bildung einer tertiären Struktur komplexe Funktionen in Proteinen auftreten. Dies kann auch auf Foldamere übertragen werden. In derselben Weise, in der beeindruckende Fortschritte im Bereich des Designs von Proteinen erzielt wurden,2 wurde die Konstruktion von Bindungsflächen zwischen Peptidstrukturen, insbesondere zwischen Peptidhelixbündeln, weiter verbessert.2b, 2c, 3 Zum Beispiel wurden Helixbündel in Peptidmimetika wie β-Peptiden4 und Oligoharnstoffen nachgewiesen.5 Vor kurzem haben wir die erste abiotische tertiäre Struktur vorgestellt, in der das Grundgerüst nicht von Peptiden oder Nukleotiden abstammt.6 Es wurden stabile Helices aus wohldefinierten aromatischen Oligoamid-Bausteinen wie 8-Aminochinolincarbonsäure7 (Q in Abbildung 1) und 6-Aminomethylpyridincarbonsäure8 gebildet. In diese wurden Hydroxygruppen an bestimmten Positionen eingefügt (X und Y in Abbildung 1) um Interhelix-Wasserstoffbrücken mit Amidcarbonylgruppen zu begünstigen (Abbildung 2 a). Verschiedene Arten von Aggregationsmodi der Helixbündel, wie die Bildung von parallelen Trimeren und Dimeren sowie gegeneinander verdrehten Dimeren, wurden beobachtet.6, 9 Im Gegensatz zu biotischen tertiären Strukturen, die sich in Wasser meist durch hydrophobe Effekte bilden, werden diese Strukturen in organischen Lösungsmitteln geformt. Alle Aggregationsmodi waren homochiral, was bedeutet, dass die beteiligten Helices dieselbe Händigkeit aufweisen. Ein weiterer Fortschritt in der Bildung von tertiären Strukturen wird in erster Linie auf der Inszenierung von Interaktionen zwischen verschiedenen sekundären Strukturen basieren, was ein komplexes Unterfangen darstellt. In dieser Arbeit wird die Interaktionsfläche zwischen Helices mit gegensätzlicher Händigkeit vorgestellt. Anders als es kürzlich für heterochirale Peptidbündel10 gezeigt wurde, demonstrieren wir die Gleichwertigkeit der Interaktion einer parallelen homochiralen und einer antiparallelen heterochiralen abiotischen Helixassoziation. Zudem wird gezeigt wie diese beiden Strukturen in derselben tertiären Struktur miteinander kombiniert werden können, ohne dabei die Stereochemie in jeder Einheit beachten zu müssen, wie das bei einem Peptid der Fall wäre.

Strukturen der Einheiten Q, Qh, X, Y, T1, T2 sowie den Foldamersequenzen. X und Y sind die geschützten Vorstufen der Wasserstoffbrücken-bildenden Einheiten X und Y. Die Sequenzen sind mit “a” im geschützten und mit “b” im ungeschützten Zustand beschriftet. Die Sequenzen sind mit einer 8-Nitro-Gruppe am N-Terminus beendet: Diese Gruppe ist als Ersatz der NH-Gruppe bei N-terminalen Q-Einheiten notiert. Die T1-Einheit führt zu einer Inversion der C→N-Sequenzpolarität; Sequenzen, welche eine T1-Einheit beinhalten, besitzen zwei N-Termini. Die Pfeile zeigen das Wasserstoffbrückenmuster zwischen den Helices und deuten in Richtung des Wasserstoffbrückenakzeptors. TMSE=2-Trimethylsilylethyl.
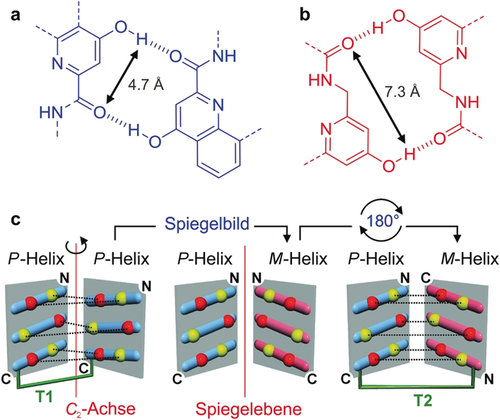
Wasserstoffbrücken der a) X- und b) Y-Einheiten. Doppelpfeile zeigen den unterschiedlichen Abstand zwischen den beiden Wasserstoffbrücken für die X- und Y-Einheiten, welche in (c) gezeigt werden. c) Helixnetz-Diagramm, welches die Wasserstoffbrücken-Interaktionsfläche zeigt. Die Anordnung von sechs Wasserstoffbrückendonoren (gelb) und -akzeptoren (rot) der X- (oben und unten) und Y-Einheiten (Mitte) sind in den sich gegenüberliegenden Ebenen angenähert. Wasserstoffbrücken sind als gestrichelte schwarze Linien gezeigt. Blaue und pinke Reihen repräsentieren die Ränder der Helices und sind je nach P- oder M-Händigkeit in andere Richtungen gekippt. Die Wasserstoffbrückenanordnung zwischen den parallelen homochiralen Helices (links) kann in eine gleichwertige Anordnung zwischen antiparallelen heterochiralen Helices (rechts) umgewandelt werden. In der mittleren spiegelsymmetrischen Struktur zeigen die Wasserstoffbrückendonoren (bzw. -akzeptoren) aufeinander und keine Wasserstoffbrücken werden gebildet: Inversion der Helix-Händigkeit oder Anordnung der Sequenzen macht eine Wasserstoffbrückenbindung unmöglich. Eine Änderung beider führt jedoch zu einem erfolgreichen Ergebnis. Die C2-Achse auf der linken Seite ist am besten in der Kristallstruktur in Abbildung 4 a zu sehen.
Es wurde gezeigt, dass die Turn-Einheit T1 (Abbildung 1) zur Bildung homochiraler paralleler Helixbündel führt, wenn sie mit den C-Termini von zwei identischen helikalen Segmenten verbunden ist. Ein Beispiel dafür ist die Sequenz 1 (Abbildung 1),6 bei der durch computerunterstützte 3D-Visualisierung ein Molekülmodell erstellt wurde. Dieses Modell ermöglichte vor allem die Anpassung der Positionen der Protonendonoren für die Bildung von Wasserstoffbrücken und führte zur Ersetzung mancher X-Einheiten durch Y-Einheiten, um sterische Abstoßungen zu vermeiden. Ein Diagramm der Helix-Helix-Interaktionsfläche zeigt, wie sich die Protonendonoren und -akzeptoren zueinander anordnen können (Abbildung 2 c, links). Dieses Diagramm zeigt ebenfalls, dass Wasserstoffbrücken gebildet werden, obwohl die Helices dieselbe Händigkeit haben: Die Neigung der Hauptkette (also die Winkel zwischen der Berührungslinie/Tangente und einer Ebene senkrecht zur Achse) sollte im Prinzip zu einem gewissen Abstand zwischen den Protonendonoren und -akzeptoren führen, wenn diese zwei Helices mit gleicher Händigkeit angeordnet sind. Jedoch sorgt das Zusammenspiel aus dem großen Helixdurchmesser und der resultierenden leichten Neigung (ca. 15°) dazu, dass die Bildung von Wasserstoffbrücken stattfindet. Eine Erweiterung dieser Beobachtung ist, dass ein antiparalleles, heterochirales Helixdimer (Abbildung 2 c, rechts) nicht nur zu einem ähnlichen Wasserstoffbrückenmuster führt, sondern auch dazu, dass die Donoren und Akzeptoren in ihrer jeweiligen Position besser zueinander passen. Dies liegt daran, dass die Berührungslinien der helikalen Ketten an der Interaktionsfläche parallel zueinander sind, was bedeutet, dass die Neigung der Reihen der Wasserstoffbrückendonoren und -akzeptoren zueinander entgegengesetzt ist (Abbildung 2 c).11 Um diese Vorhersage zu testen, wurden die T2-Einheit und die Sequenz 2 (Abbildung 1) entworfen. Es sollte darauf hingewiesen werden, dass Sequenz 2 dasselbe nonamerische Helixsegment enthält wie 1, allerdings ist eine der beiden Segmente nun mit der T2-Einheit am N-Terminus anstatt dem C-Terminus verbunden.
Die Synthese einer Fmoc-geschützten Version von T2 ist in den Hintergrundinformationen beschrieben. Für die Synthese von 2 a, und in Hinsicht auf die Vorbereitung der Synthese viel längerer Oligomere, wurde eine Festphasen-Fragmentkondensations-Methode (FSFK) entwickelt (Abbildung 3 a). Die Fragmente A und B wurden mit einer bereits beschriebenen Festphasensynthese-Methode (FPS) synthetisiert.8c, 12 Fragment A wurde danach vom Harz abgespalten, aufgereinigt und an das T2-terminierte Fragment B gekuppelt, welches sich noch auf dem Harz befand. Für die Synthese von 2 a wurden zwei identische Fragmente miteinander kondensiert. Durch eine milde, schwach saure Abspaltung vom Harz wurde das Oligomer 4 als freie Carbonsäure gewonnen, bei der die Seitenkettenschutzgruppen nicht mit abgespalten wurden. Danach wurde diese Carbonsäure in den entsprechenden Methylester 2 a umgewandelt.
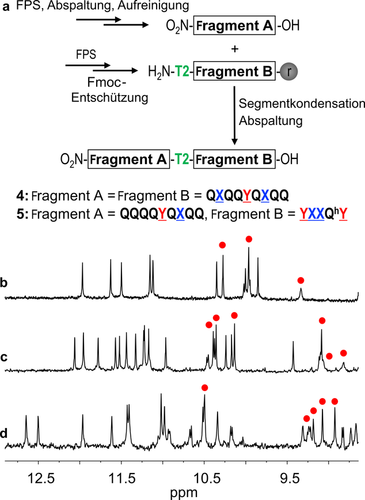
a) Schema zur Synthese der Verbindungen 4 und 5 durch Festphasensynthese-Fragmentkondensation (FSFK). Ausschnitte der 1H-NMR-Spektren (500 MHz, CDCl3), welches die NH- und OH-Signale von 19 (b), 2 b (c) und 3 b (d) zeigt. Die roten Punkte weisen auf die jeweils zugehörigen OH-Protonen hin.
Das 1H-NMR-Spektrum von 2 a zeigt zwei Signalsätze, was auf die Koexistenz von PM- und PP/MM-Konformeren in Lösung hinweist (Abbildung S1 a). Diese Beobachtung wurde bereits in der Vergangenheit mit Strukturen, die eine T1-Einheit enthalten, getätigt.6, 9 Im Gegensatz dazu zeigt die entschützte Sequenz 2 b einen Satz an scharfen NMR-Signalen, was auch für die OH-Resonanzen gilt (Abbildung 3 c). Dieses Spektrum ist ähnlich wie das von 1 (Abbildung 3 b) und weist auf eine eindeutig gefaltete Helix-Turn-Helix-Struktur hin. Eine Kristallstruktur von 2 b bestätigt die Bildung eines antiparallelen, heterochiralen Helixdimers (Abbildung 4 b). Die Ähnlichkeit der Wasserstoffbrücken-Interaktionsflächen dieser Struktur im Vergleich zu 1 ist bemerkenswert (Abbildung 4 a). Trotz der Änderung der Händigkeit und Orientierung einer der Helices, befinden sich die Protonendonoren und -akzeptoren an sehr ähnlichen Position (Abbildungen S2, S3). Die Stabilität der Wasserstoffbrücken-Interaktionsflächen wurde daraufhin durch Zugabe von [D6]DMSO in eine Lösung des Moleküls in CDCl3 untersucht. Aufgrund der Starrheit der aromatischen Helices werden Chelateffekte zwischen den mit Wasserstoffbrücken verbundenen Einheiten beobachtet, welche zu einem “Alles-oder-Nichts”-Verhalten führen: Die sechs Wasserstoffbrücken werden alle auf einmal durch eine kleine Änderung der DMSO-Konzentration unterbrochen. Bemerkenswerterweise tritt diese Umwandlung bei 1 und 2 b mit derselben Menge an DMSO auf (ca. 20 % vol/vol, Abbildungen S4–S7). Dies weist darauf hin, dass die Interaktionen zwischen den Helixbündeln durch Wasserstoffbrücken in der parallelen, homochiralen und der antiparallelen, heterochiralen Anordnung vergleichbar stabil sind.
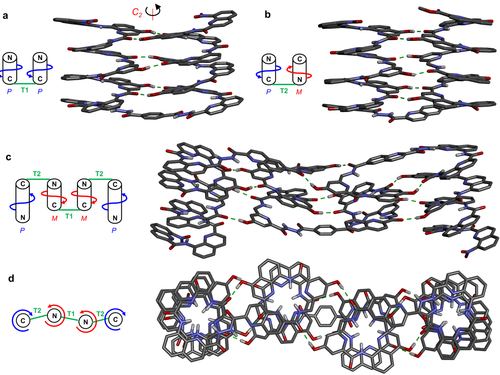
Kristallstruktur von a) 16 und b) 2 b. c) Seitenansicht und d) Oberansicht eines energetischen Minimums eines molekularen Modells von 3 b. Zeichnungen zeigen die Händigkeit der Helices, C- und N-Termini. Seitenketten von Q, Qh, T1 und T2, eingelagerte Lösungsmittelmoleküle sowie die meisten Wasserstoffatome wurden aus Gründen der Übersicht weggelassen.
Hierbei ist der Unterschied zu peptidischen helikalen Bündeln anzumerken. Eine derartige Bündelung ist bei Peptiden vor allem zwischen α-Helices derselben Händigkeit bekannt. Damit die jeweiligen Interaktionsflächen am besten zusammenpassen, winden sich diese umeinander. Studien zu heterochiralen Peptidhelixbündeln10 und vor allem die kürzlich veröffentlichten Arbeiten von Gellman et al.10a, 10b zeigen, dass die Interaktionsflächen der homochiralen und der heterochiralen Helixpeptidbündel nicht äquivalent zueinander sind. Dies trifft vor allem zu, weil die Bildung einer Helix aus zwei Einzelhelices nicht zu einer Verbesserung der Komplementarität der heterochiralen Bündel führt. Im Gegensatz dazu hindert die Starrheit der aromatischen Helices eine Spiralbildung über kurze Distanzen, und es formen sich ausschließlich parallele Anordnungen wenn diese durch Turn-Einheiten wie T1 und T2 erzeugt werden. Allerdings können aromatische Helices ihre lokale Windung leicht verändern, um die Interaktion zwischen den Helices zu verbessern: Die Helixwindung von 1 und 2 b ist grundsätzlich konstant und identisch zu den entspannten Helices, die nicht gebündelt sind.
Die Kontrolle über die Helixhändigkeit von 1 und 2 b ist relativ und nicht absolut. Sie wird nur durch die Strangorientierung über die Turn-Einheit gesteuert, sowie durch die Komplementarität der Wasserstoffbrücken. Diese wird wiederum durch die Turn-Einheit und das Zusammenpassen der Wasserstoffbrücken kontrolliert. Dies sollte prinzipiell die Kombination eines parallelen, homochiralen mit einem antiparallelen, heterochiralen Motiv in einer tertiären Struktur ermöglichen, ohne die Einflüsse der stereogenen Zentren jeder Einheit berücksichtigen zu müssen, wie es bei Peptiden der Fall wäre. Diese Theorie wurde durch das Design der Sequenz 3 b (Abbildung 1) auf die Probe gestellt. Wie in Abbildung 4 c,d dargestellt, ist zu erwarten, dass 3 b sich in eine Sequenz aus vier aufeinanderfolgenden Helices faltet. Diese Helices haben entweder eine identische oder gegensätzliche Händigkeit, je nachdem ob sie durch eine T1- oder T2-Einheit getrennt sind. Die zentralen helikalen YXXQhY-Segmente enthalten zwei unterschiedliche Wasserstoffbrücken-Interaktionsflächen, nämlich eine homochirale und eine heterochirale. Beim Entwurf von 3 b haben wir unterschiedlich lange Helices benutzt, um die Bildung einer ausgedehnten aromatischen Oberfläche zu vermeiden, welche eine Aggregation begünstigen und die Löslichkeit verringern könnte. Aus ähnlichem Grund wurden Qh-Einheiten mit einer längeren, verzweigten Alkylseitenkette zur Sequenz hinzugefügt, um die Löslichkeit zu erhöhen (Abbildung 1). Das Oligomer 3 a wurde durch eine Kombination aus FSFK (Abbildung 3 a) und einer finalen Kupplung von T1 mit 5 in Lösung synthetisiert. Das 1H-NMR-Spektrum der geschützten Sequenz 3 a war aufgrund der Anwesenheit von einer Vielzahl an Einheiten (Abbildung S1 b) und der dadurch entstandenen unterschiedlichen konformationsbasierten Stereoisomere (PMMP, PMMM, MMMM, PMPM, PMPP, MMPP und deren Enantiomere) komplex. Nach der Abspaltung der Seitenkettenschutzgruppen entstand ein scharfes Spektrum mit nur einem Signalsatz für 3 b (Abbildung 3 d). Obwohl keine eindeutige Strukturaufklärung in Lösung oder im festen Zustand möglich war, weisen diese Beobachtungen darauf hin, dass 3 b in Lösung als eine wohldefinierte, gefaltete Struktur vorliegt.
Zusammenfassend haben wir eine neue wohldefinierte, abiotische Helix-Helix-Wasserstoffbrücken-Interaktionsfläche präsentiert. Wir haben gezeigt, dass tertiäre Strukturen entworfen werden können, welche aus unterschiedlichen Interaktionsflächen zusammengesetzt sind. Das Resultat sind vorhersehbare Helix-Turn-Helix-Strukturen mit Helices unterschiedlicher Händigkeit und Orientierung – eine Anordnung, welche bei einfachen Peptiden schwierig zu erreichen ist. Wir arbeiten aktuell, zur Erweiterung dieses Prinzips, an Interaktionsflächen zwischen gegeneinander verdrehten, also nicht-parallelen, Helix-Multimeren und werden unseren Fortschritt zu gegebener Zeit berichten.
Acknowledgements
Diese Arbeit wurde vom European Reserach Council unter dem Seventh Framework Programme (Grant Agreement No. ERC-2012-AdG-320892) der Europäischen Union finanziert. Wir danken der biophysikalischen und strukturchemischen Abteilung am IECB, CNRS UMS3033, INSERM US001, Université de Bordeaux sowie Dr. B. Kauffmann (IECB) für die Hilfe bei der Sammlung der Röntgenstrukturdaten und F. Menke für NMR-Messungen.
Conflict of interest
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.




