Effiziente organokatalytische Dehydrierung von Amminboran
Abstract
Wir berichten die effiziente Dehydrierung von Amminboran durch sterisch anspruchsvolle Pyridone als Organokatalysatoren. Mit 6-tert-Butylthiopyridon wurde eine Wechselzahl (Turnover Frequency, TOF) von 88 h−1 erreicht. Experimentelle mechanistische Untersuchungen, gestützt durch DLPNO-CCSD(T) Rechnungen, deuten auf eine Protonierung der B-H-Bindungen durch den in der Mercaptopyridinform vorliegenden Katalysator als ersten Schritt des Katalysezyklus hin. Das durch diese initiale Protonierung gebildete Intermediat wurde NMR-spektroskopisch detektiert und die Molekülstruktur einer Surrogat-Verbindung mittels Einkristall-Röntgendiffraktometrie ermittelt. Ein intramolekularer Protonentransfer von der NH3-Gruppe zu dem Pyridinring in diesem Intermediat und das gleichzeitige Brechen der S-B-Bindung regeneriert das Thiopyridon und schließt somit einen katalytischen Zyklus. Dieser Schritt kann als eine anorganische Retro-En-Reaktion beschrieben werden.
Die kontrollierte Freisetzung von Wasserstoff aus Amminboran (AB), das einen H2-Gehalt von 19.7 Gew.-% aufweist, ist in Anbetracht einer möglichen Nutzung von AB als Wasserstoffspeichermaterial interessant.1 Zahlreiche Übergangsmetalle katalysieren die Dehydrierung von AB effizient.2 Zu den wirksamsten Katalysatoren zählen Nickel-Carbenkomplexe sowie Edelmetallkomplexe mit Pinzetten-Phosphinliganden, doch auch Eisen-Pinzettenkomplexe wurden erfolgreich eingesetzt.3, 4, 5 Nachdem Wegner und Mitarbeiter zeigen konnten, dass diese Reaktion auch durch bidentate Lewissäuren katalysiert wird, wurde der Dehydrierung von AB durch Hauptgruppenverbindungen große Aufmerksamkeit geschenkt.6, 7 Slootweg und Uhl berichteten über die stöchiometrische Dehydrierung von AB und die katalytische Dehydrierung von Dimethylamminboran (DMAB) durch ein Phosphin/Aluminium-basiertes frustriertes Lewis Paar (FLP).8 Aldridge et al. konnten zeigen, dass deren Xanthen-basiertes FLP die Dehydrierung von AB katalysiert und fanden Hinweise auf einen Kettenwachstumsmechanismus.9 Die beobachtete Wechselzahl (Turnover Frequency, TOF) von 4 h−1 ist im Vergleich zu den übergangsmetallkatalysierten Reaktionen jedoch gering. Anfang 2018 wurde dieses Forschungsgebiet durch den Bericht weiter vorangetrieben, dass ein strukturell rigides Phosphin-Boran FLP eine hohe Aktivität für die Dehydrierung von DMAB aufweist. Dieses FLP zeigte jedoch in der Dehydrierung von AB nur eine geringe Aktivität.10 Für praktische Anwendungen ist ein effektiver und leicht zugänglicher Organokatalysator wünschenswert. Dixon und seine Mitarbeiter konnten zeigen, dass starke Brønsted-Säuren die Dehydrierung von AB, vermutlich durch eine Protonierung der hydridischen B-H Gruppe, initiieren.11 Wir nahmen daher an, dass eine organische Verbindung, die sowohl eine acide, als auch eine basische Funktionalität aufweist, die Dehydrierung von AB durch eine Protonierung der BH3-Gruppe und eine Deprotonierung der NH3-Gruppe katalysieren könnte (Schema 1).
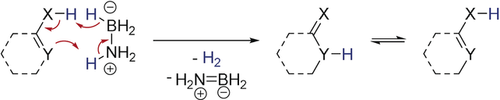
Die Arbeitshypothese dieses Forschungsprojekts: Die Dehydrierung von AB durch eine, von einem Organokatalysator vermittelte, simultane Protonierung und Deprotonierung.
Um einen katalytischen Zyklus zu schließen, muss der Organokatalysator weiterhin in der Lage sein, in seine ursprüngliche Form zurückzukehren. 2-Hydroxypyridin erfüllt die Kriterien der Bifunktionalität mit einer aciden OH-Gruppe und einem basischen Pyridinring. Des Weiteren sind 2-Hydroxypyridin und dessen Tautomer 2-Pyridon nahezu isoenergetisch. Aus diesen Gründen vermuteten wir, dass sich 2-Pyridon 1 als möglicher Katalysator für die Dehydrierung von AB eignen könnte. Zusätzlich wurden das sterisch anspruchsvollere 6-tert-Butyl-2-pyridon 2 und die saureren Thiopyridone 3 und 4 als Katalysatoren getestet.12 Die katalytischen Dehydrierungen von AB wurden mit 1 mol % des entsprechenden Organokatalysators in refluxierendem THF durchgeführt (Schema 2). Die Ergebnisse sind in Tabelle 1 zusammengefasst.
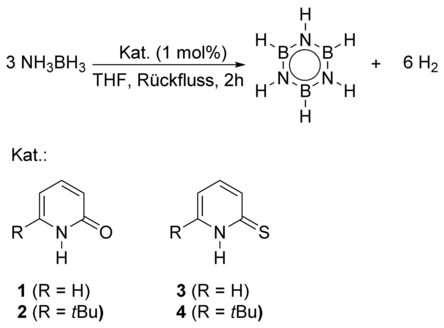
Dehydrierung von AB durch verschiedene Pyridinderivate.
Katalysator |
Äquivalente H2[a] |
Wechselzahl [h−1][b] |
Umsatz AB [%][c] |
|---|---|---|---|
1 |
0.06 |
3.2 |
13 |
2 |
0.62 |
30.8 |
28 |
3 |
0.10 |
4.8 |
17 |
4 |
1.76 |
88.0 |
99 |
- [a] Basierend auf der volumetrischen Bestimmung von H2. [b] Berechnet aus [H2]⋅[Kat.]−1 h−1. [c] Bestimmt mittels 11B-NMR-Spektroskopie unter Verwendung einer Ausgleichsgeraden des AB Signal/Integral-Verhältnis.
Das Pyridon-Stammsystem 1 zeigt nur geringe katalytische Aktivität. Bei Einsatz von 1 mol % des sterisch anspruchsvolleren 6-tert-Butyl-2-pyridon 2 werden innerhalb von zwei Stunden 0.6 Äquivalente H2 aus AB abgespalten. Dies entspricht einer Wechselzahl von 31 h−1. Als Hauptprodukt entsteht Borazin, was durch 11B-NMR-Spektroskopie gezeigt werden konnte. Thiopyridon 3 ist weniger aktiv als 2, zeigt jedoch eine leicht höhere Aktivität als das Stammsystem 1. Das deutet darauf hin, dass die Kombination von erhöhter Acidität und sterischem Anspruch die Aktivität eines Katalysators erhöhen sollte. Tatsächlich werden beim Einsatz von 1 mol % 6-tert-Butyl-2-thiopyridon 4 als Katalysator innerhalb von zwei Stunden 1.8 Äquivalente H2 aus Amminboran freigesetzt. Dies entspricht einer Wechselzahl von 88 h−1 und ist unseres Wissens die bisher höchste berichtete Aktivität in der Dehydrierung von Amminboran durch einen metallfreien Katalysator. Untersuchungen der Reaktionslösung zeigen, dass AB vollständig zu Borazin und Polyborazylen umgesetzt wurde.
Bei 120 °C in Toluol konnte DMAB durch 1 mol % 4 als Katalysator innerhalb von 4 h effizient dehydriert werden (Schema 3), was die chemische Robustheit von 4 unter harscheren Reaktionsbedingungen zeigt.
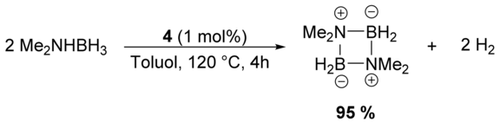
Durch 4 katalysierte Dehydrierung von DMAB.
Mit diesen unerwarteten Ergebnissen wandten wir uns einer mechanistischen Untersuchung der durch 4 katalysierten Freisetzung von H2 aus AB zu. Um zu verifizieren, dass 4 nicht als Brønsted-Säure fungiert und die Dehydrierung von AB nicht durch eine, zu einem Kettenwachstumsmechanismus führende, Protonierung von AB initiiert wird, testeten wir die Dehydrierung von AB mit 1 mol % Thiophenol, das acider als Thiopyridon ist. Bei dieser Reaktion entsteht B-(Cyclotriborazanyl)-aminboran als Hauptprodukt (Schema 4).
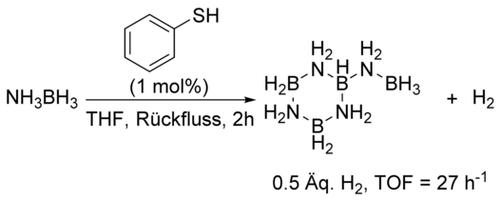
Versuchte Dehydrierung von AB durch Thiophenol. Formalladungen auf Stickstoff und Bor wurden der Übersichtlichkeit wegen ausgelassen.
Die beobachtete Wechselzahl von 27 h−1 ist signifikant niedriger, als die mit Katalysator 4 beobachtete. Dieses Ergebnis unterstreicht die Bedeutung der Bifunktionalität, also das Vorliegen des basischen Pyridinrings, für die Aktivität des Katalysators. Es ist naheliegend, die höhere katalytische Aktivität der tert-Butyl Derivate 2 und 4 der Destabilisierung der entsprechenden Dimere zuzusprechen. Die Synthese von 4 ist literaturbekannt, jedoch wurde bisher keine Molekülstruktur mittels Röntgendiffraktometrie ermittelt.13 Geeignete Einkristalle für die Röntgenstrukturanalyse konnten im Rahmen dieses Projekts erhalten werden.14 Die aus dieser Untersuchung erhaltene Molekülstruktur zeigt, dass 4 als Dimer 42 vorliegt (Abbildung 1). Der N-H⋅⋅⋅S Abstand ist im Vergleich zum C2h symmetrischen Dimer von 3 mit 3.46 Å um 0.17 Å elongiert.15
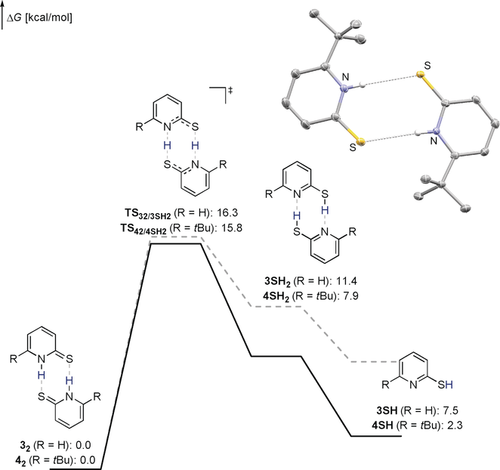
Freie Enthalpie der Bildung von 4SH und 3SH berechnet auf TightPNO-DLPNO-CCSD(T)/def2-QZVPP//PBE0-D3(BJ)/def2-TZVP Niveau. Lösungsmitteleffekte wurden implizit mit dem SMD Modell für THF berücksichtigt. Die aus der Röntgendiffraktometrie erhaltene Struktur von 42 (50 % Wahrscheinlichkeitsellipsoides, alle kohlenstoffgebundene Wasserstoffatome wurden zur besseren Übersicht ausgelassen) ist gezeigt. Ausgewählte Bindungslängen und -winkel: N(H)⋅⋅⋅S: 3.46 Å, C-S: 1.70 Å, N-H⋅⋅⋅S: 173.2°.16
Die Bildung des angenommenen aktiven Katalysators 4SH wurde weiter computerchemisch auf SMD(THF)- TightPNO-DLPNO-CCSD(T)/def2-QZVPP//PBE0-D3(BJ)/def2-TZVP Niveau untersucht (Abbildung 2).17, 18 Die Tautomerisierung von 42 benötigt eine freie Aktivierungsenthalpie von 15.8 kcal mol−1. Die Bildung von 4SH ist ausgehend von 42 leicht endergon. Die Bildung von 3SH ausgehend von 32 ist im Vergleich thermodynamisch um 5.2 kcal mol−1 benachteiligt. Dieses Ergebnis deutet darauf hin, dass eine Destabilisierung des Grundzustands 42 zur höheren Aktivität von 4 beiträgt.
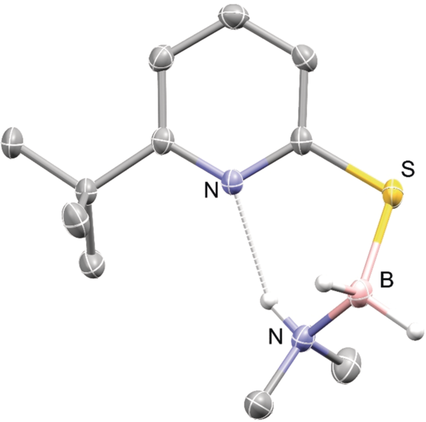
Durch Röntgendiffraktometrie ermittelte Molekülstruktur von 5Me2 (50 % Wahrscheinlichkeitsellipsoide, alle kohlenstoffgebundenen Wasserstoffatome wurden zur besseren Übersicht ausgelassen). Ausgewählte Bindungslängen und -winkel: N(H)⋅⋅⋅N: 2.8777(16) Å, B-S: 1.9107(18) Å, C-S-B: 102.61(7)°.
Anschließend wandten wir uns dem Nachweis potentieller reaktiver Intermediate zu. Bei der NMR-spektroskopischen Beobachtung einer stöchiometrischen Reaktion von 4 mit AB bei 60 °C konnten wir die Bildung eines Mercaptopyridin-Boran-Komplexes 5 innerhalb von 5 h beobachten. Die NH3 Gruppe von 5 zeigt im 1H-NMR-Spektrum ein koaleszierendes Signal bei 5.48 ppm, während die BH2 Gruppe ein Signal bei 2.62 ppm zeigt, das zu zwei integriert. Das 11B-NMR-Spektrum zeigt ein Triplett bei −13.3 ppm, eine typische Verschiebung für ein tetrakoordiniertes Boran.19 Des Weiteren konnte durch NOSY-NMR-Spektroskopie ein NOE-Kontakt zwischen der NH3 und der tert-Butylgruppe des Thiopyridons beobachtet werden, was die räumliche Nähe dieser beiden Gruppen zeigt. Die Versuche 5 aus der Reaktionslösung zu isolieren waren nicht erfolgreich, jedoch konnte ein stabiles Surrogat aus der Reaktion von 4 mit DMAB erhalten werden. Die röntgendiffraktometrische Analyse der Molekülstruktur von 5Me2 unterstützt die 5 zugewiesene Struktur (Abbildung 2). Die Struktur zeigt eine kurze N(H)⋅⋅⋅N Wasserstoffbrücke und unterstützt somit die Hypothese eines intramolekularen Protontransfers zum Pyridinring als nächsten Elementarschritt.
Es ist anzunehmen, dass 5 das Produkt einer dehydrogenativen Kupplung zwischen der Mercaptopyridinform von 4 und AB ist. Dies impliziert, dass die Dehydrierung von AB mit dieser dehydrogenativen Kupplung beginnt, welche das erste Äquivalent H2 freisetzt und 5 bildet.
Bei Verwendung von NH3BD3 als Substrat in der katalytischen Reaktion konnte ein kinetischer Isotopeneffekt (KIE) von 1.20±0.15 bestimmt werden. Dies ist in Übereinstimmung mit der berechneten Übergangszustandsstruktur: Während die S-H-Bindung gebrochen ist, ist die B-H-Bindung nur leicht verzerrt (Abbildung 3).20 Der berechnete KIE der dehydrogenativen Kupplung stimmt mit 1.01 sehr gut mit dem experimentellen Beobachtungen überein.21 In der Übergangszustandsstruktur wird ein zweites AB Molekül für die Stabilisierung der partiell negativen Ladung auf dem Thiolat benötigt. Bei längerem Erhitzen einer Reaktionslösung von 5 konnte die Bildung von Borazin und die Regeneration von 4 beobachtet werden (Schema 5). Die Reaktivität von 5 wurde weiter computerchemisch untersucht (Abbildung 4).
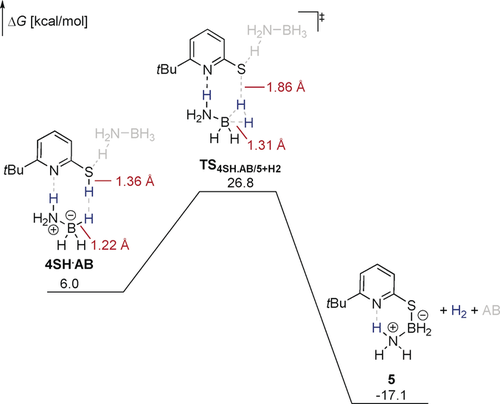
Freie Enthalpien der dehydrogenativen Kupplung zwischen 4 und AB berechnet auf TightPNO-DLPNO-CCSD(T)/def2-QZVPP//PBE0-D3(BJ)/def2-TZVP Niveau. Alle freien Enthalpien sind in Relation zu 42 und AB2 angegeben. Lösungsmitteleffekte wurden implizit mit dem SMD Modell für THF berücksichtigt. Formalladungen an Stickstoff und Bor in der Übergangszustandsstruktur sind der Übersicht wegen nicht gezeigt.
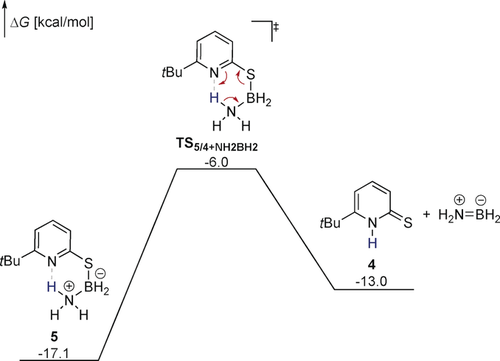
Freie Enthalpien der Freisetzung von NH2BH2 aus 5 berechnet auf TightPNO-DLPNO-CCSD(T)/def2-QZVPP//PBE0-D3(BJ)/def2-TZVP Niveau. Alle Freien Enthalpien sind in Relation zu 42 und AB2 angegeben. Lösungsmitteleffekte wurden implizit mit dem SMD Modell für THF berücksichtigt. Formalladungen an Stickstoff und Bor in der Übergangszustandsstruktur sind der Übersicht wegen nicht gezeigt.
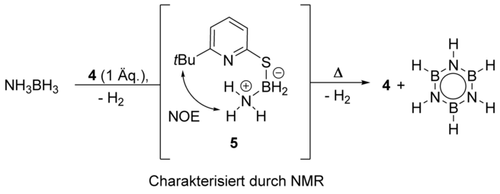
Bei der stöchiometrischen Reaktion von 4 mit AB mittels NMR-Spektroskopie beobachtetes Intermediat 5. Reaktionsbedingungen: [D8]THF, 60 °C.
Ein Protonentransfer von der NH3-Gruppe zum Pyridinring und dem damit einhergehenden Bruch der S-B-Bindung benötigt eine freie Aktivierungsenthalpie von 11.0 kcal mol−1. Das deutet darauf hin, dass 5 bei 60 °C nicht inert ist.22 Verglichen mit 4 und NH2BH2, die als Produkte im nächsten Elementarschritt entstehen, ist 5 jedoch thermodynamisch stabil. Dies ermöglicht die Beobachtung von 5 in einer stöchiometrischen Reaktion von 4 mit AB. Über längere Reaktionszeiten reagiert 5 zu 4 und Borazin, was der Reaktion thermodynamische Triebkraft verleiht und sie exergon werden lässt (Schema 5).23 Hierbei sollte angemerkt werden, dass die Reaktion aufgrund der Reorganisation der π-Elektronendichte und der Freisetzung von NH2BH2 als anorganische Retro-En-Reaktion beschrieben werden kann.
Die stöchiometrische Reaktion von 4 mit ND3BH3 liefert zusätzliche Hinweise darauf, dass die Retro-En-Reaktion Teil des katalytischen Zyklus ist. Dabei werden bei erhöhten Temperaturen die Bildung von Borazin und der Einbau von Deuterium in 4 beobachtet (Schema 6).
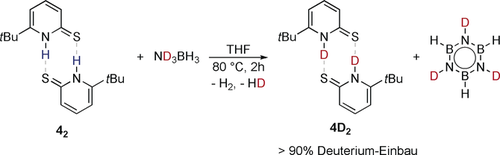
Deuterium-Einbau in 4 bei der Reaktion mit ND3BH3.
Bei der Verwendung von ND3BH3 als Substrat in der katalytischen Dehydrierung konnte ein ausgeprägter KIE von 2.4±0.3 bestimmt werden. Unter Berücksichtigung der geringen kinetischen Barriere der Retro-En-Reaktion kommt der KIE vermutlich durch den Deuterium-Einbau in 4 und die Bildung von 4SD in den folgenden Katalysezyklen zustande. Der berechnete KIE der dehydrogenativen Kupplung (Abbildung 3) ausgehend von deuteriertem 4SD und ND3BH3 beträgt 3.2, was gut mit den experimentell beobachteten Werten übereinstimmt. Basierend auf den experimentellen und computerchemischen Untersuchungen schlagen wir folgenden Mechanismus für die Dehydrierung von AB mit 4 vor: Der Katalysezyklus beginnt mit der Tautomerisierung von 4 zur Mercaptopyridinform 4SH, vermutlich über das entsprechende Dimer (Schema 7). Die dehydrogenative Kupplung von AB mit monomeren 4SH bildet den Boran-Komplex 5. Die Freisetzung von NH2BH2 regeneriert 4, das dimerisiert und den Katalysezyklus schließt. Die Beteiligung einer säurevermittelten Dehydrierung von AB über einen Kettenwachstumsmechanismus, initiiert durch 4, kann jedoch nicht ausgeschlossen werden.

Vorgeschlagener Mechanismus der durch 4 katalysierten Dehydrierung von AB.
Zusammenfassend berichten wir die durch 6-tert-Butyl-2-thiopyridon effizient katalysierte H2-Freisetzung aus AB. Die mechanistischen Untersuchungen heben die Wichtigkeit der Bifunktionalität von Thiopyridon für die katalytische Aktivität hervor. Die tert-Butylgruppe begünstigt die Monomerisierung von 4. Die Ergebnisse sollen weitere Forschung für die Entwicklung effizienter Organokatalysatoren für die H2-Speicherung anregen.24
Acknowledgements
Diese Arbeit wurde durch den Fonds der Chemischen Industrie und die DFG unterstützt. Die Autoren danken Dr. H. Hausmann und T. Müller für die Unterstützung mit NMR-Experimenten, Dr. S. Heiles für die Analyse mittels Nano-ESI-MS und Dr. D. Gerbig für die IR-Messungen und ergiebigen wissenschaftlichen Gesprächen sowie den Professoren P. R. Schreiner, R. Göttlich und H. A. Wegner für die großzügige Unterstützung des Forschungsprojekts.
Conflict of interest
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.




