Elektrochemische Oxidation von Lithiumcarbonat generiert Singulett-Sauerstoff
Abstract
Feste Alkalicarbonate sind universelle Bestandteile von Passivierungsschichten an Materialien für Interkalationsbatterien, übliche Nebenprodukte in Metall-O2-Batterien, und es wird angenommen, dass sie sich reversibel in Metall-O2 /CO2-Zellen bilden und zersetzen. In all diesen Kathoden zersetzt sich Li2CO3 zu CO2, sobald es Spannungen >3.8 V vs. Li/Li+ ausgesetzt wird. Beachtenswert ist, dass keine O2-Entwicklung detektiert wird, wie gemäß der Zersetzungsreaktion 2 Li2CO3 → 4 Li+ + 4 e− + 2 CO2 + O2 zu erwarten wäre. Deswegen war der Verbleib eines der O-Atome ungeklärt und wurde nicht identifizierten parasitären Reaktionen zugerechnet. Hier zeigen wir, dass hochreaktiver Singulett-Sauerstoff (1O2) bei der Oxidation von Li2CO3 in einem aprotischen Elektrolyten gebildet und daher nicht als O2 freigesetzt wird. Diese Ergebnisse haben weitreichende Auswirkungen auf die langfristige Zyklisierbarkeit von Batterien: sie untermauern die Wichtigkeit, 1O2 in Metall-O2-Batterien zu verhindern, stellen die Möglichkeit einer reversiblen Metall-O2 /CO2-Batterie basierend auf einem Carbonat-Entladeprodukt in Frage und helfen, Grenzflächenreaktivität von Übergangsmetallkathoden mit Li2CO3-Resten zu erklären.
In Lithium-basierten Batterien ist die Energiespeicherung durch die Kathode limitiert, weshalb intensive Forschung unternommen wird, um die Kathodenkapazität und/oder Spannung zu erhöhen.1 Die Möglichkeiten umfassen Li-stöchiometrische2 und Li-reiche3 Übergangsmetalloxid(ÜMO)-Interkalationskathoden, mit höherer Spannung und Kapazität als momentan verwendete Kathoden und Metall-O2- oder Metall-O2/CO2-Kathoden1, 4 mit niedrigerer Spannung, aber wesentlich höherer theoretischer Kapazität. Um Hochspannungs-ÜMO einsetzbar zu machen ist es erforderlich, deren reversibles Potentialfenster zu erweitern, indem man die Hochspannungsinstabilitäten von Interkalationsmaterialien und Elektrolyten zu verstehen lernt.1 Eine lange Reihe gegenwärtiger Arbeiten hat eine enge gegenseitige Abhängigkeit von Elektrolytzersetzung, Bildung/Zersetzung von Oberflächenspezies und der Umwandlung von ÜMO-Bulk und Oberflächen gezeigt.2d, 3d, 5 Insbesondere wurde kürzlich herausgefunden, dass die Gasabgabe von CO2 während des ersten Zyklus in Li-Ionen-Batterien größtenteils von verbleibendem Li2CO3 bestimmt wird, das wiederum die O2-Freisetzung aus dem ÜMO-Kristallgitter beeinflusst.5b In Li-O2-Batterien ist Li2CO3 ein unerwünschtes parasitäres Nebenprodukt, das die Wiederaufladbarkeit beeinträchtigt, während des Entlade- und Ladevorgangs akkumuliert wird und daher schlechte Energieeffizienz und Lebensdauer bewirkt.1, 4a–4f Der Nachteil der Lithiumcarbonat-Bildung konnte scheinbar in wiederaufladbaren Metall-O2/CO2-Batterien nutzbar gemacht werden, da beobachtet wurde, dass Li2CO3 elektrochemisch zersetzt werden kann.4f–4j, 6
Bisherige Erklärungen haben die Bildung von Superoxid-Radikalen oder “naszierendem Sauerstoff” vorgeschlagen, die mit Zellkomponenten in einem C-involvierenden Reaktionsweg,4f, 6 reagieren könnten, allerdings ohne definitiven Beweis für diese Mechanismen. Hier erbringen wir den überzeugenden Beweis, dass die elektrochemische Oxidation von Li2CO3 hochreaktiven Singulett-Sauerstoff bildet, der das Fehlen von O2-Entwicklung, durch parasitäre Reaktionen von Singulett-Sauerstoff mit Batteriekomponenten erklärt. In Anbetracht seiner außergewöhnlichen Reaktivität hat die 1O2-Bildung weitgreifende Folgen für die Oberflächenreaktivität von ÜMO-Kathoden und auf gekoppelte, parasitäre Reaktionen während des Ladens von Metall-O2- und Metall-O2/CO2-Batterien.
1O2 kann mittels chemischer Sonden detektiert werden, die spezifisch mit 1O2 reagieren und spektroskopisch durch das Verschwinden der Sonde und/oder das Erscheinen des Addukts gemessen werden können. Bekannte Sonden umfassen Fluorophore oder Spin-Fallen, die durch Fluoreszenz Ein-/Ausschaltung oder EPR-Spektroskopie detektiert werden können.7 Allerdings sind diese Sonden typischerweise elektrochemisch nicht stabil oberhalb von 3.5–3.7 V vs. Li/Li+ und ermöglichen daher nicht den Zugang zum relevanten Spannungsbereich der Li2CO3-Oxidation über 3.8 V. Zuvor wurde gezeigt, dass 9,10-Dimethylanthracen (DMA) diese Bedingungen erfüllt: es bildet schnell sein Endoperoxid (DMA-O2) in Gegenwart von 1O2; sowohl DMA als auch DMA-O2 sind elektrochemisch stabil über 4 V hinaus (Abbildung S1); und DMA ist auch stabil gegen Superoxid – einer weiteren möglichen reaktiven Sauerstoffspezies. Sprich, die Exposition von DMA mit Superoxid führt nicht zur Bildung von DMA-O2, das sonst fälschlicherweise der Gegenwart von 1O2 zugewiesen werden könnte.8 Um zusätzlich zu bestätigen, dass DMA-O2 nur mit 1O2, aber nicht mit anderen möglichen reaktiven O-haltigen Spezies gebildet wird, haben wir separat einen DMA-haltigen Elektrolyten Li2CO3, O2, CO2 und Li2O2 ausgesetzt. Die Bildung von DMA-O2 wurde nicht beobachtet (Abbildung S2). Gleiches gilt für DMA, das Li2O2 und CO2 ausgesetzt wurde, was zur Bildung von Peroxodicarbonat, einem möglichen Intermediat der Li2CO3-Oxidation, führt.9 Zusammenfassend bestätigen diese Ergebnisse, dass die DMA-zu-DMA-O2-Umsetzung eine sensitive und selektive Methode ist, um 1O2 in der Zelle zu detektieren.
Um zu untersuchen, ob 1O2 während der Oxidation von Li2CO3 gebildet wird, haben wir elektrochemische Zellen mit Li2CO3-gepackten Arbeitselektroden, wie im Methodenteil in den Hintergrundinformationen beschrieben, betrieben. Li2CO3 wurde gemeinsam mit Kohlenstoff gemahlen, um engen Kontakt zwischen den Beiden zu gewährleisten. Das resultierende Pulver wurde verwendet, um Kompositelektroden mit PTFE-Binder herzustellen. Um spezifisch die Reaktion an der Arbeitselektrode zu untersuchen und unerwünschte Reaktionen des Elektrolyten mit einer Li-Metall-Anode auszuschließen, haben wir Li1−xFePO4 (E°=3.45 V vs. Li/Li+) als Gegen- und Referenzelektrode verwendet. Zuerst haben wir das Startpotential der Li2CO3-Oxidation festgestellt, indem wir eine Messung mit linearem Potentialvorschub in einem online elektrochemischen Massenspektrometrie(OEMS)-Aufbau verfolgten, um die Freisetzung von Gasen zu detektieren. Abbildung 1 zeigt CO2-, O2-, CO- und H2-Entwicklung im Vergleich zur Elektronenverbrauchsrate. CO2-Entwicklung startet bei ≈3.8 V und erreicht bei höheren Spannungen ein Verhältnis von ≈2 e−/CO2. Man beachte, dass der kapazitive Strom zur anfänglichen Elektronenverbrauchsrate oberhalb der Leerlaufspannung (OCV) beiträgt und verursacht, dass die Elektronenverbrauchsrate immer geringfügig höher ist als die CO2-Entwicklungsrate. Das Einsetzen der CO2-Entwicklung bei 3.8 V ist in Übereinstimmung mit dem Gleichgewichtspotential von Reaktion 1 (E°=3.82 V vs. Li/Li+).4c, 6 Im Einklang mit zahlreichen Studien wurde im Verlauf des Ladens kein O2 detektiert.4c,4g,4h, 5b H2- und CO-Entwicklung werden über 4.2 V während des anodischen Vorschubs der Li2CO3-gepackten Elektroden beobachtet, aber keine Gasentwicklung bis zu 4.5 V von den blanken Kohlenstoffelektroden (Abbildung S3). Die Abwesenheit von CO2 bei Ladung einer blanken Elektrode beweist die Li2CO3-Oxidation in Abbildung 1 als CO2-Quelle. Der Vergleich der Referenzmessung mit der Li2CO3-gepackten Elektrode deutet auch darauf hin, dass die H2-Entwicklung, beobachtet in Abbildung 1, von einer parasitären Elektrolytzersetzungsreaktion, induziert von der Li2CO3-Oxidation herrühren muss, da der Elektrolyt in Li2CO3-freien Elektroden bis zumindest 4.5 V stabil erscheint.
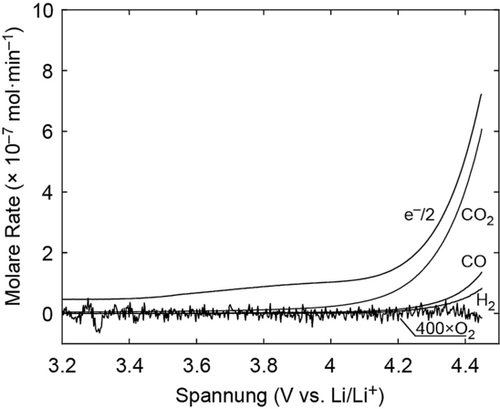
CO2-, O2-, CO- und H2-Entwicklung von der Kohlenstoff/Li2CO3/PTFE (9:1:1, m:m)-Kompositelektrode während eines linearen Potentialvorschubes mit 0.14 mV s−1 in 0.1 m LiTFSI in TEGDME in Ar-Atmosphäre.
Um zu untersuchen, ob hochreaktiver Singulett-Sauerstoff gebildet wird und damit die Abwesenheit von O2-Freisetzung erklärt werden kann, haben wir Zellen mit denselben Li2CO3-Arbeitselektroden mit 0.1 m LiTFSI in Dimethoxyethan (DME) mit zusätzlich 30 mm DMA als Elektrolyten gebaut. Die Zellen wurden bei verschiedenen Ladepotentialen gehalten bis eine Kapazität von 0.064 mAh erreicht wurde. Der Elektrolyt wurde dann extrahiert und mittels HPLC und 1H-NMR-Spektrokopie analysiert (Abbildung 2).
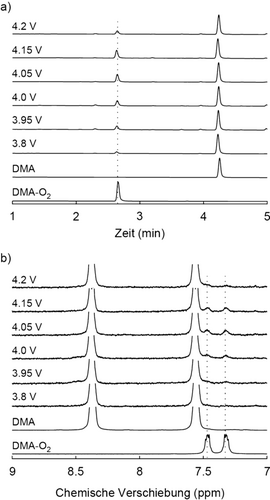
a) HPLC-Analyse des Elektrolyten nach der Polarisation von Kohlenstoff/Li2CO3/PTFE (9:1:1 m:m)-Kompositelektroden bei dem angegebenen Potentialen bis zu einer Kapazität von 0.064 mAh in 0.1 m LiTFSI in DME-Elektrolyten, der 30 mm DMA enthielt. 1HNMR-Spektroskopie bestätigt, dass DMA-O2 bei einer Retentionszeit von 2.6 min eluiert (Abbildung S2, S5). b) 1H-NMR-Spektren derselben Elektrolytproben. Die Referenzmessungen zeigen den ursprünglichen Elektrolyten (bezeichnet als DMA) und den Elektrolyten bei dem DMA vollständig zu DMA-O2 durch in situ photogenerierten 1O2 (gekennzeichnet als DMA-O2), wie in den Hintergrundinformationen beschrieben, umgesetzt wurde.
Die HPLC-Analyse zeigt, dass sich DMA-O2 bei allen Ladespannungen ab 3.8 V gebildet hat (Abbildung 2 a). Referenzmessungen, in denen Elektroden ohne Li2CO3 analog polarisiert wurden, führten nicht zur Bildung von DMA-O2 (Abbildung S4). Die 1H-NMR-Messung bestätigt gleichermaßen die Anwesenheit von DMA-O2 bei allen Spannungen (Abbildung 2 b, S6). Die HPLC- und NMR-Ergebnisse bestätigen, dass die elektrochemische Oxidation von Li2CO3 von seinem Ansatz bei 3.8 V 1O2 bildet.
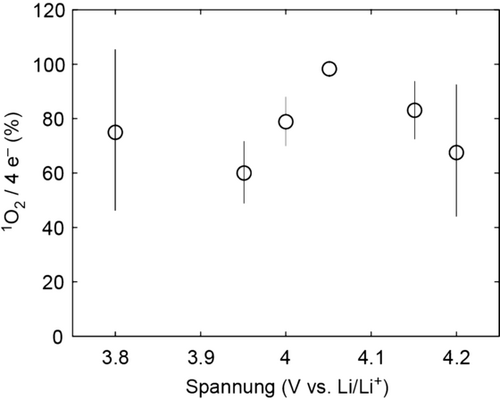
Die Menge an 1O2 (wie mittels HPLC als DMA-O2 quantifiziert) relativ zu der geflossen Ladung in Reaktion 2bei unterschiedlichen Ladespannungen. Die Werte stellen eine untere Grenze dar, da möglicherweise nicht der gesamte 1O2 zu DMA-O2 reagiert oder der Elektrolyt unvollständig extrahiert wurde.
Maximal ein 1O2 kann pro vier Elektronen erzeugt werden. 1O2 hat sich bei allen untersuchten Spannungen zu einem Ausmaß von weit über 50 % des 4 e−/1O2-Limits gebildet. Die Menge an 1O2 muss allerdings mit Vorsicht von den gemessenen Mengen an DMA-O2 abgeleitet werden und stellt eine untere Grenze des tatsächlichen Wertes dar. Dies ist darauf zurückzuführen, dass möglicherweise nicht der gesamte gebildete 1O2 mit DMA reagiert und auch auf anderen Wegen abreagieren kann. Darüber hinaus könnte der Elektrolyt unvollständig extrahiert worden sein und daher in niedrigen 1O2-Werten resultieren. Bei höheren Spannungen (z. B. 4.2 V) könnte sich DMA-O2 zu einem geringen Ausmaß zersetzen, wie in Abbildung S1 gezeigt, was die beobachtete geringere Ausbeute von DMA-O2 bei 4.2 V im Vergleich zu der bei 4.05 V in Abbildung 3 erklären könnte. Insgesamt legen die Werte in Abbildung 3 nahe, dass der Großteil, wenn nicht der gesamte “fehlende O2” von der elektrochemischen Oxidation von Li2CO3 1O2 bildet und daher nicht in der Gasphase detektiert wird.
Das völlige Fehlen der O2-Entwicklung während der Oxidation von Li2CO3 (Abbildung 1) impliziert, dass der gebildete 1O2 mit Zellkomponenten reagiert, anstatt auch nur zum Teil zu 3O2 deaktiviert zu werden. Darum haben wir die Verwendung eines 1O2-Löschers untersucht, der den 1O2 zu 3O2 deaktiviert,10 um gegebenenfalls 3O2-Entwicklung zu erzielen. Eine Vielzahl an Löschern wurde in der Literatur beschrieben, einschließlich Azide und aliphatischer Amine.10, 11 Wir haben zuvor gezeigt, dass 1,4-Diazabicyclo[2.2.2]octan (DABCO) in nicht-wässrigem Milieu effektiv ist.8a Die elektrochemische Stabilität von Löschern während der elektrochemischen Oxidation von Li2CO3 ist jedoch problematisch, da z. B. DABCO und andere Löscher (z. B. LiN3) elektrochemisch bei 3.5–3.6 V oxidiert werden (Abbildung S7).12 Dennoch könnte die Diffusion von unverbrauchtem Löscher vom Separator die Löscheroxidation an der Arbeitselektrode kompensieren und dadurch eine gewisse Löscheffizienz zeigen. Abbildung 4 zeigt die CO2- und O2-Entwicklung während einer OEMS-Messung ähnlich wie in Abbildung 1, aber mit einem Elektrolyten der 30 mm DABCO enthält. Die Oxidation von DABCO erklärt den anodischen Prozess, der bei ≈3.6 V eintritt und bei 3.9 V gipfelt. Wie zuvor startet die CO2-Entwicklung bei ≈3.8 V und erreicht eine Rate von zirka 2 e−/CO2. Interessanterweise startet die O2-Entwicklung zusammen mit der CO2-Entwicklung bei ≈3.8 V mit einer ähnlichen Wachstumsrate mit steigender Spannung. Dieses Ergebnis untermauert die Bildung von 1O2 und zeigt, dass wenn ein geeigneter Löscher gefunden werden könnte, Li2CO3 ohne die schädlichen Einflüsse von 1O2 oxidiert werden könnte.
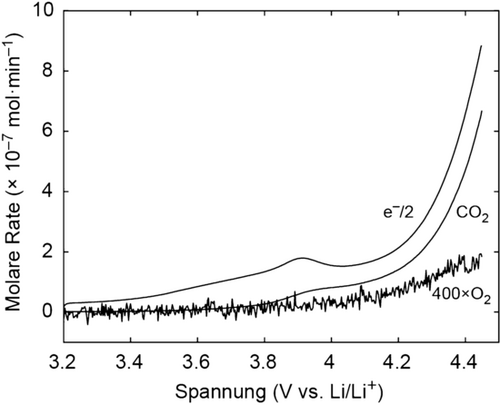
CO2- und O2-Entwicklung von Kohlenstoff/Li2CO3/PTFE (9:1:1 m:m)-Kompositelektroden während des linearen Potentialscans mit 0.14 mV s−1 in 0.1 m LiTFSI in TEGDME, der 30 mm DABCO enthielt.
Die Detektion von 1O2, und von 3O2 wenn ein Löscher anwesend ist, impliziert, dass der Mechanismus der Li2CO3-Oxidation die Bildung einer O-O-Bindung involviert. In Analogie zur Carbonat-Oxidation in wässrigem Milieu13 wurde vorgeschlagen, dass Li-Peroxodicarbonat (LiO2COOCO2Li) als Intermediat gebildet wird.4h So ein Intermediat wurde jedoch angezweifelt, da (i) CO32− schlecht löslich ist und daher möglicherweise nicht ausreichend beweglich ist, um sich zu Peroxodicarbonat zu verbinden, und (ii) die hohe Ladungsdichte des Peroxodicarbonat-Anions (−O2COOCO2−) keine O-O-Bindungsbildung erlaubt oder zu einem sofortigen Bindungsbruch führen würde.4c, 14 Jedoch sind weder große Carbonat-Beweglichkeit noch Dissoziation nötig, weshalb ein Mechanismus über das Peroxodicarbonat-Intermediat (Abbildung S8a) auf Grundlage vorhergehender Berichte vorgeschlagen werden kann.4i, 15 Formell kann Peroxodicarbonat über eine 1 e−-Oxidation/Li+-Extraktion zweier Li2CO3, die zwei LiO2CO.-Reste bilden und zu LiO2COOCO2Li 3 kombinieren, gebildet werden. Innerhalb der Li2CO3-Kristallstruktur (Abbildung S8b) erscheinen benachbarte Carbonat-Reste ausreichend nahe beieinander, um O-O-Bindungen zu bilden, wenn je 1 e− und 1 Li+ extrahiert worden ist. Die Mobilität von Intermediaten oder sogar Dissoziation vom Kristallgitter ist daher nicht notwendig. Eine DFT-Studie über die Oxidation von Li2CO3-Oberflächen hat gezeigt, dass nach der ersten Oxidation/Li+-Extraktion weitere Li+-Extraktionen energetisch besonders günstig an benachbarten Carbonat-Einheiten sind, was ihre Rekombination wahrscheinlich macht.15 Eine derartige Rekombination innerhalb des Kristallgitters wird auch durch DFT-Rechnungen unterstützt, die die Bildung von Li2CO3 über Peroxodicarbonat beschreiben, welches benachbarte Carbonat-Reste innerhalb des Li2CO3-Kristallgitter ergibt. Derselben Arbeit zu Folge stabilisiert die Koordination mit Li+-Ionen die O-O-Bindung in LiO2COOCO2Li stark im Vergleich zu −O2COOCO2−, dessen Bildung in nicht-wässrigem Milieu unwahrscheinlich ist. Ein möglicher weiterer Pfad zur 1O2-Bildung ist in Abbildung S8a vorgeschlagen. Weitere Oxidation und Decarboxylierung könnten zu LiCO4 (Abbildung S8a 4) führen, das dann wiederum 1O2 bilden könnte. Die Aufklärung des exakten Mechanismus wird jedoch weitere theoretische und/oder experimentelle Arbeiten benötigen.
Zusammenfassend zeigen wir mittels einer selektiven 1O2-Sonde und Online-Massenspektrometrie, dass die elektrochemische Oxidation von Li2CO3 in nicht-wässrigem Milieu zur Bildung von bis zu stöchiometrischen Mengen an 1O2 gemäß der Reaktion 2 Li2CO3 → 4 Li+ + 4 e− + 2 CO2 + 1O2 führt. Dies erklärt die Abwesenheit der O2-Entwicklung, was ein anhaltendes Rätsel und Ursache für viel Spekulation hinsichtlich potentieller reaktiver Sauerstoffspezies war. Die Reaktion startet bei ≈3.8 V, was nahe bei seinem thermodynamischen Wert von 3.82 V liegt. Wenn ein 1O2-Löscher anwesend war, wurde ein Teil des gebildeten 1O2 als 3O2 freigesetzt. Li2CO3 ist ein universeller Passivierungsstoff in Li-Ionen-Batterie-Kathoden und bestimmend für die Grenzflächenreaktivität. Li2CO3 ist auch ein typisches Nebenprodukt in Li-O2-Kathoden und das angestrebte Entladeprodukt in Li-O2/CO2-Batterien und muss daher beim Laden oxidiert werden, um ein reversibles System darzustellen. Unsere Ergebnisse zeigen deutlich, dass sich die Li2CO3-Bildung, sogar in Spurenmengen, schädlich auf die Stabilität von allen Li-Batterien auswirkt, in denen Elektroden über 3.8 V vs. Li/Li+ betrieben werden. Das schließt die meisten der gegenwärtig untersuchten Kathoden ein. Strategien, um die 1O2- und Li2CO3-Bildung während des Batteriebetriebes zu vermeiden, sind daher unabdinglich.
Acknowledgements
S.A.F. dankt dem Europäischen Forschungsrat (ERC) und dem Horizon 2020 Forschungs- und Innovationsprogramm (Projektnr. 636069) der Europäischen Union. N.M. dankt für die Förderung seitens der TU Graz (Förderstipendium der Fakultät für Technische Chemie, Verfahrenstechnik und Biotechnologie und Research Abroad Stipendium). Die Arbeit an der UC Berkeley wurde vom Assistant Secretary for Energy Efficiency und Energy, Office of Vehicle Technologies des U.S. Department of Energy (Vetragsnr. DE-AC02-05CH11231), des Advanced Battery Materials Research (BMR) Programms unterstützt. S.E.R. dankt für die Unterstützung vom Department of Defense (DoD) durch das National Defense Science & Engineering Graduate Fellowship (NDSEG) Programm. Die Autoren danken S.M. Borisov für die Bereitstellung des Photosensibilisators und für Diskussionen, El-Cell GmbH für MS-Testzellen, C. Leypold für Diskussionen und J. Schlegl für die Anfertigung der für die Methoden notwendigen Apparaturen.
Conflict of interest
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.




