Titelbild: Ladungsinduziertes Entwinden isolierter Proteine zu einer definierten Sekundärstruktur (Angew. Chem. 10/2016)
Graphical Abstract
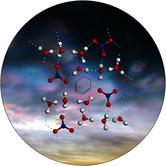
Das ladungsinduzierte Entwinden von isolierten Proteinen führt zu einer definierten Sekundärstruktur, die durch intramolekulare C5-Wasserstoffbrücken charakterisiert ist. Das Titelbild zeigt, wie die Coulomb-Abstoßung helikale Elemente auseinanderzwingt und die Bildung einer linearen Konformation, ähnlich einem β-Faltblatt-Einzelstrang, bewirkt. Wie G. von Helden und Mitarbeiter in ihrer Zuschrift auf S. 3356 ff. feststellen, ist diese Konformation vermutlich eine universelle Sekundärstruktur für hoch geladene Proteinionen.
Das ladungsinduzierte Entwinden von isolierten Proteinen führt zu einer definierten Sekundärstruktur, die durch intramolekulare C5-Wasserstoffbrücken charakterisiert ist. Das Titelbild zeigt, wie die Coulomb-Abstoßung helikale Elemente auseinanderzwingt und die Bildung einer linearen Konformation, ähnlich einem β-Faltblatt-Einzelstrang, bewirkt. Wie G. von Helden und Mitarbeiter in ihrer Zuschrift auf S. 3356 ff. feststellen, ist diese Konformation vermutlich eine universelle Sekundärstruktur für hoch geladene Proteinionen.
Atmosphärenchemie
DNA/RNA-Nanotechnologie
Anisotrope Materialien