Einfluss der Solvatisierung auf die Elektronenanlagerung an Pyrimidin†
Diese Arbeit wurde durch den FWF, Wien (I1015, P24443, M1445) und die DFG (FOR1789) unterstützt. F.F.S. dankt FCT-MEC für die Förderungen SFRH/BPD/68979/2010, UID/FIS/00068/2012 und PTDC/FIS-ATO/1832/2012.
Abstract
Die Wechselwirkung niederenergetischer Elektronen mit Biomolekülen spielt eine wichtige Rolle bei der strahlungsinduzierten Mutation von biologischem Gewebe auf molekularer Ebene. Bei Elektronenenergien unter 15 eV ist die dissoziative Elektronenanlagerung einer der Hauptprozesse, die chemische Umwandlungen von Molekülen induzieren. Bisherige Gasphasenstudien hinsichtlich der ablaufenden Prozesse auf molekularer Ebene wurden mit einzelnen Biomolekülbausteinen wie Pyrimidin als Modellmolekül durchgeführt. Hier wurde die Elektronenanlagerung sowohl an einzelnen Pyrimidinmolekülen als auch reinen oder hydratisierten Clustern untersucht. Im Unterschied zum isolierten und hydratisierten Fall, in denen kein anionisches Monomer detektiert werden konnte, gelang es, das Molekülanion bei reinen Clustern zu beobachten. Zusätzlich gibt es Hinweise darauf, dass die Fragmentierung des Pyrimidinrings unter Elektroneneinfang durch Solvatisierung effizient unterdrückt wird.
Durch die Wechselwirkung hochenergetischer Strahlung mit biologischem Gewebe werden viele Sekundärprodukte, hauptsächlich aber niederenergetische Elektronen (NEE) mit kinetischen Energien <15 eV erzeugt. Sanche und Mitarbeiter1, 2 zeigten, dass die Wechselwirkung von NEE mit Plasmid-DNA Einzel- und Doppelstrangbrüche (ESB bzw. DSB) verursacht, die zu Zellschädigungen mit ernsthaften biologischen Konsequenzen wie fehlerhafter Transkription und Replikation der Geninformation führen.3 Da die Intensitätsverteilungen der ESB und DSB Resonanzcharakter zeigten, wurden sie dem Zerfall von temporären negativen Ionen (TNI) zugeschrieben, die durch Anlagerung freier Elektronen erzeugt werden (dissoziative Elektronenanlagerung, DEA). In den letzten Jahren wurden zahlreiche DEA-Studien mit biologisch relevanten Molekülen durchgeführt, um Einblicke in die Fragmentierungsprozesse biologischer Materie durch NEE zu erhalten.4–6 DNA- und RNA-Basen spielen dabei eine wichtige Rolle, um Elektron-DNA-Wechselwirkungen besser verstehen zu können.
Weitere Aufmerksamkeit wurde Gasphasenstudien von Nukleobasen in Wechselwirkung mit Ionen,7 Photonen8 und Neutralteilchen9 gewidmet. Dabei können jedoch nur begrenzte Aussagen über die stoßinduzierte Moleküldynamik in der kondensierten Phase getroffen werden. Es könnten auch Reaktionsenergien modifiziert sein, wie es beispielsweise bei den vertikalen Ionisierungsenergien in wässrigen Lösungen im Vergleich zur Gasphase der Fall ist.10 Daher ist es nötig, den Übergang von der Gasphase auf die kondensierte Phase zu untersuchen. Experimentelle Studien zu Elektronenionisation,11 Ionenstoß12 und Photoionisation13 mit biomolekularen Clustern wurden bereits veröffentlicht, wohingegen keine Untersuchungen der Fragmentierungsdynamik durch NEE-Einfang erzeugter, anionischer Biomolekülcluster vorliegen.
Hier präsentieren wir eine erste detaillierte experimentelle Studie hinsichtlich des Solvatisierungseffektes bei der Anlagerung von NEE an reine und hydratisierte Cluster des Nukleobasen-Modellmoleküls Pyrimidin (Pyr, C4N2H4; siehe Abbildung 1). Verglichen wird die Bildung der Anionen des isolierten Moleküls mit Clustern, wodurch Aussagen über die Einflüsse der Umgebung auf die durch NEE in biologischer Materie induzierten Prozesse getroffen werden können.
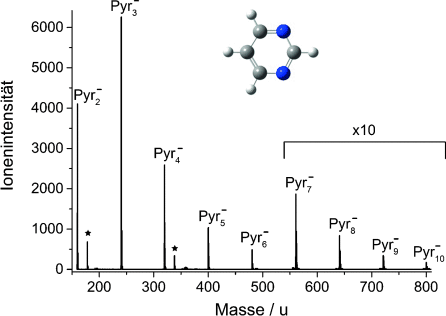
Massenspektrum von reinen Pyr-Clusteranionen, aufgenommen bei ca. 0 eV. Es wurde der gesamte Bereich zwischen Pyr2− und Pyr3− sowie Pyr4− und Pyr5− gemessen, die restlichen Segmente wurden übersprungen. Pyr-Clusteranionen mit H2O sind mit einem Stern markiert (siehe Text).
Zuerst fassen wir die durch Elektronenanlagerung (EA) induzierten Prozesse im einzelnen Pyr-Molekül zusammen. Diese Untersuchungen wurden aufgrund fehlender Literatur ebenfalls hier durchgeführt. Wie alle Nukleobasen bildet Pyr bei EA aufgrund von rascher spontaner Elektronenfreisetzung oder Dissoziation kein massenspektrometrisch detektierbares Molekülanion. Dies lässt sich in der Elektronenaffinität, die als negativ vorhergesagt wurde, erkennen14 und stimmt mit den erhaltenen Resultaten überein. Die am häufigsten auftretenden Anionen CN− und C3H2N− (mit dem Isobar C2N2−) können nur durch Ringbruch gebildet werden. Ein schwaches Signal des dehydrierten Mutteranions (Pyr−H)− ist ebenfalls messbar. Alle drei Fragmente werden ausschließlich bei hohen Energien mit zwei breiten Resonanzen um 5.5 und 9 eV gebildet.
Dagegen beobachteten Modelli et al.15 bei Elektronentransmissionsexperimenten drei niederenergetische π*-Resonanzen (bei 0.39, 0.82 und 4.26 eV; ähnliche Werte wurden in Lit. 14 angegeben). Offenbar handelt es sich hierbei um drei kurzlebige Resonanzen. Eine Möglichkeit zur Stabilisierung der Anionen gegen spontane Elektronenfreisetzung durch Einbetten in Cluster wurde in Lit. 16 vorgeschlagen. Untersuchungen hinsichtlich des Rydberg-Elektronentransfers von laserangeregten Xenon-Atomen zeigten, dass bereits ein angelagertes Pyr oder Wassermolekül ausreicht, um das Pyr-Anion gegen spontane Elektronenfreisetzung zu stabilisieren. Kelly et al.17 konnten mithilfe von Photoelektronenspektroskopie positive Elektronenaffinitäten für hydratisierte Pyr-Anionen (durch Zuführung der Elektronen in den überschallexpandierenden Neutralstrahl) nachweisen, was auch durch Dichtefunktionalrechnungen bestätigt wurde.
Das aus Anlagerung freier Elektronen (mit einer Energie nahe 0 eV) an reine Pyr-Cluster resultierende Massenspektrum ist in Abbildung 1 dargestellt. Bei den verwendeten Bedingungen zur Clustererzeugung konnten Pyr-Cluster mit bis zu 10 Molekülen detektiert werden. Zwischen den stabilen Clusterionen konnten keine solvatisierten Fragmentionen detektiert werden (auch nicht bei höheren Energien). Bei den deutlich kleineren Signalen handelt es sich stattdessen um Pyr-Clusteranionen, an die sich H2O aufgrund von Restfeuchte im System anlagern konnte. Wir beobachten keine Pyr-Monomeranionen (Masse 80 u) durch NEE-Einfang bei ungefähr 0 eV, was mit früheren Studien übereinstimmt.16, 17
Abbildung 2 a zeigt das Ionensignal des Dimeranions als Funktion der Elektronenenergie. Wie bereits aus Abbildung 1 hervorgeht, ist ein ausgeprägter Peak für 0 eV sichtbar, dessen Existenz bei dieser Energie durch die stabilisierende Wechselwirkung des TNIs mit den umgebenden Molekülen im Cluster möglich ist.18
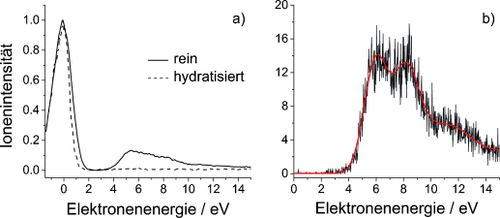
a) Anionensignal des Pyr-Dimers (m=160 u) aus reinen (durchgezogene Linie) und hydratisierten Clustern (gestrichelte Linie). b) Ionensignal des Pyr-Monomeranions nur beobachtbar bei reinen Clustern.
Neben diesem niederenergetischen Signal ist ein Signal bei höheren Energien (4–15 eV) erkennbar. Der erste Peak bei ca. 5.4 eV liegt oberhalb der drei erwähnten π*-Resonanzen, was auf eine elektronische Anregung von Pyr durch das eingefangene Elektron schließen lässt. Der π→π*-Übergang im neutralen Pyr liegt bei ca. 5.2 eV.19 Für das anionische System ist eine angeregte Resonanz bei ca. 5.5 eV bekannt,15 was mit den hier gezeigten Werten übereinstimmt. Zusätzlich wurden weitere Anregungszustände bis zu 10.5 eV vorhergesagt,20 denen hier die Intensitäten bei höheren Energien zugeschrieben werden.
In diesem Energiebereich können wir außerdem das Pyr-Monomeranion mit Resonanzen bei 6.1 und 8.2 eV beobachten (Abbildung 2 b). Dies lässt darauf schließen, dass Pyr− nur durch eine zusätzliche elektronische Anregung detektiert werden kann. Das Variieren des Expansionsdrucks bei gleichzeitiger Messung des Ionensignals lässt darauf schließen, dass zumindest ein neutraler Tetramercluster zur Stabilisierung des Anions benötigt wird. Wie es scheint, befindet sich dieses in einem metastabilen Zustand oberhalb des neutralen Grundzustands, indem spontane Elektronenfreisetzung über einen Franck-Condon-Übergang aufgrund eines größeren Gleichgewichtsabstands des Anions unterdrückt wird.21 Um diesen metastabilen Zustand erreichen zu können, muss die durch Relaxation im Cluster freigesetzte Energie durch Abdampfen neutraler Monomere abgeführt werden.
Um mögliche Hydratisierungseffekte studieren zu können, wurden hydratisierte Pyr-Cluster erzeugt. Das dadurch bei ca. 0 eV erhaltene Massenspektrum ist im Bereich von 160 bis 400 u in Abbildung 3 ersichtlich.
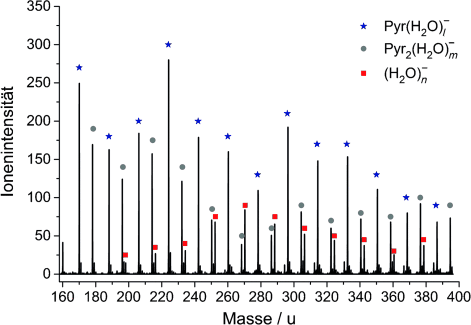
Massenspektrum des hydratisierten Pyr-Monomers und Dimers bei ca. 0 eV. Die durch DEA an hydratisierten Pyr erzeugten (H2O)n−-Anionen sind ab n≥11 erkennbar.22
Deutlich erkennbar sind die stark hydratisierten Pyr-Monomere und -Dimere, die im Fall des Monomers eine Hydratisierung mit bis zu 17 H2O-Molekülen aufweisen. Wie bei den reinen Pyr-Clustern konnten auch hier keine Fragmente oberhalb des Monomers nachgewiesen werden. Auffällig ist hingegen die deutliche Abnahme des Clustersignals bei höheren Elektronenenergien, wie in Abbildung 2 a für Pyr2− ersichtlich. Es scheint, als ob die elektronische Anregung bei den hydratisierten Pyr-Clustern unterdrückt wird. Zusätzlich zeigt sich, dass das Pyr-Monomeranion im hydratisierten Fall verschwindet. Diese Effekte könnten auf eine räumliche Abschirmung durch die umgebenden H2O-Moleküle zurückzuführen sein, wodurch die Anregung nicht mehr möglich ist. Wahrscheinlicher ist jedoch, dass das eingefangene Elektron wieder rasch emittiert wird und der Pyr-H2O-Komplex im elektronisch angeregten Zustand verweilt. Jüngste Berichte beschreiben solche Zustände im Fall hydratisierter DNA als dissoziativ und bezeichnen sie als Quelle von OH-Radikalen,23 die ESB in der DNA verursachen können. ESB führen zusammen mit der Anlagerung des freigesetzten Elektrons an der gegenüberliegenden Seite zu einem DSB, der bei gehäuftem Auftreten für die Bildung von Tumorzellen verantwortlich sein kann.23
Abschließend betrachten wir noch die Einflüsse der Solvatisierung auf die bereits erwähnten Anionen unterhalb des Pyr-Monomers. Wie sich herausstellt, werden die beiden durch Ringbruch gebildeten Ionen CN− und C3H2N− bei Solvatisierung stark unterdrückt, wobei das (Pyr−H)−-Signal detektierbar bleibt. Dieser Effekt wird durch die H-Brücken zwischen den Molekülen verstärkt, die eine Schwächung der C-H-Bindung verursachen.12 Die resultierenden (Pyr−H)−-Intensitäten sind in Abbildung 4 dargestellt. Der direkte Vergleich zeigt für Cluster eine Verschiebung des Intensitätsmaximums zu höheren Energien. Dieser Effekt basiert auf der energiedissipativen Umgebung der Cluster, die zur Stabilisierung des gebildeten Anions führt. Bezüglich Hydratisierung wurden die stabilsten Strukturen für den Fall der von Wassermolekülen umgebenden Pyr-N-Seiten gefunden.17
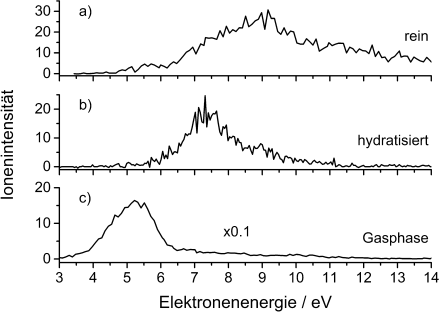
Ionensignal von (Pyr−H)−, erzeugt durch DEA an a) reine Pyr-Cluster, b) hydratisierte Pyr-Cluster und c) isoliertes Pyr.
Zusammenfassend haben wir die Elektronenanlagerung an reine und hydratisierte Pyr Clustern untersucht, um Rückschlüsse auf die Fragmentierung von Molekülen in biologischem Gewebe zu erhalten. Der Vergleich mit der Gasphase zeigt einen außergewöhnlichen Solvatisierungseffekt. Unter der Annahme eines ähnlichen Verhaltens bei DNA- und RNA-Bausteinen führt das umgebende Wasser in bestrahlten Zellen zum Schutz der Nukleobasen vor NEE. Des Weiteren zeigte sich allerdings im hydratisierten Fall eine stark unterdrückte Stabilisierung des elektronisch angeregten Pyr-Anions. Dieses Resultat stimmt mit der vor kurzem publizierten Idee der DSB-Bildung durch EA mit Energien >5 eV an hydratisierter DNA überein.
Experimentelles
Sämtliche Messungen wurden an einem doppelfokussierenden Massenspektrometer24 durchgeführt. Der verwendete Elektronenstrom betrug 10 μA mit einer Energieauflösung von ca. 1 eV, wobei die Elektronenenergie anhand von SF6-Anionen kalibriert wurde. Die Cluster wurden mittels Überschallexpansion durch eine 50-μm-Düse erzeugt. Um bessere Clusterbedingungen zu erhalten, wurde die flüssige Pyr-Probe (Sigma Aldrich, Wien, Reinheit ≥98 %) auf etwa 30 °C erhitzt und Argon (0.5 bar) als Trägergas verwendet. Die Kammern der Cluster- und Ionenquelle waren durch einen 1-mm-Skimmer getrennt. Für die Messungen der Gasphase wurde die gasförmige Probe direkt in die Ionenquelle eingeleitet.




