Catenane: fünfzig Jahre molekulare Verschlingungen
Abstract
Ein halbes Jahrhundert nach der ersten gerichteten Synthese eines [2]Catenans durch Schill und Lüttringhaus existiert heutzutage eine Vielzahl an Strategien zur Synthese von Hopf-Verschlingungen (einfach verzahnten Ringen), der einfachsten Klasse der Catenane. Die Präzision und Effektivität, mit der geeignete Template und/oder nichtkovalente Wechselwirkungen Bausteine anordnen können, ermöglichten die Synthese komplizierter – und häufig schöner – verzahnter Systeme höherer Ordnung, darunter Salomonische Verschlingungen, Borromäische Ringe und ein Davidstern-Catenan. In diesem Aufsatz werden die zahlreichen Strategien, die im 21. Jahrhundert zur Synthese von Catenanen zur Verfügung stehen, vorgestellt und potenzielle Anwendungen untersucht. Des Weiteren werden die Herausforderungen bei der Synthese noch komplizierterer Topologien aufgezeigt.
1. Einleitung
In den letzten fünfzig Jahren hat sich die Idee, verzahnte Moleküle zu synthetisieren, von einem teilweise skeptisch beäugten Forschungskonzept zu einer Wirklichkeit entwickelt, in der neue Anwendungsmöglichkeiten für Eigenschaften gesucht werden, die mit der Anwesenheit mechanischer Bindungen einhergehen. Catenane stehen an erster Stelle beim Aufbau künstlicher molekularer Maschinen und wenn die Dynamik verzahnter Strukturen in Polymeren, MOFs und anderen Materialien genutzt werden soll. Ihre Erforschung hat nicht nur zu bemerkenswerten Entwicklungen in der supramolekularen Chemie geführt, sondern auch in vielen weiteren Feldern – von der Biologie bis hin zur Physik weicher Materie. Hier besprechen wir die Synthesetaktiken zum Aufbau von Catenanen, einschließlich der verschiedenen Templatverfahren und Methoden zur Synthese einfach verzahnter [2]Catenane (Abschnitt 2) sowie verzahnter Strukturen höherer Ordnung (Abschnitt 3 und 4), den Eigenschaften der Catenane (Abschnitt 5) und ihre Eingliederung in Materialien und auf Oberflächen (Abschnitt 6). Aus einer großen Fülle an Literatur über molekulare Ringe konnten ausschließlich die wichtigsten Fortschritte der letzten fünfzig Jahre vorgestellt werden. Bei allen der in diesem Aufsatz abgebildeten Stabstrukturen handelt es sich um Originalabbildungen, die aus Koordinaten der Cambridge Structural Database (CSD) angefertigt wurden.
1.1. Geschichtlicher Hintergrund
Die erste Erwähnung der Möglichkeit, cyclische Moleküle mechanisch zu verknüpfen (diese Strukturen wurden später Catenane1 genannt), wird dem Chemienobelpreisträger des Jahres 1915, Richard Willstätter zugeschrieben,2 angeblich während eines Seminars in Zürich zu unbestimmter Zeit zwischen 1906 und 1912. Leider ist der genaue Inhalt der Diskussion in Vergessenheit geraten, dennoch ist es bemerkenswert, dass das Konzept verzahnter Moleküle überhaupt angesprochen wurde in einer Ära vor Staudingers (Willstätters Nachfolger an der damals frisch umbenannten “Eidgenössischen Technischen Hochschule” in Zürich) Behauptung, Polymere seien kovalent gebundene Ketten. Zu diesem Zeitpunkt war noch nicht einmal die Existenz von Makrocyclen – den vermeintlichen Komponenten der Catenane – bekannt.3 Ein halbes Jahrhundert später, inspiriert durch die grundlegenden Arbeiten zur Synthese mittlerer und großer cyclischer Moleküle von Ružička,4 Ziegler,5 Prelog,6 Stoll7 und weiterer Wissenschaftler,8 sowie durch die Entdeckung von cyclischen Molekülen in verschiedenen Polymerisationsreaktionen9 bekamen Spekulationen über die Existenz von Catenanen – und über ihre Synthese – neuen Antrieb. Frisch, Martin und Mark postulierten 1953, dass die flüssig-wachsartige Konsistenz von hochmolekularen Polysiloxanen auf die Gegenwart großer verzahnter Ringe zurückzuführen ist, die als Weichmacher wirken.10 Im darauffolgenden Jahr begannen Lüttringhaus und Cramer, an Syntheserouten für Catenane (z. B. 1) zu arbeiten, und, aufbauend auf Cramers Versuche aus dem Jahre 1950, Rotaxane herzustellen.11 Ein erfolgloser früher Versuch ein Catenan herzustellen, basierend auf der Cyclisierung einer Einschlussverbindung (2) eines para-disubstituierten Benzols (3) in einem Cyclodextrin (4), wurde 195811 veröffentlicht (Schema 1 a).12
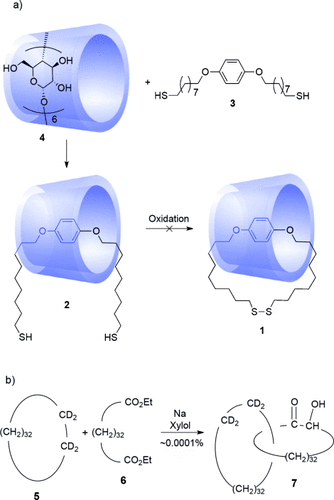
a) Lüttringhaus’ und Cramers erfolglose Synthese eines [2]Catenans (1958). Komplexierung von Dithiol 3 mit α-Cyclodextrin 4 ergibt die Einschlussverbindung 2, anschließende Oxidation führt jedoch nicht zu dem [2]Catenan 1.11 b) Synthese von [2]Catenan 7 durch statistisches Einfädeln von Diester 6 durch den Makrocyclus 5 mittels Acyloinkondensation von Wasserman (1960).1
Das erste [2]Catenan, dessen verzahnte Struktur anhand experimenteller Daten belegt werden konnte, wurde zwei Jahre später von Wasserman synthetisiert.1 Mittels IR-Spektroskopie konnte gezeigt werden, dass ein kleiner Anteil (ca. 0.0001 %)1b des durch Acyloinkondensation von Diester 6 in Gegenwart des deuterierten Makrocyclus 5 erhaltenen Produktgemisches sowohl Deuteronen als auch die Acyloingruppe (-COCHOH-) enthielt. Die Präsenz beider funktioneller Gruppen innerhalb eines Moleküls lässt sich nur mit der Bildung von Catenan 7 erklären, auch wenn ein eindeutiger Strukturbeweis (z. B. durch Massenspektrometrie) nicht geliefert werden konnte. Die Acyloingruppen der produktenthaltenden Fraktion wurden oxidativ gespalten, und es konnte eine kleine Menge 5 isoliert werden, was ebenfalls auf eine mechanische Bindung des deuterierten Alkans hinwies. Bis heute ist 7 das einzige Catenan, in dem einer der Bestandteile ein vollständig gesättigtes Cycloalkan ist.
In ihrer wegweisenden Diskussion über “Chemische Topologie”2 schlugen Frisch und Wasserman 1961 vor, molekulare Gerüste zum gerichteten Aufbau von Knoten und Verschlingungen zu nutzen.13 Dieses Konzept wurde kurz darauf von Schill und Lüttringhaus in ihrer Synthese eines Catenans mittels gerichteter kovalenter Bindungen umgesetzt (Schema 2).14 Die Aminogruppe im Hohlraum von Intermediat 8 kann mit den elektrophilen Alkylchloriden jeweils einmal oberhalb und unterhalb der Ringebene reagieren, wodurch die verschlungene Struktur 9 entsteht. Spaltung der Aryl-Stickstoff-Bindung ergibt Catenan 10 in 15 Stufen ausgehend von einem gut zugänglichen Phosphoniumsalz. Dieses Beispiel blieb für fast 20 Jahre die effizienteste Methode, Catenane herzustellen und konnte nur durch Sauvages Templatmethoden übertroffen werden (siehe Abschnitt 2.1). Die innovative Route von Schill und Lüttringhaus aus dem Jahr 1964 inspirierte Chemiker in den folgenden 50 Jahren, ihre Kreativität und Fähigkeiten der Synthese verzahnter Verbindungen zu widmen.
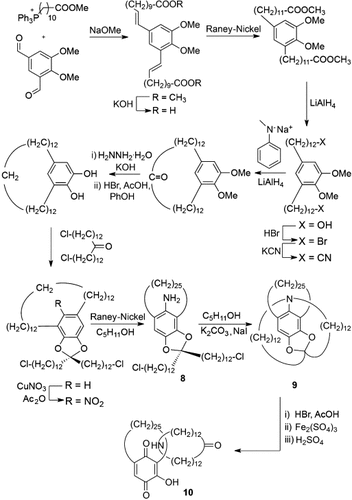
Schill und Lüttringhaus’ gerichtete Synthese eines [2]Catenans (1964).14
Im darauffolgenden Jahrzehnt nutzte Schill die zu [2]Catenan 10 führende “gerichtete Synthese”, um verwandte [3]Catenane zu erhalten (siehe z. B. Schema 3).15 Makrocyclisierung von Dibromid 11 mit Diamin 12 ergab ein Produktgemisch der Präcatenan-Isomere 13 und 14, dessen Bestandteile nicht getrennt werden konnten. Spaltung der ausrichtenden Aminogruppen lieferte ein [3]Catenan als Isomerengemisch von 15 a und 15 b. Es wurden andere Syntheserouten untersucht, in denen keine Isomerengemische erzeugt werden sollten, allerdings blieben sie letztendlich erfolglos.16
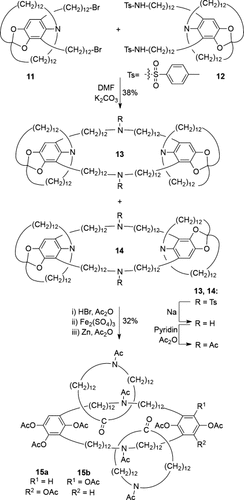
Schills gerichtete Synthese eines [3]Catenans (1969).15
In den späten 1950er Jahren stellten Wasserman2 und van Gulick17 unabhängig voneinander eine alternative Methode vor, um Knoten, Catenane und andere topologisch anspruchsvolle Strukturen herzustellen: den so genannten “Möbius-Band-Ansatz”. Ein Möbius-Band ist ein paradromischer Ring mit einer halben Drehung, also eine zweidimensionale Struktur, die nur eine Kante und eine Fläche hat. Ein Möbius-Band entsteht, wenn die Enden eines offenen Bandes vor Verknüpfung der Enden um eine halbe Drehung gegeneinander verdreht werden. Wenn ein paradromischer Ring entlang der Mittellinie durchgeschnitten wird, erhält man entweder einen einzelnen Ring, eine Verschlingung oder einen Knoten (das Möbius-Band mit einer halben Drehung ergibt einen Ring, für eine gerade Zahl an halben Drehungen erhält man eine Verschlingung, und für eine ungerade Zahl an Halbdrehungen erhält man Knoten). In Bezug auf chemische Verbindungen kann die Makrocyclisierung eines leiterförmigen Moleküls prinzipiell molekulare Analoga paradromischer Ringe erzeugen (Abbildung 1). Entfernen der “Leitersprossen” würde verschiedene Topoisomere erzeugen (Abbildung 1 c).

Erzeugung verschiedener topologischer Isomere mithilfe paradromischer Ringe. Die Makrocyclisierung eines leiterförmigen Moleküls (a) kann verschiedene cyclische Moleküle mit unterschiedlichen Windungszahlen erzeugen (b). Entfernen der Sprossen liefert verschiedene topologische Isomere (c).
Es wurde ursprünglich vorgeschlagen, mithilfe des Möbius-Band-Mechanismus die scheinbare Erzeugung von Catenanen in der metallkatalysierten Olefinmetathese von verschiedenen Cycloalkenen zu erklären.18 Als sich herausstellte, dass der Mechanismus Metallalkyliden- und Metallacyclobutan-Zwischenstufen aufweist, die inkompatibel mit einem Möbius-Band-Mechanismus zur Molekülverzahnung sind,13a wurde diese Idee aufgegeben. In den frühen 1980er Jahren synthetisierte Walba mehrere molekulare Bänder basierend auf einem Tetraether von Tetrahydroxymethylethylen (Schema 4).19 Cyclisierung von 16 ergab zwei Produkte, die als Zylinder 17 und Möbius-Band 18 identifiziert werden konnten. Folgende Alkenspaltung mit Ozon ergab zwei Stoffmengenäquivalente Triketon-Makrocyclus 19 im Fall von 17, während bei Ozonolyse von Möbius-Band 18 der Makrocyclus 20 entstand. Paradromische Ringe höherer Ordnung, die zu Catenanen und Knoten geführt hätten, wurden allerdings nicht isoliert, wahrscheinlich aufgrund zu geringer Ausbeute.19b
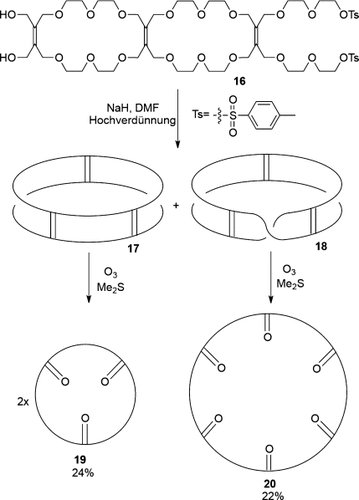
Walbas Synthese eines molekularen Möbius-Bandes.19
Obwohl die frühen statistischen und gerichteten Methoden zeigten, dass die Synthese verzahnter Verbindungen experimentell möglich ist, machten die geringen Ausbeuten und langen Syntheserouten neue Wege für ihre Synthese notwendig, wenn sie nicht den Status einer akademischen Kuriosität behalten sollten. Die Catenansynthese wurde 1983 revolutioniert, als Jean-Pierre Sauvage in Straßburg erkannte, dass die orthogonale Ausrichtung zweizähniger Liganden in tetraedrischen CuI-Komplexen genutzt werden kann, um die benötigten Kreuzungspunkte für eine Catenansynthese zu erzeugen.13c Seitdem ist die Templatsynthese Grundlage für die große Mehrheit der Catenansynthesen (Abschnitte 2–4). Bevor wir jedoch den beeindruckenden Fortschritt während der Metalltemplat-Ära vorstellen, ist es sinnvoll, zunächst die chemische Struktur mit der topologischen Nomenklatur zur Beschreibung von Verschlingungen in der Mathematik in Verbindung zu bringen (Abschnitt 1.2) und einen kurzen Überblick über natürliche und künstliche makromolekulare Catenane (Abschnitte 1.3 und 1.4) zu geben, um die niedermolekularen Catenane in einem breiteren Kontext zu sehen.
1.2. Topologie von Verschlingungen
Der Mathematiker Peter Guthrie Tait beschäftigte sich im 19. Jahrhundert mit verzahnten und verschlungenen Ringen. Aufbauend auf Lord Kelvins Vorschlag, dass die chemischen Elemente Verknotungen im Äther20 sein könnten, versuchte Tait die Knoten zu kategorisieren und zu tabellieren – in der Hoffnung, einen Zusammenhang mit dem Periodensystem der Elemente herstellen zu können.21 Dieser Zusammenhang war zwar nicht gegeben, doch Taits Arbeit ebnete einer systematischen Erforschung der Knoten den Weg und begründete damit das Gebiet der Topologie innerhalb der Mathematik. Moderne Knotentheorie beschäftigt sich auch mit Verschlingungen. Verschlingungen sind Ringe (selbst verknotet oder nicht), die miteinander verschlungen sind, während einzelne verschlungene Ringe als Knoten bezeichnet werden. Die in der Mathematik gültige Definition kann auch auf Catenane übertragen werden. Daraus folgt, dass alle Verschlingungen (mit Ausnahme derer, die keine Überkreuzungspunkte haben), in molekularer Form Catenane sind. Obwohl die Zahl an möglichen verschlungenen Ringanordnungen unendlich ist, konnten bis heute nur wenige derartige Catenane hergestellt werden.
Die Alexander-Briggs-Notation22 ist sehr geläufig, um Knoten und Verschlingungen mathematisch zu beschreiben. Die Topologie wird mit einem Symbol der Form 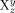 beschrieben, dabei entspricht x der Zahl der Überkreuzungspunkte, y ist die Zahl der beteiligten Komponenten, und z kennzeichnet die Ordnung der Verschlingung, um sie von anderen mit gleichen Werten für x und y zu unterscheiden. So kann das einfachste [2]Catenan mit zwei Überkreuzungspunkten, auch Hopf-Verschlingung genannt (Abbildung 2), in der Alexander-Briggs-Notation als
beschrieben, dabei entspricht x der Zahl der Überkreuzungspunkte, y ist die Zahl der beteiligten Komponenten, und z kennzeichnet die Ordnung der Verschlingung, um sie von anderen mit gleichen Werten für x und y zu unterscheiden. So kann das einfachste [2]Catenan mit zwei Überkreuzungspunkten, auch Hopf-Verschlingung genannt (Abbildung 2), in der Alexander-Briggs-Notation als 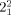 -Verschlingung beschrieben werden. Für eine gegebene Verschlingung kann es verschiedene Möglichkeiten der bildlichen Darstellung geben, alle diese Darstellungen sind aber durch Deformation oder Verschiebung der Überkreuzungspunkte ineinander überführbar. Als Beispiel sei die Salomonische Verschlingung (
-Verschlingung beschrieben werden. Für eine gegebene Verschlingung kann es verschiedene Möglichkeiten der bildlichen Darstellung geben, alle diese Darstellungen sind aber durch Deformation oder Verschiebung der Überkreuzungspunkte ineinander überführbar. Als Beispiel sei die Salomonische Verschlingung (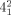 ) gegeben, die aus zwei doppelt miteinander verschlungenen Ringen besteht. Die einfachste Darstellung (Abbildung 3 A) kann durch Deformation in andere Formen überführt werden, die alle topologisch äquivalent sind (Abbildung 3 B–D).
) gegeben, die aus zwei doppelt miteinander verschlungenen Ringen besteht. Die einfachste Darstellung (Abbildung 3 A) kann durch Deformation in andere Formen überführt werden, die alle topologisch äquivalent sind (Abbildung 3 B–D).
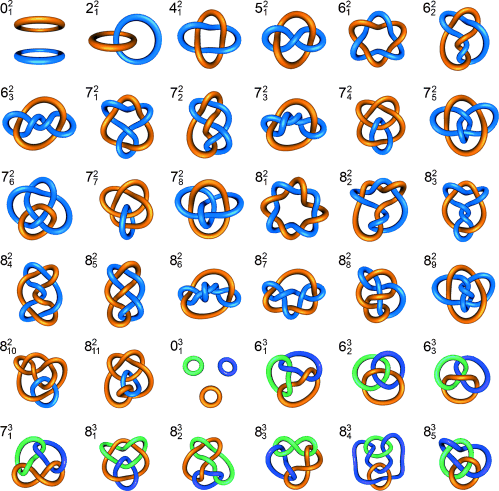
Eine Auswahl von Primverschlingungen mit bis zu acht Überkreuzungspunkten mit der zugehörigen Alexander-Briggs-Notation.
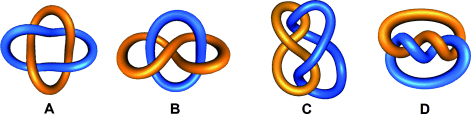
Vier verschiedene Darstellungen der Salomonischen Verschlingung (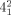 ).
).
1.3. Natürliche Catenane in Biopolymeren
Als die ersten künstlichen Catenane hergestellt wurden, waren sich die Wissenschaftler nicht bewusst, dass mechanisch gebundene molekulare Ringe auch natürlich vorkommen. 1967 konnte mittels Elektronenmikroskopie gezeigt werden, dass aus mitochondrialen HeLa-Zellen23 und menschlichen leukämischen Leukozyten24 isolierte zirkuläre DNA Catenanstrukturen aufweist (Abbildung 4). Seitdem wurden zahlreiche verzahnte DNA-Topologien entdeckt und synthetisiert.25 Die Topologie der DNA wird durch Topoisomerasen kontrolliert.26 Ihr Wirkmechanismus beruht darauf, dass sie an verknäuelte DNA binden und dann das Phosphatrückgrat aufbrechen. Durch die resultierende Lücke kann sich das Knäuel entflechten. Da die für Transkription und Replikation zuständigen Enzyme Zugriff zu nichtverknäuelten DNA-Einzelsträngen benötigen, um den genetischen Code richtig auszulesen, ist die Ver- und Entknäuelung genetischen Materials außerordentlich wichtig für Zellvermehrung und Genexpression.
a) Elektronenmikroskopische Aufnahme ringförmiger DNA mit der Topologie eines Catenans. b, c) Hervorhebung der beiden zugrundeliegenden Komponenten als Hopf-Verschlingung. Modifiziert mit Genehmigung von Lit. 23.
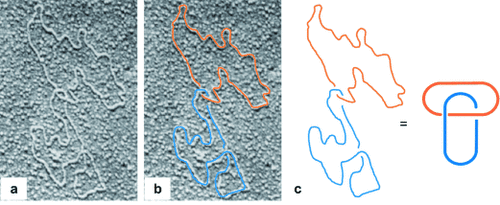
Verschlungene Strukturen in Proteinen liegen gewöhnlich als offene Knoten27 vor, haben starke Auswirkungen auf die Tertiärstruktur und beeinflussen somit die Wirkweise des Proteins stark. Protein-Catenane wurden in natürlichen Systemen entdeckt; so zeigt eine Kristallstruktur des Capsids von Bakteriophage HK97,28 dass dieses aus einem Netzwerk von cyclischen Proteinringen aufgebaut ist, die als “molekulares Kettenhemd” vorliegen (Abbildung 5). Es wird angenommen, dass die verzahnte Struktur dem relativ dünnen Bakteriophagen-Capsid zusätzliche Stabilität verleiht und so zum zusätzlichen Schutz der enthaltenen viralen Erbinformation dient. Es ermöglicht so dem Virus auch unter harschen Bedingungen die Replikation. Vier weitere natürliche Protein-Catenane sind bekannt: 1) Pyrobaculum-aerophilum-Citrat-Synthase(PaCS)-Proteine,29 in denen die Bildung einer intramolekularen Disulfidbrücke zur Verzahnung der dimeren Biopolymere führt. Diese Eigenschaft erhöht die Proteinstabilität bei hohen Temperaturen und könnte besonders wichtig sein für Pyrobaculum aerophilum, da es sich hierbei um einen thermophilen Organismus handelt; 2) zwei verzahnte Proteinringe in Peroxiredoxin III in mutierten Rindermitochondrien;30 3) das Rekombinationsprotein R (RecR), welches das Bakterium Deinococcus radiodurans für Reparaturen mittels rekombinatorischer DNA verwendet und die Struktur verzahnter Oktamere31 aufweist; es wird vermutet, dass Komponenten von RecR geöffnet und geschlossen werden können und als DNA-Klammern während des Reparaturprozesses dienen; 4) Catenane von E.-coli-Ribonucleotid-Reductase der Klasse 1a (RNR).32 Des Weiteren gibt es Belege dafür, dass in den CS2-Hydrolase-Enzymen des Archaeons Acidianus A1-3 Catenane vorkommen.33
Die “Kettenhemd”-Anordnung von Proteinen im Capsid der Bacteriophage HK97 (einzelne Proteinringe sind durch eingefärbte Bereiche hervorgehoben). a) Das sich wiederholende Muster der verzahnten Proteine, das dem sphärischen Capsid zugrundeliegt. b) Querschnitt des Capsids mit drei verzahnten Proteinringen. c) Vergrößerte Ansicht des Überlappungsbereichs der Ringe (vernetzende Isopeptidbindungen sind hervorgehoben). Wiedergabe mit Genehmigung von Lit. Lit. 28.
1.4. Verwendung synthetischer Biopolymere zum Aufbau von Catenanen
Durch die Möglichkeit, die DNA-Erkennung zu steuern und DNA automatisiert zu synthetisieren, konnten in den letzten Jahren kompliziertere DNA-Strukturen aufgebaut werden. Syntheserouten für DNA-Catenane34 nutzen normalerweise DNA-Einzelstränge mit einer definierten Basensequenz, die geeignet ist, sich mit einem weiteren komplementären Einzelstrang zu einem gewundenen Doppelstrang zu hybridisieren. Durch diesen Prozess können Überkreuzungspunkte erzeugt werden, Catenane können dann durch Ligation der offenen Enden erzeugt werden (Abbildung 6). Der Prozess lässt sich noch besser steuern, wenn B- und Z-DNA verwendet wird, um rechts- bzw. linksdrehende Windungen auszubilden. Seeman nutzte dieses Verfahren, um eine Vielzahl an DNA-Strukturen herzustellen, unter anderem Borromäische Ringe,35 einen Oktaederstumpf36 und DNA-Würfel.37 Eine neuere Entwicklung ist der Versuch, die relative Bewegung der Ringe zueinander zum Aufbau molekularer Maschinen basierend auf DNA-Catenanen zu nutzen.38
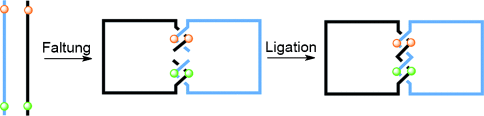
Herstellung von Catenanen aus künstlichen DNA-Einzelsträngen. Komplementäre DNA-Sequenzen (durch farbige Kugeln dargestellt) falten sich zu Helicaten, anschließende Ligation der Stränge ergibt Catenane.
Obwohl Design und Synthese deutlich anspruchsvoller sind, konnten auch Protein-Catenane synthetisiert werden.39 Während der dimeren Faltung eines tumorunterdrückenden Proteins p53 bilden sich kreuzende, konkave Peptidstränge, die durch native chemische Ligation zu einem Catenan geschlossen werden können.
2. Synthese von Hopf-Verschlingungen (einfach verzahnten [2]Catenanen)
2.1. Durch nichtkovalente Wechselwirkung begünstigte Catenansynthesen
Nachteile der frühen Methoden, die auf statistischen und gerichteten Ansätzen beruhten,40 waren geringe Ausbeuten und/oder lange Syntheserouten (Abschnitt 1.1). Deshalb blieben Catenane lange Zeit eine akademische Kuriosität, und es konnten keine Anwendungen entwickelt werden. Dies änderte sich, als die Templatsynthese von verzahnten und verschlungenen Strukturen eingeführt wurde.41 Nun war es zum ersten Mal möglich, Catenane in größerem Maßstab zu produzieren. Zur Bildung einer verzahnten Verbindung müssen die Stränge physisch überlappen, um die nötigen Überkreuzungspunkte zu erzeugen, bevor ein kovalenter Einfang stattfindet. Für diese Aufgabe sind Template ideal, da sie die Komponenten binden und geeignet ausrichten können.42 Zu den häufig hohen Ausbeuten und relativ kurzen Syntheserouten der Templatsynthesen kommt hinzu, dass sich die Struktur der präorganisierten Anordnungen zuverlässig voraussagen lässt. Somit sind sie für die Syntheseplanung komplexer Topologien gut geeignet. Die letzten drei Jahrzehnte haben eine Fülle von faszinierenden mechanisch verzahnten molekularen Architekturen hervorgebracht, die immer komplexer wurden.
2.1.1. Passive Metalltemplate
Die Ausrichtung von Liganden um Übergangsmetallkationen hat sich als eine der praktischsten, vielseitigsten und zuverlässigsten Methoden zur Erzeugung molekularer Überkreuzungspunkte herausgestellt,41, 42b,42c,42e,42f,42h,42i was auf die verschiedenen wohldefinierten Koordinationsgeometrien zurückzuführen ist, die Übergangsmetallkomplexe annehmen. Der Arbeitskreis von Sauvage nutzte dies 1983 als erster zur Synthese von verzahnten Molekülen in der Metalltemplatsynthese eines [2]Catenans (Schema 5).43 Das ursprüngliche System nutzte einen 2,9-Diphenyl-1,10-phenanthrolin(dpp)-Liganden 21 und den verwandten Makrocyclus 22, die eine eingefädelte Struktur annehmen, wenn sie an ein tetraedrisch koordiniertes CuI-Ion gebunden sind. Die senkrecht zueinander stehenden Liganden erzeugen einen Überkreuzungspunkt. “Zuklipsen” mit einer Makrocyclisierung mittels Williamson-Ethersynthese liefert das [2]Catenan 24-CuI in 42 % Ausbeute. Um den metallfreien Catenand 24 zu erhalten, konnte das Kupferion quantitativ durch Behandlung mit Kaliumcyanid entfernt werden (Schema 5).
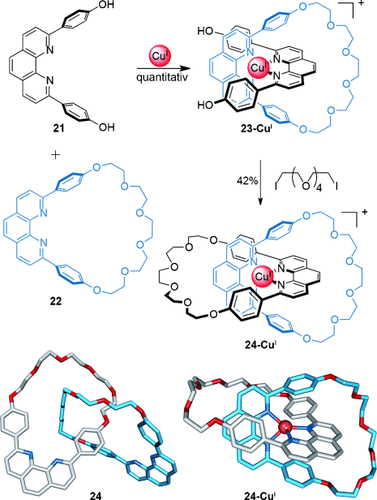
Sauvages Metalltemplatsynthese eines [2]Catenans durch Makrocyclisierung mittels Williamson-Ethersynthese am tetraedrisch koordinierten Komplex 23-CuI, der durch Koordination von Ligand 21 und Makrocyclus 22 an CuI erzeugt wurde.43
Neue Methoden zum Aufbau kovalenter Bindungen finden häufig schnell Anwendung in der Synthese verzahnter Moleküle. Eine doppelte Makrocyclisierung mittels Ringschluss-Olefinmetathese (RCM) verbesserte die Ausbeute an [2]Catenan auf 90 %, wenn geeignete dpp-Liganden44 eingesetzt wurden (Schema 6).
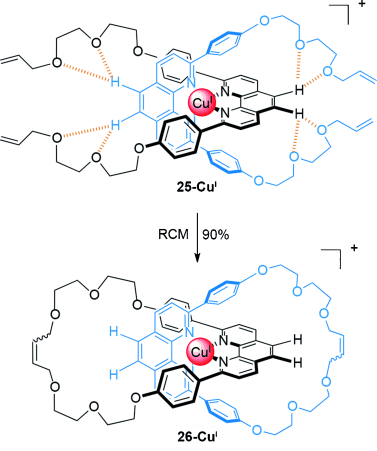
Sauvages Makrocyclisierung mittels Olefinmetathese, um das [2]Catenan 26-CuI in hoher Ausbeute zu bilden.44 Elektrostatische Wechselwirkungen zwischen den Sauerstoffatomen der Glykolether und den aromatischen Protonen der metallkoordinierten dpp-Liganden könnte die intramolekulare Cyclisierung fördern.
Eine wichtige Eigenschaft der Metalltemplatsynthese von Catenanen ist, dass das oder die Metallionen nach dem kovalenten Einfang der verzahnten Topologie entfernt werden können (z. B. Catenan 24, Schema 5). Nach Entfernung des Templats können sich die Makrocyclen relativ unabhängig voneinander bewegen, die Molekularbewegung wird dann kaum durch nichtkovalente Wechselwirkungen beeinflusst, zumindest innerhalb der toplogischen Grenzen.45
Seit der ersten Metalltemplatsynthese mit dpp-Liganden und CuI-Ionen wurde dieses Konzept auf andere Metalle ausgedehnt. Übergangsmetalltemplate mit oktaedrischen,46 trigonal-bipyramidalen,47 quadratisch-planaren48 und linearen49 Koordinationsgeometrien wurden erfolgreich für Catenan-Synthesen verwendet. Kürzlich wurden auch Lanthanoidtemplate zur Synthese verzahnter Moleküle verwendet.50
Die Effektivität des Metalltemplats kann durch die Anwendung reversibler Reaktionen noch weiter gesteigert werden, da sie zuverlässig das thermodynamisch stabilste Produkt bilden, was nach sorgfältiger Syntheseplanung oft ein Catenan sein kann. Iminbildung ist für die Synthese verzahnter Strukturen an Metalltemplaten besonders attraktiv, da sie unter milden Bedingungen stattfindet und Fehlererkennung während des Anordnungsprozesses ermöglicht (Schema 7).46d, 51
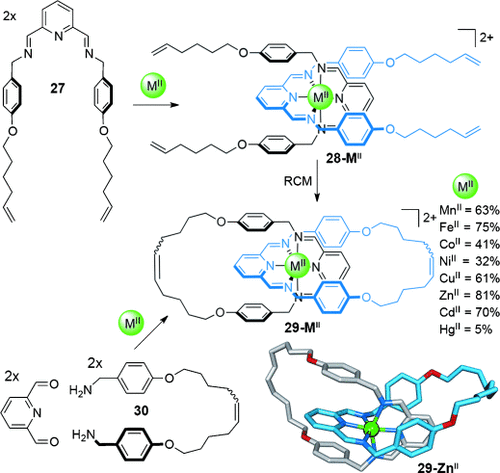
Oktaedrische [2]Catenane 29-MII werden um eine Reihe zweiwertiger Metallionen mittels RCM aus dem Präcatenan 28-MII gebildet oder durch Iminbildung aufgebaut.46d Die angegebenen Ausbeuten beziehen sich auf die Syntheseroute über doppelte RCM. Stabilisierende π-π-Wechselwirkungen zwischen den Phenyl- und Pyridylringen spielen wahrscheinlich eine wichtige Rolle im Aufbauprozess.
Ligand 27 liegt eine Struktur zugrunde, die erfolgreich genutzt wurde, um Benzylamid-Catenane und -Rotaxane aufzubauen.52 Er wurde mit einer dreizähnigen 2,6-Diiminopyridin-Einheit versehen, die den Aufbau von [2]Catenanen über zwei verschiedene Routen ermöglicht. Ein Ansatz nutzt den Präcatenan-Komplex 28-MII. Die folgende doppelte Makrocyclisierung mittels RCM der terminalen Alkene liefert das [2]Catenan 29-MII in guter Ausbeute. Alternativ kann die Catenansynthese unter thermodynamischer Kontrolle durchgeführt werden, dabei wird die reversible Natur der Iminbildung zwischen der Bis(benzylamin)-Kette 30 und 2,6-Diformylpyridin in Gegenwart eines zweiwertigen Metallsalzes ausgenutzt (Schema 7). Die Kristallstrukturen vieler Catenate weisen π-π-Wechselwirkungen zwischen den Liganden auf. Dies wird häufig bei Benzylamid-Catenanen und -Rotaxanen beobachtet und stellt sicher, dass die verzahnte Struktur bevorzugt gegenüber makrocyclischen Produkten gebildet wird.
Auch die Verwendung von Metall-Metall-Anziehungen als alternatives Templat für die Bildung von Catenanen wurde untersucht. Beer und Mitarbeiter fanden heraus, dass das [2]Catenan 32-CuIICuIII (Schema 8) durch eine Umlagerung von Makrocyclus 31-CuII nach partieller Oxidation entsteht.53 Charge-Transfer-Wechselwirkungen zwischen den CuII- und CuIII-Zentren im gemischtvalenten Catenan sind wahrscheinlich die Triebkraft für die Bildung der verzahnten Makrocyclen. Diese Strategie konnte auf CuII-AuIII-Catenane ausgeweitet werden, als Ausgangspunkt dienten zwei homometallische Makrocyclen.54
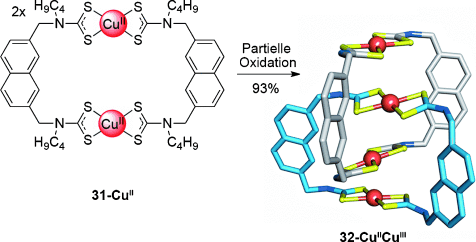
Beers durch partielle Oxidation von Makrocyclus 31-CuII erhaltenes gemischtvalentes [2]Catenan 32-CuIICuIII.53 Alkylketten sind nicht gezeigt.
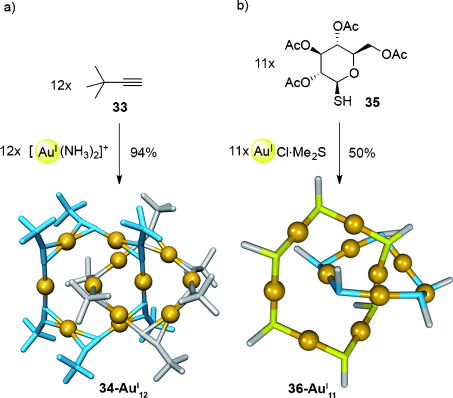
Auch aurophile Wechselwirkungen wurden zum Aufbau von anorganischen Catenanen aus kleinen metallorganischen Fragmenten genutzt. Das erste Beispiel dieser Art wurde von Mingos et al. (Schema 9 a) vorgestellt,55 Alkin 33 wurde mit [Au(NH3)2]+ behandelt, um das [2]Catenan 34-AuI12 zu erhalten. Die Kombination von η1-Au-η1-, η2-Au-η1- und η2-Au-η2-Koordinationsmodi zwischen den Komponenten ergab verzahnte hexamere Makrocyclen, die durch zahlreiche aurophile Wechselwirkungen zwischen den AuI-Zentren stabilisiert werden. Auch AuI-Thiolat-Wechselwirkungen wurden verwendet, um ein [2]Catenan zu bilden (Schema 9 b).56
2.1.2. Aktivtemplatsynthese
Während passive Metalltemplate häufig eine effiziente Möglichkeit darstellen, Liganden zu binden und zu verzahnten Strukturen (oder deren Vorstufen) auszurichten, lassen sie eine weitere wichtige Eigenschaft der Übergangsmetalle ungenutzt, nämlich ihre Fähigkeit, die Reaktion zu katalysieren und kovalente Bindungen zu bilden. Im letzten Jahrzehnt wurden zahlreiche Akivtemplatstrategien entwickelt.57 In der Aktivtemplatsynthese spielt das Metallion eine Doppelrolle: einerseits wirkt es als Templat zur Ausrichtung oder Verschlingung der Komponenten, andererseits katalysiert es die Bindungsbildung, die die verzahnte Struktur kovalent fixiert. In der Aktivtemplatsynthese reichen häufig unterstöchiometrische Mengen des Metalls aus,58 während die Verwendung temporärer Erkennungsstellen die “spurlose” Synthese verzahnter Strukturen ermöglicht.59 Erste Anwendungen der Aktivtemplatsynthese konzentrierten sich auf die Synthese von Rotaxanen,58–60 wurden aber später auch auf Catenane61 und Kleeblattknoten62 ausgedehnt.
Die CuAAC-“Klick”-Reaktion ist die am häufigsten verwendete Reaktion in der Aktivtemplatsynthese.63 Die Synthese eines heterozirkulären (aus zwei verschiedenen Ringen bestehenden) [2]Catenans wurde durch Makrocyclisierung von Strang 37 um den Makrocyclus 3861a (Schema 10 a) erreicht. Zunächst koordiniert ein CuI-Ion an ein Pyridylchelat innerhalb von Makrocyclus 38 und den komplementären Azid- und Alkingruppen von 37 und konzentriert die losen Stränge im Hohlraum des Makrocyclus; so wird ein Überkreuzungspunkt erzeugt. Kovalenter Einfang des verzahnten Produkts wird durch die CuI-katalysierte Cycloaddition der Strang-Enden erreicht und ergibt das [2]Catenan 39 in 53 % Ausbeute. Die Synthese analoger [2]Catenane, deren Makrocyclus ein Bipyridin-Chelat enthält, konnte auch realisiert werden, allerdings waren längere Reaktionszeiten und höhere Konzentrationen nötig.
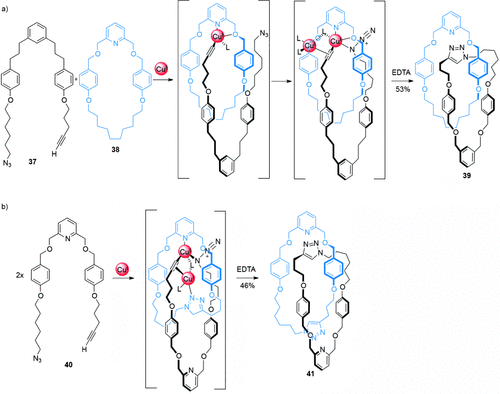
Die Aktivtemplatsynthese von (a) heterozirkulärem [2]Catenan 39 und (b) homozirkulärem [2]Catenan 41 über CuAAC-Makrocyclisierungen.61a
Eine weitere Variation des Konzeptes stellt ein doppelter Makrocyclisierungsprozess mit Strang 40 dar (Schema 10 b): Ein Strang wird in situ zum entsprechenden Makrocyclus geschlossen, und ein zweiter Strang kann sich nun wie schon zuvor durch den Hohlraum fädeln und cyclisiert werden, um das homozirkuläre (aus zwei identischen Ringen bestehende) [2]Catenan 41 zu bilden. Die Effektivität der Aktivtemplatsynthese wird dadurch verdeutlicht, dass das Templat zwei verschiedene bindungsbildende Reaktionen ausführt. Das [2]Catenan wird in befriedigender Ausbeute (46 %) gebildet, makrocyclisches Nebenprodukt fällt nur in geringem Ausmaß (<7 %) an.
Neben der CuAAC-“Klick”-Reaktion wurden [2]Catenane auch durch Aktivtemplatsynthese mittels Cadiot-Chodkiewicz-Kupplung eines terminalen Alkins mit einem Bromalkin61a sowie durch oxidative Alkinhomokupplung hergestellt, bei beiden Reaktionen handelt es sich um CuI-katalysierte Prozesse.61b
2.1.3. Aufbau von Catenanen durch π-π-Wechselwirkungen
Stoddart führte ein wegweisendes Forschungsprojekt zur Synthese von Catenanen und Rotaxanen durch, in dem er Wechselwirkungen zwischen π-elektronenreichen (Donor) und π-elektronenarmen (Akzeptor) aromatischen Ringen nutzte, um molekulare Stränge durch Makrocyclen zu fädeln.64 Das erste Beispiel wurde 1989 veröffentlicht, es handelte sich um die Synthese eines Donor-Akzeptor-[2]Catenans, in der Strang 42 mit Makrocyclus 43 und 1,4-Bis(brommethyl)benzol 44 in Acetonitril65 umgesetzt wurde (Schema 11). Da es keine nennenswerten Wechselwirkungen zwischen Dikation 42 und dem elektronenreichen Makrocyclus 43 gibt, wurde vorgeschlagen, dass der Strang zunächst mit 1,4-Bis(brommethyl)benzol zu einem Trikation reagiert, das ein elektronenarmes Bipyridinium-Motiv aufweist und stark im Hohlraum von 43 gebunden wird (Schema 11, Intermediat in eckigen Klammern). Das [2]Catenan 45 wird in 70 % Ausbeute gebildet und ist auch direkt aus 4,4′-Bipyridin, 1,4-Bis(brommethyl)benzol und dem Makrocyclus 43 zugänglich.66 Dieses Anordnungsmotiv wurde verwendet, um eine große Zahl verzahnter molekularer Systeme zu entwickeln.67
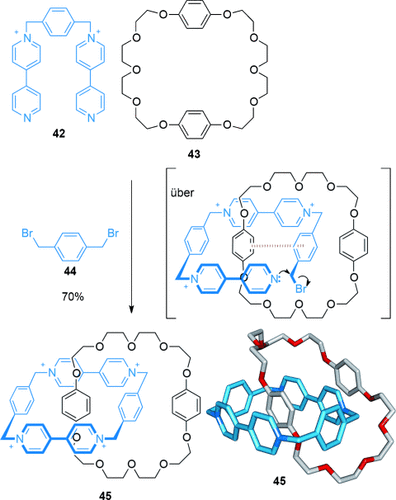
Stoddarts erstes [2]Catenan, mit ausgeprägten Stapeleffekten von elektronenreichen und -armen aromatischen π-Systemen.65
Neutrale Donor-Akzeptor-Ligandensätze, die sich zu Catenanen zusammenfügen, wurden von Sanders entwickelt68 (Schema 12). Sie weisen eine erhöhte chemische Stabilität auf und sind besser in organischen Lösungsmitteln löslich als Stoddarts kationische, Viologen-basierte Makrocyclen und Catenane. Kombination von zwei Strangmolekülen 46 mit dem Makrocyclus 47 liefert nach oxidativer intermolekularer Kupplung der Alkine das [2]Catenan 48.
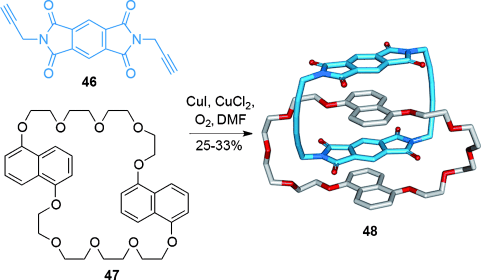
Sanders Verwendung von neutralen π-elektronenreichen und -armen Motiven, um ein [2]Catenan durch oxidative Alkinkupplung aufzubauen.68
Vor kurzem wurden elektronenreiche Pillar[5]aren-Cyclophane für die diastereoselektive Synthese eines [2]Catenans69 genutzt (Schema 13). Strang 49, der eine elektronenarme Pyridiniumeinheit aufweist, und das Pillar[5]aren 50 setzten sich zu einem Pseudorotaxan zusammen. Eine anschließende RCM unter Hochverdünnung (0.5 mM) erzeugte das [2]Catenan 51 (25 %). Die Rotation der Alkoxybenzoleinheiten kann prinzipiell zu acht verschiedenen Diastereomeren von Catenan 51 führen, es konnte allerdings nur ein Diastereomer nachgewiesen werden, die Alkoxybenzole haben also alle dieselbe Orientierung zueinander.70
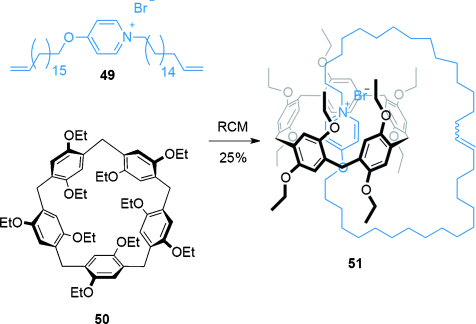
Ogoshis Synthese eines [2]Catenans durch Einfädeln eines Pyridiniumsalzes durch den Hohlraum eines Pillar[5]arencyclophans.69
2.1.4. Wasserstoffbrücken und Halogenbrücken als Template
Neben Übergangsmetalltemplaten und π-Wechselwirkungen werden auch Wasserstoffbrücken in großem Maße genutzt, um verzahnte Moleküle aufzubauen. Das erste System dieser Art wurde durch Zufall entdeckt: Hunter wollte mit 52 einen Rezeptor für p-Benzochinon herstellen71 (Abbildung 7). Um die geringe Ausbeute an 52 (10 %) zu verbessern, sollte die Zwischenstufe 54 zunächst isoliert und dann cyclisiert werden (Schema 14).72, 73 Die Reaktion mit Isophthaloyldichlorid ergab den erwarteten Makrocyclus 52, zusammen mit zwei weiteren Produkten, die beide die doppelte Masse des erwarteten Makrocyclus hatten. Eines der Produkte wurde schnell als der tetramere Makrocyclus 55 (Schema 14) identifiziert, die Charakterisierung des letzten Produktes gestaltete sich hingegen ungleich schwieriger. Das komplexe 1H-NMR-Spektrum und die geringe Polarität der Verbindung wiesen auf eine verzahnte Struktur hin. Durch sorgfältige Analyse der 1H-NMR-Spektren konnte sie als das [2]Catenan 56 (Schema 14) identifiziert werden. Es ist erwähnenswert, dass das Catenan in einer Eintopf-Doppelmakrocyclisierung gebildet wird, bei der zunächst 54 mit Isophthaloyldichlorid zum Makrocyclus 52 cyclisiert wird und anschließend eine zweite Makrocyclisierung im Hohlraum des zuerst gebildeten Makrocyclus stattfindet, die 56 in 34 % Ausbeute erzeugt.

Hunters Benzochinonrezeptor.
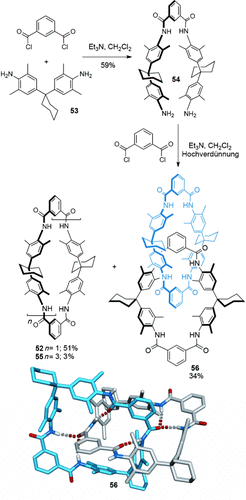
Ungefähr zur gleichen Zeit erforschte der Arbeitskreis von Vögtle die Synthese ähnlicher Amidmakrocyclen,74 und die Kondensation von Diamin 53 und 5-Methoxyisophthaloyldichlorid zur Bildung eines [2]Catenans in 10 % Ausbeute wurde durchgeführt. Wenige Tage nachdem Hunters Catenan 56 veröffentlicht wurde, und vermutlich angeregt durch Hunters ausgedehnte 1H-NMR-Analyse, die die Catenanstruktur bestätigte, reichte er seine eigene Veröffentlichung zur Synthese eines strukturell sehr ähnlichen Catenans ein.75 In beiden Fällen verhindern die sperrigen Cyclohexylgruppen eine freie Rotation der Makrocyclen im [2]Catenan.
In Bezug auf die dynamischen Eigenschaften und ihre potenziellen Verwendung in molekularen Maschinen wurden die Amidcatenane von Hunter und Vögtle weit von einem Benzylamid-[2]Catenansystem übertroffen, das zufälligerweise bei der Synthese eines makrocyclischen CO2-Rezeptors entdeckt wurde.76 Das [2]Catenan 57 wurde in einem Schritt aus Dibenzylamin und Isophthaloyldichlorid (Schema 15) in einer direkten Kondensation von acht Molekülen hergestellt, die das Produkt in 20 % Ausbeute ergibt. Bis heute ist diese einstufige Synthese ausgehend von kommerziell verfügbaren Ausgangsmaterialien, die keine chromatographische Reinigung der Produkte benötigt, eine der einfachsten Arten, ein mechanisch verzahntes Molekül herzustellen. Die Kristallstruktur, die gleichzeitig die erste eines Amidcatenans war, bestätigte die Anordnung der Wasserstoffbrücken und verdeutlichte, dass die Struktur durch ein Netzwerk von π-π-Wechselwirkungen weiter stabilisiert wurde (Schema 15). Im Unterschied zu anderen Amidcatenanen können die Makrocyclen von 57 in Lösung umeinander rotieren.77 Benzylamidcatenane sind im Allgemeinen einfach herzustellen, strukturell sehr vielseitig, und die Dynamik der Ringe ist je nach System variabel und kontrollierbar.78
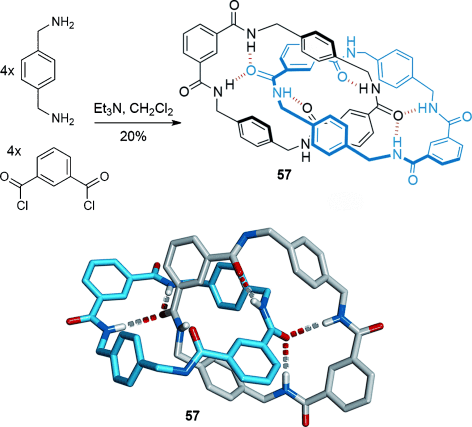
Kondensation von acht Molekülen zum Aufbau des Benzylamid[2]catenans 57.76
Der Arbeitskreis von Beer berichtete über die Verwendung von Halogenbrücken79 in der Templatsynthese von [2]Catenanen. Das [2]Catenan 60-Br− wurde in 24 % Ausbeute mittels RCM aus 58 und 58-Br− erzeugt (Schema 16).80 Wird die Makrocyclisierung in Abwesenheit des Bromidions durchgeführt, konnte nur die Vorstufe 58 isoliert werden, und kein [2]Catenan wurde gebildet.
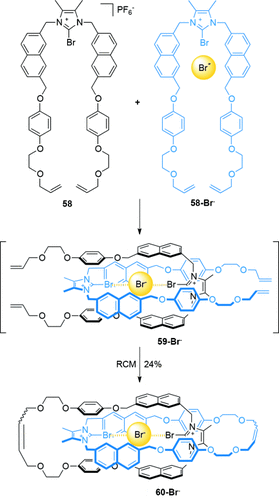
Beers auf Halogenbrücken basierende Synthese von [2]Catenan 60-Br−.80
Eine Pyridiniumiodid-Pyridin-Wechselwirkung könnte eine zentrale Rolle beim Aufbau von [2]Catenan 62 (Schema 17) spielen.81 Die Pseudorotaxan-Komplexvorstufe 61 hat eine deutlich höhere Assoziierungskonstante in Dichlormethan (Ka=(180±20) M−1) als der entsprechende Komplex ohne das Iodatom (Ka=30 M−1). RCM von 61 erzeugte das [2]Catenan 62, allerdings nur in mäßiger Ausbeute (6.5 %).
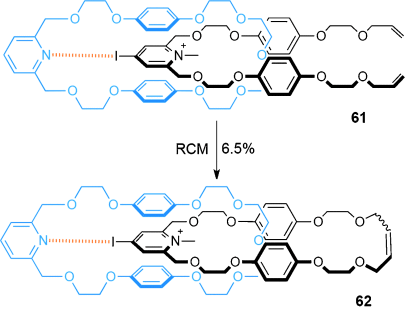
Beers Synthese eines durch Pyridiniumiodid-Pyridin-Wechselwirkung stabilisierten [2]Catenans.81
2.1.5. Durch hydrophobe Effekte gesteuerte Catenansynthesen
Solvophobe Effekte können genutzt werden, um die Verschlingung der Komponenten in der Synthese verzahnter Verbindungen (oder ihrer Vorstufen) zu erleichtern, indem die Oberfläche hydrophober Einheiten und somit die dem polaren Lösungsmittel ausgesetzte Fläche durch Bildung von Einschlusskomplexen minimiert wird.82 Während Cramer und Lüttringhaus’ Versuche,11 ein [2]Catenan aus Cyclodextrinkomplexen herzustellen, in den 1950er Jahren erfolglos geblieben waren (wie in Abschnitt 1.1 beschrieben), konnte Stoddart in den 1990er Jahren verzahnte Produkte mit einem ähnlichen Ansatz herstellen12 (Schema 18). Der Einschlusskomplex von 63 mit Heptakis(2,6-di-O-methyl)-β-cyclodextrin (DM-β-CD, 64) wurde mit Terephthaloyldichlorid cyclisiert und lieferte das [2]Catenan 65 in 3 % Ausbeute.
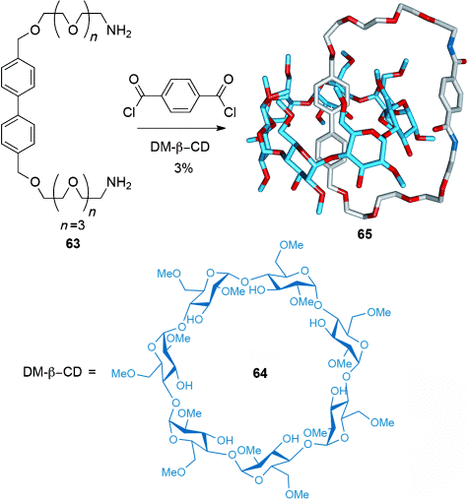
Stoddarts Synthese eines auf hydrophoben Wechselwirkungen basierenden [2]Catenans 65.82
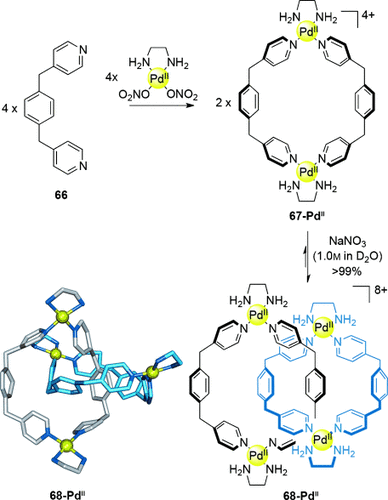
Ferner können hydrophobe Effekte genutzt werden, um im Gleichgewicht eine thermodynamische Bevorzugung der verzahnten Makrocyclen zu erreichen. Dieses Konzept wurde durch Zufall in Form von Fujitas “magischen Ringen”83 entdeckt (Schema 19). In wässrigen alkalischen Lösungen verzahnt sich der Makrocyclus 67-PdII spontan zum [2]Catenan 68-PdII. Bei geringer Konzentration liegt das Gleichgewicht auf der Seite des Makrocyclus, aber bei hoher Konzentration (oder bei hohen Salzkonzentrationen, um den hydrophoben Effekt zu verstärken) liegt fast ausschließlich das [2]Catenan vor.84
2.1.6. Alkalimetallkationen-Template
Während ihre definierten Ionenradien Alkalimetalle zu exzellenten Templaten für Kronenether verschiedener Größen machen,85 sind sie aufgrund des Fehlens gut definierter dreidimensionaler Koordinationsgeometrien ungeeignete Template für verzahnte Moleküle. Trotzdem konnten Chiu und Mitarbeiter ein Beispiel vorstellen, bei dem ein [2]Catenan unter thermodynamischer Kontrolle durch ein Alkalimetallionen-Templat gebildet wird (Schema 20).86 In diesem System wird Diamin 69 mit Dialdehyd 70 in Gegenwart eines Natriumsalzes in einem unpolaren Lösungsmittel durch reversible Iminbildung zu dem [2]Catenan 72-NaI umgesetzt (Schema 20). Um den Templateffekt zu maximieren, wurde als Gegenion das schwach koordinierende Tetrakis[3,5-bis(trifluormethyl)phenyl]borat (TFPB) verwendet. Mit einem Äquivalent NaTFPB bildet sich ausschließlich der Makrocyclus 71-NaI im Reaktionsgemisch (65 % Ausbeute). Werden hingegen nur 0.5 Äquivalente NaTFPB verwendet, so entsteht das [2]Catenan 72-NaI, das nach Reduktion der Imine das [2]Catenan 73 in 17 % Ausbeute über zwei Synthesestufen ergibt.
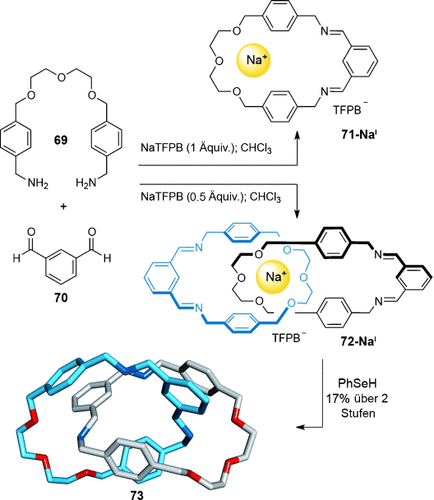
Chius Synthese eines [2]Catenans mit einem NaI-Templat.86
2.1.7. Anionen-Template
Die Verwendung von Anionentemplaten wurde erst im letzten Jahrzehnt verwirklicht.87 Während einige Anionen (z. B. Halogenide und Oxoanionen) aufgrund ihrer geringen Größe und hohen Ladungsdichte starke elektrostatische Wechselwirkungen eingehen können, erschwert das Fehlen vorhersagbarer Koordinationsgeometrien in ihren Assoziierungskomplexen den Einsatz als Template für Überkreuzungspunkte. Beer und Mitarbeiter lösten einige dieser Probleme durch die Verwendung nichtkovalenter Wechselwirkungen im Verbund mit Anionentemplaten, um den Aufbau verzahnter Strukturen zu kontrollieren. Beispielsweise enthält der Makrocyclus 74, der als Baustein für die [2]Catenan-Vorstufe 76-Cl− dient, 1) eine Isophthalamideinheit, um Wasserstoffbrücken zu bilden, 2) Hydrochinongruppen, um π-π-Wechselwirkungen zu ermöglichen, und 3) eine Ethylenglykolkette, um Wechselwirkungen mit elektronenarmen Gruppen bilden zu können; außerdem hilft der gauche-Effekt dabei, eine stabile cyclische Konformation einzunehmen. Dies ermöglicht die Synthese von [2]Catenan 77-Cl− in 45 % Ausbeute (Schema 21).88 Diese Strategie konnte verbessert werden, indem zwei Stränge 75 verwendet wurden, die jeweils eine Diamidopyridiniumeinheit enthalten und um ein einzelnes Chloridion angeordnet werden. Makrocyclisierung durch RCM ergibt ein [2]Catenan in 78 % Ausbeute.89
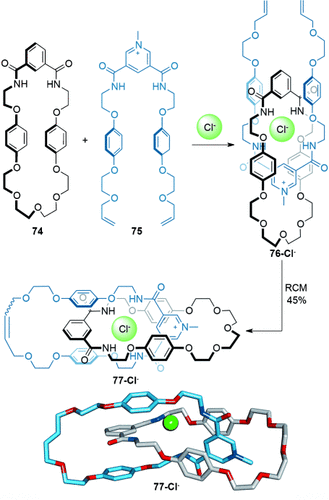
Beers Synthese eines [2]Catenans mit einem Chloridion als Templat.88
2.1.8. Radikal-Radikal-Wechselwirkungen
Die Fähigkeit von stabilen Viologenradikalen, in Lösung zu dimerisieren, ist seit mehr als fünfzig Jahren bekannt,90 die Triebkraft dabei ist die Bildung einer Spezies mit geschlossenschaliger Elektronenkonfiguration. Stoddart und Mitarbeiter stellten kürzlich eine [2]Catenan-Synthese vor, die dieses Dimerisierungsphänomen nutzt (Schema 22).91 Reduktion von 782+ zum Monoradikal mit einem Überschuss an Zinkstaub erzeugte die verschlungene dimere Struktur 792(.+) (Schema 22), und Cyclisierung mit 4,4′-Bipyridin ergab das [2]Catenan 804(.+). Obwohl die Radikale teilweise an Luft abgefangen werden und eine Gleichgewichtsmischung von 802.6+ und 80.7+ entsteht, ist die radikalische Struktur über Wochen bei Umgebungsbedingungen stabil, und es werden Oxidationsmittel benötigt, um vollständig die nichtradikalische Spezies 808+ zu bilden.
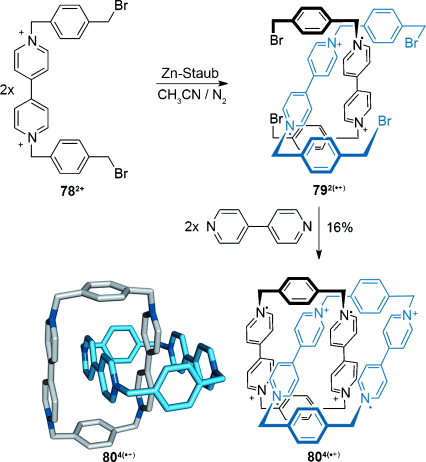
Stoddarts Synthese eines [2]Catenans durch Radikalpaarung.91
2.2. Catenansynthesen mit dynamisch-kombinatorischen Bibliotheken
Dynamisch-kombinatorische Bibliotheken (DCLs), sind aus molekularen Bausteinen bestehende Systeme, deren Komponenten durch reversible Reaktionen miteinander verknüpft werden können und so eine Mischung (“Bibliotheken”) verschiedener Spezies bilden.92 Da die Bestandteile der DCL im Gleichgewicht miteinander stehen, bestimmt die thermodynamische Stabilität der einzelnen Strukturen die Zusammensetzung der Bibliothek. Die Lage des Gleichgewichts kann durch Änderung der Reaktionsbedingungen beeinflusst werden (z. B. durch Zugabe eines Substrats, das nichtkovalent an eine Spezies der Bibliothek bindet und so deren freie Energie herabsetzt).
Sanders und Otto entdeckten ein durch Hydrazonaustausch gebildetes [2]Catenan in einer DCL, deren Bausteine 81 auf Peptiden basierten (Schema 23). Die Bausteine bilden schnell lineare Oligomere, die sich innerhalb von 60 Minuten zu cyclischen Molekülen verschiedener Größen umlagerten. Zugabe von Acetylcholin zu der DCL bewirkte, dass sich die Bausteine vorwiegend zu 82 zusammensetzten – einem [2]Catenan, das aus zwei trimeren Ringen besteht. Obwohl zwei Diastereomere möglich sind (Stereoisomerie durch unterschiedliche Ausrichtung der asymmetrischen Ringe), wird nur ein Diastereomer beobachtet. Der Tripeptidbaustein wurde später von Gagné derartig modifiziert, dass ein aus tetrameren Makrocyclen bestehendes [2]Catenan resultiert.94 In diesem Fall ist die Triebkraft für die Reaktion die Bildung von Wasserstoffbrücken sowie π-π- und CH-π-Wechselwirkungen und nicht die Bindung von Acetylcholin.
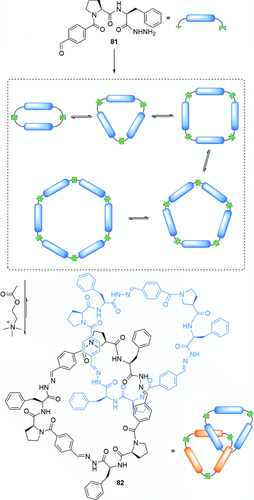
Sanders’ in einer DCL gebildetes und durch Bindung von Acetylcholin verstärktes [2]Catenan.93
[2]Catenane konnten ebenfalls in DCLs erzeugt werden, deren Komponenten mittels Disulfidaustausch verknüpft wurden. Von Sanders entwickelte Systeme nutzen Naphthalindiimid(NDI)- und Dioxynaphthlin(DN)-Motive (Schema 24). Oxidation des dithiolfunktionalisierten NDI 83 und des cysteinfunktionalisierten DN 84 in wässriger NaNO3-Lösung ergab ein aus heterodimeren Ringen (d. h. jeder Ring besteht aus einer NDI- und einer DN-Einheit) bestehendes [2]Catenan 85, dessen Untereinheiten gemäß Donor-Akzeptor-Akzeptor-Donor (DAAD) gestapelt sind.95 Durch Modifizierung des DN-Bausteins in Form von 86 bildete sich ein analoges DAAD-Catenan und ein weiteres Catenan mit einer DADD-Anordnung der Bausteine.96 Die von den [2]Catenanen 85 und 87 eingenommene DAAD-Konfiguration maximiert die π-π-Wechselwirkungen zwischen den Komponenten, während die normalerweise ungünstige Stapelung von π-Donoren durch hydrophobe Effekte und den vorteilhaften Wechselwirkungen im DAD-Stapel überkompensiert wird. Das Fehlen von Catenanen mit der thermodynamisch optimalen DADA-Konformation wurde damit begründet, dass der Hohlraum des Akzeptor-Homodimers zu klein ist, um eine Donoreinheit aufzunehmen.
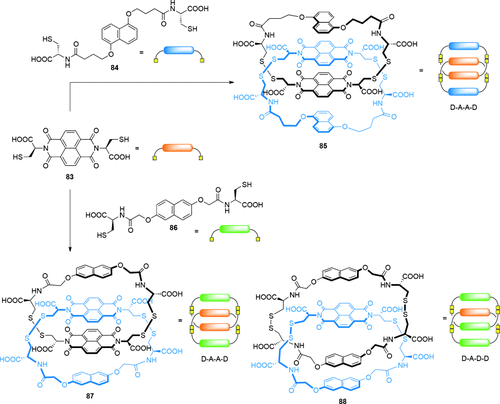
Von Sanders vorgestelltes System, in dem partielle Kontrolle über die Zusammensetzung von [2]Catenanen, die mittels einer disulfidbasierten DCL aufgebaut wurden, über die Auswahl des DN-Bausteins erreicht werden konnte. In beiden Fällen enthält die DCL zu Beginn auch unverzahnte Makrocyclen. Das [2]Catenan 85 wurde durch Zugabe eines kationischen Interkalators, der sich zwischen die inneren NDI-Einheiten einlagert, oder durch Zugabe von polaren Salzen, um den hydrophoben Effekt zu erhöhen, verstärkt gebildet. Das [2]Catenan 87 wurde durch Zugabe polarer Salze verstärkt gebildet, während 88 durch Zugabe eines dreifachen Überschusses an DN 86 relativ zu NDI 83 oder Erhöhung der Ionenstärke des Lösungsmittels verstärkt gebildet wurde.95, 96
3. Lineare und radiale [n]Catenane höherer Ordnung
3.1. [n]Catenane
Die Verzahnung zweier Makrocyclen kann zu einer Vielzahl topologisch isomerer [2]Catenane führen (z. B. Hopf-Verschlingung, Salomonische Verschlingung, Davidstern-Catenan usw., siehe Abschnitt 4). Die Addition eines weiteren Makrocyclus eröffnet eine weitere Möglichkeit zur Topoisomerie, in der die Konnektivität der Ringe variiert werden kann (z. B. lineare und cyclische Catenane, Abbildung 8 a). Hinzufügen von weiteren Makrocyclen erhöht sowohl die Zahl als auch die Komplexität der Verknüpfungsmöglichkeiten (Abbildung 8 b). So ist für ein [4]Catenan sowohl eine lineare als auch eine radiale Anordnung möglich. Die Zahl der Verkettungsmöglichkeiten steigt rasch mit der Zahl der beteiligten Komponenten (z. B. in Form von Catenan-Netzwerken, Abbildung 8 b).
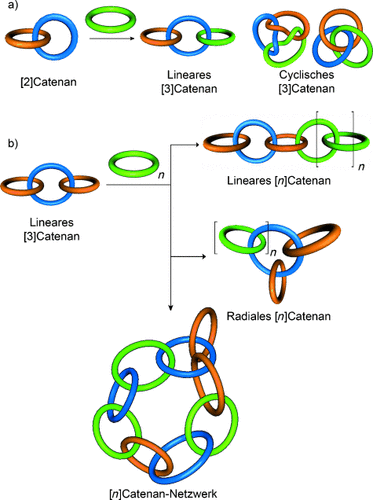
Klassifizierung von [n]Catenanen höherer Ordnung (n>2). a) Topoisomere [3]Catenane. b) Das Hinzufügen von weiteren Makrocyclen zu einem linearen [3]Catenan ergibt weitere Topoisomere.
3.1.1. Lineare [n]Catenane
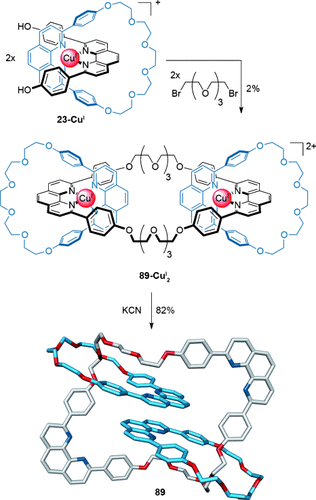
Das erste lineare [3]Catenan wurde von Schill über eine aufwendige vielstufige Synthese hergestellt, die auf seiner gerichteten [2]Catenan-Synthese aufbaute (siehe Abschnitt 1.1).15 Später wendete Sauvage die Metalltemplatsynthese an, um zwei Metallopseudorotaxane 23-CuI zu einem [3]Catenan 89-CuI2 zu verknüpfen, wenn auch nur in 2 % Ausbeute (Schema 25).97 Das Metallcatenat wurde mit Kaliumcyanid demetalliert, um den metallfreien [3]Catenand 89 zu erhalten.98 Eine Weiterentwicklung ersetzte die Williamson-Ethersynthese durch eine oxidative Alkinkupplung für die intermolekulare Makrocyclisierung; die Ausbeute an [3]Catenan konnte so auf 58 % erhöht werden.99
Durch Vergrößerung des Durchmessers des elektronenarmen Makrocyclus machte die Gruppe von Stoddart es möglich, zwei elektronenreiche Makrocyclen mit einem tetrakationischen Cyclophan zu verschlingen.100 Das durch Addition von 90 an 91 entstehende Trikation ist groß genug, um von zwei Makrocyclen umwickelt zu werden, die entweder Hydrochinon- (43) oder 1,5-Dioxynaphthalineinheiten (47) tragen (Schema 26). Die resultierenden [3]Catenane 92 und 93 wurden in 20 % bzw. 31 % Ausbeute isoliert.
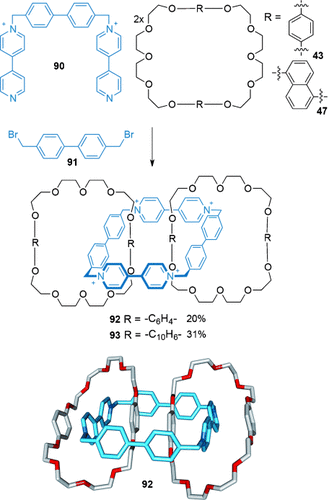
Stoddarts Aufbau von [3]Catenanen.100
Ein ähnlicher Ansatz wurde angewendet, um ein lineares [5]Catenan aufzubauen, das von Stoddarts Arbeitskreis “Olympiadan” getauft wurde, da es dieselbe Topologie aufweist wie die Olympischen Ringe.101 Der Einbau zusätzlicher elektronenreicher 1,5-Dioxynaphthalin-Gruppen in den großen Kronenether-Makrocyclen von [3]Catenan 96, um eine weitere Cyclisierung von Dikation 42 und 1,4-Bis(brommethyl)benzol 44 zu ermöglichen, ergab das [5]Catenan 97 in 5 % und das [4]Catenan 98 in 31 % Ausbeute (Schema 27). Die Ausbeute der Catenanbildung wurde durch Ultrahochdruckbedingungen verbessert (97: 31 % bei 12 kbar), außerdem wurden nichtlineare [6]- und [7]Catenane in 28 % bzw. 26 % Ausbeute erzeugt. Ultrahochdruckbedingungen verbessern die Ausbeuten vermutlich deshalb, weil sich die Gesamtteilchenzahl bei der Reaktion zum Produkt verringert.
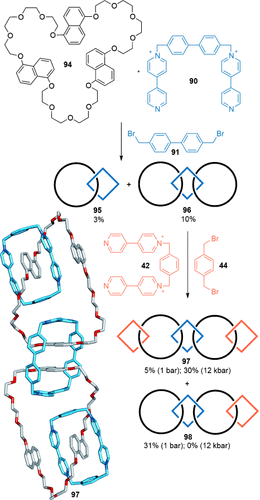
Stoddarts lineares [5]Catenan “Olympiadan”.101
Beispiele für diskrete lineare [4]- oder [5]Catenane sind immer noch selten, hingegen umfassen erfolgreiche Strategien zur Synthese linearer [3]Catenane einen amidbasierte [3]Catenan-Rotationsmotor (siehe Abschnitt 5.2),102 Fujitas PdII-[3]Catenan,103 Loebs Wirt-Gast-[3]Catenan104 und Sanders’ mittels einer DCL gebildeten [3]Catenan.105
3.1.2. Radiale [n]Catenane: Fädeln von n-1 Makrocyclen auf einen zentralen Makrocyclus
Sauvage berichtete 1991 über die ersten radialen [n]Catenane, die er als “Multicatenane” bezeichnete.106 Ähnlich der Synthese linearer [3]Catenane (Schema 25) wurden durch intermolekulare Cyclisierung CuI-komplexierter Pseudorotaxane mit Alkinfunktionalitäten (99-CuI) Catenate mittels oxidativer Homokupplung hergestellt (Schema 28). Neben dem erwarteten [3]Catenat 100-CuI2, das in 23 % Ausbeute gebildet wurde, konnte auch ein Dreikernkomplex in 23 % Ausbeute isoliert werden, der als ein [4]Catenat aus einem zentralen 66-gliedrigen Hexa-In-Ring und drei peripheren 30-gliedrigen Ringen interpretiert wurde. Anscheinend bildeten sich in der Reaktion auch Homologe höherer Ordnung, Elektrospray-Massenspektrometrie des Rohproduktes lieferte Hinweise auf radiale [n]Catenate mit bis zu sechs Ringen an einem zentralen Makrocyclus.
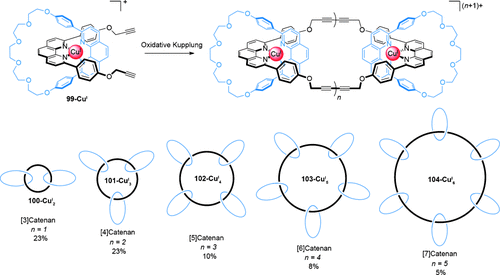
Sauvages durch oxidative Homokupplung von alkinfunktionalisierten Pseudorotaxanen erzeugente radiale [n]Catenane, detektiert mittels ESI-MS. Die Ausbeuten basieren auf den m/z-Peakintensitäten und sind Näherungswerte. Die Catenane 100-CuI2, 101-CuI3 und 102-CuI4 konnten mittels chromatographischer Methoden isoliert werden, 103-CuI5 und 104-CuI6 hingegen nicht.106
Ein radiales [4]Catenan 110-ZnII, zusammengesetzt aus einem aus sechs Porphyrineinheiten bestehenden Nanoring und drei mechanisch verzahnten Phenanthrolinmakrocyclen 106, wurde von Anderson und Mitarbeitern61c synthetisiert (Schema 29). Das Rotaxan-Porphyrindimer 107-ZnII wurde in 61 % Ausbeute durch Aktivtemplat-Glaser-Homokupplung von zwei monosilylgeschützten Dialkinylporphyrinen 105-ZnII im Hohlraum von Phenanthrolinmakrocyclus 106 erhalten. Entschützung der Alkine gab 108-ZnII, das mittels oxidativer Homokupplung in Gegenwart des Hexapyridyltemplats 109 in 62 % Ausbeute zu dem [4]Catenan 110-ZnII umgesetzt werden konnte. Durch Behandlung mit DABCO wurde das Templat 109 in 89 % Ausbeute entfernt.
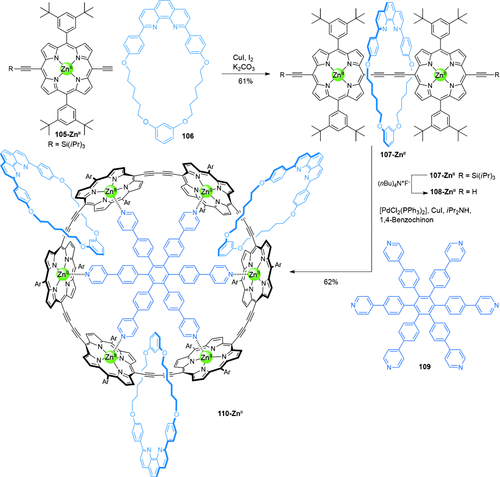
Andersons Synthese des radialen [4]Catenans 110-ZnII.61c
Kim verknüpfte drei Cucurbituril-Diammonium-Pseudorotaxane107 111 durch Platin-Pyridin-Koordination zu einer cyclischen Anordnung. So entstand eine “molekulare Halskette” in Form des radialen [4]Catenans 112-PtII in 90 % Ausbeute (Schema 30).108 Wird das Substitutionsmuster des Pyridins von 4- nach 3-Substitution geändert, so erhielt man das radiale [5]Catenan 114-Pt in 84 % Ausbeute (Schema 31).109 Ein Strang mit Phenanthrolinliganden wurde genutzt, um zwei Pseudo[3]rotaxane mit CuII-Ionen zu einem ähnlichen radialen [5]Catenan zu verknüpfen.110
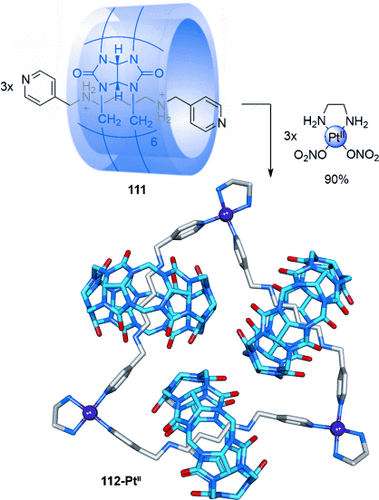
Kims Synthese eines radialen [4]Catenans 112-PtII, das als eine “molekulare Halskette” bezeichnet wurde. Das Catenan besteht aus aufgefädelten Cucurbituril-Makrocyclen, die über PtII-Ionen miteinander verknüpft sind.108
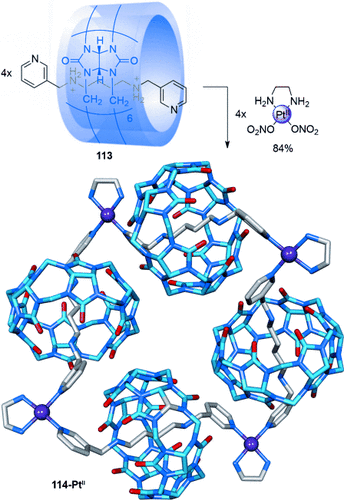
Kims radiales [5]Catenan.109
Böhmer und Mitarbeiter zeigten die Bildung einer [8]Catenan-artigen Struktur 117 mittels Ringschluss an einem durch Wasserstoffbrücken zusammengehaltenen Dimer der Calix[4]arene 115 und 116 (Schema 32).111 Wenn 115 durch ein Calix[4]aren ersetzt wird, dessen intramolekulare Cyclisierung zwei anellierte Ringe erzeugt, wird ein verwandtes Bis([3]catenan) gebildet.
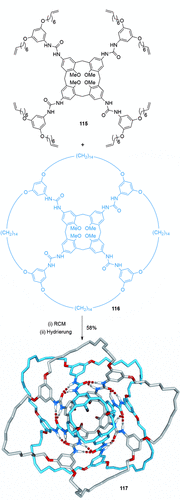
Böhmers aus verzahnten Calix[4]aren-Dimeren bestehende [8]Catenan-artige Struktur. Wasserstoffbrücken zwischen den Harnstoffeinheiten werden durch gestrichelte Linien visualisiert.111
3.1.3. Andere [3]Catenan-Topologien
Mithilfe eines Lanthanoidtemplats synthetisierten Gunnlaugsson und Mitarbeiter eine verzahnte Struktur, die als cyclisches [3]Catenan interpretiert wird (Schema 33).50a Drei Äquivalente des Pyridyldiamidliganden 118 koordinieren an ein einzelnes EuIII-Kation, um eine Anordnung zu erzeugen, die durch intramolekulare Cyclisierung der Komponenten mittels RCM ein [3]Catenan ergibt. Da in diesem Fall nur eine geringe Präorganisation der Liganden erreicht wird, ist es jedoch auch möglich, dass sich beim “Zuklipsen” andere Topologien gebildet haben (Makrocyclen, [2]Catenane oder Knoten). Sowohl 1H-NMR-Spektroskopie als auch Massenspektrometrie wiesen darauf hin, dass der Komplex im Laufe der Reaktion vollständig geschlossen wurde. Der Nachweis von [2]Catenanen bestehend aus zwei Äquivalenten 118 als Nebenprodukt weist auf die Bildung von 119-EuIII hin und darauf, dass der Intraliganden-Ringschluss in diesem Lanthanoidtemplat-System bevorzugt wird.
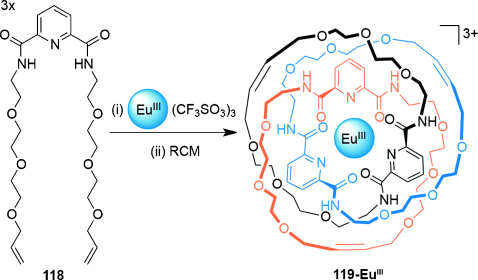
Gunnlaugssons Lanthanoid-Templatsynthese einer scheinbaren  -Verschlingung.50a
-Verschlingung.50a
3.1.4. [n]Catenan-Netzwerke
Die Natur vermeidet das Vakuum; das Verweben und Verschlingen von Ringen während der Kristallisation zu unendlich ausgedehnten Catenanstrukturen ist weit verbreitet. So gibt es unter anderem Derivate von Makrocyclen und Käfigen, die dynamische Bindungen (z. B. koordinative Bindungen) bilden.112 Die Verzahnung wird durch Maximierung der Van-der-Waals-Wechselwirkungen verursacht und nicht durch Wechselwirkung bestimmter Erkennungsmotive. Solvatation des Netzwerks nimmt der Polycatenanbildung die Triebkraft und löst üblicherweise den Abbau des Netzwerks aus. Da die üblichen Eigenschaften verzahnter Moleküle wie starke Amplituden der Komponentenbewegung in dicht gepackten kristallinen Strukturen normalerweise nicht beobachtet werden, ist die Nützlichkeit solcher Architekturen gegenwärtig unklar.
Polycatenan-Netzwerken werden einige der frühesten Effekte mechanischer Bindung zugeschrieben. Die anomalen physikalischen Eigenschaften von Polysiloxanen wurde in den 1950er10 Jahren verzahnten cyclischen Polymeren zugeschrieben, ebenso wie das Depolymerisationsverhalten und die gummiartige Elastizität von polymerem Phosphonitrilchlorid.113 Ein halbes Jahrhundert später schlugen Endo und seine Mitarbeiter vor, dass sich bei der Substanzpolymerisation von 1,2-Dithian 120 Polycatenannetzwerke bilden (121; Schema 34 a). Deutliche Unterschiede in den thermischen und physikalischen Eigenschaften von 121 im Vergleich zu linearen Poly(1,2-dithianen) mit Benzylmercaptan-Endgruppen (Schema 30 b) und cyclischen Poly(oxoethylenen) lassen auf eine neue Netzwerktopologie schließen. Nach der Polymerisation von 120 in Gegenwart von 122 ist es unmöglich, 122 aus dem entstehenden Polymergemisch zu entfernen, obwohl sich die Löslichkeit der Polymere in Methanol stark unterscheidet. Dies legt die Bildung eines verzahnten Netzwerkes nahe. Eine analoge Untersuchung von Ringöffnungspolymerisationen von 1,4-Dihydro-2,3-benzodithiin ergab ein Polymer mit ähnlichen Eigenschaften wie 121.115
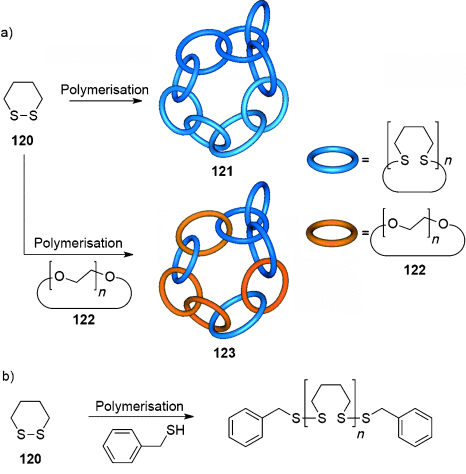
a) Endos durch Polymerisation von 1,2-Dithian erhaltene Polycatenan-Netzwerke. b) Synthese linearer Poly(1,2-dithiane).114
3.2. Verzahnte Käfigmoleküle
Die Verzahnung von Käfigmolekülen kann durch die Interpenetration von Käfigflächen zu neuen Catenantopologien führen. Das erste käfigbasierte Catenan wurde von Fujita in einer Eintopf-Zehnkomponenten-Selbstaufbaureaktion beschrieben (Schema 35).116 In D2O kombinierten sich sechs Äquivalente quadratisch-planar koordinierender PdII- oder PtII-Kationen mit jeweils zwei Äquivalenten der tripodalen pyridinbasierten Liganden 124 und 125 zu dem verzahnten Käfig 126-MII. Hydrophobe Effekte, zusammen mit π-π-Wechselwirkungen zwischen den Komponenten, führen zur Bildung des Catenans unter thermodynamischer Kontrolle.
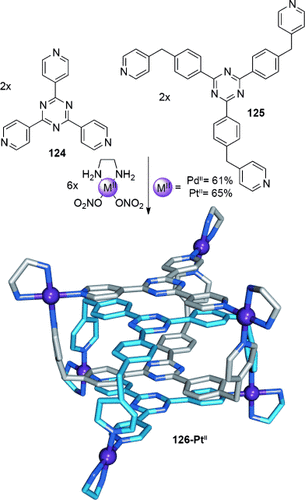
Fujitas über Selbstorganisation von vier organischen Liganden mit sechs quadratisch-planar koordinierten Metallkationen (PdII oder PtII)116 gebildeter dreifach verzahnter Käfigkomplex. Der Abstand zwischen den aromatischen Flächen ist ideal für starke π-π-Stapeleffekte mit einem weiteren, interkalierten Käfig.
Seitdem wurden zahlreiche weitere Käfigtopologien beschrieben, die auf Metall-Ligand-Koordination beruhen, wie Hardies dreifach verzahnte chirale Käfige basierend auf CoII- und ZnII-Koordination,117 Kurodas viersträngige PdII-Käfige118 und Clevers verzahnte phenothiazinhaltige PdII-Käfige.119
Die Syntheserouten sind allerdings nicht auf Systeme beschränkt, die Metallkoordinationsbindungen enthalten. Beer und Mitarbeiter nutzten Sulfationen als Templat, um den Catenankäfigkomplex 130-SO42− zu bilden (Schema 36).120 Die Struktur wurde mittels 1H-NMR-Spektroskopie, Massenspektrometrie und diffusionsgeordneter NMR-Spektroskopie (DOSY) bestätigt.
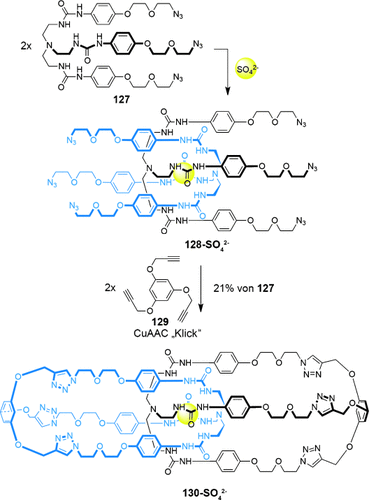
Beers Templatsynthese eines Catenankäfigmoleküls an Sulfationen.120
Eine alternative Strategie, um dreifach verzahnte Käfige herzustellen, wurde durch Zufall von Cooper und Mitarbeitern entdeckt.121 In Gegenwart von Trifluoressigsäure bilden Trialdehyd 131 und ein geeignetes Diamin 132 Kristalle der [2]Catenan-Käfige 134 a, 134 b oder 134 c (ausgehend von Diamin 132 a, 132 b bzw. 132 c; Schema 37). Bemerkenswerterweise wird das verzahnte Produkt gebildet, obwohl kein offensichtliches Erkennungsmotiv vorhanden ist, das die Käfige zusammenhält. Es ist möglich, dass das Catenan am besten aus der Reaktionsmischung auskristallisiert (die verzahnte Struktur füllt wahrscheinlich besser den leeren Raum aus und maximiert die Van-der-Waals-Wechselwirkungen im Festkörper), während die reversible Iminbildung nach dem Prinzip von Le Châtelier während des mehrwöchigen Kristallisationsprozesses ständig [2]Catenan nachproduziert. Die gebildeten Catenankäfige sind allerdings relativ stabil, wenn sie nach dem Kristallisationsprozess unter neutralen Bedingungen gelöst werden, was dadurch zu erklären ist, dass sie durch den langsamen Iminaustausch kinetisch eingefangen sind.
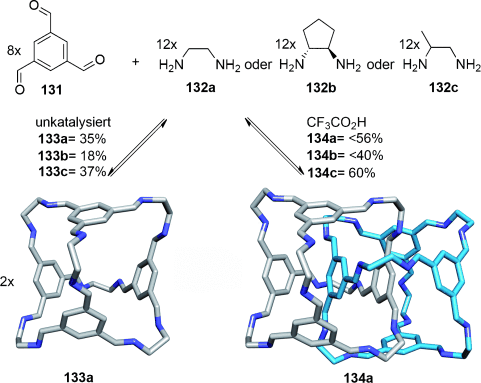
Ein [2]Catenan-Käfig wurde vor kurzem von Mastalerz und Mitarbeitern beschrieben.123 Durch reversible Boronsäureesterbildung wurde aus 40 Komponenten ein vierfach verzahntes Catenan aufgebaut. Die Arbeitskreise von Nitschke und Sanders haben die Synthese des [7]Catenans 136-FeII (Schema 38) beschrieben, basierend auf einem tetraedrischen Metall-organischen Käfigkomplex, bei dem jeweils ein Makrocyclus auf jede Käfigkante gefädelt ist.124
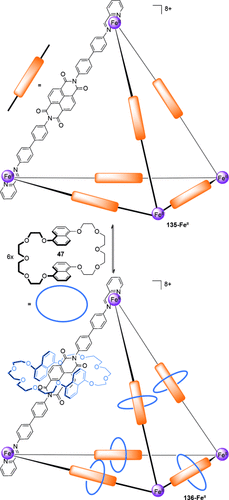
Nitschke und Sanders’ [7]Catenat basierend auf der dynamischen Einfädelung von Makrocyclen um jede Kante des Käfigs.124
4. Verschlungene [n]Catenane höherer Ordnung
Die Einführung zweier zusätzlicher Überkreuzungspunkte zu einer Hopf-Verschlingung (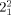 -Verschlingung) erzeugt ein intrinsisch chirales, doppelt verschlungenes [2]Catenan, das umgangssprachlich auch als ein Salomonischer Knoten bekannt ist. Da es sich jedoch bei dieser Topologie um eine Verschlingung und nicht um einen Knoten handelt (eine
-Verschlingung) erzeugt ein intrinsisch chirales, doppelt verschlungenes [2]Catenan, das umgangssprachlich auch als ein Salomonischer Knoten bekannt ist. Da es sich jedoch bei dieser Topologie um eine Verschlingung und nicht um einen Knoten handelt (eine 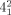 -Verschlingung in der Alexander-Briggs-Notation), wird sie von Chemikern als Salomonische Verschlingung bezeichnet. Werden zwei weitere Überkreuzungspunkte hinzugefügt, kann dies zu einem dreifach verschlungenen Davidstern-[2]Catenan (
-Verschlingung in der Alexander-Briggs-Notation), wird sie von Chemikern als Salomonische Verschlingung bezeichnet. Werden zwei weitere Überkreuzungspunkte hinzugefügt, kann dies zu einem dreifach verschlungenen Davidstern-[2]Catenan (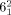 -Verschlingung) führen. Mit nur wenigen bislang erfolgreichen Synthesen stellen Catenane, in denen die Ringkomponenten mehrmals ineinander verschlungen sind, eine wichtige Herausforderung für Organiker dar.
-Verschlingung) führen. Mit nur wenigen bislang erfolgreichen Synthesen stellen Catenane, in denen die Ringkomponenten mehrmals ineinander verschlungen sind, eine wichtige Herausforderung für Organiker dar.
4.1. Molekulare Salomonische Verschlingungen
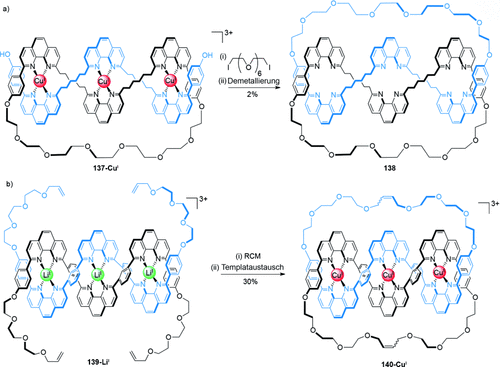
Durch die Cyclisierung eines linearen doppelsträngigen Helicates, das drei Metallzentren enthält, führte die Gruppe von Sauvage die erste Synthese einer Salomonischen Verschlingung durch (Schema 39).125 Die Cyclisierung des verschlungenen und eingefädelten Komplexes 137-CuI durch eine Williamson-Ethersynthese erzeugte die Salomonische Verschlingung 138, nach einer Demetallierung, mit 2 % Gesamtausbeute (Schema 39 a). Eine effizientere Synthese verlief über das Lithiumhelicat 139-LiI, das durch doppelte Olefinmetathese cyclisiert wurde und die entsprechende Salomonische Verschlingung 140-CuI, nach einem Metallionenaustausch, mit 30 % Ausbeute ergab (Schema 39 b).126
Während der Einsatz längerer linearer Helicate theoretisch die Zahl an Überkreuzungspunkten erhöhen könnte, muss diese Strategie jedoch noch für die Herstellung molekularer Knoten und Verschlingungen zugänglich gemacht werden. Indem das lineare Helicat länger wird, wächst allerdings auch der Abstand zwischen den Endpunkten, die verknüpft werden sollen, und somit wird die Synthese rasch unmöglich.127 Kreisförmige Helicate bieten den Vorteil kleinerer Abstände während der Cyclisierung, jedoch auf Kosten einer steigenden Zahl auszuführender Verknüpfungen. Kreisförmige Helicate wurden erfolgreich angewendet, um molekulare Knoten und Verschlingungen einschließlich der Salomonischen Verschlingung herzustellen (Schema 40).
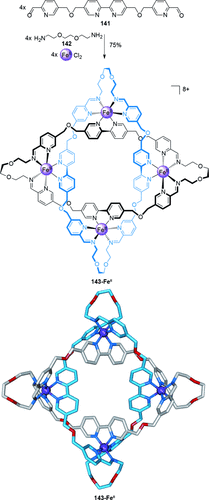
Die Eintopfsynthese einer Salomonischen Verschlingung basierend auf einem tetrameren kreisförmigen Helicat.129
Bisaldehyd 141 reagiert mit Aminbausteinen und bildet einen dreizähnigen Liganden, der an den von Lehn entdeckten Oligo(bipyridin)-Liganden erinnert, gefolgt von dem Aufbau eines tetrameren kreisförmigen Helicats zusammen mit Übergangsmetallionen.128 Durch Erhitzen eines äquimolaren Gemisches von Dialdehyd 141, Diamin 142 und FeCl2 wird die Salomonische Verschlingung 143-FeII mit 75 % Ausbeute gebildet (Schema 40).129 Die Bildung des dreizähnigen Liganden in situ ermöglicht die Selbstorganisation eines tetrameren kreisförmigen Helicats durch Koordination von FeII, in dem die parallel verlaufenden Ligandenstränge durch die neu gebildeten Bisimin-Verknüpfungen kovalent verbunden werden. Die Effektivität dieses Vorgehens wird der Kombination von den dynamischen und reversiblen Iminbindungen und der Metallionen-Ligand-Koordination zugeschrieben, die Fehler in der Verknüpfung korrigieren. Hinzu kommt der gauche-Effekt in der Glykolverknüpfung, der eine energetisch günstige Cyclisierung der Struktur ermöglicht.
Wie bei der Hopf-Verschlingung, einem [2]Catenan, wurden auch Salomonische Verschlingungen synthetisiert, die Metallkationen im Molekülgerüst enthalten. Puddephatt und Mitarbeiter stellten die Salomonische Verschlingung 145-AuI her, die aus dem Dialkinylgold-Polymer 144-AuI und den zugegebenen Diphosphanliganden besteht, welche um die Koordination der Metallionen konkurrieren (Schema 41).130 Aurophile Wechselwirkungen zwischen den Goldkationen, enthalten in jeder der Ringkomponenten des Catenans, treiben die Bildung der Salomonischen Verschlingung 145-AuI an.
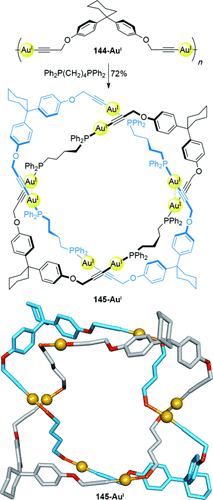
Puddephatts Salomonische Verschlingung, erzeugt durch die Umlagerung eines Dialkin-AuI-Polymers, ausgelöst durch die Zugabe von koordinierenden Diphosphanliganden. Phosphophenyl-Gruppen sind in der Kristallstruktur nicht abgebildet. Au-Au-Abstände: 3.130(2) und 3.239(2) Å.130
Vor kurzem beschrieben Severin und Mitarbeiter die Bildung einer großen Salomonischen Verschlingung mit der Verwendung von CuI-Templaten für die Organisation von Pyridin-derivatisierten Bispyridin-Liganden, die durch Koordination zu PtII verbunden sind (Schema 42).131 Wenn der Ligand 146 mit [Pt(dppp)(OTf)2] (dppp=1,3-Bis(diphenylphosphanyl)propan) und [Cu(MeCN)4]BF4 im stöchiometrischen Verhältnis 2:2:1 kombiniert wurde, erhielt man die Salomonische Verschlingung 147-PtIICuI. Zwölf PtII-Konnektoren bilden zwei gewölbte sechskernige Makrocyclen, während sechs CuI-Bispyridin-Komplexe zu einer verflochtenen Topologie führen. Andere Beispiele von Salomonischen Verschlingungen umfassen Systeme nahe verwandt mit den Borromäischen Ringen von Stoddart,132 und ein kürzlich erschienener Bericht weist darauf hin, dass eine Salomonische Verschlingung in einer dynamisch-kombinatorischen Bibliothek gebildet wurde.133 Eine verwandte Topologie (“Salomonischer Würfel”) wurde von Hardie und Mitarbeitern publiziert.134
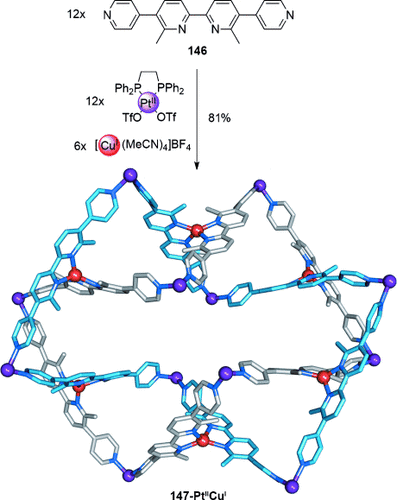
Severins Salomonische Verschlingung, welche eine 2:1-Mischung aus quadratisch planar und tetraedrisch koordinierten Metallkationen enthält. Die dppp-Liganden um die PtII-Metallzentren sind in der Kristallstruktur nicht abgebildet.131
4.2. Ein Davidstern-[2]Catenan
In ihrer einfachsten Darstellung enthält die Davidstern-Topologie (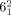 -Verschlingung) zwei Ringe, die dreimal ineinander verflochten sind und somit sechs alternierende Überkreuzungspunkte bilden. In der molekularen Terminologie kann der Davidstern als ein dreifach verschlungenes [2]Catenan angesehen werden. Wie die Salomonische Verschlingung (
-Verschlingung) zwei Ringe, die dreimal ineinander verflochten sind und somit sechs alternierende Überkreuzungspunkte bilden. In der molekularen Terminologie kann der Davidstern als ein dreifach verschlungenes [2]Catenan angesehen werden. Wie die Salomonische Verschlingung ( -Verschlingung), ist auch diese Topologie intrinsisch chiral. Die Synthese des Davidstern-[2]Catenans wurde verwirklicht, indem die funktionellen Endgruppen eines hexameren ringförmigen Helicats in einer Olefinmetathese verbunden wurden (Schema 43).135 Struktur und Topologie wurden mittels Röntgenstrukturanalyse bestätigt. Der Schlüssel zur erfolgreichen Synthese sind die eingebauten ortho-substituierten Phenylgruppen in den Alken-Konnektoren. Die Drehung der Phenylgruppe schränkt die Konformation der Konnektoren ein und lenkt diese so, dass sie korrekt verknüpft werden. Demetallierung von 150-FeII ergab das komplett organische Davidstern-[2]Catenan.
-Verschlingung), ist auch diese Topologie intrinsisch chiral. Die Synthese des Davidstern-[2]Catenans wurde verwirklicht, indem die funktionellen Endgruppen eines hexameren ringförmigen Helicats in einer Olefinmetathese verbunden wurden (Schema 43).135 Struktur und Topologie wurden mittels Röntgenstrukturanalyse bestätigt. Der Schlüssel zur erfolgreichen Synthese sind die eingebauten ortho-substituierten Phenylgruppen in den Alken-Konnektoren. Die Drehung der Phenylgruppe schränkt die Konformation der Konnektoren ein und lenkt diese so, dass sie korrekt verknüpft werden. Demetallierung von 150-FeII ergab das komplett organische Davidstern-[2]Catenan.
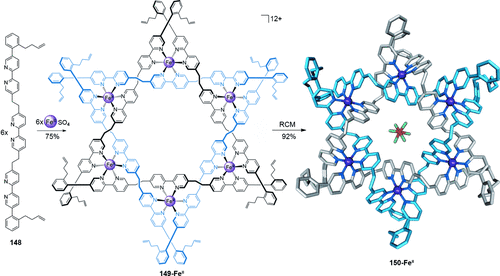
Ein Davidstern-[2]Catenan, synthetisiert durch RCM eines hexameren ringförmigen Helicatgerüsts. In der Kristallstruktur 150-FeII ist ein PF6−-Ion gezeigt, das sich im zentralen Hohlraum des Helicates befindet, so orientiert, dass die Fluoratome auf die zwölf elektronenarmen Protonen in der Wand des Hohlraumes gerichtet sind. CH⋅⋅⋅F-Abstand: 1.88–2.43 Å.135
4.3. Molekulare Borromäische Ringe
Borromäische Ringe, die einfachste Art von Brunnschen Verschlingungen, sind [3]Catenan-Topoisomere, in denen keine der Ringkomponenten ineinander verschlungen ist, jedoch kann der Gesamtaufbau nicht getrennt werden, ohne dass einer der Ringe gebrochen wird.136
Eine Eintopf-Metalltemplatsynthese des molekularen Borromäischen Ringes 153-ZnII aus sechs 2,6-Diformylpyridinliganden (151), sechs Bipy-basierten Liganden (152) mit terminalen primären Aminogruppen und sechs ZnII-Ionen wurde von Stoddart und Mitarbeitern beschrieben (Schema 44).137 Die Borromäische Ring-Topologie wurde mittels Röntgenstrukturanalyse bestätigt, die auch π-π-Wechselwirkungen zwischen den phenolischen und den Bipyridylringen offenbarte, die wahrscheinlich den Prozess des Zusammenbaus unterstützen. Die ZnII-Template konnten von der Struktur durch Reduktion der Iminbindungen mit NaBH4 entfernt werden, gefolgt von einer Demetallierung mit Ethylendiamintetraessigsäure (EDTA), welche die metallfreien Borromäischen Ringe hervorbrachte.138 Die Synthese von Borromäischen Ringen unter Verwendung derselben oder ähnlicher Liganden, aber mit anderen Übergangsmetallen (CuII, CoII, MnII und CdII) als Templat wurde ebenfalls verwirklicht. Wurden jedoch äquimolare Mengen von Zn(OAc)2 und Cu(OAc)2 in einem Versuch angewendet, heterometallische Borromäische Ringe zu bilden, resultierte dies stattdessen in einer heterometallischen Salomonischen Verschlingung.132a
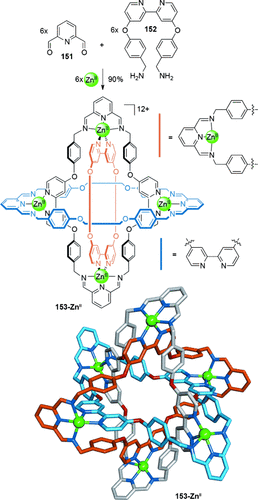
Stoddarts Borromäische Ringe, mit den Kohlenstoffatomen jedes Makrocyclus der verschlungenen Topologie in verschiedenen Farben abgebildet (hellblau, orange und grau). Zusätzliche Anionen, welche die sechs Koordinationsstellen an den ZnII-Zentren besetzen, sind nicht abgebildet. Die ZnII-Zentren sind alle kristallographisch äquivalent und nehmen verzerrt oktaedrische Geometrien an (cis-N-ZnII-N-Bindungswinkel: 72.5(2)–109.5(3)8). Zwischen den Phenylringen und den Bispyridingruppen liegen ausgeprägte π-π-Wechselwirkungen vor (Abstände: 3.51 und 3.72 Å).137
Molekulare Borromäische Ringe wurden auch zufällig entdeckt, zum Beispiel von Jin et al. während der Untersuchung der Synthese von Cp*Rh-Metallvierecken (Cp*=η5-C5Me5; Schema 45).140 Die Liganden 154 a, 154 b oder 154 c koordinierten an [(RuCp*Cl2)2]. Die Entnahme von Chlorid-Ionen mit AgOTf, gefolgt von der Zugabe von 156-CuII führte zu den Borromäischen Ringen 157-RuIICuII(a–c). Es wurde herausgefunden, dass die relative Länge der Liganden für die Bildung der Borromäischen Ringe entscheidend ist; zu lange oder zu kurze Liganden, oder solche mit einem nichtoptimalen Verhältnis der Längen, resultierten in nichtverflochtenen Metallvierecken anstelle der verflochtenen Strukturen.
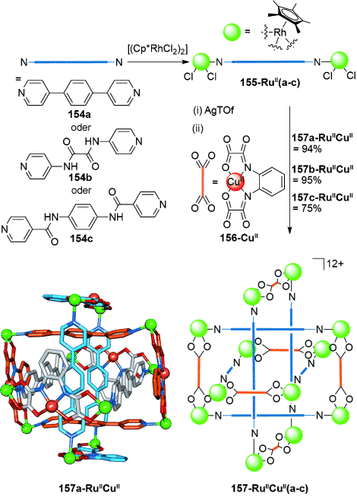
Jins Borromäische Ringe, aufgebaut aus RhCp*-Metallvierecken. Cp*-Liganden um das Rh-Zentrum sind in der Kristallstruktur nicht abgebildet.140
5. Catenane als Schalter, Rotationsmotoren und Sensoren
Die verflochtene Architektur von Catenanen kann auf verschiedenen Wegen für Funktionen und Aufgaben verschiedener Art eingesetzt werden. Die Dynamik der Bewegungen, die die Komponenten im großen Umfang eingehen können, machen ein Catenan zu einem attraktiven Kandidat für den Einsatz in molekularen Maschinen.141 Die Änderung der relativen Position der Ringe kann als Schalter genutzt werden, oder eine gerichtete 360°-Drehung eines Ringes im Bezug zum anderen kann als Basis für einen Rotationsmotor dienen.142 Der Hohlraum, welcher durch die verflochtenen Makrocyclen gebildet wird, kann gebraucht werden, um funktionelle Gruppen präzise in einem 3D-Raum zu positionieren – ein wichtiges Merkmal für die Bindung von Substraten mit höchster Genauigkeit.
5.1. Catenanschalter
Sauvage und Mitarbeiter haben gezeigt, dass die Bewegung der Ringe im Hetero-[2]Catenat 158 sowohl elektrochemisch wie auch photochemisch gesteuert werden kann (Schema 46 a).143 Obwohl viele Metall-Ligand-Wechselwirkungen kinetisch recht stabil sind, kann der Unterschied bevorzugter Koordinationssphären der verschiedenen Oxidationsstufen verwertet werden, um ein cokonformatives Schalten in einem [2]Catenan auszulösen. Oxidation des Metallatoms in dpp,dpp-[158-CuI] (entweder chemisch oder elektrochemisch) kehrt die Reihenfolge der bevorzugten Koordinationszahlen um (die bevorzugte Reihenfolge für CuII lautet 6>5>4). Daher wird eine Veränderung in der Cokonformation beobachtet, die zu dem fünffach koordinierten Komplex dpp,terpy-[158-CuII] führt. Die Kinetik der Bewegung der ineinandergreifenden Komponenten während des Umschaltens ist wegen der Bildung des metastabilen dpp,dpp-[158-CuII]-Zustandes nach der Oxidation relativ langsam. Während der Prozess durch Reduktion umgekehrt werden kann, um dpp,dpp-[158-CuI] zu regenerieren, macht die Bildung des metastabilen dpp,terpy-[158-CuI]-Zustandes das Schalten noch langsamer.
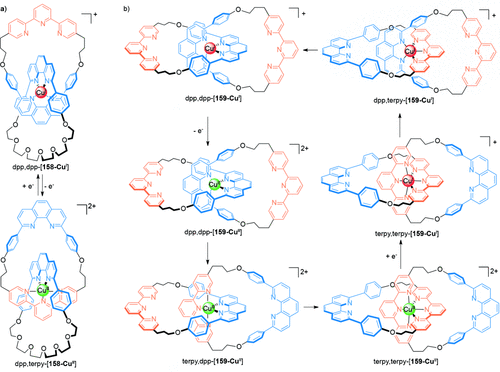
Das Verhalten des verwandten Homo-[2]Catenats 159 (Schema 46 b), bei dem jeder Ring eine zweizähnige dpp- und eine dreizähnige terpy-Einheit enthält, ist komplexer.144 In dpp,dpp-[159-CuI] bindet das Kupferatom die beiden dpp-Einheiten wie üblich in tetraedrischer Koordinationsgeometrie. Wird aber das Metallatom chemisch oder elektrochemisch oxidiert, drehen sich beide Ringe umeinander, und das bevorzugte sechsfach koordinierte Isomer terpy,terpy-[159-CuII] entsteht. Es wurde gezeigt, dass dieser Prozess stufenweise abläuft: Zunächst rotiert ein Ring, dann wird der fünffach koordinierte Komplex (terpy,dpp-[159-CuII]) gebildet.144 Verglichen mit den Reaktionen zahlreicher anderer Übergangsmetallkomplexe ist dieser Prozess schnell, denn die Liganden lagern sich binnen einiger Sekunden um. Der Vorgang ist durch die Reduktion zu CuI vollständig reversibel, er verläuft über die gleiche fünffach koordinierte Geometrie (über dpp,terpy-[159-CuI]) ab.
Die Stoddart-Gruppe beschrieb das Umschalten der Cokonformation im [2]Catenan 160, welches aus einem elektronenarmen Cyclobisparaquat(p-phenylen)(CBPQT4+)- Makrocyclus und einem elektronenreichen Kronenethermakrocyclus besteht (Schema 47).145 Im Anfangszustand 1604+ hält sich das tetrakationische Cyclophan über dem elektronenreicheren Tetrathiafulvalen(TTF)-Haltepunkt im Kronenethermakrocyclus auf. Nach der chemischen oder elektrochemischen Oxidation von TTF, wird jedoch die Dihydroxynaphthalineinheit (DNP) zur elektronenreicheren Einheit, was zur Folge hat, dass die Struktur umschaltet und der Cyclophanmakrocyclus zur DNP-Einheit wandert (1605+/6+). Durch eine Reduktion der TTF-Einheit zurück zum neutralen Zustand kann die Bewegung rückgängig gemacht werden.
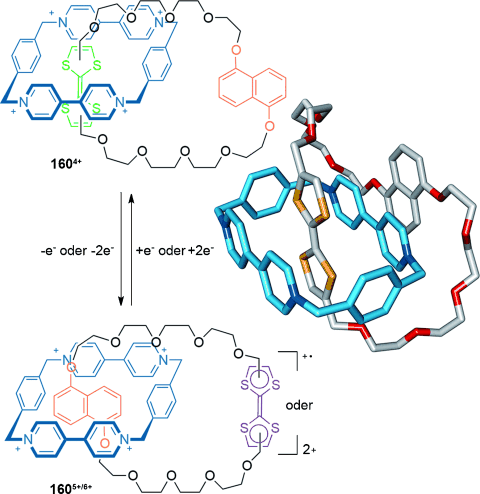
Stoddarts Umschalten der Cokonformation des [2]Catenans, herbeigeführt durch die relative Stärke der π-π-Wechselwirkung zwischen den elekronenreichen und -armen aromatischen Resten der Makrocyclen.145
Ein ähnliches [2]Catenan zeigt das Umschalten der Cokonformation ausgelöst durch π-π-Wechselwirkungen und Radikalpaarung, welche die dominanten Kräfte in dem Makrocyclus sind (Schema 48).146 Der CBPQT4+-Makrocyclus hält sich im Catenan 1616+ über der Dioxynaphthalineinheit auf. Nach Reduktion der Bispyridiniumeinheit (bipy2+) zu bipy+. ändert die Wechselwirkung der Radikalpaarung die überwiegende Struktur zu dem Catenan 1613(+.). Oxidation stellt 1616+ wieder her und kehrt den Schaltprozess um.
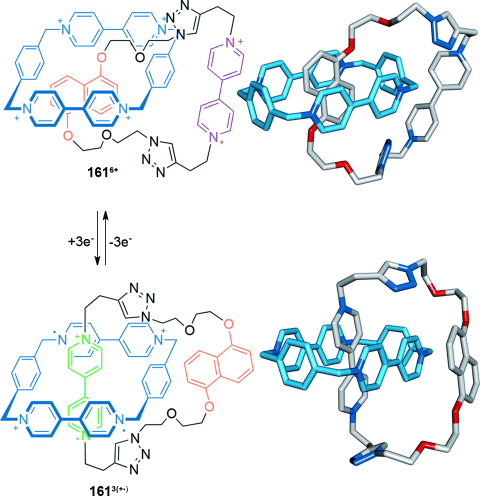
Durch wechselnde π-π-Wechselwirkung zwischen elektronenarmen und -reichen Arenen und durch Radikalpaarung induziertes reversibles Umschalten in Stoddarts [2]Catenan, gefolgt von Reduktion/Oxidation der Bispyridiniumeinheit.146
Das pH-induzierte Umschalten eines [2]Catenans zwischen zwei gut definierten Cokonformationen wurde von Sauvage beschrieben (Schema 49).147 Der reversible Schaltvorgang der Cokonformation zwischen den Catenanen 162 und 162-H+ wurde durch Protonierung und Deprotonierung des jeweiligen Catenans erreicht.
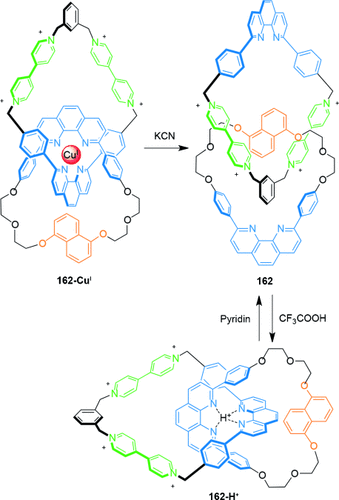
Sauvages pH-induziertes Umschalten der Cokonformation, gefolgt von der Demetallierung eines durch CuI-Templat gelenkten [2]Catenans.147
Eine Kombination aus Metallkoordinierung/Demetallierung und Bildung von Wasserstoffbrücken führte zu einem reversiblen Umschalten im [2]Catenan 163-PdII (Schema 50).148 In beiden 163-PdII und 163-H2 sind die Pyridineinheiten der beiden Makrocyclen entweder durch Beteiligung in der Metallkoordination oder der Bildung von Wasserstoffbrücken dicht beieinander positioniert. Jedoch Zugabe von [PdCl2(CH3CN)2] zu 163-H2 erzeugt 163-H2-PdCl2(CH3CN) mit der bevorzugten Cokonformation, in der ein Ring relativ zum anderen um 180° gedreht ist. Der Schaltprozess kann umgekehrt werden durch Deprotonierung der Amid-Stickstoffatome mit NaH oder durch Demetallierung und anschließende Einlagerung eines basischen PdII-Salzes.
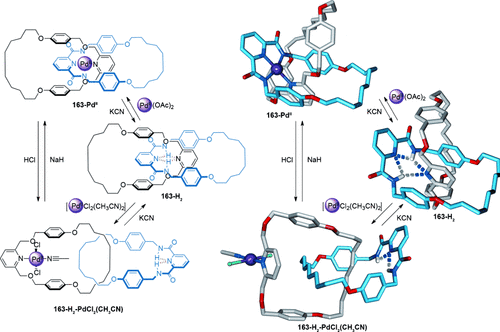
Ein Schaltprozess mit drei Zuständen zwischen zwei Cokonformationen eines [2]Catenans, erzeugt durch variable Koordinationsarten von geeigneten PdII-Kationen.148
Ungerichtetes Schalten zwischen drei verschiedenen Cokonformationen wurde mit dem [2]Catenan 164 erreicht (Schema 51 a).102a Drei Haltepunkte sind eingebettet in einem großen Makrocyclus: A (grün), B (rot) und C (gelb). Jeder Haltepunkt weist eine unterschiedliche Bindungsaffinität für den kleineren Benzylamidmakrocyclus auf. Die Bindungsaffinität der Fumaramid-Haltepunkte A und B kann durch Photoisomerisierung zur Maleinamid-Form (Z) drastisch reduziert werden, die für die beiden Stationen mit verschiedenen Wellenlängen erfolgt, da sich der Haltepunkt A neben einem Benzophenonrest befindet.
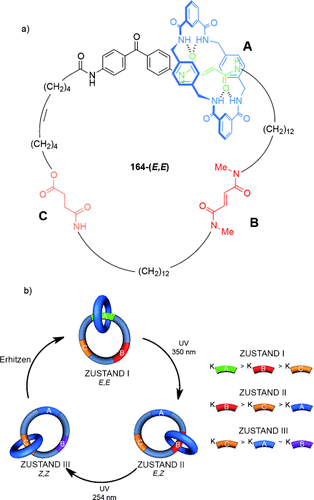
Ein [2]Catenan, in welchem die Veränderung der Bindungsaffinitäten der drei Haltepunkte zu einem Benzylamid- Makrocyclus das Umschalten zwischen drei diskreten Cokonformationen ermöglicht. a) Struktur des [2]Catenans 164-(E,E); b) Darstellung des Schaltprozesses.102a
Im Anfangszustand (E,E) ist die Reihenfolge der Bindungsaffinitäten der Haltepunkte für den kleinen Makrocyclus A>B>C, und deshalb hält sich der kleine Benzylamidmakrocyclus überwiegend am Haltepunkt A auf. Nach der Isomerisierung von E zu Z des Haltepunkts A ändert sich die Reihenfolge der relativen Bindungsaffinitäten zu B>C>A, und der kleine Makrocyclus bewegt sich überwiegend zu Haltepunkt B (Zustand I zu Zustand II, Schema 51 b). Die nächste Veränderung der Position des Benzylamidmakrocyclus findet nach der Isomerisierung des Haltepunktes B statt, mit der Folge, dass der Makrocyclus sich bevorzugt am Haltepunkt C aufhält (Zustand II zu Zustand III, Schema 51 b). Die Reihenfolge der Bindungsaffinitäten ist jetzt C>A≈B. Die Isomerisierung von A und B zurück zur Fumaramidgruppe stellt die ursprüngliche Reihenfolge der Bindungsaffinitäten A>B>C wieder her, und der Benzylamidmakrocyclus kehrt zur Anfangsposition zurück.
In anderen Catenanen wurde das Umschalten durch Bindung von Anionen149 und photochemischen Stimuli150 erreicht.
5.2. Catenane als Rotationsmotoren
Die Einführung von kinetischen Barrieren, um die Brownsche Molekularbewegung in eine Richtung zu blockieren, kann genutzt werden, um die Richtung der Rotationsbewegung eines Makrocyclus in einem Catenan festzulegen und einen molekularen Motor herzustellen. [3]Catenan 165 (Schema 52 a)102a unterscheidet sich vom [2]Catenan 164 (Schema 51 a) nur durch die Zugabe eines weiteren Benzylamidmakrocyclus und enthält die gleichen einstellbaren Bindungsaffinitäten der Haltepunkte, um die Position des kleineren Makrocyclus zu kontrollieren. Die isolierte Amidgruppe (dunkelgrün) dient als der vierte Haltepunkt, D. Die Reihenfolge der Bindungsaffinitäten zwischen dem Benzylamidmakrocyclus und den Haltepunkten ist A>B>C>D in 165-(E,E), und die beiden Makrocyclen halten sich entsprechend ursprünglich an den Haltepunkten A und B auf.
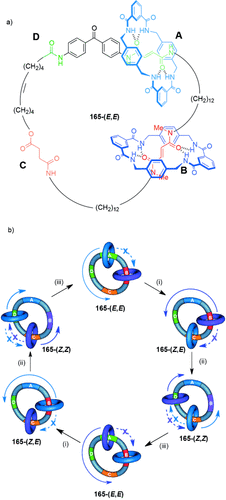
Ein [3]Catenan-Rotationsmotor. a) Struktur des [3]Catenans 165-(E,E);102a b) Darstellung der unidirektionalen Rotation. Bedingungen: i) UV (350 nm); ii) UV (254 nm); iii) Erhitzen.
Nach der Photoisomerisierung des Haltepunktes A bewegt sich der blaue Makrocyclus von Haltepunkt A zu C (KB>KC>KD>KA). Wichtig ist, dass die Wanderung des Ringes nur in eine Richtung rund um den großen Ring erfolgen kann (gegen den Uhrzeigersinn in Schema 52 b), da der zweite Makrocyclus sich auf Haltepunkt B aufhält. Durch E-zu-Z-Isomerisierung des Haltepunktes B kann der violette Makrocyclus ebenfalls nur in eine Richtung (gegen den Uhrzeigersinn) zum Haltepunkt D wandern (KC>KD>KA≈KB). Deshalb bewegt sich der blaue Ring dem anderen Ring folgend unidirektional um den großen Ring. Die vollständige unidirektionale 360°-Rotation beider kleinen Ringe erfordert ein zweimaliges Durchlaufen der Reaktionssequenz.
Selektive Rotation in beide Richtungen ist mit dem [2]Catenan 166 möglich (Schema 53).102b In diesem Fall wird der Weg der Wanderung des kleineren Ringes um den großen Ring durch die Reihenfolge bestimmt, in welcher die blockierenden Gruppen auf beiden Seiten des Succinamidester-Haltepunkts entfernt werden. Angefangen bei 166-Succ-(Z), macht die Isomerisierung des Maleinamid-Haltepunktes (violett) zum Fumaramid (grün) diesen für den Benzylamidmakrocyclus zum bevorzugten Haltepunkt. Wird eine der blockierenden Gruppen entfernt (tBuSiMe2 für Rotation gegen den Uhrzeigersinn; CPh3 für Rotation im Uhrzeigersinn), so kann eine unidirektionale Bewegung des Ringes stattfinden, die in 166-Fum-(E) resultiert. Der Fumaramid-Haltepunkt kann anschließend zum Maleinamid isomerisiert werden, was zu einer thermodynamischen Triebkraft führt, resultierend in der Bewegung des Makrocyclus zurück zum Succinamid-Haltepunkt 166-Mal-(Z). Entfernung der blockierenden Gruppen in entgegengesetzter Weise wie bei der ersten Veränderung (CPh3 für Rotation gegen den Uhrzeigersinn; tBuSiMe2 für Rotation um den Uhrzeigersinn) resultiert in einer unidirektionalen 360°-Rotation des Benzylamidmakrocyclus um den großen Ring.
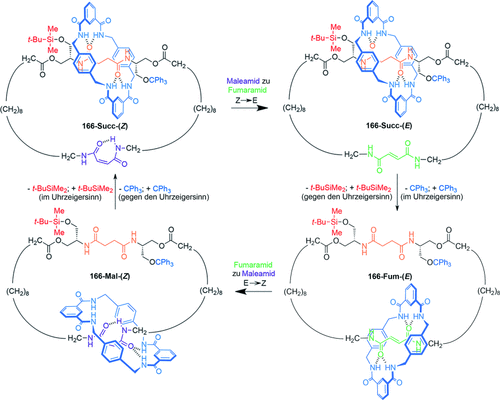
Sequenz von Abspaltung und Schalten in dem [2]Catenan-Rotationsmotor 166, der zu einer unidirektionalen und reversiblen Rotation fähig ist.102b
5.3. Catenane als selektive Wirte für Anionen und Kationen
In diesem Aufsatz wird offensichtlich, dass die Triebkraft zur Bildung von Catenanen oft eine nichtkovalente Anziehung zwischen den Komponenten und/oder dem Templat ist. Diese Wechselwirkungen bleiben oftmals bestehen, nachdem die verflochtene Struktur gebildet ist und Hohlräume im 3D-Raum entstanden sind. Ein solches Catenan hat die funktionellen Gruppen, die oft gut zusammen passen, präzise positioniert, und somit können Substrate hoch selektiv gebunden werden. Bei Catenanen, die mithilfe von Anionentemplaten synthetisiert wurden, stellen sich diese Eigenschaften als besonders nützlich heraus, wenn das resultierende Catenan bestimmte Anionen selektiv zu binden vermag.151 Dies führte wiederum zu Catenanen, die modifiziert wurden, um solche Bindungsereignisse entweder photo- oder elektrochemisch zu signalisieren.
Beer und Mitarbeiter verwendeten das Ferrocen-derivatisierte [2]Catenan 167 (Schema 54), um selektiv Chloridionen anstelle von Oxoanionen zu komplexieren und anschließend die Bindung elektrochemisch anzuzeigen.152 Die Bindung der Chloridionen erleichtert die Oxidation von Ferrocen zu Ferrocinium und kann zyklovoltammetrisch detektiert werden. Eine Röntgenstrukturanalyse von 167-Cl− weist darauf hin, dass die Selektivität der Anionenbindung wahrscheinlich durch den Hohlraum des Catenans bestimmt wird, der zu klein ist, um größere Anionen aufzunehmen.
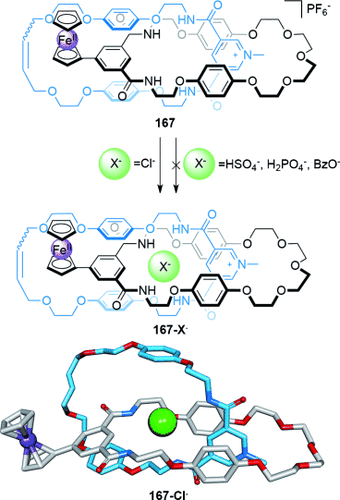
Beers Catenan mit einem Ferrocenmotiv ermöglicht die elektrochemische Erkennung der Anionenbindung an 167 (selektiv für Chloridionen). Die Bindungsselektivität des nichtverflochtenen Makrocyclus 167 wurde durch die Basizität des Anions (BzO−>H2PO4−>Cl−>HSO4−) bestimmt.152
Eine optische Antwort erfolgt durch Anionenbindung zum [2]Catenan 60 (Schema 55, die Synthese ist dargestellt in Abschnitt 2.1.4).80 Chlorid- oder Bromidionen reduzieren deutlich die Intensität der Naphthalin-Emissionsbande (309 nm), begleitet vom Erscheinen einer neuen Bande (445 nm). Keine Änderung im Emissionsspektrum wurde mit einer Auswahl von alternativen Anionen detektiert. Jeong et al. haben auch Fluoreszenz eingesetzt, um die selektive Bindung von Chlorid an ein [2]Catenan zu messen, das einen Indolocarbazol-Fluorophor enthält.153
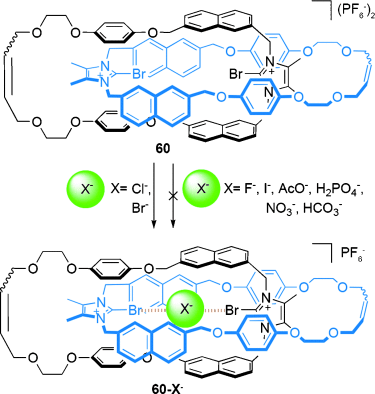
Beers selektive Bindung von Chlorid- und Bromidionen, optisch detektiert anhand einer Veränderung des Naphthalin-Emissionsspektrums.80
Yashima und Mitarbeiter154 nutzten das [2]Catenan 168, um Kationenbindung durch Änderung mithilfe von Circulardichroismus (CD) zu detektieren (Schema 56). Der chirale R-Phenylethyl-Substituent auf der Amidiniumseite der Salzbrücke induzierte eine Drehung des m-Terphenyl-Motivs in beiden Makrocyclen des Catenans, die einen eindeutigen Cotton-Effekt in dem CD-Spektrum induzierte. Nach Zugabe von Zn(ClO4)2 wurde durch Koordination von ZnII die Salzbrücke unterbrochen, was in signifikanten Änderungen des CD-Spektrums resultierte.
Yashimas Kationenerkennungs-Catenan durchläuft ein Umschalten von einem “gesperrten” Zustand zu einem Zustand, in dem die Makrocyclen frei rotieren können.154
6. In Polymerketten und Materialien eingebaute oder oberflächenfixierte Catenanverkettungen
Angesichts der hohen Kosten für die Einführung neuer molekularer Bausteine werden zukünftige kommerzielle Polymere wahrscheinlich auf dem Zusammenbau und der neuen Anordnung bereits existierender, billiger Monomere basieren. Die Einführung eines Catenans in ein Polymergerüst ermöglicht den Einbau von flexiblen, mobilen oder umschaltbaren Verkettungen, welche die rheologischen,155 mechanischen156 und dynamischen157 Eigenschaften der resultierenden Materialien beeinflussen können. Koordinierte Bewegungen von Catenanen in einer organisierten Anordnung könnten Anwendung in der Entwicklung von Festkörper-Elektronikbauteilen finden. Dazu wäre der Einschluss von Catenanen in oder auf Trägermaterial erforderlich, zum Beispiel in Metall-organischen Gerüsten oder auf funktionellen Oberflächen.
6.1. [2]Catenane in Polymeren
6.1.1. [2]Catenane als Verkettungen in der Hauptkette
Hauptketten-Poly[2]catenane bestehen aus [2]Catenanen, die auf lineare Art und Weise durch kovalente Bindungen miteinander verknüpft sind (Abbildung 9). Polykondensation des Catenats 169-CuI, oder des entsprechenden metallfreien Catenans 169, mit der Dicarbonsäure 170 brachte die Polymere 171-CuI bzw. 171 hervor,158 wobei der Polymerisationsgrad eher bescheiden ist (Schema 57).159 Verwandte Poly[2]catenane basierend auf CuI-dpp-[2]Catenan-Motiven wurden auch von Shimada und Mitarbeitern beschrieben.160

Ein Hauptketten-Poly[2]catenan.
Um den Einfluss mechanischer Verkettungen in Polymerketten zu testen, wurden kommerzielle Polymere (Polycarbonat und Poly(ethylenterephthalat)) mit dem Benzylamid-[2]Catenan dotiert.161 Die Phenolgruppe von Catenan 172 kann für die Umesterung der Polymere verwendet werden. Die Methylierung der Amid-Stickstoffatome verhindert die Bildung von Wasserstoffbrücken zwischen den Komponenten und ermöglicht somit die relativ freie Bewegung der Ringe. Dies führt zur Verstärkung jener physikalischen Eigenschaften, die durch die mechanischen Bindungen hinzugefügt wurden (Schema 53). Die Festphasenpolymerisation von Catenan 172 und Bisphenol-A-Polycarbonat-Oligomeren (Schema 58) erzeugte Copolymere, die aus 10, 20 oder 30 Gew.-% Catenanverkettungen bestehen.161a Im Fall, dass nur ein kleiner Anteil eingelagert wurde (10 Gew.-%), wurde eine homogene Verteilung des [2]Catenans beobachtet; heterogene Verteilung aber resultierte eher durch einen höheren Grad an Einlagerung. Die Einlagerung der Catenanverkettungen hatte jedoch einen bescheidenen Effekt auf die Glasübergangstemperatur (Tg) des resultierenden Polymers. Hagiwara und Mitarbeiter haben für die Polymerisation mit den starren Dialkinkomplexen durch Sonogashira-Kupplung162 und der CuAAC-“Klick”-Reaktion163 alternativ funktionalisierte Derivate des Catenans 172 verwendet. Andere Poly[2]catenane wurden ebenfalls hergestellt.164
Die Festphasenpolymerisation von [2]Catenan-Monomer 172 und Bisphenol-A-Polycarbonat-Oligomeren, um Hauptketten-Poly[2]catenan-Copolymere zu erzeugen.161a
6.1.2. Catenane als Polymerseitenketten
Im Unterschied zu den Hauptketten-Poly[2]catenanen ist in Polymeren mit Catenan-Seitenketten nur eine Funktionalisierung an einem der beiden Makrocyclen im Catenan nötig. Da die mechanische Bindung des Catenans nicht mehr Teil des Polymerrückgrates ist (Abbildung 10), wird angenommen, dass andere Eigenschaften im resultierenden Material zum Vorschein kommen. Polymere mit Catenan-Seitenketten wurden entweder durch Polymerisation eines einzelnen Makrocyclus des Catenans165 oder durch Anbringen eines Catenans an ein zuvor gebildetes Polymer synthetisiert.166
Seitenketten-Poly[2]catenan, in welchem (A) ein einzelner Makrocyclus Teil der Hauptkette eines Polymers bildet oder (B) das ganze Catenan eine angehängte Gruppe ist.
Das Seitenketten-Poly[2]catenan 176 wurde durch die Reaktion von Diol-Catenan 174 mit Bis(4-isocyanatophenyl)methan 175 (Schema 59) hergestellt.165a Ein angehängtes Poly[2]catenan wurde von Swager und Mitarbeitern165b durch elektrochemische Polymerisation erhalten.
Stoddarts Seitenketten-Poly[2]catenan, in dem ein einzelner Makrocyclus des [2]Catenans Teil des Polymerrückgrates ist.165a
Eine alternative Strategie, um ein Poly[2]catenan anzuhängen, wurde von Bria und Kollegen vorgestellt.166 Funktionalisierung des [2]Catenan-Monomers 177 (Schema 60) mit einer einzigen Alkingruppe ermöglicht den Einbau in das Copolymer 178 durch CuAAC-“Klick”-Reaktion und führt zu 179.
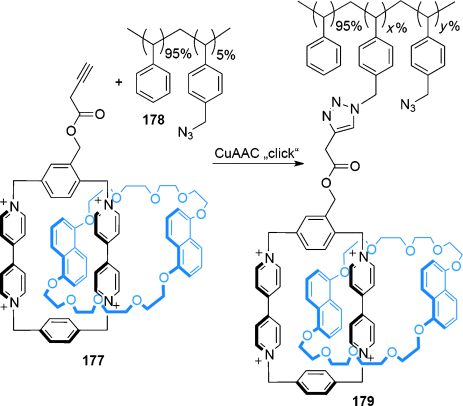
Brias Seitenketten-[2]Catenan-Polymer.166
6.1.3. In Metall-organische Gerüste eingebaute Catenane
Die äußerst organisierte Anordnung der Moleküle in kristallinen Feststoffen, kombiniert mit den Räumen, die für die Bewegung der Komponenten verfügbar sind, führte zur Untersuchung von Metall-organischen Gerüsten als Tragwerk für verschlungene Moleküle. Während Rotaxane in verschiedene Arten von Metall-organischen Gerüsten eingebaut worden sind,167 stellen Catenane wegen ihrer Größe und Form eine signifikante Herausforderung dar. Trotzdem wurden Metall-organische Gerüste, die [2]Catenane enthalten, von Stoddart und Yaghi beschrieben.168 Ein Catenan, das den molekularen “Stützbalken” 180 enthält, bildet nach Erhitzen mit Cu(NO3)2⋅2.5 H2O eine 2D-Anordnung (Schema 61 a). In dem Metall-organischen Gerüst koordiniert jedes CuI-Kation Carboxylatgruppen von zwei Stützbalken und eine Acetylengruppe eines zusätzlichen Moleküls 180 im η2-Modus. Um solche großen Moleküle einzubauen, muss das Netzwerk eine abwechselnde Sequenz von Catenanorientierungen bilden, die oberhalb und unterhalb der Ebene der 2D-Platte positioniert sind, und zusätzlich eine weitreichende Ordnung zwischen den gestapelten Reihen aufweisen. Ein regelmäßigeres Metall-organisches 2D-Gerüst wurde mit einem verwandten Catenan gebildet, das in einen längeren koordinierenden molekularen Stützbalken (Schema 61 b) eingebaut wurde.169 Ein ähnliches Metall-organisches 3D-Gerüst wurde ebenfalls publiziert.170
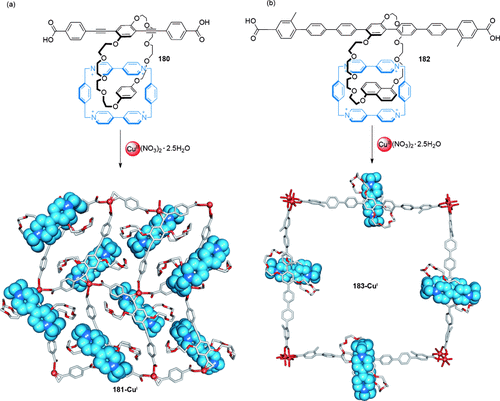
6.2. Oberflächenfixierte Catenane
Catenane an Oberflächen zu befestigen ist ein alternatives Vorgehen, um eine organisierte Anordnung von verschlungenen Molekülen zu erhalten. Catenane können auf verschiedene Arten an die Oberfläche festgemacht werden: 1) befestigt über eine “Leine” (Abbildung 11, Typ A); 2) chemisorbiert, sodass die Oberfläche einen intrinsischen Teil eines Ringes bildet (Abbildung 11, Typ B); oder 3) physisorbiert (Abbildung 11, Typ C).171
Drei verschiedene Befestigungsarten für [2]Catenane auf einer Oberfläche.
Der Prozess des Anbindens eines [2]Catenans an eine Goldoberfläche ist illustriert anhand des Dithiol[2]catenans 184 (Schema 62).172 Röntgen-Photoelektronenspektroskopie (XPS) deutet darauf hin, dass 184 anfänglich eine Monoschicht bildet, in welcher die Catenane senkrecht auf der Oberfläche organisiert und nur über eine der beiden Thiolgruppen chemisorbiert sind. Nach ausreichender Zeit (14 Stunden im Fall von 184) findet das Catenan jedoch eine Cokonformation niedrigerer Energie, in der beide Thiolgruppen an die Goldoberfläche gebunden sind und somit das Catenan parallel zur Oberfläche ausgerichtet ist.
Ein Thiol-funktionalisiertes [2]Catenan, gebunden an eine Au(111)-Oberfläche.172
Beers Chlorid-bindendes Catenan mit einer elektrochemisch aktiven Ferrocen-Anzeigegruppe (siehe Abschnitt 5.3) wurde ebenfalls für die Befestigung an eine Oberfläche abgeändert.152 Der Dithiol-Pseudorotaxan-Komplex 187 (Schema 63) bildete auf einer Au(111)-Oberfläche nach 8 Stunden eine selbstorganisierte Monoschicht (188), die aber prinzipiell ein [2]Catenan ist, in welchem die Au(111)-Oberfläche einen Teil des Ringes bildet. Diese Strategie, um [2]Catenane an der Oberfläche zu bilden, wurde ursprünglich von Gokel und Kaifer eingeführt.173 Andere Catenan-Monoschichten wurden von Sauvages Gruppe beschrieben.174
Beers Chlorid enthaltenes Pseudorotaxan, das ein [2]Catenan mit einer Au(111)-Oberfläche bildet.152
Cokonformatives Umschalten wurde auch in einer gemischten Langmuir-Monoschicht des [2]Catenans 160 und des Phospholipids Dimyristoylphosphatidsäure (DMPA) gezeigt, die zwischen einer Si-Elektrode und einer Ti/Al-Elektrode eingeklemmt war (Schema 64, siehe auch Abschnitt 5.1.1).175 Anlegen einer Spannung von −2 V oder +2 V an das System resultierte in der Oxidation von 1604+ oder der partiellen Reduktion von 1605+. Eine eindeutige Veränderung im Übergangswiderstand wurde zwischen dem Schalten von 1604+ und 1605+ beobachtet.
Stoddarts schaltbares [2]Catenan, geschichtet zwischen zwei Elektroden.175
Cokonformatives Umschalten kann auch in einem Catenan, das an einer Oberfläche gebunden ist, beobachtet werden. Stoddart und Mitarbeiter176 zeigten, dass das TTF-basierende Catenan 1894+ (Schema 65) immer noch schalten kann, auch wenn es auf einem Metallnanopartikel (Au, Pd oder Pt) chemisorbiert ist. Reversible Oxidation und Reduktion des auf der Oberfläche angebrachten Catenans zwischen 1894+-NP und 1896+-NP wurde mit Fe(ClO4)3 bzw. Ascorbinsäure erreicht.
Stoddarts schaltbares [2]Catenan, befestigt auf einem Metallnanopartikel. TOAB=Tetraoctylammoniumbromid.176
Benzylamid-Catenane wurden ausgiebig als chemisorbierte und physisorbierte dünne Schichten auf verschiedenen Oberflächen studiert. Gut organisierte Schichten von Catenanen wie 57 können durch Sublimation im Ultrahochvakuum aufgebaut werden. Die Catenane der ersten Monoschicht wurden anschließend auf einer Au-Oberfläche über die Carbonylgruppen chemisorbiert. Die elektronischen und die Schwingungsstrukturen wurden durch XPS und hochauflösende Elektronenenergieverlustspektroskopie (HREELS) sowie mit Infrarot-Reflexions-Absorptions-Spektroskopie charakterisiert.177 An Oberflächen physisorbierte Catenane wurden auch von Sauvages Gruppe untersucht.178
Trotz dieser Erfolge bleiben der Einbau von Catenanen in Polymere und der Aufbau von organisierten Anordnungen auf Oberflächen oder der Einbau in kristallinen Feststoffen eine große Herausforderung. Die Anwendung der dynamischen Eigenschaften der Catenane (inhärente Flexibilität, Rotation oder das Umschalten der relativen Positionen der Ringe) muss in solchen Umgebungen auf eine nutzbare Weise noch erreicht werden.
7. Schlussfolgerung und Ausblick
Das Ende einer Ära …︁
Die Templatsynthese von Catenanen ist unangefochten einer der größten Triumphe in der supramolekularen Chemie. Ihretwegen können Chemiker heutzutage routinemäßig Hopf-Verschlingungen in einem Schritt, hoher Ausbeute und aus gut zugänglichen Bausteinen herstellen. Eine solche Situation wäre vor fünfzig Jahren unvorstellbar gewesen, da in jener Ära nur wenig oder kein Verständnis für Templatsynthese, Wirt-Gast-Chemie, Selbstorganisationsprozesse oder den Gebrauch von nichtkovalenten Wechselwirkungen existierte, und noch keine modernen Verfahren für die Bildung von kovalenten Bindungen zur Verfügung standen. Die Synthese verschlungener Moleküle spiegelt den dramatischen Fortschritt in der Chemie wider. Schill und Lüttringhaus zeigten brillant, wie Chemiker Synthesewege entwerfen können, um eine Kontrolle in allen drei Dimensionen zu erzielen und molekulare Stränge kontrolliert zu kreuzen oder eine organische Kette durch einen Makrocyclus zu fädeln. Sauvages großartiger Beitrag war es, zu zeigen, dass die Synthese solcher Strukturen durch Berücksichtigung der bevorzugten Koordinationsgeometrie von Übergangsmetallen beträchtlich vereinfacht werden kann, um die molekularen Bausteine zusammenzufügen und zu orientieren. Stoddart erkannte schließlich (nebst der Entwicklung wegweisender Synthesen für Catenane und Rotaxane in den Jahren um 1990) das Potenzial mechanisch verbundener Moleküle als Bausteine von molekularen Maschinen. Mit der Verwirklichung dieser Vision schaffte er den Anreiz für eine Generation von Chemikern, die Vorstellungskraft und Kreativität zu nutzen und immer innovativere und erfolgreichere Wege hin zu verschlungenen Molekülen zu entwickeln.
Die Erfolge, die durch Metallkoordination, Wasserstoffbrücken, aromatische π-π-Wechselwirkungen, hydrophobe Effekte, Halogenbrücken und verbesserte Methoden zum kovalenten Einfang wie Aktivtemplatsynthese, dynamisch-kovalente Chemie, Olefinmetathese und “Klick”-Chemie erzielt werden konnten, bedeuten, dass das Problem der Synthese von [2]Catenanen mit der Topologie einer Hopf-Verschlingung effektiv gelöst ist.
…︁ und der Beginn einer neuen Ära!
Allerdings bleibt der Rest des Gebietes der chemischen Topologie ein nahezu komplett unberührtes Territorium. Die Synthese von Catenanen ist nur für die einfachste Hopf-Verschlingung gelöst. Nur eine Handvoll der in Abbildung 2 gezeigten komplexeren Verschlingungen (und dort gibt es unzählige Möglichkeiten)21 wurde bis jetzt hergestellt (Salomonische Verschlingung, Borromäische Ringe und ein Davidstern-Catenan).179 Bisher ist nicht bekannt, wie die Dynamik der Komponenten kontrolliert werden kann, oder ob es potenzielle Anwendungen für sie gibt. Oftmals wird angenommen, dass Chemiker heutzutage mit ausreichend Zeit und Ressourcen fast jedes Molekül herstellen können.180 Das stimmt jedoch nicht für die komplexen topologischen Strukturen. Weder existiert ein generelles Verfahren für die Synthese von Catenanen, die komplizierter sind als die Hopf-Verschlingung, noch gibt es eine Strategie für die Kontrolle der Stereochemie (über oder unter) an Überkreuzungspunkten (die für die Synthese jeglicher Topologie nötig ist); gleichfalls gibt es keine Methoden, um effektiv Catenane in Materialien einzubauen (Polymere, Metall-organische Gerüste oder Oberflächen und Schnittstellen) und um ihre verschlungene Architektur und Dynamik anzuwenden.
Das sind die wichtigsten ungelösten Probleme – in der Synthese, dem Design und der Anwendung – die der Erforschung und Verwertung eines gewaltigen Gebietes im chemischen Raum momentan im Wege stehen. In der Tat scheinen viele dieser Herausforderungen in der chemischen Topologie sogar noch verblüffender als die Probleme, denen die Pioniere der Catenanchemie vor fünfzig Jahren gegenüberstanden!
Die Biologie zeigt uns, dass die Organisation von Materie mit topologischer Komplexität auf der molekularen Ebene ein gewaltiges Potenzial bietet für das Erreichen von neuen Molekül- und Materialeigenschaften (Stärke, Leichtigkeit, Flexibilität, Dynamik). Chemiker müssen die Wege zu einem bislang nicht realisierten Reichtum an Form und Funktion noch finden, damit sie sich eines der letzten großen unerforschten Gebiete der Synthesechemie zunutze machen können. Was genau die nächsten fünfzig Jahre der Catenanforschung bringen werden, ist natürlich nicht vorhersehbar, aber sie werden genauso vielseitig und voller Überraschungen sein wie die ersten fünfzig Jahre.
Acknowledgements
Wir danken dem EPSRC für die Unterstützung unseres Forschungsprogrammes über molekulare Knoten und Verschlingungen und Steffen L. Woltering sowie Alina L. Nussbaumer für hilfreiche Diskussionen und die deutsche Übersetzung dieses Aufsatzes.
Biographical Information
Guzmán Gil-Ramírez erhielt seinen B.Sc. an der Universität Jaume I (Castellón, Spanien). Im Jahr 2005 wechselte er nach Tarragona (Spanien)und promovierte dort unter der Anleitung von Prof. Ballester an der ICIQ über die Anion-π-Wechselwirkungen und Selbstorganisation molekularer Kapseln. 2010 wechselte er nach Oxford, um in der Arbeitsgruppe von Prof. Anderson und Prof. Briggs an der Entwicklung von N@C60-basierten Materialien für die Quanten-Informationsverarbeitung zu arbeiten. 2013 trat er der Gruppe von Prof. Leigh bei. Seine Forschungsinteressen umfassen organische funktionale Materialien und kontrollierte molekulare Bewegung.
Biographical Information
Alexander Stephens studierte an der Universität Sheffield (Großbritannien), wo er 2011 den WebElements-Preis für seinen MChem-Abschluss erhielt. 2012 begann er mit der Promotion im Arbeitskreis von Prof. Leigh an der Universität von Edinburgh (Großbritannien). Später zog er mit der Gruppe an die Universität von Manchester (Großbritannien) um. Er entwickelt neue Synthesestrategien für Moleküle mit komplexer Topologie.
Biographical Information
David Leigh erhielt seinen B.Sc. und seinen Doktortitel an der Universität Sheffield. Nach einem Aufenthalt als Postdoktorand in Ottawa (1987–1989) wurde er Dozent am Institute of Science and Technology der Universität Manchester (Großbritannien). Nach Aufenthalten an den Universitäten Warwick und Edinburgh kehrte er 2012 nach Manchester zurück und übernahm den Sir-Samuel-Hall-Lehrstuhl für Chemie. Seine Forschungsinteressen umfassen chemische Topologie sowie synthetische Motoren und Maschinen auf molekularer Ebene.








