Das vielseitige Verhalten von Eisen bei der selektiven Methanaktivierung – eine radikale Wendung†
Diese Arbeit wurde durch das NWO Gravitation Program, das Netherlands Center for Multiscale Catalytic Energy Conversion (MCEC) und ein European Research Council (ERC) Advanced Grant (no. 321140) gefördert. Wir danken Jelle Boereboom für die Anfertigung der Grafik für das Inhaltsverzeichnis sowie Dr. Pieter Bruijnincx für wertvolle Diskussionen.
Graphical Abstract
Die selektive Aktivierung von Methan und seine direkte Umwandlung in leichte Olefine und Arene bleibt eine anspruchsvolle Aufgabe. Wie neueste Arbeiten zeigen, erweist sich ein Katalysatormaterial, das aus gittergebundenen, einzelnen Eisenatomen besteht, als sehr aktiv und selektiv in der direkten, nichtoxidativen Umwandlung von Methan zu Ethylen, Benzol und Naphthalin, ohne dabei Koksablagerungen zu bilden.
Methan ist als Hauptbestandteil der meisten Erdgase mit seinem großen Vorkommen ein sehr wichtiges Grundstoffmolekül für die Produktion von Grundchemikalien (z. B. Ethylen, Propylen und Arene) sowie von Energieträgern (d. h. von Kraftstoffen). Kürzlich haben sowohl der Schiefergas-Boom – besonders in den USA – als auch das Vorkommen gewaltiger Mengen von Methangashydraten an verschiedenen Orten der Erde zusätzlich ein großes Interesse entfacht, wirtschaftliche Verfahren im Großmaßstab für die selektive Aktivierung von Methan zu entwickeln.
Die gegenwärtigen kommerziellen Wege zur Methanaktivierung umfassen die Umwandlung von Methan in Synthesegas, ein Gemisch aus CO und H2, und dessen anschließende Überführung in Kohlenwasserstoffe wie Propylen, Arene und Treibstoffe.1–3 Die “methanol-to-hydrocarbon”(MTH)-Katalyse umfasst die katalytische Umwandlung von Synthesegas-basiertem Methanol (oder Dimethylether) in Mischungen von z. B. Ethylen, Propylen und Arenen, abhängig vom Zeolithmaterial und den Reaktionsbedingungen. Alternativ ist das aus Methan hergestellte Synthesegas nutzbar, indem es mit Eisen- oder Cobalt-basierten Fischer-Tropsch-Synthese(FTS)-Katalysatoren in beispielsweise Wachse umgewandelt wird, die nachfolgend mit Zeolith-basierten Katalysatoren wieder zu Chemikalien und Kraftstoffen wie Diesel gecracked werden können. Allerdings sind beide Wege der Synthesegasumwandlung komplexe mehrstufige katalytische Verfahren, die – z. B. aufgrund der Synthesegaserzeugung – energieintensiv, teuer in Bezug auf die verschiedenen beteiligten Reaktions- und Trennungsschritte sowie wenig atomeffizient sind.
Angesichts dieser Nachteile suchen Wissenschaftler an Universitäten wie auch in der Industrie nach kosten- und ressourceneffizienteren Wegen zur direkten Nutzung von Methan. Ein Beispiel für eine solche Methode ist die oxidative Kupplung von Methan (oxidative coupling of methane, OCM), die in der Gasphase Methylradikale generiert, die anschließend zu Ethylen rekombinieren.4, 5 Leider bieten die gegenwärtigen OCM-Katalysatormaterialien sowie die zugehörigen Reaktor(Membran)-Designs nicht die erforderliche Leistung in Bezug auf die Aktivität wie auch die (noch wichtigere) Selektivität (z. B. werden CO2-Erzeugung und Bildung von Koksablagerungen beobachtet). Firmen wie Siluria oder UOP berichteten jüngst allerdings über eine (Vor)kommerzialisierung von Verfahren für die Methankupplung zu Ethylen.6
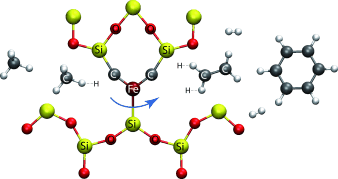
In einer aktuellen Untersuchung veröffentlichten Guo und Mitarbeiter ein neues Katalysatormaterial, das die Nachteile z. B. der OCM-Technik umgehen könnte.7 Es zeigte sich, dass der neuartige Katalysator, der aus einzelnen, gittergebundenen Eisenzentren besteht (Abbildung 1), in nichtoxidativer Weise hohe Ausbeuten an Ethylen, Benzol und Naphthalin generiert. Angesichts der relativ hohen Betriebstemperatur von 1363 K ist die vernachlässigbare Menge der gebildeten Koksablagerungen äußerst bemerkenswert, die zu einer beispiellosen Gesamtselektivität für Ethylen und Arene von >99 % mit einer Selektivität für Ethylen von 48 % bei einer Methanumsetzung von 48 % führt. Die Autoren halten die Isolation der aktiven Zentren für ausschlaggebend, da das Fehlen benachbarter Eisenzentren katalytische C-C-Kupplungen verhindert, die nachfolgend zu einer Bildung von Koksablagerungen führen könnten.

Strukturmotiv des entwickelten 0.5 Gew.-% Fe@SiO2-Katalysatormaterials, aktiv in der selektiven Aktivierung von Methan unter Bildung von Ethylen, Benzol und Naphthalin ohne wesentliche Entstehung von Koksablagerungen bei hohen Reaktionstemperaturen.
Dem Vorschlag zufolge besteht das aktive Zentrum in diesem Katalysator aus einem einzelnen Eisenatom, das an ein Silicium- und zwei Kohlenstoffatome koordiniert ist (Abbildung 1). Diese Schlussfolgerung wurde aus “extended X-ray absorption fine structure”(EXAFS)-Untersuchungen, ergänzt durch “high-angle dark field”(HAADF)-Rastertransmissionselektronenmikroskopie, abgeleitet.7 Das aktive Zentrum ist demnach als eine lokale Eisen-Silicid-Carbid-Mischphase (FexSiyCz mit x=1, y=1 und z=2) zu betrachten, in der ein Eisenatom in einer trigonalen Umgebung innerhalb einer anscheinend sehr inerten porösen SiO2-Matrix eingebettet ist. Da eine enorme Menge an Literatur z. B. auf den Gebieten der Metallurgie, Mineralogie und Elektronikwerkstoffe vorliegt, müssen weitere Charakterisierungsstudien die genaue Beschaffenheit dieses aktiven Zentrums aufklären.8 Dies ist mithilfe zusätzlicher Methoden wie der Mößbauer-Spektroskopie (MS), der Auger-Elektronenspektroskopie (AES) oder der Elektronenenergieverlustspektroskopie (EELS; bevorzugt in Verbindung mit Transmissionselektronenmikroskopie, TEM) möglich, wenngleich jedes dieser Verfahren wie auch die ursprünglich veröffentlichten EXAFS-Messungen eine Reihe von wohldefinierten Eisen-Silicid- und Eisen-Carbid-Referenzverbindungen für eine korrekte Spektralanalyse erfordern werden.
Erwähnenswert ist diesem Zusammenhang die spezielle Methode zur Synthese des Katalysatormaterials mit kleiner Oberfläche und gittergebundenen, einzelnen Eisenzentren, das als 0.5 Gew.-% Fe@SiO2-Katalysator bezeichnet wird. Ein Eisenmetasilicat (Fe2SiO4), besser bekannt als Fayalit, wird an Luft bei hohen Temperaturen (1973 K) mit SiO2 verschmolzen, das resultierende Material in einer Kugelmühle gemahlen und mit wässriger HNO3 umgesetzt. Der vorgefundene 0.5 Gew.-% Fe@SiO2-Katalysator übertrifft die klassisch hergestellten, oberflächenreichen Fe/SiO2- und Fe/ZSM-5-Katalysatoren deutlich, besonders was die Bildung von Koksablagerungen angeht.7 Da diese klassisch hergestellten eisenbasierten Katalysatoren nicht – oder zumindest nicht im gleichen Maße – über isolierte Eisenatome mit ihrer besonderen Koordinationsumgebung verfügen, verdeutlicht der neue Katalysator, dass es notwendig ist, die Bildung von benachbarten (mehratomigen) Eisenzentren zu unterdrücken, die typischerweise die unerwünschte C-C-Kupplung katalysieren und letztlich zur Bildung von Koksablagerungen führen.
Damit kommen wir zum Reaktionsweg dieses besonderen 0.5 Gew.-% Fe@SiO2-Katalysators. Guo et al. führten Dichtefunktionaltheorie(DFT)-Rechnungen, gestützt von “vacuum ultraviolet soft photoionization molecular-beam mass spectrometry”(VUV-SPI-MBMS)-Messungen, durch, um das Vorhandensein von Methylradikalen in der Gasphase über der Katalysatoroberfläche nachzuweisen. Der Reaktionsmechanismus ist in Abbildung 2 skizziert. Der Ablauf der Methanaktivierung beginnt mit der Erzeugung von Methylradikalen am isolierten Eisenzentrum, wie es in der OCM-Chemie der Fall ist.4, 5 Zwei dieser Methylradikale kombinieren nachfolgend in der Gasphase und bilden Ethan, das jedoch in der Gasphase nicht beobachtet wird. Stattdessen wird Ethan unter den gewählten Bedingungen leicht zu Ethylen dehydriert. Dieses könnte anschließend eine Wasserstoffabstraktion unter Bildung eines .C2H3-Radikals eingehen. Diese Radikale sind in der Lage, mit anderen Ethylenmolekülen zu reagieren, und nach anschließender Dehydrierung und Cyclisierung entsteht Benzol. Letzteres kann ebenfalls dehydriert werden, sodass weiteres Kettenwachstum und Cyclisierung die Bildung von Naphthalin zur Folge hat. Anders als bei der OCM-Chemie werden ROO.-Radikale vermieden, was ungewünschte Peroxidreaktionswege beträchtlich verringert, die typischerweise zu großen Mengen an Oxygenaten und/oder CO2 führen. Die hauptsächlichen Gasphasenprodukte sind damit Ethylen, Benzol, Naphthalin und Wasserstoff.
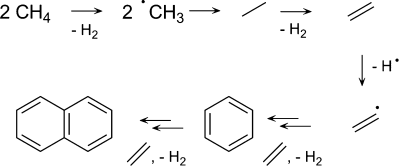
Vorgeschlagener Reaktionsmechanismus, der nicht nur die katalytische Bildung von Methylradikalen, sondern auch diejenige weiterer C2- und C6-Radikalspezies umfasst, die nach Rekombinations- und Cyclisierungsvorgängen zu den beobachteten Endprodukten führen.
Bemerkenswerterweise ähnelt die Chemie von Guo et al. in Teilen sehr derjenigen bei der Ethylenproduktion beim besten kommerziellen Verfahren – dem Steamcracken von Kohlenwasserstoffen (z. B. Naphtha). Im Wesentlichen umfasst diese herkömmliche Technik ebenfalls Radikalchemie, bei der Kohlenwasserstofffragmente, darunter Ethylen, Benzol und Naphthalin, bei hoher Temperatur (1073–1123 K) generiert werden, wenngleich das Verfahren wegen des spezifischen Charakters des Ausgangsmaterials (komplexe Gemische) viel weniger selektiv ist. Beim Steamcracken bilden sich erhebliche Mengen an Koksablagerungen an den Wänden der Spaltrohre. Das besondere Merkmal des von Guo et al. veröffentlichten Katalyseweges besteht darin, dass von Methan als preiswertem Rohstoff ausgegangen wird und einige der normalen radikalischen Reaktionswege anscheinend blockiert sind.
Das größte Rätsel der von Guo et al. beschriebenen Katalysechemie ist das (fast) völlige Ausbleiben der Bildung von Koksablagerungen. Dies ist ein sehr ermutigendes Ergebnis im permanenten Bestreben, selektive Wege zur direkten Nutzung von Methan zu entwickeln. In der Zukunft sind Verbesserungen der relativen Ausbeuten von Ethylen, Benzol und Naphthalin erforderlich, damit dieses neuartige katalytische Crackverfahren für eine Implementierung in der petrochemischen Industrie interessant wird. Genauso wichtig für die weitere Entwicklung dieser Technik ist die Langzeitstabilität des Katalysesystems, da die gegenwärtigen Untersuchungen auf Durchläufe von bis zu 60 h begrenzt sind. Zukünftige Forschungen werden zeigen, ob die veröffentlichten, hochselektiven Ausbeuten an Ethylen und Arenen mit dieser speziellen Katalysatorformulierung bei verlängerter Katalysatorlebensdauer unter diesen relativ harschen Reaktionsbedingungen aufrechterhalten werden können.