Effiziente und stereodivergierende elektrochemische Synthese von optisch reinen Menthylaminen†
Dr. Jörn Kulisch
Kekulé-Institut für Organische Chemie und Biochemie, Universität Bonn, Gerhard-Domagk-Straße 1, 53121 Bonn (Deutschland)
Search for more papers by this authorDr. Martin Nieger
Laboratory of Inorganic Chemistry, University of Helsinki (Finnland)
Search for more papers by this authorDr. Florian Stecker
BASF SE, GCI/E—M311, Ludwigshafen (Deutschland)
Search for more papers by this authorDr. Andreas Fischer
BASF SE, GCI/E—M311, Ludwigshafen (Deutschland)
Search for more papers by this authorCorresponding Author
Prof. Dr. Siegfried R. Waldvogel
Kekulé-Institut für Organische Chemie und Biochemie, Universität Bonn, Gerhard-Domagk-Straße 1, 53121 Bonn (Deutschland)
Institut für Organische Chemie, Johannes-Gutenberg Universität Mainz, Duesbergweg 10–14, 55128 Mainz (Deutschland)
Kekulé-Institut für Organische Chemie und Biochemie, Universität Bonn, Gerhard-Domagk-Straße 1, 53121 Bonn (Deutschland)Search for more papers by this authorDr. Jörn Kulisch
Kekulé-Institut für Organische Chemie und Biochemie, Universität Bonn, Gerhard-Domagk-Straße 1, 53121 Bonn (Deutschland)
Search for more papers by this authorDr. Martin Nieger
Laboratory of Inorganic Chemistry, University of Helsinki (Finnland)
Search for more papers by this authorDr. Florian Stecker
BASF SE, GCI/E—M311, Ludwigshafen (Deutschland)
Search for more papers by this authorDr. Andreas Fischer
BASF SE, GCI/E—M311, Ludwigshafen (Deutschland)
Search for more papers by this authorCorresponding Author
Prof. Dr. Siegfried R. Waldvogel
Kekulé-Institut für Organische Chemie und Biochemie, Universität Bonn, Gerhard-Domagk-Straße 1, 53121 Bonn (Deutschland)
Institut für Organische Chemie, Johannes-Gutenberg Universität Mainz, Duesbergweg 10–14, 55128 Mainz (Deutschland)
Kekulé-Institut für Organische Chemie und Biochemie, Universität Bonn, Gerhard-Domagk-Straße 1, 53121 Bonn (Deutschland)Search for more papers by this authorWir danken für die Unterstützung durch den Sonderforschungsbereich 813 “Chemie an Spinzentren” (DFG) und die BASF SE.
Graphical Abstract
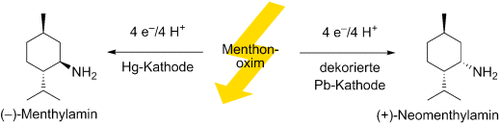
Die Kathode weist den Weg zu den epimeren Menthylaminen. Ausgehend von Menthonoxim ergibt die Reduktion an Hg-Kathoden hauptsächlich (−)-Menthylamin, wogegen eine Pb-Kathode einen Zugang zu (+)-Neomenthylamin eröffnet (siehe Schema). Eine In-situ-Belegung der Pb-Kathode führt zu sauberen und quantitativen Umsetzungen. Darüber hinaus wird bei dieser praktischen Methode die Pb-Korrosion vollständig vermieden.
Supporting Information
Detailed facts of importance to specialist readers are published as ”Supporting Information”. Such documents are peer-reviewed, but not copy-edited or typeset. They are made available as submitted by the authors.
| Filename | Description |
|---|---|
| ange_201101330_sm_miscellaneous_information.pdf2.6 MB | miscellaneous_information |
Please note: The publisher is not responsible for the content or functionality of any supporting information supplied by the authors. Any queries (other than missing content) should be directed to the corresponding author for the article.
References
- 1
- 1aM. Breuer, K. Ditrich, T. Habicher, B. Hauer, M. Keßeler, R. Stürmer, T. Zelinski, Angew. Chem. 2004, 116, 806–843;
10.1002/ange.200300599 Google ScholarAngew. Chem. Int. Ed. 2004, 43, 788–824;
- 1bU. Kraatz, G. Hänssler, Eur. Pat. Appl. EP 0 341 475A2, 1989.
- 2J. Seyden-Penne, Chiral Auxiliaries and Ligands in Asymmetric Synthesis, Wiley, New York, 1995.
- 3
- 3aS. Hashiguchi, A. Fujii, J. Takehara, T. Ikariya, R. Noyori, J. Am. Chem. Soc. 1995, 117, 7562–7563;
- 3bA. Fujii, S. Hashiguchi, N. Uematsu, T. Ikariya, R. Noyori, J. Am. Chem. Soc. 1996, 118, 2521–2522.
- 4A. S. Bommarius, M. Schwarm, K. Stingl, M. Kottenhahn, K. Huthmacher, K. Drauz, Tetrahedron: Asymmetry 1995, 6, 2851–2888.
- 5
- 5aG. M. Rishton, D. M. Retz, P. A. Tempest, J. Novotny, S. Kahn, J. J. S. Treanor, J. D. Lile, M. Citron, J. Med. Chem. 2000, 43, 2297–2299;
- 5bM. Yildirim, H. C. Wals, B. J. Van Vliet, J. H. M. Lange, PCT Int. Appl. WO 2008152086A2, 2008;
- 5cP. H. Boyle, Q. Rev. 1971, 25, 323–341;
- 5dI. M. Malkowsky, M. Nieger, O. Kataeva, S. R. Waldvogel, Synthesis 2007, 773–778.
- 6H. Oertling, A. Reckziegel, H. Surburg, H.-J. Bertram, Chem. Rev. 2007, 107, 2136–2164.
- 7
- 7aC. M. Nachtsheim, A. W. Frahm, Arch. Pharm. 1989, 322, 187–197;
- 7bG. Knupp, A. W. Frahm, Chem. Ber. 1984, 117, 2076–2098;
- 7cA. G. Schultz, M. Macielag, D. E. Podhorez, J. C. Suhadolnik, R. K. Kullnig, J. Org. Chem. 1988, 53, 2456–2464;
- 7dN. Welschoff, S. R. Waldvogel, Synthesis 2010, 3596–3601.
- 8E. Pinard, S. M. Ceccarelli, H. Stalder, D. Alberati, Bioorg. Med. Chem. Lett. 2006, 16, 349–353.
- 9M. C. Schopohl, C. Siering, O. Kataeva, S. R. Waldvogel, Angew. Chem. 2003, 115, 2724–2727;
10.1002/ange.200351102 Google ScholarAngew. Chem. Int. Ed. 2003, 42, 2620–2623.
- 10M. Bomkamp, C. Siering, K. Landrock, H. Stephan, R. Fröhlich, S. R. Waldvogel, Chem. Eur. J. 2007, 13, 3724–3732.
- 11R. Orghici, U. Willer, M. Gierszecwska, S. R. Waldvogel, W. Schade, Appl. Phys. B 2008, 90, 355–360.
- 12R. Grosser, W. Lange, B. Boehmer, D. Arlt, D. Bielefeldt, Ger. Offen. DE 40 21 108A1, 1990.
- 13M. Grosse-Bley, B. Bömer, R. Grosser, D. Arlt, W. Lange, Ger. Offen. DE 41 20 695A1, 1991.
- 14M. Grosse-Bley, B. Bömer, R. Grosser, W. Lange, F. P. Hoever, D. Arlt, Ger. Offen. DE 42 21 711A1, 1992.
- 15B. Bömer, R. Grosser, W. Lange, U. Zweering, B. Koehler, W. Sirges, M. Grosse-Bley, Ger. Offen. DE 195 46 136A1, 1995.
- 16W. Lange, R. Grosser, B. Köhler, S. Michel, U. Zweering, B. Bömer, Ger. Offen. DE 197 14 343A1, 1997.
- 17R. Angerbauer, R. Grosser, W. Hinsken, J. Rehse, Eur. Pat. Appl. EP 0 617 019A1, 1994.
- 18J. Looft, T. Vössing, J. Ley, M. Backes, M. Blings, Eur. Pat. Appl. EP 1 989 944A1, 2008.
- 19O. Wallach, Ber. Dtsch. Chem. Ges. 1891, 24, 3992–3993.
10.1002/cber.189102402292 Google Scholar
- 20M. C. Schopohl, K. Bergander, O. Kataeva, R. Fröhlich, S. R. Waldvogel, Synthesis 2003, 2689–2694.
- 21N. D. Zubavera, A. A. Vedenyapin, E. I. Klabunovskii, Russ. J. Appl. Chem. 2009, 82, 1234–1237.
- 22J. Tafel, E. Pfeffermann, Ber. Dtsch. Chem. Ges. 1902, 35, 1510–1518.
- 23U. Griesbach, D. Zollinger, H. Pütter, C. Comminellis, J. Appl. Electrochem. 2005, 35, 1265–1270.
- 24S. R. Waldvogel, S. Mentizi, A. Kirste, Top. Curr. Chem. 2011, DOI: .
- 25N. Komatsu, S. Simizu, T. Sugita, Synth. Commun. 1992, 22, 277–279.
- 26A. J. Fry, J. H. Newberg, J. Am. Chem. Soc. 1967, 89, 6374.
- 27Die Verbindung wurde von der BASF SE bereitgestellt, wobei sich im Elektrolyten unmittelbar das entsprechende Bisulfat bildet.
- 28
- 28aH. Pütter in Organic Electrochemistry, 4. Aufl. (Hrsg.: ), Marcel Dekker, New York, 2001, S. 1259–1308;
- 28bD. Sopher, A. Gieseler, H. Hibst, K. Harth, Ger. Offen. DE 43 19 951A1, 1993;
- 28cM. M. Baizer, J. Electrochem. Soc. 1964, 111, 215–222;
- 28dM. M. Baizer, C. R. Campbell, R. H. Fariss, R. Johnson, U.S. Patent 3 193 480, 1965;
- 28eM. M. Baizer, U.S. Patent 3 250 690, 1960.
- 2914 ist schlecht in 2-proz. Schwefelsäure in Methanol löslich. Daher wurde eine Konzentration <0.01 % angenommen.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.