Photoswitching of the Fluorescent Protein asFP595: Mechanism, Proton Pathways, and Absorption Spectra†
Lars V. Schäfer
Abteilung für theoretische und computergestützte Biophysik, Max-Planck-Institut für Biophysikalische Chemie, Am Fassberg 11, 37077 Göttingen, Germany, Fax: (+49) 551-201-2302
Search for more papers by this authorGerrit Groenhof Dr.
Abteilung für theoretische und computergestützte Biophysik, Max-Planck-Institut für Biophysikalische Chemie, Am Fassberg 11, 37077 Göttingen, Germany, Fax: (+49) 551-201-2302
Search for more papers by this authorAstrid R. Klingen
Abteilung Strukturbiologie/Bioinformatik, Universität Bayreuth, Universitätsstrasse 30, 95447 Bayreuth, Germany
Search for more papers by this authorG. Matthias Ullmann Prof. Dr.
Abteilung Strukturbiologie/Bioinformatik, Universität Bayreuth, Universitätsstrasse 30, 95447 Bayreuth, Germany
Search for more papers by this authorMartial Boggio-Pasqua Dr.
Department of Chemistry, Imperial College London, London SW7 2AZ, UK
Search for more papers by this authorMichael A. Robb Prof. Dr.
Department of Chemistry, Imperial College London, London SW7 2AZ, UK
Search for more papers by this authorHelmut Grubmüller Prof. Dr.
Abteilung für theoretische und computergestützte Biophysik, Max-Planck-Institut für Biophysikalische Chemie, Am Fassberg 11, 37077 Göttingen, Germany, Fax: (+49) 551-201-2302
Search for more papers by this authorLars V. Schäfer
Abteilung für theoretische und computergestützte Biophysik, Max-Planck-Institut für Biophysikalische Chemie, Am Fassberg 11, 37077 Göttingen, Germany, Fax: (+49) 551-201-2302
Search for more papers by this authorGerrit Groenhof Dr.
Abteilung für theoretische und computergestützte Biophysik, Max-Planck-Institut für Biophysikalische Chemie, Am Fassberg 11, 37077 Göttingen, Germany, Fax: (+49) 551-201-2302
Search for more papers by this authorAstrid R. Klingen
Abteilung Strukturbiologie/Bioinformatik, Universität Bayreuth, Universitätsstrasse 30, 95447 Bayreuth, Germany
Search for more papers by this authorG. Matthias Ullmann Prof. Dr.
Abteilung Strukturbiologie/Bioinformatik, Universität Bayreuth, Universitätsstrasse 30, 95447 Bayreuth, Germany
Search for more papers by this authorMartial Boggio-Pasqua Dr.
Department of Chemistry, Imperial College London, London SW7 2AZ, UK
Search for more papers by this authorMichael A. Robb Prof. Dr.
Department of Chemistry, Imperial College London, London SW7 2AZ, UK
Search for more papers by this authorHelmut Grubmüller Prof. Dr.
Abteilung für theoretische und computergestützte Biophysik, Max-Planck-Institut für Biophysikalische Chemie, Am Fassberg 11, 37077 Göttingen, Germany, Fax: (+49) 551-201-2302
Search for more papers by this authorWe thank Martin Andresen, Christian Eggeling, Stefan Hell, Stefan Jakobs, Andre Stiel, and Markus Wahl for kindly providing us with the mutant asFP595 structures prior to publication and for stimulating discussions. A.R.K. and L.V.S. thank the Boehringer Ingelheim Fonds for PhD scholarships. We thank Martin Stumpe for his help with the frontispiece.
Graphical Abstract
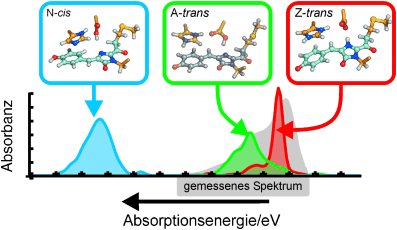
Molekularer Lichtschalter: Am Ein-/Ausschalten der Fluoreszenz des Proteins asFP595 ist eine trans-cis-Isomerisierung beteiligt (siehe Schema). Quantenmechanische und klassische Simulationen erhellen die spektroskopischen Eigenschaften von asFP595 und verschaffen einen genauen Einblick in den Photoschaltmechanismus. Der trans-cis-Konformationswechsel löst eine Protonentransferkaskade zwischen dem Chromophor und benachbarten Aminosäuren aus.
Supporting Information
Supporting information for this article is available on the WWW under http://www.wiley-vch.de/contents/jc_2001/2007/z602315_s.pdf or from the author.
Please note: The publisher is not responsible for the content or functionality of any supporting information supplied by the authors. Any queries (other than missing content) should be directed to the corresponding author for the article.
References
- 1J. Lippincott-Schwartz, N. Altan-Bonnet, G. H. Patterson, Nat. Cell Biol. 2003, Suppl. S, 7.
- 2A. Miyawaki, A. Sawano, T. Kogure, Nat. Cell Biol. 2003, Suppl. S, 1.
- 3R. Y. Tsien, Annu. Rev. Biochem. 1998, 67, 509.
- 4R. Ando, H. Mizuno, A. Miyawaki, Science 2004, 306, 1370.
- 5D. M. Chudakov, V. V. Belousov, A. G. Zarisky, V. V. Novoselov, D. B. Staroverov, D. B. Zorov, S. Lukyanov, K. A. Lukyanov, Nat. Biotechnol. 2003, 21, 191.
- 6K. A. Lukyanov, A. F. Fradkov, N. G. Gurskaya, M. V. Matz, Y. A. Labas, A. P. Savitsky, M. L. Markelov, A. G. Zaraisky, X. N. Zhao, Y. Fang, W. Y. Tan, S. A. Lukyanov, J. Biol. Chem. 2000, 275, 25879.
- 7 Organic Photochromic and Thermochromic Compounds: Main Photochromic Families, Vol. 1 (Eds.: ), Plenum, New York, 1999.
- 8S. W. Hell, S. Jakobs, L. Kastrup, Appl. Phys. A 2003, 77, 859.
- 9S. W. Hell, Nat. Biotechnol. 2003, 21, 1347.
- 10S. W. Hell, M. Dyba, S. Jakobs, Curr. Opin. Neurobiol. 2004, 14, 599.
- 11M. Andresen, M. C. Wahl, A. C. Stiel, F. Gräter, L. V. Schäfer, S. Trowitzsch, G. Weber, C. Eggeling, H. Grubmüller, S. W. Hell, S. Jakobs, Proc. Natl. Acad. Sci. USA 2005, 102, 13070.
- 12D. M. Chudakov, A. V. Feofanov, N. N. Mudrik, S. Lukyanov, K. A. Lukyanov, J. Biol. Chem. 2003, 278, 7215.
- 13M. Hofmann, C. Eggeling, S. Jakobs, S. W. Hell, Proc. Natl. Acad. Sci. USA 2005, 102, 17565.
- 14P. G. Wilmann, J. Petersen, R. J. Devenish, M. Prescott, J. Rossjohn, J. Biol. Chem. 2005, 280, 2401.
- 15M. L. Quillin, D. A. Anstrom, X. K. Shu, S. O'Leary, K. Kallio, D. A. Chudakov, S. J. Remington, Biochemistry 2005, 44, 5774.
- 16V. Helms, Curr. Opin. Struct. Biol. 2002, 12, 169.
- 17D. Stoner-Ma, A. A. Jaye, P. Matousek, M. Towrie, S. R. Meech, P. J. Tonge, J. Am. Chem. Soc. 2005, 127, 2864.
- 18N. Agmon, Biophys. J. 2005, 88, 2452.
- 19P. Leiderman, D. Huppert, N. Agmon, Biophys. J. 2006, 90, 1009.
- 20O. Vendrell, R. Gelabert, M. Moreno, J. M. Lluch, J. Am. Chem. Soc. 2006, 128, 3564.
- 21A. D. Bacon, M. C. Zerner, Theor. Chim. Acta 1979, 53, 21.
- 22L. K. Hanson, J. Fajer, M. A. Thompson, M. C. Zerner, J. Am. Chem. Soc. 1987, 109, 4728.
- 23L. N. Oliveira, E. K. U. Gross, W. Kohn, Int. J. Quant. Chem. 1990, Suppl. 24, 707.
10.1002/qua.560382470 Google Scholar
- 24E. Runge, E. K. U. Gross, Phys. Rev. Lett. 1984, 52, 997.
- 25 Recent Advances in Density Functional Methods (Eds.: ), World Scientific Publishing, Singapore, 1995.
- 26M. Petersilka, U. J. Gossmann, E. K. U. Gross, Phys. Rev. Lett. 1996, 76, 1212.
- 27C. Jamorski, M. E. Casida, D. R. Salahub, J. Chem. Phys. 1996, 104, 5134.
- 28G. Groenhof, M. F. Lensink, H. J. C. Berendsen, J. G. Snijders, A. E. Mark, Proteins Struct. Funct. Genet. 2002, 48, 202.
- 29M. A. L. Marques, X. Lopez, D. Varsano, A. Castro, A. Rubio, Phys. Rev. Lett. 2003, 90, 2581 011.
- 30J. A. Gascon, V. S. Batista, Biophys. J. 2004, 87, 2931.
- 31X. Lopez, M. A. L. Marques, A. Castro, A. Rubio, J. Am. Chem. Soc. 2005, 127, 12329.
- 32N. Sanna, G. Chillemi, A. Grandi, S. Castelli, A. Desideri, V. Barone, J. Am. Chem. Soc. 2005, 127, 15429.
- 33B. Grigorenko, A. Savitsky, I. Topol, S. Burt, A. Nemukhin, Chem. Phys. Lett. 2006, 424, 184.
- 34A. Warshel, M. Levitt, J. Mol. Biol. 1976, 103, 227.
- 35T. A. Schüttrigkeit, T. von Feilitzsch, C. K. Kompa, K. A. Lukyanov, A. P. Savitsky, A. A. Voityuk, M. E. Michel-Beyerle, Chem. Phys. 2006, 323, 149.
- 36I. V. Yampolsky, S. J. Remington, V. I. Martynov, V. K. Potapov, S. Lukyanov, K. A. Lukyanov, Biochemistry 2005, 44, 5788.
- 37A. Warshel, Proc. Natl. Acad. Sci. USA 1984, 81, 444.
- 38S. Habuchi, R. Ando, P. Dedecker, W. Verheijen, H. Mizuno, A. Miyakawa, J. Hofkens, Proc. Natl. Acad. Sci. USA 2005, 102, 9511.
- 39S. Habuchi, M. Cotlet, T. Gensch, T. Bednarz, S. Haber-Pohlmeier, J. Rozenski, G. Dirix, J. Michiels, J. Vanderleyden, J. Heberle, F. C. DeSchryver, J. Hofkens, J. Am. Chem. Soc. 2005, 127, 8977.
- 40G. U. Nienhaus, K. Nienhaus, A. Holzle, S. Ivanchenko, F. Renzi, F. Oswald, M. Wolff, F. Schmitt, C. Rocker, B. Vallone, W. Weidemann, R. Heilker, H. Nar, J. Wiedenmann, Photochem. Photobiol. 2006, 82, 351.
- 41B. Bieger, L.-O. Essen, D. Oesterhelt, Structure 2003, 11, 375.
- 42N. M. Derix, R. W. Wechselberger, M. A. van der Horst, K. J. Hellingwerf, R. Boelens, R. Kaptein, N. A. J. van Nuland, Biochemistry 2003, 42, 14501.
- 43G. Groenhof, M. Bouxin-Cademartory, B. Hess, S. P. de Visser, H. J. C. Berendsen, M. Olivucci, A. E. Mark, M. A. Robb, J. Am. Chem. Soc. 2004, 126, 4228.
- 44S. H. Vosko, L. Wilk, M. Nusair, Can. J. Phys. 1980, 58, 1200.
- 45A. D. Becke, Phys. Rev. A 1988, 38, 3098.
- 46J. P. Perdew, Phys. Rev. B 1986, 33, 8822.
- 47A. F. Bell, X. He, R. M. Wachter, P. J. Tonge, Biochemistry 2000, 39, 4423.
- 48D. van der Spoel, B. Hess, E. Lindahl, G. Groenhof, A. E. Mark, H. J. C. Berendsen, J. Comput. Chem. 2005, 26, 1701.
- 49W. L. Jorgensen, J. Tirado-Rives, J. Am. Chem. Soc. 1988, 110, 1657.
- 50Gaussian 03, M. J. Frisch, G. W. Trucks, H. B. Schlegel, G. E. Scuceria, M. A. Robb, J. R. Cheeseman, J. A. Montgomery, Jr., T. Vreven, K. N. Kudin, J. C. Burant, J. M. Millam, S. S. Iyengar, J. Tomasi, V. Barone, B. Mennucci, M. Cossi, G. Scalmani, N. Rega, G. A. Petersson, H. Nakatsuji, M. Hada, M. Ehara, K. Toyota, R. Fukuda, J. Hasegawa, M. Ishida, T. Nakajima, Y. Honda, O. Kitao, H. Nakai, M. Klene, X. Li, J. E. Knox, H. P. Hratchian, J. B. Cross, C. Adamo, J. Jaramillo, R. Gomperts, R. E. Stratmann, O. Yazyev, A. J. Austin, R. Cammi, C. Pomelli, J. W. Ochterski, P. Y. Ayala, K. Morokuma, G. A. Voth, P. Salvador, J. J. Dannenberg, V. G. Zakrzewski, S. Dapprich, A. D. Daniels, M. C. Strain, O. Farkas, D. K. Malick, A. D. Rabuck, K. Raghavachari, J. B. Foresman, J. V. Ortiz, Q. Cui, A. G. Baboul, S. Clifford, J. Cioslowski, B. B. Stefanov, G. Liu, A. Liashenko, P. Piskorz, I. Komaromi, D. J. Fox, T. Keith, M. A. Al-Laham, C. Y. Peng, A. Nanayakkara, M. Challacombe, P. M. W. Gill, B. Johnson, W. Chen, M. W. Wong, C. Gonzalez, J. A. Pople, Gaussian, Inc., Pittsburgh, PA, 2003.
- 51G. M. Ullmann, E.-W. Knapp, Eur. Biophys. J. 1999, 28, 533.
- 52D. Bashford, M. Karplus, Biochemistry 1990, 29, 10219.
- 53QMCT: a Monte Carlo titration program, G. M. Ullmann, Universität Bayrouth, 2005.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.