Synthese optisch aktiver Butenolide und γ-Lactone aus β,γ-ungesättigten Carbonsäureestern mit der asymmetrischen Dihydroxylierung nach Sharpless†
Dipl.-Chem. Christian Harcken
Institut für Organische Chemie der Universität Tammannstraße 2, D-37077 Göttingen Telefax: Int. + 551/392944 E-mail: [email protected]
Search for more papers by this authorCorresponding Author
Prof. Dr. Reinhard Brückner
Institut für Organische Chemie der Universität Tammannstraße 2, D-37077 Göttingen Telefax: Int. + 551/392944 E-mail: [email protected]
Institut für Organische Chemie der Universität Tammannstraße 2, D-37077 Göttingen Telefax: Int. + 551/392944 E-mail: [email protected]Search for more papers by this authorDipl.-Chem. Christian Harcken
Institut für Organische Chemie der Universität Tammannstraße 2, D-37077 Göttingen Telefax: Int. + 551/392944 E-mail: [email protected]
Search for more papers by this authorCorresponding Author
Prof. Dr. Reinhard Brückner
Institut für Organische Chemie der Universität Tammannstraße 2, D-37077 Göttingen Telefax: Int. + 551/392944 E-mail: [email protected]
Institut für Organische Chemie der Universität Tammannstraße 2, D-37077 Göttingen Telefax: Int. + 551/392944 E-mail: [email protected]Search for more papers by this authorDiese Untersuchungen wurden vom Fonds der Chemischen Industrie gefördert. Der BASF AG danken wir für Chemikalienspenden.
Abstract
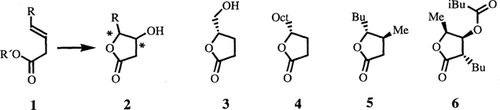
Nichtkonjugierte ungesättigte Ester 1 und AD-Mix α oder AD-Mix β ergeben cis-konfigurierte γ-Alkyl-β-hydroxy-γ-lactone 2 - breit einsetzbare Vorläufer γ-chiraler Butenolide und γ-chiraler Butyrolactone von mittlerer bis sehr hoher Enantiomerenreinheit. Dies zeigen die Synthesen der Naturstoffe 3 (92% ee), 4 (95% ee), 5 (97% ee) und 6 (78% ee).
References
- 1 Neuere Übersichten: a) H. C. Kolb, M. S. VanNieuwenhze, K. B. Sharpless, Chem. Rev. 1994, 94, 2483–2547; b) G. Poli, C. Scolastico, Methoden Org. Chem. (Houben-Weyl), 4th ed. 1952-, Vol. E21e, S. 4547–4598.
- 2 Kürzlich beschriebene Synthesen nichtracemischer γ-chiraler Butenolide: a) B. Figadère, J.-F. Peyrat, A. Cavé, J. Org. Chem. 1997, 62, 3428–3429; b) J. A. Marshall, M. A. Wolf, E. M. Wallace, J. Org. Chem. 1997, 62, 367–371; c) A. van Oeveren, B. L. Feringa, J. Org. Chem. 1996, 61, 2920–2921.
- 3 Kürzlich beschriebene Synthesen nichtracemischer γ-chiraler γ-Lactone: a) W.-Y. Yu, C. Bensimon, H. Alper, Chem. Eur. J. 1997, 3, 417–423; b) T. Chevtchouk, J. Ollivier, J. Salaün, Tetrahedron: Asymmetry 1997, 8, 1011–1014; c) A.-M. Fernandez, J.-C. Plaquevent, L. Duhamel, J. Org. Chem. 1997, 62, 4007–4014; d) S.-i. Fukuzawa, K. Seki, M. Tatsuzawa, K. Mutoh„ J. Am. Chem. Soc. 1997, 119, 1482–1483.
- 4 Z.-M. Wang, X.-L. Zhang, K. B. Sharpless, S. C. Sinha, A. Sinha-Bagchi und E. Keinan ( Tetrahedron Lett. 1992, 33, 6407–6410) beschrieben je drei Umwandlungen vom Typ 4→3 und 4→ent-3 (R=Et, Hex, Ph; 92 bis >99% ee).
- 5 Y. Miyazaki, H. Hotta und F. Sato ( Tetrahedron Lett. 1994, 35, 4389–4392) beschreiben für R=SiMe3 eine 4→3-Umwandlung mit 86% ee.
- 6 C. S. Pak, E. Lee, G. H. Lee, J. Org. Chem. 1993, 58, 1523–1530.
- 7 Von allen neuen Verbindungen wurden zufriedenstellende 1H-NMR-Spektren (300 MHz, CDCl3), IR-Spektren (KBr) und Elementaranalysen erhalten.
- 8 W. C. Still, M. Kahn, A. Mitra, J. Org. Chem. 1978, 43, 2923–2925.
- 9 Typische Arbeitsvorschrift für die Gewinnung von Typ-3-Lactonen aus nichtkonjugierten ungesättigten Estern 4: [18].
- 10 Die optische Reinheit wurde jeweils kapillargaschromatographisch an Heptakis-(2,6-di-O-methyl-3-O-pentyl)-β-cyclodextrin/OV 1701 (1/4) bestimmt (25-m-Säule); 70 kPa H2, isotherm. RT-Werte von AD-abgeleitetem Produkt (oder daraus erhaltenem Butenolid) und dessen Enantiomer (als Bestandteil des zugehörigen racemischen Gemischs): 10 50.5 min (110°C: Enantiomer 51.4 min); 15 53.6 min (130°C; Enantiomer 54.8 min); 23 45.4 min (110°C: Enantiomer 44.3 min).
- 11 Aufklärung der räumlichen Struktur: R. Hill, R. van Heyningen, Biochem. J. 1951, 49, 332–335.
- 12 Ausgewählte Synthesen von linksdrehendem Ranunculin-Aglycon: a) P. Camps, J. Cardellach, J. Font, R. M. Ortuño, O. Ponsati, Tetrahedron 1982, 38, 2395–2402 (aus D-Ribonolacton in zwei Stufen): b) B. Häfele, V. Jäger, Liebigs Ann. Chem. 1987, 85–87; J. Mann, N. K. Partlett, A. Thomas, J. Chem. Res. (S) 1987, 369 (aus 1,2:5,6-Di-O-isopropyliden-D-mannitol in drei Stufen): c) K. Koseki, T. Ebata, H. Kawakami, H. Matsushita, Y. Naoi, K. Itoh, Heterocycles 1990, 31, 423–426 (aus Lävoglucosenon in drei Stufen): d) S. Takano, A. Kurotaki, M. Takahashi, K. Ogasawara, Synthesis 1986, 403–406; G. A. Danilova, V. I. Mel'nikova, K. K. Pivnitsky, Tetrahedron Lett. 1986, 27, 2489–2490 (aus 1,2:5,6-Di-O-isopropyliden-D-mannitol in sechs Stufen); e) O. Yamada, K. Ogasawara, Synthesis 1995, 1291–1294 (aus cis-2-Buten-1,2-diol in elf Stufen): f) J. A. J. M. Vekemans, G. A. M. Franken, G. J. F. Chittenden, E. F. Godefroi, Tetrahedron Lett. 1987, 28, 2299–2300 (O-Acetyl-11: aus D-Ribonolacton in zwei Stufen); g) S. Hanessian, P. J. Murray, S. P. Sahoo, Tetrahedron Lett. 1985, 26, 5627–5630 (O-tBuPh2Si-11: aus L-Glutaminsäure in fünf Stufen).
- 13 Aufklärung der räumlichen Struktur: J. W. Wheeler, G. M. Happ, J. Araujo, J. M. Pasteels, Tetrahedron Lett. 1972, 4635–4638.
- 14 In einer Stufe nach der allgemeinen Vorschrift von N. Ragoussis, Tetrahedron Lett. 1987, 28, 93–96, erhalten.
- 15 Ausgewählte Synthesen von (+)-Dodecanolid: a) G. Tuynenburg Muys, B. van der Ven, A. P. de Jonge, Nature 1962, 194, 995–996; T. Ohkuma, M. Kitamura, R. Noyori, Tetrahedron Lett. 1990, 31, 5509–5512 (aus nicht käuflich erhältlichem Ethyl-4-oxododecanoat in zwei Stufen); b) Y. Naoshima, H. Hasegawa, T. Saeki, Agric. Biol. Chem. 1987, 51, 3417–3419 (aus Diethyl-3-oxoglutarat in vier Stufen); c) J. P. Vigneron, J. Bloy, Tetrahedron Lett. 1980, 21, 1735–1738 (aus 1-Undecin-3-on in vier Stufen); d) H. Kakeya, N. Sakai, T. Sugai, H. Ohta, Agric. Biol. Chem. 1991, 55, 1877–1881 (aus 2-Hydroxydecannitril in sechs Stufen); e) C. Bonini, C. Federici, L. Rossi, G. Righi, J. Org. Chem. 1995, 60, 4803–4812 (aus Octanal in sechs Stufen); f) G. C. Paddon-Jones, C. J. Moore, D. J. Brecknell, W. A. König, W. Kitching, Tetrahedron Lett. 1997, 38, 3479–3482 (aus L-Glutaminsäure in sechs Stufen); g) T. Ebata, H. Kawakami, K. Koseki, H. Matsushita, Agric. Biol. Chem. 1991, 55, 1685–1686, in Fortführung von Anfangsstufen von M. P. Balfe, M. Irwin, J. Kenyon, J. Chem. Soc. 1941, 313–316 (aus Tetrahydrofurfurol in sieben Stufen); h) V. Cerè, C. Mazzini, C. Paolucci, S. Pollicino, A. Fava, J. Org. Chem. 1993, 58, 4567–4571 (aus 1,4:3,6-Dianhydro-D-mannitol in sieben Stufen); i) T. Sugai, K. Mori, Agric. Biol. Chem. 1984, 48, 2497–2500 [aus N-(Chloracetamidoyl)decansäure in acht Stufen]; j) S. Chattopadhyay, V. R. Mamdapur, M. S. Chadha, Tetrahedron 1990, 46, 3667–3672 (aus 1,2:5,6-Di-O-isopropyliden-D-mannitol in neun Stufen); k) H. Nemoto, H. Ishibashi, M. Mori, S. Fujita, K. Fukumoto, J. Chem. Soc. Perkin Trans. 1 1990, 2835–2840 (aus Methyl-1-hydroxycyclopropancarboxylat in zehn Stufen).
- 16 Ausgewählte Synthesen von (-)-trans-Quercuslacton: a) D. Hoppe, O. Zschage, Angew. Chem. 1989, 101, 67–69; Angew. Chem. Int. Ed. Engl. 1989, 28, 69–71 (aus Crotylalkohol in vier Stufen); b) M. Beckmann, H. Hildebrandt, E. Winterfeldt, Tetrahedron: Asymmetry 1990, 1, 335–345, in Förtführung von Anfangsstufen von K. Matcheva, M. Beckmann, D. Schomburg, E. Winterfeldt, Synthesis 1989, 814–817 (aus Maleinsäureanhydrid und einem enantiomerenreinen Dien in fünf Stufen); c) J. P. Marino, R. F. de la Pradilla, Tetrahedron Lett. 1985, 26, 5381–5384 (aus trans-1-Brompropen in sechs Stufen); d) R. Bloch, L. Gilbert, J. Org. Chem. 1987, 52, 4603–4605, in Fortführung von Anfangsstufen von R. Bloch, E. Guibé-Jampel, C. Girard, Tetrahedron Lett. 1985, 26, 4087–4090 (aus dem Diels-Alder-Addukt von Maleinsäureanhydrid und Furan in sieben Stufen); e) R. M. Ortuño, R. Merce, J. Font, Tetrahedron 1987, 43, 4497–4506 (aus D-Ribonolacton in sieben Stufen); f) C. Günter, A. Mosandl, Liebigs Ann. Chem. 1986, 2112–2122 (aus Pentanal in acht Stufen); g) D. F. Taber, J. B. Houze, J. Org. Chem. 1994, 59, 4004–4006 (aus Geraniol in elf Stufen); eine weitere Mehrstufensynthese bietet Lit.[3b].
- 17 Aufklärung der räumlichen Struktur: M. Masuda, K. Nishimura, Phytochem. 1971, 10, 1401–1402; M. Masuda, K. Nishimura, Chem. Lett. 1981, 1333–1336.
- 18 19: 18 (2.66 mL, 2.34 g, 15.0 mmol) wurde zu einem Gemisch aus tBuOH (50 mL), H2O (50 mL), AD-Mixß (21.0 g) und Methansulfonsäureamid (1.43 g, 15.0 mmol, 1.0 Äquiv.) gegeben Nach 36 h Rühren bei 0°C versetzte man mit gesättigter wäßriger Na2SO3-Lösung (2 mL), extrahierte mit tBuOMe (3 × 100 mL), trocknete die vereinigten organischen Phasen über Na2SO4, entfernte das Lösungsmittel unter vermindertem Druck und isolierte durch Flash-Chromatographie an Kieselgel (Lit.[8]; 5 cm, Petrolether/tBuOMe 1/1 / 1/3) 19 (2.20 g, 92%) als farblose Flüssigkeit. [α]D25 = 70.8° (c = 1.36 in MeOH). Kapillar-Gaschromatographie[10] (130°C) von 19 (RT 75.6 min) und dem analog synthetisierten Enantiomer (RT 77.3 min) ergab für ersteres 97% ee.- IR (in Substanz): ū = 3450, 2960, 2870, 1760, 1205, 1170, 1085, 1015, 975 cm−1. 1H-NMR (300 MHz, CDCl3): δ = 0.94 (t, J4′,3′ = 7.0 Hz, 4′-H3), 1.32–1.56 (m, 2′-H2, 3′-H2), 1.66–1.94 (m, 1′-H2), AB-Signal (δA = 2.55, δB = 2.79, JAB = 17.9 Hz, zusätzlich aufgespalten durch JB,4 = 5.5 Hz, 3-H2), A-Teil teilweise überlagert von 2.61 (br.s, OH), 4.37 (ddd, J5,1′-H(1) = 8.9, J5,1′-H(2) = 5.8, J5,4 = 3.8 Hz, 5-H), 4.48 (dd, J4,3-H(B) ≈ J4,5 ≈ 4.4 Hz, 4-H). C,H-Analyse: C8H14O3 (158.2): ber.: C 60.74, H 8.92; gef.: C 60.59, H 9.15.
- 19 ADs disubstituierter Olefine vom Typ trans-MeCHCHR verliefen mit 72% ee in Fall von 2-Buten („unveröffentliches Ergebnis”︁ in Lit.[1a]), 73% ee im Fall von 1-Phenyl-3-penten-1-in (K.-S. Jeong, P. Sjö, K. B. Sharpless, Tetrahedron Lett. 1992, 33, 3833–3836) und 95% ee lediglich bei den elektronisch oder sterisch andersartigen Substraten 1-Chlor-2-buten (K. P. M. Vanhessche, Z.-M. Wang, K. B. Sharpless, Tetrahedron Lett. 1994, 35, 3469–3472) und 4,4-Dimethyl-2-penten („univeröffentliches Ergebnis”︁ in Lit.[1a]).
- 20 Methode: H.-M. Shieh, G. D. Prestwich, J. Org. Chem. 1981, 46, 4319–4321. Methylierungen zu 23 analoger Hydroxylactone sind nach A. R. Chamberlin, M. Dezube, S. H. Reich, D. J. Sall, J. Am. Chem. Soc. 1989, 111, 6247–6256, in Abwesenheit von HMPA möglich.
- 21a) D. Seebach, Chimia 1985, 39, 147–148; b) D. Seebach, A. K. Beek, A. Studer in Modern Synthetic Methods 1995 (Hrsg.: B. Ernst C. Leumann), VCH, Weinheim, 1995, S. 1–178.
- 22 Das Enantiomer von 25 wurde von J. Mulzer, T. Schulze, A. Strecker, W. Denzer, J. Org. Chem. 1988, 53, 4098–4103, und M. P. Sibi, J. Lu, C. L. Talbacka, J. Org. Chem. 1996, 61, 7848–7855 synthetisiert, während racemisches 25 von C. Mukai, O. Kataoka, M. Hanaoka, J. Org. Chem. 1993, 58, 2946–2952, hergestellt wurde.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.