Kontrolle des Reaktionsverlaufes bei nucleophilen Additionen an ortho-substituierte (η6-Anisol)tricarbonylchrom-Komplexe: Dienolether-Bildung versus tele-Substitution†
Corresponding Author
Prof. Dr. Hans-Günther Schmalz
Institut für Organische Chemie der Technischen Universität Straße des 17. Juni 135. D–10623 Berlin Telefax: Int. + 30/314–21105
Institut für Organische Chemie der Technischen Universität Straße des 17. Juni 135. D–10623 Berlin Telefax: Int. + 30/314–21105Search for more papers by this authorKurt Schellhaas Dipl.-Chem.
Institut für Organische Chemie der Technischen Universität Straße des 17. Juni 135. D–10623 Berlin Telefax: Int. + 30/314–21105
Search for more papers by this authorCorresponding Author
Prof. Dr. Hans-Günther Schmalz
Institut für Organische Chemie der Technischen Universität Straße des 17. Juni 135. D–10623 Berlin Telefax: Int. + 30/314–21105
Institut für Organische Chemie der Technischen Universität Straße des 17. Juni 135. D–10623 Berlin Telefax: Int. + 30/314–21105Search for more papers by this authorKurt Schellhaas Dipl.-Chem.
Institut für Organische Chemie der Technischen Universität Straße des 17. Juni 135. D–10623 Berlin Telefax: Int. + 30/314–21105
Search for more papers by this authorDiese Arbeit wurde von der Volkswagenstiftung (Projekt I/69907) und vom Fonds der Chemischen Industrie (Promotionsstipendium für K. S.) gefördert. Wir danken der Chemetall GmbH für Chemikalienspenden und Herrn Prof. M. F. Semmelhack, Princeton, für eine wertvolle Diskussion.
Abstract
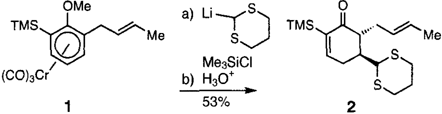
Chlortrimethylsilan ist das Reagens der Wahl, um die aus nucleophilen Additionen an ortho-substituierte Arentricarbonylchrom-Komplexe hervorgehenden anionischen Zwischenstufen zu bändigen und deren Hang zur tele-Substitution zu unterdrücken. So läßt sich 1 unter vollständiger Erhaltung der absoluten Konfiguration in das Cyclohexenon 2 überführen (≥ 95 % ee), einer vielversprechenden Vorstufe für eine Totalsynthese von (+)-Ptilocaulin.
References
- 1 E. O. Fischer, K. Öfele, Z. Naturforsch. B 1958, 13, 458.
- 2 Übersichtsartikel: L. S. Hegedus, Organische Synthese mit Übergangsmetallen VCH, Weinheim, 1995, Kap. 10.
- 3 Neuere Arbeiten: a) E. P. Kündig, A. Ripa, R. Liu, G. Bernardinelli, J. Org. Chem. 1994, 59, 4773; b) K. Kamikawa, T. Watanabe, M. Uemura, J. Org. Chem. 1996, 61, 1375; c) M. Brands, H. G. Wey, J. Bruckmann, C. Krüger, H. Butenschön, Chem. Eur. J. 1996, 2, 182.
- 4a) H.-G. Schmalz, J. Hollander, M. Arnold, G. Dürner, Tetrahedron Lett. 1993, 34, 6259; b) H.-G. Schmalz, M. Arnold, J. Hollander, J. W. Bats, Angew. Chem. 1994, 106, 77; Angew. Chem. Int. Ed. Engl. 1994, 33, 109; c) H.-G. Schmalz, A. Schwarz, G. Dürner, Tetrahedron Lett. 1994, 35, 6861; d) H.-G. Schmalz, A. Majdalani, T. Geller, J. Hollander, J. W. Bats, Tetrahedron Lett. 1995, 36, 4777.
- 5
Ein Beispiel ist die kürzlich entdeckte radikalische Cyclisierung von Arentricarbonylchrom-Komplexen: a)
H.-G. Schmalz,
S. Siegel,
J. W. Bats,
Angew. Chem.
1995,
107,
2597;
10.1002/ange.19951072122 Google ScholarAngew. Chem. Int. Ed. Engl. 1995, 34, 2383; b) H.-G. Schmalz, S. Siegel, A. Schwarz, Tetrahedron Lett. 1996, 37, 2947.
- 6 Isolierung und Strukturaufklärung: G. C. Harbour, A. A. Thymiak, K. L. Rinehart, Jr., P. D. Shaw, R. G. Hughes, Jr., S. A. Mizsak, J. H. Coats, G. E. Zurenko, L. H. Li, S. L. Kuentzel, J. Am. Chem. Soc. 1981, 103, 5604.
- 7 Arbeiten zur Synthese: a) B. B. Snider, W. C. Faith, Tetrahedron Lett. 1983, 24, 861; b) J. Am. Chem. Soc. 1984, 106, 1443; c) W. R. Roush, A. E. Walts, J. Am. Chem. Soc. 1984, 106, 721; d) A. E. Walts, W. R. Roush, Tetrahedron 1985, 41, 3463; e) T. Uyehara, T. Furuta, Y. Kabasawa, J. Yamada, T. Kato, J. Chem. Soc. Chem. Commun. 1986, 539; f) T. Uyehara, T. Furuta, Y. Kabasawa, J. Yamada, T. Kato, Y. Yamamoto, J. Org. Chem. 1988, 53, 3669; g) A. Hassner, K. S. K. Murthy, Tetrahedron Lett. 1986, 27, 1407; h) M. Asaoka, M. Sakurai, H. Takei, Tetrahedron Lett. 1990, 31, 4759.
- 8 H.-G. Schmalz, K. Schellhaas, Tetrahedron Lett. 1995, 36, 5511.
- 9a) M. F. Semmelhack, J. J. Harrison, Y. Thebtaranonth, J. Org. Chem. 1979, 44 3275; b) M. F. Semmelhack, H. T. Hall, Jr., R. Farina, M. Yoshifuji, G. Clark, T. Bargar, K. Hirotsu, J. Clardy, J. Am. Chem. Soc. 1979, 101, 3535; c) M. F. Semmelhack, G. R. Clark, J. L. Garcia, J. J. Harrison, Y. Thebtaranonth, W. Wulff, A. Yamashita, Tetrahedron 1981, 37, 3957; d) M. F. Semmelhack in Comprehensive Organometallic Chemistry II, Vol. 12 (Hrsg.: E. W. Abel, F. G. A. Stone, G. Wilkinson), Pergamon, NY, 1995, S. 979; Für eine Anwendung dieser Chemie zur Synthese von (±)-Acorenon B (Herstellung eines spirocyclischen 5,5-disubstituierten Cyclohexenons) siehe: e) M. F. Semmelhack, A. Yamashita, J. Am. Chem. Soc. 1980, 102, 5924.
- 10
Übersichtsartikel über nucleophile Additionen an Aren-Komplexe:
M. F. Semmelhack
in
Comprehensive Organic Synthesis, Vol.4
(Hrsg.: B. M. Trost,
I. Fleming).
Pergamon, Oxford
1991,
S. 517.
10.1016/B978-0-08-052349-1.00102-5 Google Scholar
- 11 Alle neuen Verbindungen wurden durch die üblichen spektroskopischen Methoden charakterisiert und gaben korrekte Elementaranalysen.
- 12a) D. A. Price, N. S. Simpkins, A. M. MacLeod, A. P. Watt, J. Org. Chem 1994, 59, 1961; b) Tetrahedron Lett. 1994 35, 6159; c) H.-G. Schmalz, K. Schellhaas, Tetrahedron Lett. 1995, 36, 5515.
- 13 Durch Erniedrigung der Reaktionstemperatur konnte die Enantioselektivität der Reaktion gegenüber den früheren Vorschriften [12] gesteigert werden. Die angegebene absolute Konfiguration von 6 basiert auf der Zuordnung von Simpkins [12a].
- 14 Die Enantiomerenüberschüsse wurden HPL-chromatographisch mit einer Chiralcel-OJ-Säule (Daicel) bestimmt. Die Trennbedingungen wurden mit racemischen Proben optimiert.
- 15a) M. F. Semmelhack, A. Zask, J. Am. Chem. Soc. 1983, 105, 2034; zur Herstellung von rac-3 nach einem anderen Verfahren: b) M. F. Semmelhack, J. Bisaha, M. Czarny, J. Am. Chem. Soc. 1979, 101, 768.
- 16 Nach der extraktiven Aufarbeitung enthält das Dienolether-Rohprodukt noch einen erheblichen Anteil an (nicht definierten) Chromkomplexen. Eine vollständige Dekomplexierung wird erreicht, indem man die gelbe Lösung für einige Zeit dem Sonnenlicht aussetzt. Danach weist die GC-MS- und 1H-NMR-Analyse des Produktgemisches 8 als dominierende Hauptkomponente aus (neben geringen Mengen an 2. dekomplexiertem 9 sowie einigen nichtidentifizierten Nebenprodukten).
- 17 Die trans-Konfiguration von 2 geht aus den 1H-NMR-Kopplungskonstanten hervor; die Signale wurden anhand eines COSY-Spektrums eindeutig zugeordnet.
- 18 Dieses Produkt entstand unter analogen Bedingungen in einer ähnlich hohen Ausbeute wie die von 2; rac-10: Schmp. 98°C (Hexan); FT-IR (KBr): ṽ = 1652, 1597, 1343, 1246, 841 (s) cm−1; 1H-NMR (400 MHz. CDCl3): δ = 0.12 (s, 9H), 1.05 (d, J = 7 Hz. 3 H), 1.89 (m, 1 H). 2.09 (m, 1 H), 2.26 (ddd. J = 20, 10, 2 Hz, 1H), 2.45 (pseudo-sept., J = 5 Hz, 1 H), 2.69–2.91 (m, 6H), 4.00 (d, J = 10 Hz, 1H), 7.06 (pseudo-dd, J = 5, 2 Hz, 1H); 13C-NMR (67.5 MHz, CDCl3): δ = −0.7 (q), 10.3 (q), 25.9 (t). 28.3 (t). 29.7 (t). 29.8 (t). 41.1 (d), 42.9 (d), 49.3 (d), 140.2 (s), 155.5 (d), 205.1 (s): HR-MS: m/z: = 300.10378 (ber. für C14H24OS2Si).
- 19a) J.-C. Boutonnet, F. Rose-Munch, E. Rose, Tetrahedron Lett. 1985, 26, 3989: b) J. P. Djukie, F. Rose-Munch, E. Rose, F. Simon, Y. Dromzee, Organametallics 1995, 14, 2027. zit. Lit.
- 20 Für nucleophile tele- und eine-Substitutionen (SNAr-Reaktion) an Cr(CO)3- komplexierten Arenen gibt es viele Beispiele [10]. aber nur relativ wenige, bei denen eine Methoxygruppe als Abgangsgruppe dient [4b. 8. 19b].
- 21 Es ist bekannt, daß die Umsetzung von anionischen η5-Komplexen vom Typ 12 mit Ph3SnCl zu (isolierbaren) stannylierten Produkten führt. deren Strukturen zu der von 15 analog sind: E. P. Kündig, A. F. Cunningham, Jr., P. Paglia, D. P. Simmons, G. Bernardinelli, Helv. Chim. Acta 1990, 73, 386.
- 22 In diesen Fällen trat eine charakteristische Rotfärbung der Reaktionsmischung auf, wie man sie auch bei der Zugabe von TFA zu Lösungen anionischer Intermediate vom Typ 12 beobachtet.
- 23 Dies wurde durch 1H-NMR-spektroskopische Untersuchung einer Probe sichergestellt. die vor der Hydrolyse der Reaktionsmischung unter Luftausschluß entnommen und nach Entfernung aller flüchtigen Bestandteile im Vakuum in C6D6 gelöst worden war.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.