Asymmetrische Epoxidierung von Enonen mit Sauerstoff in Gegenwart von Diethylzink und (R, R)-N-Methylpseudoephedrin†
Corresponding Author
Prof. Dr. Dieter Enders
Institut für Organische Chemie der Technischen Hochschule Professor-Pirlet-Straße 1, D–52074 Aachen Telefax: Int. + 241/8888–127
Institut für Organische Chemie der Technischen Hochschule Professor-Pirlet-Straße 1, D–52074 Aachen Telefax: Int. + 241/8888–127Search for more papers by this authorDr. Jiqun Zhu
Institut für Organische Chemie der Technischen Hochschule Professor-Pirlet-Straße 1, D–52074 Aachen Telefax: Int. + 241/8888–127
Search for more papers by this authorDr. Gerhard Raabe
Institut für Organische Chemie der Technischen Hochschule Professor-Pirlet-Straße 1, D–52074 Aachen Telefax: Int. + 241/8888–127
Search for more papers by this authorCorresponding Author
Prof. Dr. Dieter Enders
Institut für Organische Chemie der Technischen Hochschule Professor-Pirlet-Straße 1, D–52074 Aachen Telefax: Int. + 241/8888–127
Institut für Organische Chemie der Technischen Hochschule Professor-Pirlet-Straße 1, D–52074 Aachen Telefax: Int. + 241/8888–127Search for more papers by this authorDr. Jiqun Zhu
Institut für Organische Chemie der Technischen Hochschule Professor-Pirlet-Straße 1, D–52074 Aachen Telefax: Int. + 241/8888–127
Search for more papers by this authorDr. Gerhard Raabe
Institut für Organische Chemie der Technischen Hochschule Professor-Pirlet-Straße 1, D–52074 Aachen Telefax: Int. + 241/8888–127
Search for more papers by this authorDiese Arbeit wurde vom Fonds der Chemischen Industrie, von der Deutschen Forschungsgemeinschaft (Leibniz-Preis) und von der Europäischen Union (HCM-network: Metal Mediated and Catalysed Organic Synthesis) gefördert. Wir danken den Firmen Degussa AG, BASF AG, Bayer AG, Hoechst AG und Knoll AG für Chemikalienspenden.
Abstract
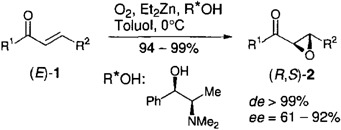
Eine effziente Methode zur asymmetrischen Epoxidierung von α,β-ungesättigten Ketonen 1 ist die Umsetzung mit Sauerstoff in Gegenwart von Diethylzink und (R,R)-N-Methylpseudoephedrin. Sie liefert die Epoxide 2 in ausgezeichneten Ausbeuten, mit vollständiger Diastereoselektivität und mit Enantiomerenüberschüssen bis zu 92 %. Der eingesetzte enantiomerenreine Aminoalkohol kann nahezu quantitativ und mit unveränderter optischer Reinheit zurückerhalten werden.
References
- 1 K. Katsuki, K. B. Sharpless, J. Am. Chem. Soc. 1980, 102, 5974–5976.
- 2a) R. M. Hanson, K. B. Sharpless, J. Org. Chem. 1986, 51, 1922–1925; Übersichtsartikel: b) R. A. Johnson, K. B. Sharpless in Catalytic Asymmetric Synthesis (Hrsg.: I. Ojima), VCH, New York, 1993, S. 103; c) A. C. Oehlschlager in Houben-Weyl, Methods of Organic Chemistry, Bd. E21e (Hrsg.: G. Helmchen, R. W. Hoffmann, J. Mulzer, E. Schaumann), Thieme, Stuttgart, 1995, S. 4675.
- 3a) W. Zhang, J. L. Loebach, S. R. Wilson, E. N. Jacobsen, J. Am. Chem. Soc. 1990, 112, 2801–2803; b) B. D. Brandes, E. N. Jacobsen, Tetrahedron Lett. 1995, 36, 5123–5126. c) Übersichtsartikel: E. N. Jacobsen in Catalytic Asymmetric Synthesis (Hrsg.: I. Ojima), VCH, New York, 1993, S. 159.
- 4a) R. Irie. K. Noda, Y. Ito, N. Matsumoto, T. Katsuki, Tetrahedron Lett. 1990, 31, 7345–7348; b) T. Fukuda, R. Irie, T. Katsuki, Synlett 1995, 197–198; c) Übersichtsartikel: T. Katsuki, Coord. Chem. Rev. 1995, 140, 189–214.
- 5 S. Juliá, J. Masana, J. C. Vega, Angew. Chem. 1980, 92, 968–969; Angew. Chem. Int. Ed. Engl. 1980, 19, 929–930.
- 6a) S. Juliá, J. Guixer, J. Masana, J. Rocas, S. Colonna, R. Annunziata, H. Molinari, J. Chem. Soc. Perkin Trans. 1 1982, 1317–1324; b) S. Banfi, S. Colonna, H. Molinari, S. Juliá, J. Guixer, Tetrahedron 1984, 40, 5207–5211; c) B. C. B. Bezuidenhoudt, A. Swanepoel, J. A. N. Augustyn, D. Ferreira, Tetrahedron Lett. 1987, 28, 4857–4860; d) S. Itsuno, M. Sakakura, K. Ito, J. Org. Chem. 1990, 55, 6047–6049; c) P. W. Baures, D. S. Eggleston, J. R. Flisak, K. Gombatz, I. Lantos, W. Mendelson, J. J. Remich, Tetrahedron Lett. 1990, 31, 6501–6504; f) C. Bolm, Angew. Chem. 1991, 103, 414–415; Angew. Chem. Int. Ed. Engl. 1991, 30, 403–404; g) J. R. Flisak, K. J. Gombatz, M. M. Holmes, A. A. Jarmas, I. Lantos, W. L. Mendelson, V. J. Novack, J. J. Remich, L. Snyder, J. Org. Chem. 1993, 58, 6247–6254; h) M. E. Lasterra Sanchez, S. M. Roberts, J. Chem. Soc. Perkin Trans. 1 1995, 1467–1468; i) M. E. Lasterra Sanchez, U. Felfer, P. Mayon, S. M. Roberts, S. R. Thornton, C. J. Todd, J. Chem. Soc. Perkin Trans. 1 1996, 343–348.
- 7
Benzylchininiumchlorid: a)
R. Helder,
J. C. Hummelen,
R. W. P. M. Laane,
J. S. Wiering,
H. Wynberg,
Tetrahedron Lett.
1976,
1831–1834;
b)
J. C. Hummelen,
H. Wynberg,
Tetrahedron Lett.
1978,
1089–1092;
c)
H. Wynberg,
B. Marsman,
J. Org. Chem.
1980,
45,
158–161;
d)
H. Pluim,
H. Wynberg,
J. Org. Chem.
1980,
45,
2498–2502;
e)
Y. Harigava,
H. Yamaguchi,
M. Onda,
Heterocycles
1981,
15,
183–185.
10.3987/S-1981-01-0183 Google Scholar
- 8 Rinderserum-Albumin: a) S. Colonna, A. Manfredi, Tetrahedron Lett. 1986, 27, 387–390; b) S. Colonna, A. Manfredi, A. M. Spadoni, Tetrahedron Lett. 1987, 28, 1577–1580; c) S. Colonna, N. Gaggero, A. Manfredi, A. M. Spadoni, L. Casella, G. Carrea, P. Pasta, Tetrahedron 1988, 44, 5169–5178.
- 9 Cyclodextrine; a) S. Banfi, S. Colonna, S. Julia, Synth. Commun. 1983, 13, 1049–1052; b) S. Colonna, S. Banfi, A. Pagagni, Gazz. Chim. Ital. 1985, 115, 81–83; c) Y. Hu, A. Harada, S. Takahashi, Synth. Commun. 1988, 18, 1607–1610; d) S. Colonna, A. Manfredi, R. Annunziata, N. Gaggero, J. Org. Chem. 1990, 55, 5862–5866.
- 10 Chirale Platinkomplexe: C. Baccin, A. Gusso, F. Pinna, G. Strukul, Organometallics 1995, 14, 1161–1167.
- 11 Über diastereoselektive Enon-Epoxidierungen mit O2 R2Zn ist bereits berichtet worden: K. Yamamoto, N. Yamamoto, Chem. Lett. 1989, 1149–1152. Die Autoren postulierten als oxidierende Spezies ROOZnR. Unsere asymmetrische Variante spricht dagegen für den in Schema 2 gezeigten Mechanismus über 4. Cyclohexenon wird unter unseren Bedingungen nicht epoxidiert.
- 12 Hergestellt nach a) S. Smith, J. Chem. Soc. 1927, 2056–2059 (65% Ausbeute. Schmp. 29°C, Sdp. 91–92°C (8 mbar), [α]D22 = −48.6 (c = 5.1 in MeOH)), in Übereinstimmung mit Literaturdaten; b) W. N. Nagai, S. Kanao, Justus Liebigs Ann. Chem. 1929, 470, 157–182; c) T. Kanzawa, Bull. Chem. Soc. Jpn. 1956, 29, 398–403; d) K. Yamamoto, K. Tsuruoka, J. Tsuji, Chem. Lett. 1977, 1115–1116; e) H.-J. Schneider, M. Lonsdorfer, Org. Magn. Reson. 1981, 16 (2), 133–137.
- 13 B. Marsman, H. Wynberg, J. Org. Chem. 1979, 44, 2312–2315.
- 14 Die Zinkkomplexe sind in den Reaktionsgleichungen vereinfachend als Monomere dargestellt, ohne zu berücksichtigen, daß sie auch als Dimere vorliegen könnten.
- 15 Alkylzinkalkoxide wurden sehr erfolgreich in der enantioselektiven Addition von Dialkylzink an Aldehyde eingesetzt. Übersichtsartikel; a) R. Noyori, M. Kitamura, Angew. Chem. 1991, 103, 34–55; Angew. Chem. Int. Ed. Engl. 1991, 30, 49–70; b) K. Soai, S. Niwa, Chem. Rev. 1992, 92, 833–856.
- 16 G. Sosnovsky, J. H. Brown, Chem. Rev. 1966, 66, 529–566.
- 17 G. Jander, E. Blasius, Lehrbuch der analytischen und präparativen anorganischen Chemie, 14. Aufl., Hirzel, Stuttgart, 1995, S. 422.
- 18 Ein analoger Mechanismus wurde bei der Epoxidierung von Enonen mit H2O2 im alkalischen Medium postuliert; H. O. House, R. S. Ro, J. Am. Chem. Soc. 1958, 80, 2428–2433.
- 19 Die Kopplungskonstanten der vicinalen, trans-ständigen Protonen am Oxiranring der Epoxyketone 2 betragen im 1H-NMR-Spektrum 1.68–2.02 Hz und entsprechen damit den Literaturdaten für trans-Epoxide; a) C. A. Reilly, J. D. Swalen, J. Chem. Phys. 1960, 32, 1378–1384; b) K. L. Williamson, C. A. Lanford, C. R. Nicholson, J. Am. Chem. Soc. 1964, 86, 762–765.
- 20 Kristallstrukturdaten von 7; monoklin, Raumgruppe P21(4), a = 13.988(2), b = 18.846(17), c = 14.141(9) Å, β = 106.09(2)°; 25 Reflexe, 12.23°<< 16.98°; Z = 2, V = 3581.8 Å3, Mr = 1202.29, ρber. = 1.115 gcm−3. Der Kristall wurde ohne Kapillare direkt im Stickstoffstrom vermessen (T = 190 K), F(000) = 1288, MoKα-Strahlung (Λ = 0.71069 Å), sin/Δmax = 0.651, ä = 7.32 cm−1 (keine Absorptionskorrektur), Rint = 0.102(30), 4963 beobachtete Reflexe (I>2(I)) im Bereich - 18<h<17, 0<k<24, 0<l<18. Lösung der Struktur mit der Schweratommethode (SHELXS86 [26]), Verfeinerung mit XTAL3.2 [27]. 4963 Reflexe in abschließender Kleinste-Quadrate-volle-Matrix-Verfeinerung von 410 Parametern. R = 0.103, Rw = 0.077 (w = 1/n2). S = 2.717, Restelektronendichte 1.6 e Å−3. Verbindung 7 kristallisiert mit zwei freien Molekülen des Liganden (fehlgeordnet) pro Formeleinheit. Die schlechte Qualität des Kristalls ließ eine anisotrope Verfeinerung nur der Zn-Atome und der Atome in deren unmittelbarer Umgebung (O1A-D, N1A-D, C1A-D, C2A-D) zu. Alle anderen atomaren Parameter wurden isotrop verfeinert, Wasserstoffpositionen berechnet. Alle Versuche, Kristalle besserer Qualität zu präparieren waren erfolglos. Die kristallographischen Daten (ohne Strukturfaktoren) der in dieser Veröffentlichung beschriebenen Struktur wurden als „supplementary publication no. CCDC-179–57”︁ beim Cambridge Crystallographic Data Centre hinterlegt. Kopien der Daten können kostenlos bei folgender Adresse angefordert werden; The Director, CCDC, 12 Union Road, GB-Cambridge CB2 1EZ (Telefax: Int. +1223/336–033; E-mail: [email protected]).
- 21 Ein verwandtes achirales Zink-bisalkoxid mit Ci-Symmetrie ist bekannt: P. L. Orioli, M. D. Vaira, L. Sacconi, Inorg. Chem. 1966, 5, 400–405.
- 22 Es ist uns bereits gelungen, mit der gleichen Methode ein Nitroalken diastereo-und enantioselektiv zu epoxidieren: J. Zhu, Dissertation, Technische Hochschule Aachen, 1996.
- 23 Mit der halben Menge an (1R,2R)-N-Methylpseudoephedrin gelangen die Epoxidierungen mit ähnlichen Ausbeuten bei längeren Reaktionszeiten und mit zumeist um einige Prozent niedrigeren Enantiomerenüberschüssen, z. B. 2b: 17 h. 94% Ausbeute, 87% ee.
- 24 Da eine lange Verweilzeit unter O2 einen negativen Einfluß auf die Reaktion ausüben kann, ist es zu empfehlen, nach 3.5 h den O2-gefüllten gegen einen mit Argon gefüllten Ballon auszutauschen.
- 25 2g wurde zusätzlich durch präparative HPLC gereinigt. Alle neuen Verbindungen wurden spektroskopisch (IR, NMR, MS) eindeutig charakterisiert und gaben korrekte Elementaranalysen oder passende hochaufgelöste Massenspektren.
- 26 G. M. Sheldrick in Crystallographic Computing 3 (Hrsg.: G. M. Sheldrick, C. Krüger, R. Goddard), University Press, 1985, S. 175.
- 27 S. R. Hall, H. D. Flack, J. M. Stewart, XTAL3.2 Reference Manual, Universitäten von West-Australien. Genf und Maryland Lamb, Perth 1992.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.