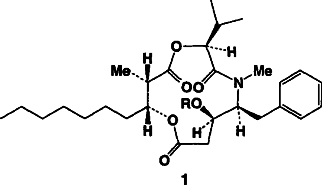
Eine konvergente, enantioselektive Totalsynthese von Hapalosin: ein Wirkstoff zur Vermeidung resistenter Tumorzellen in der Chemotherapie†
Corresponding Author
Prof. Arun K. Ghosh
Department of Chemistry, University of Illinois at Chicago 845 West Taylor Street, Chicago, IL 60607 (USA) Telefax: Int. + 312/996–0431
Department of Chemistry, University of Illinois at Chicago 845 West Taylor Street, Chicago, IL 60607 (USA) Telefax: Int. + 312/996–0431Search for more papers by this authorWenming Liu
Department of Chemistry, University of Illinois at Chicago 845 West Taylor Street, Chicago, IL 60607 (USA) Telefax: Int. + 312/996–0431
Search for more papers by this authorYibo Xu
Department of Chemistry, University of Illinois at Chicago 845 West Taylor Street, Chicago, IL 60607 (USA) Telefax: Int. + 312/996–0431
Search for more papers by this authorZhidong Chen
Department of Chemistry, University of Illinois at Chicago 845 West Taylor Street, Chicago, IL 60607 (USA) Telefax: Int. + 312/996–0431
Search for more papers by this authorCorresponding Author
Prof. Arun K. Ghosh
Department of Chemistry, University of Illinois at Chicago 845 West Taylor Street, Chicago, IL 60607 (USA) Telefax: Int. + 312/996–0431
Department of Chemistry, University of Illinois at Chicago 845 West Taylor Street, Chicago, IL 60607 (USA) Telefax: Int. + 312/996–0431Search for more papers by this authorWenming Liu
Department of Chemistry, University of Illinois at Chicago 845 West Taylor Street, Chicago, IL 60607 (USA) Telefax: Int. + 312/996–0431
Search for more papers by this authorYibo Xu
Department of Chemistry, University of Illinois at Chicago 845 West Taylor Street, Chicago, IL 60607 (USA) Telefax: Int. + 312/996–0431
Search for more papers by this authorZhidong Chen
Department of Chemistry, University of Illinois at Chicago 845 West Taylor Street, Chicago, IL 60607 (USA) Telefax: Int. + 312/996–0431
Search for more papers by this authorWir danken Professor Robert Moriarty für hilfreiche Diskussionen. Diese Arbeit wurde von der University of Illinois at Chicago und den Merck-Research-Laboratorien unterstützt.
Abstract
Tumorzellen können wahrend einer Chemotherapie gegen die verabreichten Wirkstoffe resistent werden, was sich vielleicht durch Hapalosin (R H), ein Cyclodepsipeptid, verhindern läßt. Die Totalsynthese dieses Naturstoffes bestätigte seine Konstitution und Konfiguration. Detaillierten Struktur-Wirkungs- Studien sollte jetzt nichts mehr Wege stehen.
References
- 1 K. Stratmann, D. L. Burgoyne, R. E. Moore, G. M. L. Patterson, C. D. Smith, J. Org. Chem. 1994, 59, 7219.
- 2 J. A. Endicott, V. Ling, Annu. Rev. Biochem. 1989, 58, 137.
- 3a) J. Pastan, M. M. Gottesman, Annu. Rev. Med. 1991, 42, 277; b) N. Kartner, J. R. Riordan, V. Ling, Science 1983, 221, 1285.
- 4 R. F. Ozols, R. E. Cunnion, R. W. Klecker, T. C. Hamilton, Y. Ostchega, J. E. Parrillo, R. C. Young, J. Clin. Oncl. 1987, 5, 641.
- 5 S. Nahm, S. M. Weinreb, Tetrahedron Lett. 1981, 32, 3815.
- 6 Die Bestimmung der Konfiguration des Hauptisomers basierte auf dem Vergleich des entsprechenden BOC-Derivates von 3 mit der Verbindung, die durch Öffnung des bekannten Epoxids [7] (3S)-Azido-(1R,2R)-epoxy-4-phenylbutan mit Vinylmagnesiumbromid (2 Äquiv.) und Kupfercyanid (katalytische Mengen) bei Temperaturen zwischen −20 und 0°C und nachfolgender Hydrierung des Azids mit 10% Pd/C in Ethylacetat und in Gegenwart von (BOC)2O erhalten worden war (Gesamtausbeute 20–22%). Die Konfiguration des erhaltenen 4(R)-Hydroxy-5(S)-tert-butyloxycarbonyl-amino-phenylhexan ist mit der des hydrierten BOC-Derivates von 3 identisch.
- 7 A. K. Ghosh, W. J. Thompson, M. K. Holloway, S. P. McKee, T. T. Duong, H. Y. Lee, P. M. Munson, A. M. Smith, J. M. Wai, P. L. Darke, J. A. Zugay, E. A. Emini, W. A. Schleif, J. R. Huff, P. S. Anderson, J. Med. Chem. 1993, 36, 2300.
- 8 P. J. Carlsen, T. Katsuki, V. Martin, K. B. Sharpless, J. Org. Chem. 1981, 46, 3936.
- 9 Erhältlich bei Sepracor Inc., Marlborough, MA 01752 (USA). Informationen zur Synthese und zur Reinigung vgl. a) A. K. Ghosh, S. P. McKee, W. M. Sanders, Tetrahedron Lett. 1991, 32, 711; b) W. J. Thompson, P. M. D. Fitzgerald, M. K. Holloway, E. A. Emini, P. L. Darke, B. M. McKeever, W. A. Schleif, J. C. Quintero, J. A. Zugay, T. J. Tucker. J. E. Schwering, C. F. Homnick, J. Nunberg, J. P. Springer, J. R. Huff, J. Med. Chem. 1992, 35, 1685.
- 10 A. K. Ghosh, T. T. Duong, S. P. McKee, J. Chem. Soc. Chem. Commun. 1992, 1673. Andere asymmetrische Aldolreaktionen mit geeigneten chiralen Auxiliaren sind in Lit. [11] genannt.
- 11a) D. A. Evans, Asymmetric Synth. 1984, 3, 1; b) C. H. Heathcock, Asymmetric Synth. 1984, 3, 111; c) W. Oppolzer, J. Blagg, I. Rodriguez, E. Walther, J. Am. Chem. Soc. 1990, 112, 2767; c) H. Roder, G. Helmchen, E.-M. Peters, K. Peters, H. G. von Schnering, Angew. Chem. 1984, 96, 895; Angew. Chem. Int. Ed. Engl. 1984, 23, 898; d) G. Gardillo, M. Orena, M. Romero, S. Sandri, Tetrahedron 1989, 45, 1501; e) W. Sankhavasi, M. Yamamoto, S. Kohmoto, K. Yamada, Bull. Chem. Soc. Jpn. 1991, 64, 1425; f) S. E. Drewes, D. S. Malissar, G. P. Roos, Chem. Ber. 1991, 124, 2913, zit. Lit.
- 12 D. A. Evans, T. C. Britton, J. A. Ellman, Tetrahedron Lett. 1987, 28, 6141.
- 13 K. Mori, Tetrahedron 1976, 32, 1101.
- 14 B. Neises, W. Steglich, Angew. Chem. 1978, 90, 556; Angew. Chem. Int. Ed. Engl. 1978, 17, 522.
- 15 J. Inanaga, K. Hirata, H. Saeki, T. Katsuki, M. Yamaguchi, Bull. Chem. Soc. Jpn. 1979, 52, 1989.
- 16 Allen neuen Verbindungen sind vollständig spektroskopisch und analytisch charakterisiert worden.
- 17 Eine reine Probe von Verbindung 11 wurde nach Chromatographie an Silicagel (10% MeOH/CHCl3) erhalten: [α]D23 −5.1 (c = 0.93. CHCl3); 1H-NMR (400 MHz): δ = 0.88 (t. 3 H, J = 6.9 Hz, CH3), 0.98 (d, 3 H, J = 7.0 Hz, CH3), 1.02 (d, 3 H. J =7.1 Hz, CH3), 1.18 (d, 3 H. J = 7.0 Hz. CH3), 1.17–1.31 (m, 10 H, (CH2)5), 1.51 (m, 1 H, CH2), 1.72 (m. 1 H, CH2), 2.29 (m, 1 H, CH(CH3)2), 2.47 (dd, 1 H, J = 4.0, 16.2 Hz, CH2-C=O), 2.66 (s, 3 H, N-CH3), 2.71 –2.82 (m, 2 H, CH2-C=O, MeCHC=O), 3.00 (dd, 1 H, J = 5.2, 14.2 Hz, CH2Ph), 3.18 (dd, 1 H. J = 8.8, 14.2 Hz, CH2Ph), 3.35 (s, 3 H, CH3O), 3.55 (brs, 1 H, CH-NHMe), 3.66 (br, 1 H, NHMe), 4.43 (m, 1 H, CH-OMOM), 4.73 (ABq, 2 H, J = 6.4, 9.5 Hz, O-CH2-OMe), 4.79 (d, 1 H, J = 4.1 Hz, O-CH-CHMe2), 5.34 (dt, 1 H, J = 3.1, 7.6 Hz, CH-O-CO-CH2), 7.20–7.38 (m, 5 H, Ph); 13C-NMR (100 MHz): δ = 9.81 (CH3), 14.04 (CH3), 17.29 (CH3), 19.28 (CH3), 22.58 (CH2). 25.65 (CH2), 29.11 (CH2), 29.31 (CH2), 29.74 (CHMe2), 30.42 (CH2), 30.98 (CH2), 31.73 (CH2Ph), 39.22 (CH2), 40.43 (CHMeCO), 41.04 (NCH3), 56.20 (OCH3), 68.46 (CHNMe), 75.27 (CHOMOM), 77.17 (OCHCHMe2), 78.66 (CH2CHOC=O), 96.50 (OCH2OMe), 126.82 (CH), 128.77 (CH), 128.72 (CH), 129.18 (CH), 129.37 (CH). 137.2 (C=CH), 169.7 (C=O), 170.0 (C=O), 173.5 (C=O); IR (in Substanz): ṽ = 3660, 3621, 3020, 2975, 1730, 1716. 1527 cm−1; MS (70eV): m/z: 551 (M+).
- 18 S. Hanessian, D. Delorme, Y. Dufresne, Tetrahedron Lett. 1984, 25, 2515.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.