Chirale Lithium-1-oxyalkanide durch asymmetrische Deprotonierung; enantioselektive Synthese von 2-Hydroxyalkansäuren und sekundären Alkanolen†
Corresponding Author
Prof. Dr. Dieter Hoppe
Institut für Organische Chemie der Universität, Olshausenstraße 40, W-2300 Kiel 1
Institut für Organische Chemie der Universität, Olshausenstraße 40, W-2300 Kiel 1Search for more papers by this authorDipl.-Chem. Folker Hintze
Institut für Organische Chemie der Universität, Olshausenstraße 40, W-2300 Kiel 1
Search for more papers by this authorDipl.-Chem. Petra Tebben
Institut für Organische Chemie der Universität, Olshausenstraße 40, W-2300 Kiel 1
Search for more papers by this authorCorresponding Author
Prof. Dr. Dieter Hoppe
Institut für Organische Chemie der Universität, Olshausenstraße 40, W-2300 Kiel 1
Institut für Organische Chemie der Universität, Olshausenstraße 40, W-2300 Kiel 1Search for more papers by this authorDipl.-Chem. Folker Hintze
Institut für Organische Chemie der Universität, Olshausenstraße 40, W-2300 Kiel 1
Search for more papers by this authorDipl.-Chem. Petra Tebben
Institut für Organische Chemie der Universität, Olshausenstraße 40, W-2300 Kiel 1
Search for more papers by this authorDiese Arbeit wurde von der Deutschen Forschungsgemeinschaft und dem Fonds der Chemischen Industrie gefördert.
Abstract
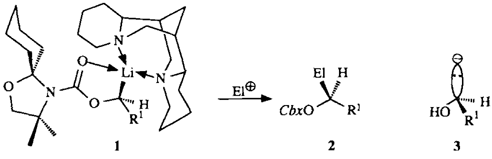
Eine allgemeine, sehr einfache präparative Lösung für chirale Synthone des Typs 3 bieten die Lithiumkomplexe 1. Sie werden durch asymmetrische Deprotonierung der entsprechenden prochiralen „nichtaktivierten”︁ Alkylcarbamate mit sec-Butyllithium/(-)-Spartein erzeugt. 1 läßt sich durch Elektrophile stereospezifisch zu den geschützten Hydroxy-Derivaten 2 (> 95 ee) substituieren, und die Cbx-Gruppe ist leicht abspaltbar. R1 = Alkyl, Cbx = Carbamoylrest von 1.
References
- 1[a] Übersichten: D. Seebach, Angew. Chem. 91 (1979) 259–278; Angew. Chem. Int. Ed. Engl. 18 (1979) 239–258; (b) J. E. Saavedra in T. A. Hase (Hrsg.): Umpoled Synthons, Wiley, New York 1987, S. 101.
- 2 Bei erhöhter Temperatur treten Wittig-Umlagerungen ein; Übersicht: T. Nakai, K. Mikami, Chem. Rev. 86 (1986) 885–902.
- 3[a] W. C. Still, A. Mitra, J. Am. Chem. Soc. 100 (1978) 1927–1928; (b) J. S. Sawyer, A. Kucerovy, T. L. Macdonald, G. J. McGarvey, J. Am. Chem. Soc. 110 (1988) 842–853.
- 4[a] Übersicht: T. Cohen, M. Bhupathy, Acc. Chem. Res. 22 (1989) 152–161; (b) T. Cohen, M. T. Lin, J. Am. Chem. Soc. 106 (1984) 1131–1131; (c) A. Fernandez-Mayoralas, A. Marra, M. Trumtel, A. Veyrières, P. Sinay, Tetrahedron Lett. 30 (1989) 2537–2540; (d) S. D. Rychnovsky, D. E. Mickus, Tetrahedron Lett. 30 (1989) 3011–3014.
- 5[a] P. Beak, B. G. McKinnie, J. Am. Chem. Soc. 99 (1977) 5213; (b) P. Beak, L. G. Carter, J. Org. Chem. 46 (1981) 2363–2373; (c) R. Schlecker, D. Seebach, W. Lubosch, Helv. Chim. Acta 61 (1978) 512–526.
- 6[a] W. C. Still, C. Sreekumar, J. Am. Chem. Soc. 102 (1980) 1201–1202; (b) V. J. Jephcote, A. J. Pratt, E. J. Thomas, J. Chem. Soc. Chem. Commun. 1984, 800–802; J. Chem. Soc. Perkin Trans. 1 1989, 1529–1535; (c) P. Lesimple, J.-M. Beau, P. Sinay, J. Chem. Soc. Chem. Commun. 1985, 894–895; (d) J. A. Marshall, W. Y. Gung, Tetrahedron 45 (1989) 1043–1052; (e) J. M. Chong, E. K. Mar, Tetrahedron 45 (1989) 7709–7716; (f) D. S. Matteson, P. B. Tripathy, A. Sarkur, K. N. Sadhu, J. Am. Chem. Soc. 111 (1989) 4399–4402; (g) R. J. Linderman, A. Ghannam, J. Am. Chem. Soc. 112 (1990) 2392–2398.
- 7[a]
Frühere Versuche zur chiralen Modifizierung von Organolithium-Verbindungen durch (—)-Spartein:
H. Nozaki,
T. Aratani,
T. Toraya,
R. Noyori,
Tetrahedron
27
(1971)
905–913;
(b)
L. M. Engelhardt,
W.-P. Leung,
C. L. Raston,
G. Salem,
P. Twiss,
A. H. White,
J. Chem. Soc. Dalton Trans.
1988, 2403–2409.
(c)
Asymmetrische Deprotonierungen von 2-Alkenylcarbamaten:
D. Hoppe,
O. Zschage,
Angew. Chem.
101
(1989)
67–69;
Angew. Chem. Int. Ed. Engl.
28
(1989)
65–67;
10.1002/ange.19891010115 Google Scholar(d) O. Zschage, J.-R. Schwark, D. Hoppe, Angew. Chem. Int. Ed. Engl. 102 (1990) 336–337 bzw. Angew. Chem. Int. Ed. Engl. 29 (1990) 296–297.
- 8 N. G. Rondan, K. N. Houk, P. Beak, W. J. Zajdel, J. Chandrasekhar, P. von R. Schleyer, J. Org. Chem. 46 (1981) 4108–4110; vgl. dazu auch D. Seebach, J. Hansen, P. Seiler, J. M. Gromek, J. Organomet. Chem. 285 (1985) 1–13.
- 9 Übersicht: D. Hoppe, Angew. Chem. 96 (1984) 930–946; Angew. Chem. Int. Ed. Engl. 23 (1984) 932–948.
- 10 Von allen neuen Verbindungen liegen passende Elementaranalysen (C,H ± 0.3%) vor.
- 11 P. Mickon, A. Rassat, Bull. Soc. Chim. Fr. 1971, 3561–3567.
- 12 Während der Abfassung des Manuskripts erschien eine Arbeit zur Carboxylierung von enantiomerenangereicherten α-(Benzyloxymethyl)alkaniden des Typs 4b: P. C.-M. Chan, J. M. Chong, Tetrahedron Lett. 31 (1990) 1985–1988.
- 13 Korreliert als 14b-Methylester mit einem aus ( R)-Milchsäure gewonnenen Präparat.
- 14 Zur Bestimmung des ee-Wertes wurden die Säuren 14 zunächst mit Diazomethan in ihre Methylester überführt und diese anschließend mit 5–8 Mol-% Tris-[(hepta-fluorpropylhydroxymethylen)-(D)-campherato]europium(III) (Eu(hfpc)3) an einem 300 MHz-NMR-Spektrometer anhand des α-H-Signals vermessen. Die Absorptionsbanden sind aufgrund von Amid-E-Z-Isometrie jeweils verdoppelt. Die enantiomeren (S)-14-Methylester waren in keiner Probe nachweisbar.
- 15 Theoretische Studie zur Carboxylierung: E. Kaufmann, S. Sieber, P. von R. Schleyer, J. Am. Chem. Soc. 111 (1989) 4005–4008.
- 16 D. Hoppe, A. Carstens, T. Krämer, Angew. Chem. 102 (1990) 1455; Angew. Chem. Int. Ed. Engl. 29 (1990) Nr. 12.
- 17 Gaschromatographisch bestimmt am Alkohol 18 als (—)-( S)-Phenylethylurethan, Verhältnis 98:2; W. H. Pirkle, M. S. Hoekstra, J. Org. Chem. 39 (1974) 3904–3906.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.