Isocorrole: Neuartige tetrapyrrolische Makrocyclen†‡
Stefan Will
Institut Für Organische Chemie der Universität, Greinstraße 4, W-5000 Köln 41
Search for more papers by this authorAfssaneh Rahbar
Institut Für Organische Chemie der Universität, Greinstraße 4, W-5000 Köln 41
Search for more papers by this authorDr. Hans Schmickler
Institut Für Organische Chemie der Universität, Greinstraße 4, W-5000 Köln 41
Search for more papers by this authorJohann Lex
Institut Für Organische Chemie der Universität, Greinstraße 4, W-5000 Köln 41
Search for more papers by this authorCorresponding Author
Prof. Dr. Emanuel Vogel
Institut Für Organische Chemie der Universität, Greinstraße 4, W-5000 Köln 41
Institut Für Organische Chemie der Universität, Greinstraße 4, W-5000 Köln 41Search for more papers by this authorStefan Will
Institut Für Organische Chemie der Universität, Greinstraße 4, W-5000 Köln 41
Search for more papers by this authorAfssaneh Rahbar
Institut Für Organische Chemie der Universität, Greinstraße 4, W-5000 Köln 41
Search for more papers by this authorDr. Hans Schmickler
Institut Für Organische Chemie der Universität, Greinstraße 4, W-5000 Köln 41
Search for more papers by this authorJohann Lex
Institut Für Organische Chemie der Universität, Greinstraße 4, W-5000 Köln 41
Search for more papers by this authorCorresponding Author
Prof. Dr. Emanuel Vogel
Institut Für Organische Chemie der Universität, Greinstraße 4, W-5000 Köln 41
Institut Für Organische Chemie der Universität, Greinstraße 4, W-5000 Köln 41Search for more papers by this authorDiese Arbeit wurde von der Deutschen Forschungsgemeinschaft gefördert.
Professor Albert Eschenmoser zum 65. Geburtstag gewidmet
Abstract
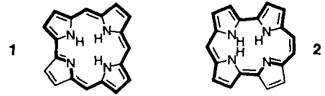
Die Ringkontraktion eines Porphycenderivats ergibt ein Isocorrolderivat, dessen Ringgerüst deutlich stärker als das von Corrol von der Planarität abweicht. Nach spektroskopischen Befunden hat man es dennoch mit einer aromatischen Verbindung zu tun. 1 und 3 sind die Stammverbindungen Corrol bzw. Isocorrol.
References
- 1 A. Eschenmoser, Angew. Chem. 100 (1988) 5; Angew. Chem. Int. Ed. Engl. 27 (1988) 5.
- 2
A. W. Johnson,
I. T. Kay,
J. Chem. Soc.
1965, 1620;
A. W. Johnson,
Pure Appl. Chem.
23
(1970)
375;
A. W. Johnson
in K. M. Smith (Hrsg.):
Porphyrins and Metalloporphyrins,
Elsevier, Amsterdam
1975,
S. 729;
R. Grigg
in D. Dolphin (Hrsg.):
The Porphyrins,
Vol. II,
Academic Press, New York
1978,
S. 327;
10.1016/B978-0-12-220102-8.50017-8 Google ScholarN. S. Genokhova, T. A. Melent'eva, V. M. Berezovskii, Usp. Khim. 49 (1980) 2132 [ Russ. Chem. Rev. 49 (1980) 1056];10.1070/RC1980v049n11ABEH002527 Google ScholarT. A. Melent'eva, Russ. Chem. Rev. 52 (1983) 1136 [ Russ. Chem. Rev. 52 (1983) 641].10.1070/RC1983v052n07ABEH002871 Google Scholar
- 3 Zur Röntgenstrukturanalyse eines Corrols siehe: H. R. Harrison, O. J. R. Hodder, D. C. Hodgkin, J. Chem. Soc. B 1971, 640.
- 4 P. B. Hitchcock, G. M. McLaughlin, J. Chem. Soc. Dalton Trans. 1976, 1927; Y. Murakami, S. Yamada, Y. Matsuda, K. Sakata, Bull. Chem. Soc. Jpn. 51 (1978) 123; Y. Murakami, Y. Matsuda, K. Sakata, S. Yamada, Y. Tanaka, Y. Aoyama, Bull. Chem. Soc. Jpn. 54 (1981) 163.
- 5 E. Vogel, M. Köcher, H. Schmickler, J. Lex, Angew. Chem. 98 (1986) 262; Angew. Chem. Int. Ed. Engl. 25 (1986) 257; P. F. Aramendia, R. W. Redmond, S. Nonell, W. Schuster, S. E. Braslavsky, K. Schaffner, E. Vogel, Photochem. Photobiol. 44 (1986) 555; E. Vogel, M. Köcher, M. Balei, I. Teichler, J. Lex, H. Schmickler, O. Ermer, Angew. Chem. 99 (1987) 912; Angew. Chem. Int. Ed. Engl. 26 (1987) 931; B. Wehrle, H.-H. Limbach, M. Köcher, O. Ermer, E. Vogel, Angew. Chem. Int. Ed. Engl. 99 (1987) 914 bzw. Angew. Chem. Int. Ed. Engl. 26 (1987) 934; H. Levanon, M. Toporowicz, H. Ofir, R. W. Fessenden, P. K. Das, E. Vogel, M. Köcher, K. Pramod, J. Phys. Chem. 92 (1988) 2429; J. Schlüpmann, M. Huber, M. Toporowicz, M. Köcher, E. Vogel, H. Levanon, K. Möbius, J. Am. Chem. Soc. 110 (1988) 8566; E. Vogel, M. Köcher, J. Lex, O. Ermer, Isr. J. Chem. 29 (1989) 257; E. Vogel, Pure Appl. Chem. 62 (1990) 557.
- 6 E. Vogel, M. Balci, K. Pramod, P. Koch, J. Lex, O. Ermer, Angew. Chem. 99 (1987) 909; Angew. Chem. Int. Ed. Engl. 26 (1987) 928; M. W. Renner, A. Forman, W. Wu, C. K. Chang, J. Fajer, J. Am. Chem. Soc. 111 (1989) 8618; L. R. Furenlid, M. W. Renner, K. M. Smith, J. Fajer, J. Am. Chem. Soc. 112 (1990) 1634.
- 7 Für die Durchführung dieser Rechnungen danken wir Prof. G. Hohlneicher (Universität Köln) und Prof. R. Gleiter (Universität Heidelberg).
- 8 Bei der Porphycen-Stammverbindung führt die Reaktion mit Brom zwar ebenfalls ausschließlich zu β-pyrrolischer Bromierung, doch tritt hier der Bromsubstituent in die bei 5 durch die Propylgruppe besetzte 2-Stellung; 2-Bromporphycen ist einziges isollertes Monobrom-Substitutionsprodukt (unveröffentlichte Versuche mit K. Pramod und H.-J. Dünnwald). Dieses Substitutionsmuster der Bromierung ist entgegengesetzt dem des Porphyrins, denn dort erfolgt regioselektive Substitution an der Methinbrücke unter Bildung von 5-Bromporphyrin [ H. J. Callot, E. Schaeffer, J. Chem. Res. (S) 1978, 51; L. R. Nudy, H. G. Hutchinson, C. Schieber, F. R. Longo, Tetrahedron 40 (1984) 2359], obwohl man nach PPP-Rechnungen elektrophilen Angriff eher am β-pyrrolischen Kohlenstoffatom erwartet hätte [ J. V. Knop, J.-H. Fuhrhop, Z. Naturforsch. B 25 (1970) 729]. Die früher von E. Samuels, R. Shuttleworth und T. S. Stevens [J. Chem. Soc. C 1968, 145] beobachtete β-pyrrolische Bromierung von Porphyrin ließ sich von F. R. Longo et al. (obiges Zitat) nicht reproduzieren.
- 9
A. Bongini,
G. Cainelli,
M. Contento,
F. Manescalchi,
Synthesis
1980, 143.
10.1055/s-1980-28952 Google Scholar
- 10 Die Tribromverbindung (Fp = 269–270°C), die gegenwärtig noch näher untersucht wird, kann wie 6 zum Hauptprodukt gemacht werden.
- 11 C32H34Br4N4, Zers. > 300°C, Kristalle aus Hexan-Dichlormethan; triklin, Raumgruppe P&1macr;, Z = 1; a = 5.686(1), b = 10.208(2), c = 13.839(3) Å, α = 96.13(2), β = 93.27(2), γ = 96.16(2)°; Qber = 1.67 g cm−3; Intensitätsmessungen auf Vierkreisdiffraktometer [Raumtemperatur, λMo = 0.71069 Å, θMo(max) = 25°]; empirische Absorptionskorrektur; Verfeinerung ( C, N, Br anisotrop, H. isotrop ) unter Berücksiehtigung von 1677 Reflexen mit Fo > 4 s̀(Fo); R = 0.063, Rw = 0.073[18].
- 12 2,3,6,7,12,13,16,17-Octaethylporphycen ist von Interesse, da es mit Zink und einigen anderen Metallen planare Komplexe liefert, die stabiler sind als die entsprechenden Metallkomplexe von 3 und 5; E. Vogel, P. Koch, unveröffentlicht.
- 13
A. Gossauer:
Die Chemie der Pyrrole,
Springer, Berlin
1974,
S. 326.
10.1007/978-3-642-51118-9 Google Scholar
- 14 Die Porphycen-Isocorrol-Umlagerung weckt Assoziationen mit der Ringkontraktionsstufe der Biosynthese des Corrinrings von Vitamin B12 [1]. Eine Kontraktion von Porphyrinen zu Corrolen wurde unseres Wissens bisher nicht beobachtet.
- 15 C32H34Br4N4O°CH2Cl2, Zers. > 180°C, Kristalle aus Dichlormethan; triklin, Raumgruppe P&1macr;, Z = 2; a = 8.443(2), b = 13.898(3), c = 16.034(4) Å, α = 66.15(2), β = 88.01(2), γ = 87.02(2)°; Qber. = 1.75 g cm−3; Intensitätsmessungen auf Vierkreisdiffraktometer [Raumtemperatur, λMo = 0.71069 Å, θMo(max) = 25°]; empirische Absorptionskorrektur; Verfeinerung (C, N, O, Cl, Br anisotrop, H isotrop) unter Berücksichtigung von 2301 Reflexen mit Fo > 4 s̀(Fo); R = 0.074, Rw = 0.063[18].
- 16 K. M. Smith in A. R. Katritzky, C. W. Rees (Hrsg.): Comprehensive Heterocyclic Chemistry, Vol. 4, Pergamon Press, Oxford 1984, S. 386.
- 17 Porphyrine: T. P. Wijesekera, J. B. Paine III, D. Dolphin, F. W. B. Einstein, T. Jones, J. Am. Chem. Soc. 105 (1983) 6747; N-protonierte Porphyrine: N. Hirayama, A. Takenaka, Y. Sasada, E.-I. Watanabe, H. Ogoshi, Z.-I. Yoshida, J. Chem. Soc. Chem. Commun. 1974, 330; N-substituierte Porphyrine: D. K. Lavallee: The Chemistry and Biochemistry of N-Substituted Porphyrins, VCH Publishers, New York-Weinheim 1987; N,N′,N″,N‴-Tetramethyloctaethylporphyrin-Dikaton: B. Franck, Angew. Chem. 94 (1982) 327, Angew. Chem. Int. Ed. Engl. 21 (1982) 343; M. Gosmann, Dissertation, Universität Münster 1986 (siehe auch nachstehendes Zitat); Tetrathiaporphyrin-Dikation: E. Vogel, P. Röhrig, M. Sicken, B. Knipp, A. Herrmann, M. Pohl, H. Schmickler, J. Lex, Angew. Chem. 101 (1989) 1683; Angew. Chem. Int. Ed. Engl. 28 (1989) 1651.
- 18 Weitere Einzelheiten zu den Kristallstrukturuntersuchungen können beim Fachinformationszentrum Karlsruhe, Gesellschaft für wissenschaftlich-technische Information mbH, W-7514 Eggenstein-Leopoldshafen 2, unter Angabe der Hinterlegungsnummer CSD-54911, der Autoren und des Zeitschriftenzitats angefordert werden.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.