Phenylenverknüpfte, chinonsubstituierte Porphyrintrimere†
Corresponding Author
Prof. Jonathan L. Sessler
Department of Chemistry, University of Texas at Austin Austin, TX 78712 (USA)
Department of Chemistry, University of Texas at Austin Austin, TX 78712 (USA)Search for more papers by this authorVincent L. Capuano
Department of Chemistry, University of Texas at Austin Austin, TX 78712 (USA)
Search for more papers by this authorCorresponding Author
Prof. Jonathan L. Sessler
Department of Chemistry, University of Texas at Austin Austin, TX 78712 (USA)
Department of Chemistry, University of Texas at Austin Austin, TX 78712 (USA)Search for more papers by this authorVincent L. Capuano
Department of Chemistry, University of Texas at Austin Austin, TX 78712 (USA)
Search for more papers by this authorDiese Arbeit wurde von der Robert A. Welch Foundation, der Camille and Henry Dreyfus Foundation (Teacher-Scholar Award für J. L. S.) und den National Institutes of Health (GM41657 für J. L. S.) gefördert.
Abstract
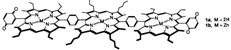
Die drei photoaktiven Porphyrinreste und die beiden Acceptoreinheiten sollten 1 zu einem geeigneten Modell machen, um der Frage nach dem Wie des ersten Schritts der Ladungstrennung in photosynthetischen Reaktionszentren nachzugehen. Die statischen und dynamischen Elektronenspektren von 1 sprechen für einen „Superaustausch”︁, d.h. einen effizienten Elektronentransfer von allen drei Porphyrineinheiten zu den Chinoneinheiten.
References
- 1 M. A. Fox, M. Chanon (Hrsg.): Photoinduced Electron Transfer, Elsevier, Amsterdam 1988.
- 2(a) R. A. Marcus, N. Sutin, Biochim. Biophys. Acta 810 (1985) 265. (b) M. W. Windsor, J. Chem. Soc. Faraday Trans.2 1986, 2237; (c) C. Kirmaier, D. Holten, Photosynth. Res. 13 (1987) 225. (d) G. Feher, J. P. Allen, M. Y. Okamura, D. C. Rees, Nature (London) 39 (1989) 111. (e) R. Huber, Angew. Chem. 101 (1989) 849. Angew. Chem. Int. Ed. Engl. 28 (1989) 848.
- 3(a) J. Deisenhofer, O. Epp, K. Miki, R. Huber, H. Michel, J. Mol. Biol. 180 (1984) 385. (b) Nature (London) 318 (1985) 618. (c) C.-H. Chang, M. Schiffer, D. Tiede, U. Smith, J. Norris, J. Mol. Biol. 186 (1985) 201. (d) J. P. Allen, G. Feher, T. O. Yeates, H. Komiya, D. C. Rees, Proc. Natl. Acad. Sci. USA 84 (1987) 5730. 6162.
- 4(a) N. W. Woodbury, M. Becker, D. Middendorf, W. W. Parsons, Biochemistry 24 (1985) 7516. (b) J. Breton, J.-L. Martin, G. R. Fleming, J.-C. Lambry, Biochemistry 27 (1988) 8576. (c) R. A. Goldstein, L. Takiff, S. G. Boxer, Biochim. Biophys. Acta 934 (1988) 253. (d) M. R. Gunner, P. L. Dutton, J. Am. Chem. Soc. 111 (1989) 3400.
- 5(a) J. R. Miller, T. L. Calcaterra, G. L. Closs, J. Am. Chem. Soc. 106 (1984) 3047. (b) Y. Sakata, S. Nishitani, N. Nishimizu, S. Misumi, A. R. McIntosh, J. R. Bolton, Y. Kanda, A. Karen, T. Okada, N. Mataga, Tetrahedron Lett. 26 (1985) 5207. (c) A. D. Joran, B. A. Leland, P. M. Felker, A. H. Zewail, J. J. Hopfield, P. B. Dervan, Nature (London) 327 (1987) 508. (d) M. R. Wasielewski, Photochem. Photobiol. 47 (1988) 923. (e) H. Oevering, J. W. Verhoeven, M. N. Paddon-Row, E. Costaris, N. S. Hush, Chem. Phys. Lett. 143 (1988) 488. (f) D. Gust, T. A. Moore, A. L. Moore, D. Barrett, L. O. Bensasson, M. Rougee, J. Am. Chem. Soc. 110 (1988) 321. (g) D. Mauzerall, J. Weiser, H. A. Staab, Tetrahedron 45 (1989) 4807. (h) M. D. Johnson, J. R. Miller, N. S. Green, G. L. Closs, J. Phys. Chem. 93 (1989) 1173. (i) A. Osuka, K. Maruyama, I. Yamazaki, N. Tamai, Chem. Phys. Lett. 165 (1990) 392. (j) H. Meier, Y. Kobuke, S.-i. Kugimiya, J. Chem. Soc. Chem. Commun. 1989, 923; (k) J. von Gersdorff, M. Huber, H. Schubert, D. Niethammer, B. Kirste, M. Plato, K. Möbius, H. Kurreck, R. Eichberger, R. Kietzmann, F. Willig, Angew. Chem. 102 (1990) 690. Angew. Chem. Int. Ed. Engl. 29 (1990) 670.
- 6(a) J. L. Sessler, M. R. Johnson, Angew. Chem. 99 (1987) 679. Angew. Chem. Int. Ed. Engl. 26 (1987) 678. (b) J. L. Sessler, M. R. Johnson, T.-Y. Lin, S. E. Creager, J. Am. Chem. Soc. 110 (1988) 3659. (c) J. L. Sessler, M. R. Johnson, T.-Y. Lin, Tetrahedron 45 (1989) 4767. (d) J. L. Sessler, M. R. Johnson, S. E. Creager, J. Fettinger, J. A. Ibers, J. Rodriguez, C. Kirmaier, D. Holten in E. Riklis (Hrsg.): Photobiology: The Science and its Applications, Plenum, New York, im Druck.
- 7(a) Y. Won, R. A. Friesner, Biochim. Biophys. Acta 975 (1988) 9. (b) Biochim. Biophys. Acta 977 (1989) 99.
- 8(a) R. A. Marcus, Chem. Phys. Lett. 133 (1987) 471. (b) S. F. Fischer, P. O. Scherer, J. Chem. Phys. 115 (1987) 151. (c) S. Creughton, J. K. Hwang, A. Warshel, W. W. Parson, J. Norris, Biochemistry 27 (1988) 774.
- 9(a) M. Bixon, J. Jortner, M. E. Michel-Beyerle, A. Ogrodnik, W. Lersch, Chem. Phys. Lett. 140 (1987) 626. (b) M. E. Michel-Beyerle, M. Bixon, J. Jortner, J. Chem. Phys. 115 (1988) 188. (c) M. Plato, K. Mobins, M. E. Michel-Beyerle, M. Bixon, J. Jortner, J. Am. Chem. Soc. 110 (1988) 7279. (d) M. Bixon, J. Jortner, J. Chem. Phys. 159 (1989) 17. (e) S. G. Boxer, R. A. Goldstein, D. J. Lockhart, T. R. Middendorf, L. Takiff, J. Phys. Chem. 93 (1989) 8280.
- 10 Vorgestellt auf der 4th Int. Conf. Bioinorg. Chem. (Boston, MA, USA 1989).
- 11 Nach Einreichen dieser Arbeit wurde über die Synthese eines zu 2 analogen acceptorfreien Trimers berichtet: T. Nataga, A. Osuka, K. Maruyama. J. Am. Chem. Soc. 112 (1990) 3054. Für weitere Berichte über acceptorfreie oligomere Tetrapyrrolsysteme siehe: A. Osuka, K. Matuyama, H. Tomita, Chem. Lett. 1988, 1243; A. Osuka, K. Maruyama, J. Am. Chem. Soc. 110 (1988) 4454. S. Chardon-Noblat, J.-P. Sauvage, P. Mathis, Angew. Chem. 101 (1989) 631. Angew. Chem. Int. Ed. Engl. 28 (1989) 583. G. M. Dubowchik, A. D. Hamilton, J. Chem. Soc. Chem. Commun. 1987, 293; J. Chem. Soc. Chem. Commun. 1986, 665, 1391; L. R. Milgrom, J. Chem. Soc. Perkin Trans. 1 1983, 2535.
- 12 I. Abdalmuhdi, C. K. Chang, J. Org. Chem. 50 (1985) 411.
- 13 Hergestellt durch Reduktion von Terephthaladehydmono(diethylacetal) mit LiAIH4 in THF.
- 14 Alle neuen Verbindungen ergaben 1H-NMR-, 13C-NMR- und massenspektrometrische Daten, die mit den vorgeschlagenen Strukturen übereinstimmen.
- 15(a) J. S. Lindsey, R. W. Wagner, J. Org. Chem. 54 (1989) 828. (b) J. S. Lindsey, I. C. Schreiman, H. C. Hsu, P. C. Kearney, A. M. Marguerettaz, J. Org. Chem. 52 (1987) 827.
- 16 J. M. Lansinger, R. C. Ronald, Synth. Commun. 9 (1979) 341.
- 17 Die Diphenylporphyrin-Kontrollverbindung 2,8,12,18-Tetrabutyl-3,7,13,17-tetramethyl-5,15-diphenylporphyrin wurde durch Kondensation von 7 mit Benzaldehyd hergestellt [14].
- 18(a) Y. Won, R. A. Friesner, M. R. Johnson, J. L. Sessler, Photosynth. Res. 22 (1989) 201. (b) J. Ha, R. A. Friesner, J. L. Sessler, unveröffentlichte Ergebnisse.
- 19 Wichtig: Wie aufgrund früherer Studien [1] erwartet, beobachtet man in einer 1:1-Mischung aus 2 und Benzochinon bei den verwendeten Konzentrationen (ca. 10−5M) keine signifikante Löschung der Porphyrinfluoreszenz.
- 20 Berechnet relativ zu Tetraphenylporphyrin (πf = 0.11).
- 21 Dieses Ergebnis wird gestützt durch die direkte Untersuchung der Absorption von angeregten Zuständen im Picosekundenbereich: Die Lebensdauer des angeregten Singulettzustandes von 1a muß ≤ 75 ps, die Grenze der zeitlichen Auflösung der uns zur Verfügung stehenden Geräte, sein. Wir danken Stefan Hubig und Anthony Harriman am Center for Fast Kinetics Research (eine von mehreren Stellen genutzte NIH-Einrichtung an der University of Texas) für die Unterstützung bei der Aufnahme der statischen und dynamischen Spektren.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.