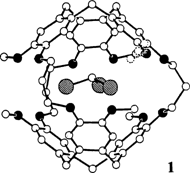
Struktur und Eigenschaften des Cryptophan-E/CHCl3-Komplexes, eines stabilen van-der-Waals-Moleküls†
Dr. Josette Canceill
Equipe de Recherche du C.N.R.S. No. 285 Chimie des Interactions Moléculaires, Collège de France 11, place Marcelin-Berthelot, F-75231 Paris Cedex 05 (Frankreich)
Search for more papers by this authorDr. Michèle Cesario
Institut de Chimie des Substances Naturelles, C.N.R.S. B.P. 1, F-91190 Gif-sur-Yvette (Frankreich)
Search for more papers by this authorCorresponding Author
Prof. Dr. André Collet
U.M.R. C.N.R.S.-E.N.S.L. 117 Stéréochimie et Interactions Moléculaires Ecole Normale Supérieure de Lyon 46, allée ďItalie, F-69364 Lyon Cedex 07 (Frankreich)
U.M.R. C.N.R.S.-E.N.S.L. 117 Stéréochimie et Interactions Moléculaires Ecole Normale Supérieure de Lyon 46, allée ďItalie, F-69364 Lyon Cedex 07 (Frankreich)Search for more papers by this authorDr. Jean Guilhem
Institut de Chimie des Substances Naturelles, C.N.R.S. B.P. 1, F-91190 Gif-sur-Yvette (Frankreich)
Search for more papers by this authorLiliane Lacombe
Equipe de Recherche du C.N.R.S. No. 285 Chimie des Interactions Moléculaires, Collège de France 11, place Marcelin-Berthelot, F-75231 Paris Cedex 05 (Frankreich)
Search for more papers by this authorDr. Bénédicte Lozach
U.M.R. C.N.R.S.-E.N.S.L. 117 Stéréochimie et Interactions Moléculaires Ecole Normale Supérieure de Lyon 46, allée ďItalie, F-69364 Lyon Cedex 07 (Frankreich)
Search for more papers by this authorDr. Claudine Pascard
Institut de Chimie des Substances Naturelles, C.N.R.S. B.P. 1, F-91190 Gif-sur-Yvette (Frankreich)
Search for more papers by this authorDr. Josette Canceill
Equipe de Recherche du C.N.R.S. No. 285 Chimie des Interactions Moléculaires, Collège de France 11, place Marcelin-Berthelot, F-75231 Paris Cedex 05 (Frankreich)
Search for more papers by this authorDr. Michèle Cesario
Institut de Chimie des Substances Naturelles, C.N.R.S. B.P. 1, F-91190 Gif-sur-Yvette (Frankreich)
Search for more papers by this authorCorresponding Author
Prof. Dr. André Collet
U.M.R. C.N.R.S.-E.N.S.L. 117 Stéréochimie et Interactions Moléculaires Ecole Normale Supérieure de Lyon 46, allée ďItalie, F-69364 Lyon Cedex 07 (Frankreich)
U.M.R. C.N.R.S.-E.N.S.L. 117 Stéréochimie et Interactions Moléculaires Ecole Normale Supérieure de Lyon 46, allée ďItalie, F-69364 Lyon Cedex 07 (Frankreich)Search for more papers by this authorDr. Jean Guilhem
Institut de Chimie des Substances Naturelles, C.N.R.S. B.P. 1, F-91190 Gif-sur-Yvette (Frankreich)
Search for more papers by this authorLiliane Lacombe
Equipe de Recherche du C.N.R.S. No. 285 Chimie des Interactions Moléculaires, Collège de France 11, place Marcelin-Berthelot, F-75231 Paris Cedex 05 (Frankreich)
Search for more papers by this authorDr. Bénédicte Lozach
U.M.R. C.N.R.S.-E.N.S.L. 117 Stéréochimie et Interactions Moléculaires Ecole Normale Supérieure de Lyon 46, allée ďItalie, F-69364 Lyon Cedex 07 (Frankreich)
Search for more papers by this authorDr. Claudine Pascard
Institut de Chimie des Substances Naturelles, C.N.R.S. B.P. 1, F-91190 Gif-sur-Yvette (Frankreich)
Search for more papers by this authorWir danken der Région Rhône-Alpes und der Société LIPHA für ein Stipendium (an B. L.)
Abstract
In Abwesenheit hydrophober Effekte hängt die Triebkraft der Komplexbildung zwischen neutralen Wirt- und Gastmolekülen (z. B. Cryptophan E und Halogenmethanen) von mehreren Faktoren ab: Sind Größe und Form passend wie im CHCl3-Komplex 1, ist die Komplexierung enthalpiegesteuert, und es entstehen stabile Übermoleküle („van-der-Waals-Moleküle”︁).
References
- 1 J. Canceill, L. Lacombe, A. Collet, J. Am. Chem. Soc. 108 (1986) 4230.
- 2 J. Canceill, L. Lacombe, A. Collet, C.R. Acad. Sci. Sér. II 304 (1987) 815.
- 3 Ubersicht zur Komplexierung neutraler Molekule: F. Diederich, Angew. Chem. 100 (1988) 372 Angew. Chem. Int. Ed. Engl. 27 (1988) 362.
- 4 Im gegenwärtigen Gebrauch bezieht sich der Ausdruck „van-der-Waals-Molekul”︁ nur auf sehr kurzlebige Spezies wie He…He oder C6H6 · Cl2, die Gegenstand zahlreicher theoretischer und experimenteller Untersuchungen waren. Wir erweitern diese Definition hier auf Supramolekule, die in Lösung bei 273 K Lebensdauern von einigen Sekunden haben können siehe: A. van der Avoid, P. E. S. Wormer, F. Mulder, R. M. Berns, Top. Curr. Chem. 93 (1980) 3 P. Hobza, R. Zahradnik, Top. Curr. Chem. 93 (1980) 53.
- 5 Der Kristall, der zur Aufnahme der Röntgendaten diente, wurde aus Chloroform/95% Ethanol erhalten. Die asymmetrische Einheit besteht aus einem 1 · CHCl3-Supramolekul mit zusätzlichen, außerhalb liegenden CHCl3- und H2O-Molekulen in nicht stöchiometrischen Verhältnissen, entsprechend [(C57H60O12 · CHCl3), 0.2 CHCl3, 0.2 H2O]. Monoklin, Raumgruppe P21/ n, a = 38.262(14), b = 12.441(5), c = 12.748(5) Å, ß = 95.78(6)°, V = 6037 Å3, Z = 4, Qber = 1.192 g cm−1. Insgesamt wurden 8688 unabhängige Reflexe mit einem automatischen Vierkreisdiffraktometer unter Verwendung graphit-monochromatisierter CuKα-Strahlung (1.5418 Å) aufgenommen. 4380 Reflexe wurden für die Strukturermittlung und -verfeinerung [ I > 3 s ( I)] verwendet. Lorentz- und Polarisationskorrektur wurden durchgefuhrt, jedoch keine Absorptionskorrektur. Die Struktur wurde mit Direkten Methoden [10] gelöst; die Atomkoordinaten und anisotropen Temperaturparameter für schwerere Atome (mit Ausnahme von Lösungsmittelmolekulen und einer fehlgeordneten Methylgruppe) wurden bis zu R = 13.3% ( RW = 11.9%) mit SHELX-76 [11] ermittelt. Den Wasserstoffatomen an den theoretischen Positionen (C–H 1.08 Å) wurden die äquivalenten isotropen Temperaturfaktoren der C-Atome zugeordnet, an denen sie gebunden sind. Die Elektronendichte-analyse des inneren Bereichs des Hohlraums zeigte das Chloroform-Molekul in zwei gleichmäßig besetzten Orientierungen. Eine der sechs Methylgruppen zeigte an drei Positionen Rotationsfehlordnung mit Besetzungsfaktoren von 0.6, 0.2 und 0.2. Fourier-Differenz-Reihen ergaben die Anwesenheit zusätzlicher Molekule in den Gitterleerstellen: Chloroform-Molekule in zwei einander ausschließenden Positionen (Besetzungsfaktor = 0.09 und 0.11) und ein Wasser-Molekul (Besetzungsfaktor = 0.02). Die Verfeinerung der Koordinaten der internen und externen Chloroform-Molekule wurde für starre Gruppen mit einem theoretischen Modell durchgefuhrt (C-Cl = 1.73 Å, Cl-C-Cl = 111°). Die maximale Restelektronendichte beträgt 0.58 eÅ−3. Weitere Einzelheiten zur Kristallstruktur-untersuchung können beim Direktor des Cambridge Crystallographic Data Centre, University Chemical Laboratory, Lensfield Road, GB-Cambridge CB2 1EW (UK) unter Angabe des vollständigen Zeitschriftenzitats angefordert werden.
- 6 A. Bondi: Physical Properties of Molecular Crystals, Liquids and Glasses, Wiley, New York 1968 A. I. Kitaïgorodsky: Molecular Crystals and Molecules, Academic Press, London 1973.
- 7 Aufgrund von linearen Regressionen kleinster Fehlerquadrate für lnK gegen T−1 in mehreren unabhängigen Experimenten schätzen wir den Fehlerbereich von ΔH1 und ΔS1 auf ± 1 kcal mol−1 bzw. ±3 cal mol−1 K−1.
- 8 Diese Frage wird hier nicht näher erörtert. Fur relevante Diskussionen siehe J. J. Moura Ramos, L. Dumont, M. L. Stien, J. Reisse, J. Am. Chem. Soc. 102 (1980) 4150 G. Michaux, J. Reisse, J. Am. Chem. Soc. 104 (1982) 6895 M. Claessens, O. Fabre, D. Zimmermann, J. Reisse, Bull. Soc. Chim. Belg. 93 (1984) 983 M. Ohba, K. Arakawa, Bull. Chem. Soc. Jpn. 58 (1985) 3068.
- 9 Fur eine ähnliche Feststellung siehe [3] und F. Diederich, K. Dick, D. Griebel, Chem. Ber. 118 (1985) 3588.
- 10 C. Riche, Abstr. 7th Eur. Crystallogr. Mtg., Jeruslem 1982, S. 25.
- 11 D. Sheldrick, SHELX-76, a Program for Crystal Structure Determination, University of Cambridge (England) 1976.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.