Gürtel- und Kragenmoleküle: Ein Hexaepoxyoctacosahydro[12]cyclacen†
Dr. Franz H. Kohnke
Department of Chemistry, The University Sheffield S3 7HF (Großbritannien)
Beurlaubt von der Universität von Messina.
Search for more papers by this authorAlexandra M. Z. Slawin
Chemical Crystallography Laboratory Department of Chemistry, Imperial College London SW7 2AY (Großbritannien)
Search for more papers by this authorCorresponding Author
Dr. J. Fraser Stoddart
Department of Chemistry, The University Sheffield S3 7HF (Großbritannien)
J. Fraser Stoddart, Department of Chemistry, The University Sheffield S3 7HF (Großbritannien)
David J. Williams, Chemical Crystallography Laboratory Department of Chemistry, Imperial College London SW7 2AY (Großbritannien)
Search for more papers by this authorCorresponding Author
Dr. David J. Williams
Chemical Crystallography Laboratory Department of Chemistry, Imperial College London SW7 2AY (Großbritannien)
J. Fraser Stoddart, Department of Chemistry, The University Sheffield S3 7HF (Großbritannien)
David J. Williams, Chemical Crystallography Laboratory Department of Chemistry, Imperial College London SW7 2AY (Großbritannien)
Search for more papers by this authorDr. Franz H. Kohnke
Department of Chemistry, The University Sheffield S3 7HF (Großbritannien)
Beurlaubt von der Universität von Messina.
Search for more papers by this authorAlexandra M. Z. Slawin
Chemical Crystallography Laboratory Department of Chemistry, Imperial College London SW7 2AY (Großbritannien)
Search for more papers by this authorCorresponding Author
Dr. J. Fraser Stoddart
Department of Chemistry, The University Sheffield S3 7HF (Großbritannien)
J. Fraser Stoddart, Department of Chemistry, The University Sheffield S3 7HF (Großbritannien)
David J. Williams, Chemical Crystallography Laboratory Department of Chemistry, Imperial College London SW7 2AY (Großbritannien)
Search for more papers by this authorCorresponding Author
Dr. David J. Williams
Chemical Crystallography Laboratory Department of Chemistry, Imperial College London SW7 2AY (Großbritannien)
J. Fraser Stoddart, Department of Chemistry, The University Sheffield S3 7HF (Großbritannien)
David J. Williams, Chemical Crystallography Laboratory Department of Chemistry, Imperial College London SW7 2AY (Großbritannien)
Search for more papers by this authorDiese Arbeit wurde von der British Technology Group, der Royal Society, den Agricultural and Food sowie Science and Engineering Research Councils in Großbritannien und von der Accademia dei Lincei sowie der Universität von Messina in Italien gefördert.
Abstract
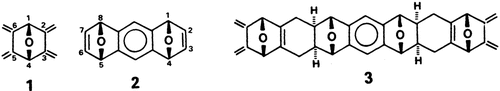
Wiederholte Diels-Alder-Reaktionen der passend gekrümmten, starren Edukte 1 und 2 ergeben über die zentrale Zwischenstufe 3 die nicht nur ästhetisch reizvolle Titel- (und Titelbild-)Verbindung. Im letzten Schritt der Synthese wird 3 unter hohem Druck (9–10 kbar) mit 2 umgesetzt (Ausbeute immerhin 20%). Die Diels-Alder-Reaktionen sind bemerkenswert stereoselektiv, die Zwischenprodukte topologisch äußerst interessant und das Endprodukt – es spricht für sich.
References
- 1 Entschiedene Förderer höchst spekulativer Projekte sind rar. Bei diesem waren es Dr. R. D. Handscombe (Universität von Sheffield) und Prof. Dr. G. Stagno d'Alcontres (Universität von Messina). Wir danken ihnen für ihre moralische Unterstützung und allen Doktoranden, die im Laufe der Jahre in unserem Laboratorium in Sheffield Ausgangsmaterialien für das „verrückte Molekül”︁ hergestellt haben, für ihre von Enthusiasmus getragenen Anstrengungen. - Einer der Autoren (J. F. S.) dankt dem Leverhulme Trust für ein Research Fellowship.
- 2 Vor kurzem wurden für Gürtelmoleküle aus 1,4-Cyclohexadien-Einheiten Kraftfeldrechnungen durchgeführt (R. W. Alder, R. B. Sessions, J. Chem. Soc. Perkin Trans. 2 1985, 1849). Verbindungen des Typs 1 wurden dort als [n]Beltene bezeichnet. Die Spannungsenergie pro 2-Buten-1,2,3,4-tetrayl-Einheit nimmt den Rechnungen zufolge vom [3]Belten zum [12]Belten monoton ab. Bezüglich der Komplexierung kleiner Moleküle führten Berechnungen zu der Voraussage, daß beispielsweise für Acetylen [9]Belten der optimale molekulare Rezeptor sein sollte.
- 3 Mit Blick auf die Zukunft der Cyclophanchemie hat F. Vögtle die Herausforderung hervorgehoben, die die Synthese der [n]Cyclacene 2 bietet (Top. Curr. Chem. (”︁Cyclophanes II'') 115 (1983) 157); die [n]Cyclacene sind als eine neue Stoffklasse - möglicherweise handelt es sich um neuartige eindimensionale Leiter - auch von erheblichem theoretischem Interesse (S. Kivelson, O. L. Chapman, Phys. Rev. B 28 (1983) 7236).
- 4 Anfangs stellten wir 4 aus 3,4-Furandicarbonsäuredimethylester und Acetylendicarbonsäuredimethylester in einer Sechsstufensynthese dar (P. Vogel, A. Florey, Helv. Chim. Acta 57 (1974) 200). Später wandten wir die ergiebige Vierstufensynthese, ausgehend vom Diels-Alder-Addukt von Furan und Maleinsäureanhydrid an (C. Mahaim, P.-A. Carrupt, J.-P. Hagenbuch, A. Florey, P. Vogel, Helv. Chim. Acta 63 (1980) 1149). Eine Einkristall-Röntgenstrukturanalyse des Zwischenprodukts 7-Oxabicyclo[2.2.1]heptan-2,3,5,6-tetracarbonsäuretetramethylester bestätigte, daß es in all- exo-Konfiguration vorliegt ( F. H. Kohnke, A. M. Z. Slawin, J. F. Stoddart, D. J. Williams, unveröffentlichte Ergebnisse).
- 5 Die Darstellung von 1,4:5,8-Diepoxy-1,4,5,8-tetrahydroanthracen aus 1,2,4,5-Tetrabrombenzol und Furan sowie die chromatographische Isolierung erfolgten nach einer freundlicherweise von Prof. Dr. H. Hart zur Verfügung gestellten detaillierten Arbeitsvorschrift (persönliche Mitteilung, 1986), die einige wesentliche Zusatzinformationen zu der bereits veröffentlichten (H. Hart, N. Raja, M. A. Meador, D. L. Ward, J. Org. Chem. 48 (1983) 4357) enthält. Wir schlossen auf das Vorliegen des syn-Isomers 5 über die Röntgenstrukturanalysen einer zu 5 isomeren Verbindung. Obwohl sich die von uns erhaltenen Kristalldaten (F. H. Kohnke, A. M. Z. Slawin, J. F. Stoddart, D. J. Williams, unveröffentlichte Ergebnisse) vollständig von denen unterscheiden, die in der obengenannten Veröffentlichung von Hart et al. für das anti-Isomer von 5 angegeben sind, zeigten die Daten doch, daß die Kristalle ausschließlich Moleküle mit anti-Struktur enthalten. Diese beiden Kristallstrukturen müssen als verschiedenene Kristallmoldifikationen) (Polymorphie) entsprechen.
- 6 Diese Prinzipien nutzten andere (siehe beispielsweise D. J. Cram, Science 219 (1983) 1177; H. C. Kang, A. W. Hanson, B. Eaton, V. Boekelheide, J. Am. Chem. Soc. 107 (1985) 1979; D. J. Cram, K. D. Stewart, I. Goldberg, K. N. Trueblood, J. Am. Chem. Soc. 107 (1985) 2574) bei der Synthese von Hohlraum-Molekülen. - Ein Beispiel für ein Molekül, das ähnlich wie 8 „kragenartige”︁ Struktur hat, ist Cucurbituril; es kann leicht aus Harnstoff, Glyoxal und Formaldehyd hergestellt werden (W. A. Freeman, M. L. Mock, N.-Y. Shih, J. Am. Chem. Soc. 106 (1984) 1416). Cucurbituril bildet Wirt-Gast-Komplexe in Lösung (W. C. Mock, N.-Y. Shih, J. Org. Chem. 48 (1983) 3618; J. Org. Chem. 51 (1986) 4440) und katalysiert 1,3-dipolare Cycloadditionen (W. L. Mock, T. A. Mirra, J. P. Wepsiec, T. L. Manimaran, J. Org. Chem. 48 (1983) 3619).
- 7 Mit der Röntgenstrukturanalyse von 6a (Abb. 1) wurde nicht nur die Stereochemie von 6 nachgewiesen, sondern auch gezeigt, daß Anthracen die dienophile Doppelbindung von 6 bevorzugt von der exo-Seite her angreift. Dies legt nahe, daß das 1 :2-Addukt aus 5 und Anthracen (H. Hart, N. Raju, M. A. Meador, D. L. Ward, J. Org. Chem. 48 (1983) 4357) exo-exo-Konfiguration hat.
- 8 Aufgrund des negativen Aktivierungsvolumens wird die Diels-Alder-Reaktion durch Druckerhöhung beschleunigt (kürzlich erschienene Übersicht: N. S. Isaacs, A. V. George, Chem. Br. 23 (1987) 47). Wir danken Prof. S. V. Ley (Imperial College, London), der unsere Bedenken, diese Methode anzuwenden, zerstreute, und Dr. N. S. Isaacs (SERC High Pressure Service Facility, Universität von Reading), der uns bei der Darstellung von 8 half.
- 9 Obwohl intramolekulare Diels-Alder-Reaktionen mit flexiblen Trienen im letzten Jahrzehnt intensiv untersucht wurden (neuere Übersicht: E. Ciganek, Org. React. 32 (1984) 1), gilt dies nicht für sehr starre Moleküle mit Dien- und Dienophil-Einheiten.
- 10 P.-A. Carrupt, P. Vogel, Tetrahedron Lett. 1979, 4533; Y. Bessiére, P. Vogel, Helv. Chim. Acta 63 (1980) 232.
- 11 A. A. Pinkerton, D. Schwarzenbach, J. H. A. Stibbard, P.-A. Carrupt, P. Vogel, J. Am. Chem. Soc. 103 (1983) 2095; J.-M. Tornare, P. Vogel, A. A. Pinkerton, D. Schwarzenbach, Helv. Chim. Acta 68 (1985) 2195.
- 12 Nicolet-R3m-Diffraktometer, ω-Scans, CuKα-Strahlung (Graphitmonochromator). Ein Kristall der Verbindung 8 wurde unter Chloroform in ein Lindemann-Kapillarröhrchen eingeschmolzen, das so auseinandergezogen wurde, daß der Kristall im Lösungsmitteldampf verblieb; eine numerische Absorptionskorrektur wurde durchgeführt. Beide Strukturen wurden durch direkte Methoden gelöst und anisotrop verfeinert; die R-Werte sind, insbesondere bei 8, infolge starker Unordnung durch eingeschlossene Lösungsmittel hoch. Weitere Einzelheiten zu den Kristallstrukturuntersuchungen können beim Direktor des Cambridge Crystallographic Data Centre, University Chemical Laboratory, Lensfield Road, Cambridge CB2 1EW (England) unter Angabe der Autoren und des Literaturzitats angefordert werden.
- 13 Das Monoaddukt 6 ist instabil und polymerisiert. Daher bevorzugen wir die Synthese von 8 über das Bisaddukt 7, das bei -20°C unter Lichtausschluß einige Monate ohne Zersetzung gelagert werden kann.
- 14 Alle neuen Verbindungen lieferten zufriedenstellende Elementaranalysen und passende spektroskopische Daten. Wir sind Herrn P. R. Ashton für EI- und FAB-Massenspektren (Spektrometer: Kratos MS80RF) und Dr. C. M. Spencer für Hochfeld-NMR-Spektren (Spektrometer: Bruckner WH400) sehr dankbar. Ferner danken wir Dr. A. D. McNaught (The Royal Society of Chemistry, London) für seine Hinweise zur Benennung dieser neuen Verbindungen mit Trivialnamen und systematischen Namen.
- 15 Siehe beispielsweise R. O. Angus Jr., R. P. Johnson, J. Org. Chem. 48 (1983) 373; L. L. Miller, A. D. Thomas, C. L. Wilkins, D. A. Weil, J. Chem. Soc. Chem. Commun. 1986, 661.
- 16 Siehe beispielsweise G. A. Russell, N. K. Suleman, H. Iwamura, O. W. Webster, J. Am. Chem. Soc. 103 (1981) 1560; E. Lipczynska-Kochany, H. Iwamura, Chem. Lett. 1982, 1075; C. S. Wilcox, L. M. Greer, V. Lynch, J. Am. Chem. Soc. 109 (1987) 1865.
- 17 Diese Clathratbildung erklärt den augenblicklichen Verlust von Chloroform und das Kollabieren der Kristalle bei ihrer Entfernung aus der Mutterlauge.
- 18 Einige ausgezeichnete Übersichtsartikel zu diesem Thema findet man in: W. H. Watson (Hrsg.): Stereochemistry and Reactivity of Systems containing π-Electrons, Verlag Chemie International, Deerfield Beach, FL, USA 1983.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.