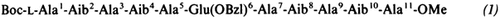Zur Struktur des helicalen N-Terminus im Alamethicin – α-Helix oder 310-Helix?†
Dipl.-Chem. Thomas Butters
Institut für Organische Chemie der Universität Auf der Morgenstelle 18, D-7400 Tübingen
Search for more papers by this authorDipl.-Chem. Peter Hütter
Institut für Organische Chemie der Universität Auf der Morgenstelle 18, D-7400 Tübingen
Search for more papers by this authorCorresponding Author
Prof. Dr. Günther Jung
Institut für Organische Chemie der Universität Auf der Morgenstelle 18, D-7400 Tübingen
Institut für Organische Chemie der Universität Auf der Morgenstelle 18, D-7400 TübingenSearch for more papers by this authorDipl.-Chem. Norbert Pauls
Institut für Organische Chemie der Universität Auf der Morgenstelle 18, D-7400 Tübingen
Search for more papers by this authorDipl.-Chem. Heribert Schmitt
Institut für Organische Chemie der Universität Auf der Morgenstelle 18, D-7400 Tübingen
Search for more papers by this authorProf. Dr. George M. Sheldrick
Anorganisch-chemisches Institut der Universität Tammannstraße 4, D-3400 Göttingen
Search for more papers by this authorCorresponding Author
Doz. Dr. Werner Winter
Institut für Organische Chemie der Universität Auf der Morgenstelle 18, D-7400 Tübingen
Institut für Organische Chemie der Universität Auf der Morgenstelle 18, D-7400 TübingenSearch for more papers by this authorDipl.-Chem. Thomas Butters
Institut für Organische Chemie der Universität Auf der Morgenstelle 18, D-7400 Tübingen
Search for more papers by this authorDipl.-Chem. Peter Hütter
Institut für Organische Chemie der Universität Auf der Morgenstelle 18, D-7400 Tübingen
Search for more papers by this authorCorresponding Author
Prof. Dr. Günther Jung
Institut für Organische Chemie der Universität Auf der Morgenstelle 18, D-7400 Tübingen
Institut für Organische Chemie der Universität Auf der Morgenstelle 18, D-7400 TübingenSearch for more papers by this authorDipl.-Chem. Norbert Pauls
Institut für Organische Chemie der Universität Auf der Morgenstelle 18, D-7400 Tübingen
Search for more papers by this authorDipl.-Chem. Heribert Schmitt
Institut für Organische Chemie der Universität Auf der Morgenstelle 18, D-7400 Tübingen
Search for more papers by this authorProf. Dr. George M. Sheldrick
Anorganisch-chemisches Institut der Universität Tammannstraße 4, D-3400 Göttingen
Search for more papers by this authorCorresponding Author
Doz. Dr. Werner Winter
Institut für Organische Chemie der Universität Auf der Morgenstelle 18, D-7400 Tübingen
Institut für Organische Chemie der Universität Auf der Morgenstelle 18, D-7400 TübingenSearch for more papers by this authorDiese Arbeit wurde von der Deutschen Forschungsgemeinschaft und dem Fonds der Chemischen Industrie unterstützt.
Abstract
Die Kristallstruktur des helicalen Undecapeptids (1), eines Modells der N-terminalen Alamethicin-Helix, macht wahrscheinlich, daß in den Antibiotica Alamethicin, Trichotoxin und Suzukacillin keine 310-, sondern eine α-Helix-Konformation vorliegt. Die neun N-terminalen Aminosäuren von (1) sind Teil einer α-Helix. Boc-L-Ala1-Aib2-Ala3-Aib4-Ala5-Glu(OBzl)6-Ala7-Aib8-Ala9-Aib10-Ala11-OMe (1).
References
- 1 G. Boheim, H. A. Kolb, J. Membr. Biol. 38, 99 (1978), zit. Lit.; B. Sakmann, G. Boheim, Nature 282, 336 (1979); G. Boheim, K. Janko, D. Leibfritz, T. Ooka, W. A. König, G. Jung, Biochim. Biophys. Acta 433, 182 (1976); G. Boheim, G. Irmscher, G. Jung, Biochim. Biophys. Acta 507, 485 (1978).
- 2
G. Jung,
N. Dubischar,
D. Leibfritz,
Eur. J. Biochem.
54,
395
(1975);
W. Mayr,
R. Oekonomopulos,
G. Jung,
Biopolymers
18,
425
(1979);
W. Mayr,
G. Jung,
Liebigs Ann. Chem.
1980,
1489;
10.1002/jlac.198019801006 Google ScholarR. Oekonomopulos, G. Jung, Biopolymers 19, 203 (1980).
- 3 G. Jung, H. Brückner, R. Oekonomopulos, G. Boheim, E. Breitmaier, W. A. König in E. Gross, J. Meienhofer: Peptides: Structure and Biological Function, Proc. 6th Am. Pept. Symp. 1978, Pierce Chem. Comp., Rockford 1979, S. 647; G. Irmscher, G. Jung, Eur. J. Biochem. 80, 165 (1977); H. Brückner, W. A. König, M. Greiner, G. Jung, Angew. Chem. 91, 508 (1979); Angew. Chem. Int. Ed. Engl. 18, 476 (1979).
- 4 N. Shamala, R. Nagaraj, P. Balaram, Biochem. Biophys. Res. Commun. 79, 292 (1977); G. D. Smith, W. L. Duax, E. W. Czerwinski, N. E. Kendrick, G. R. Marshall, F. S. Mathews in M. Goodman, J. Meienhofer Peptides, Proc. 5th Am. Pept. Symp. 1977, Wiley, New York 1978, S. 277; N. Shamala, R. Nagaraj, P. Balaram, J. Chem. Soc. Chem. Commun. 1978, 996; E. Benedetti, C. Pedone, C. Toniolo, Abstr. 16th Eur. Pept. Symp., Copenhagen 1980, S. 150; R. Nagaraj, N. Shamala, P. Balaram, J. Am. Chem. Soc. 101, 16 (1979); siehe auch B. R. Malcolm, Biopolymers 16, 2591 (1977).
- 5 A. W. Burgess, S. J. Leach, Biopolymers 12, 2599 (1973).
- 6 H. Schmitt, Diplomarbeit, Universität Tübingen 1979.
- 7 NONIUS CAD4, Datensätze mit MoKα- sowie mit CuKα-Strahlung (Graphitmonochromator) bei −130°C (Mo) und Raumtemperatur (Cu). Die beste Auflösung wurde mit einem Raumtemperatur-Cu-Datensatz erreicht, und nur mit diesen Daten gelang die Lösung des Phasenproblems. Abb. 1 und die Zellkonstanten a = 10.702(1), b = 24.225(3), c = 13.817(1) Å, β= 96.11(6)° beziehen sich ebenfalls auf diesen Datensatz.
- 8 G. M. Sheldrick, 1981, noch unveröffentlicht.
- 9 β-Turn (‘β-Bend’) ist ein durch H-Brücken stabilisierter Knick in einer Peptidkette.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.