Bekanntes und Neues zum Basalzellkarzinom
Redaktion
Prof. Dr. Trautinger, St. Pölten
Die allermeisten BZK können effektiv und sicher mit chirurgischen Standardverfahren beziehungsweise in ausgewählten Fällen mit topischen Therapien behandelt werden.
Für Deutschland wurde für 2020 eine rohe Inzidenzrate von >200 Fällen pro 100.000 Einwohner vorausgesagt.
Bei hellhäutigen Menschen wird das durchschnittliche Lebenszeitrisiko an einem BZK zu erkranken auf 30 % geschätzt.
Hauptrisikofaktoren, ein BZK zu entwickeln, sind UV-Strahlung, männliches Geschlecht, heller Hauttyp, fortgeschrittenes Alter (> 60 Jahre), langdauernde Immunsuppression, eine positive Familien- und/oder Eigenanamnese sowie bestimmte Genodermatosen (BZK-Syndrom, Xeroderma pigmentosum).
In der Pathogenese des BZK sind genetische Mutationen maßgeblich. So zählt das BZK zu den Tumoren mit der höchsten Mutationslast. Auf molekularer Ebene kommt es in den meisten Fällen zu einer abnormen Aktivierung des Hedgehog-Signalwegs.
Anhand des klinischen Bildes allein kann keine sichere Zuordnung zu einem histologischen Subtyp gemacht werden.
In vielen Fällen können in einem BZK mehrere histologische Subtypen nachgewiesen werden.
Die Stratifizierung nach Rezidivrisiko ist für die Therapieentscheidung maßgeblich.
Die Verdachtsdiagnose eines BZK kann, sofern charakteristische Merkmale vorliegen, mit freiem Auge klinisch gestellt werden. Die Diagnosesicherung erfolgt histologisch mittels (Exzisions-)Biopsie.
Die Dermatoskopie hat sich vor allem zur Differenzierung des BZK von Melanomen, kutanen Plattenepithelkarzinomen oder benignen Hauttumoren als sehr wertvoll erwiesen.
Die Operation, mit dem Ziel einer kompletten histologischen Entfernung des BZK inklusive aller subklinischer Ausläufer sowie dem Erreichen eines funktionell und ästhetisch adäquaten Ergebnisses ist bei allen BZK – sofern eine Operation möglich und sinnvoll ist – die Therapie der ersten Wahl.
Basalzellkarzinome mit einem niedrigen Rezidivrisiko und einer Tumordicke ≤ 2 mm können auch mit topischen Verfahren behandelt werden, wenngleich hierfür gegenüber der Operation nur eine abgeschwächte Empfehlung besteht.
Patienten mit einem hohen Rezidivrisiko, bei denen eine Operation nicht sicher möglich oder sinnvoll ist beziehungsweise solche, die eine Operation ablehnen sowie Patienten mit einem mBZK sollen in einem interdisziplinären Tumorboard besprochen werden, um die Operabilität zu prüfen beziehungsweise die Indikationen zur Strahlen- oder Systemtherapie zu stellen.
Direkte Vergleichsstudien zwischen den beiden Medikamenten gibt es nicht und in den Zulassungsstudien wurden unterschiedliche Designs verwendet. Die Effektivität von Sonidegib und Vismodegib beim lfBZK sowie ihr Nebenwirkungsprofil werden aber als ähnlich erachtet.
Cemiplimab stellt bei Patienten mit lfBZK in der Zweit- oder Drittlinientherapie eine sinnvolle Therapieoption dar.
Aufgrund der Möglichkeit von Lokalrezidiven beziehungsweise dem erhöhten Risiko, ein weiteres BZK beziehungsweise auch kutanes Plattenepithelkarzinom oder Melanom zu entwickeln, werden bei Patienten mit Zustand nach BZK regelmäßige Nachsorgeuntersuchungen empfohlen.
Zusammenfassung
Das Basalzellkarzinom (BZK) ist der häufigste maligne Tumor bei hellhäutigen Menschen und macht circa 75 % aller Hautkrebsfälle aus. Seit Jahrzehnten werden weltweit steigende Inzidenzraten berichtet. Hauptrisikofaktoren sind UV-Strahlung, männliches Geschlecht, heller Hauttyp, fortgeschrittenes Alter, langandauernde Immunsuppression, eine positive Familien-/Eigenanamnese sowie bestimmte Genodermatosen. Das BZK metastasiert selten und die Mortalität ist gering, allerdings kann es zu einer erheblichen Morbidität führen. In der Pathogenese sind genetische Mutationen, welche insbesondere den Hedgehog-Signalweg betreffen, bedeutsam. In der Diagnostik werden neben der Inspektion mit dem freien Auge und der Dermatoskopie zunehmend auch nichtinvasive Verfahren (optische Kohärenztomographie, konfokale Laserscanmikroskopie) eingesetzt, wobei auf die histologische Diagnosesicherung nur in Ausnahmefällen verzichtet werden kann. Klinisch und histologisch werden zahlreiche Unterformen unterschieden. Die Unterscheidung zwischen BZK mit hohem und niedrigem Rezidivrisiko beeinflusst die Therapieplanung maßgeblich. Die allermeisten BZK können effektiv und sicher mit chirurgischen Standardverfahren beziehungsweise in ausgewählten Fällen mit topischen Therapien behandelt werden. Lokal fortgeschrittene und metastasierte BZK werden einer Radiatio oder Systemtherapie zugeführt. Die Strahlentherapie ist zudem eine Option für ältere Patienten, wenn Kontraindikationen gegen eine Operation bestehen. In der Systemtherapie sind in Europa aktuell die Hedgehog-Inhibitoren Vismodegib und Sonidegib zugelassen. Eine Zulassung für den PD1-Inhibitor Cemiplimab in der Zweitlinientherapie ist zu erwarten.
Einleitung und Definition
Das Basalzellkarzinom (BZK) ist der häufigste maligne Tumor bei hellhäutigen Menschen [1] und macht circa 75 % aller Hautkrebsfälle aus [2]. Historisch wird das BZK auch als Basaliom bezeichnet. Die Verwendung dieses Begriffes wird jedoch aufgrund der potenziellen Aggressivität durch das infiltrative und destruierende Wachstum nicht mehr empfohlen [3, 4].
Es handelt sich um einen langsam wachsenden, lokal infiltrierenden und destruierenden, epithelialen Tumor mit basaloider Differenzierung, der sich ohne vorhergehende Präkanzerose aus Stammzellen innerhalb des Haarfollikels und/oder der interfollikulären Epidermis entwickelt [3-6]. Prädilektionsstellen sind UV-exponierte Körperareale, hier in erster Linie der Kopf- und Halsbereich, gefolgt von Stamm und Extremitäten [7]. Eine primäre Manifestation an Schleimhäuten, Handflächen oder Fußsohlen ist ungewöhnlich, wurde aber in Einzelfällen berichtet [7, 8].
Die allermeisten BZK können effektiv und sicher mit chirurgischen Standardverfahren beziehungsweise in ausgewählten Fällen mit topischen Therapien behandelt werden [2-4]. Die Raten an Metastasierung und Mortalität sind sehr gering [7, 9]. Allerdings kann das BZK zu einer erheblichen Morbidität führen, einerseits durch das gehäufte Auftreten in kosmetisch sensiblen Arealen, andererseits durch das lokal infiltrative und destruierende Wachstum, das bei fehlender oder inadäquater Therapie nach Jahren zu einem fortgeschrittenen Befund führen kann, der ein interdisziplinäres Therapiekonzept notwendig macht [1–4, 10]. Neben der Krankheitslast verursacht das BZK zudem erhebliche Kosten im Gesundheitssystem [1].
Epidemiologie
Seit Jahrzehnten werden weltweit steigende Inzidenzraten berichtet. Für Europa wurde eine jährlich steigende Inzidenzrate von 5,5 % pro Jahr prognostiziert [1]. Diese Zunahme wird einerseits auf häufigere histopathologische Diagnosesicherung, vermehrte Registrierung in Krebsregistern und eine alternde Bevölkerung, andererseits auch auf vermehrte Sonnenexposition zurückgeführt [11]. Aufgrund von uneinheitlichen statistischen Erfassungen in den einzelnen Ländern sind internationale Vergleiche nur schwierig zu ziehen [1]. In vielen Ländern – so auch in Österreich – werden Daten zu nichtmelanozytärem Hautkrebs (NMSC; non-melanoma skin cancer) aufgrund der hohen Prävalenz und der niedrigen Mortalität nicht in der Krebsstatistik publiziert [12]. In vielen Fällen beruhen die Daten auf kleinen, regional begrenzten Beobachtungsstudien [1]. Erschwerend für eine exakte Erfassung kommt hinzu, dass beim Auftreten von mehreren BZK häufig nur der erste Tumor registriert wird [13]. Für Deutschland wurde für 2020 eine rohe Inzidenzrate von > 200 Fällen pro 100 000 Einwohner vorausgesagt [14]. Die höchsten Raten an BZK weltweit finden sich in Australien und Neuseeland mit einer Inzidenz von > 1000 pro 100 000 Einwohner, wobei hier zuletzt abflachende Werte gemeldet werden [1]. Möglicherweise besteht ein Zusammenhang zwischen steigender Inzidenz und abnehmendem geographischem Breitengrad (Äquator = Breitengrad 0), sofern die Einwohner des entsprechenden Landes einen hellen Hauttyp haben [1, 11]. Dies konnte insbesondere in den USA belegt werden, wo eine deutliche Inzidenzzunahme von Norden nach Süden zu beobachten ist [1, 11] und zuletzt in südlichen Bundesstaaten Raten von 770–1070 pro 100 000 Einwohner verzeichnet wurden [15]. Bei hellhäutigen Menschen wird das durchschnittliche Lebenszeitrisiko an einem BZK zu erkranken auf 30 % geschätzt [16]. Das mittlere Erkrankungsalter von Patienten mit BZK betrug in Deutschland 2014 laut Krebsstatistik 72 Jahre, circa 52 % aller Fälle waren männliche Patienten [9]. Bezüglich der Mortalität konnte gezeigt werden, dass diese im Vergleich zur Allgemeinbevölkerung sogar geringer ist [9]. Dies wird darauf zurückgeführt, dass suspekte Hautläsionen im höheren Alter eher bei ansonsten gesunden Patienten abgeklärt werden [9].
Eine Metastasierung ist sehr selten und wird mit 0,028 bis 0,55 % angegeben [7], wobei möglicherweise eine Untererfassung bei nicht standardmäßig durchgeführter Ausbreitungsdiagnostik vorliegt [3, 4]. Das lokal fortgeschrittene BZK (lfBZK), definiert als Untergruppe von Tumoren, bei denen eine R0-Resektion aufgrund einer Mitbeteiligung vital oder funktionell bedeutsamer Strukturen nicht sicher erzielt werden kann [3, 4], wurde in einer Studie mit einer Häufigkeit von 0,8 % aller BZK beschrieben [17].
Pathogenese und Risikofaktoren
Bei der Pathogenese des BZK kommt es zu einem komplexen Zusammenspiel zwischen Umweltfaktoren sowie Phänotyp und Genotyp eines Individuums [11]. Die Hauptrisikofaktoren ein BZK zu entwickeln sind UV-Strahlung, männliches Geschlecht, heller Hauttyp (Fitzpatrick I und II), fortgeschrittenes Alter (> 60 Jahre), langdauernde Immunsuppression, eine positive Familien- und/oder Eigenanamnese sowie Genodermatosen wie das BZK-Syndrom oder Xeroderma pigmentosum [2-4].
Bei der UV-Strahlung als dem wichtigsten externen Risikofaktor spielen insbesondere eine hohe intermittierende Exposition (Sonnenbrände) in jungen Jahren sowie die Verwendung von Solarien eine Rolle [11]. Es konnte zudem gezeigt werden, dass Außenbeschäftigte mit hoher beruflicher UV-Exposition im Vergleich zu Personen mit geringer oder moderater beruflicher UV-Exposition ein signifikant höheres Risiko haben, an einem BZK zu erkranken [18, 19]. Basierend auf diesen Daten wird aktuell in Deutschland die Anerkennung des BZK als beruflich erworbene Krankheit angestrebt. Seltenere externe Risikofaktoren sind chronische Arsenexposition sowie ionisierende Strahlung [11]. Basalzellkarzinome können zudem in Narben und chronischen Ulzera entstehen [3, 4]. Die Bedeutung der Immunsuppression ist insbesondere bei Organtransplantierten evident. Hier besteht im Vergleich zur Allgemeinbevölkerung ein 6fach erhöhtes Risiko, ein BZK zu entwickeln [20]. In einer Metaanalyse konnte gezeigt werden, dass circa ein Drittel aller Patientin mit Zustand nach BZK ein weiteres entwickelt [21].
In der Pathogenese des BZK sind genetische Mutationen maßgeblich. So zählt das BZK zu den Tumoren mit der höchsten Mutationslast [22, 23]. Ein großer Teil dieser Mutationen ist UV-induziert [22-24]. Auf molekularer Ebene kommt es in den meisten Fällen zu einer abnormen Aktivierung des Hedgehog-Signalwegs [24], der eine wichtige Funktion bei der Organogenese, Erhaltung von Stammzellen und Gewebsregeneration einnimmt [24]. Bei sporadischen BZK finden sich inaktivierende beziehungsweise aktivierende Mutationen in PTCH1 (ca. 90 %) und SMO (ca. 10 %), die als Signaltransduktoren im Hedgehog-Signalweg fungieren [23]. Bei BZK, die mit dem BZK-Syndrom assoziiert sind, einer seltenen, autosomal dominant vererbten Multisystemerkrankung (geschätzte Prävalenz 1 : 56 000 [25]), die in bis zu 40 % auch de novo entstehen kann, liegt eine Keimbahnmutation zumeist in PTCH1 vor, seltener in PTCH2 oder SUFU [26]. Für das BZK-Syndrom werden neben dem Auftreten multipler BZK bereits in jungen Jahren als weitere Hauptkriterien Kieferzysten vor dem 20. Lebensjahr, palmares oder plantares Pitting, eine Verkalkung der Falx cerebri, das Auftreten eines Medulloblastoms sowie eine positive Familienanamnese beschrieben [3, 4].
Neben dem Hedgehog-Signalweg können weitere Signalwege, Tumorsuppressoren sowie Protoonkogene wie TP53 und die RAS-Protoonkogenfamilie bei der Pathogenese des BZK involviert sein [23, 24]. Zuletzt wurden zahlreiche weitere Gene (MYCN, PPP6C, STK19, LATS1, ERBB2, PIK3CA, PTPN14, RB1, FBXW7) identifiziert [23].
Klassifikation
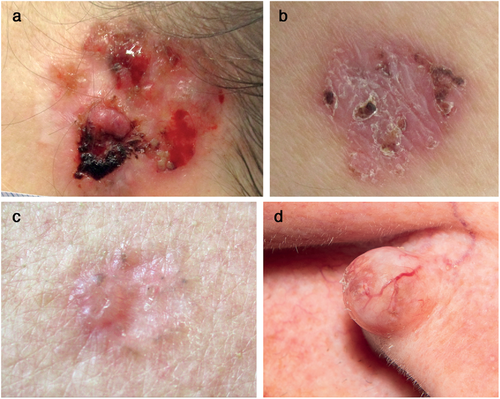
Beim BZK können klinisch und histologisch verschiedene Formen unterschieden werden. Als typische klinische Erscheinungsformen sind die Subtypen (ulzero-)nodulär, superfiziell, sklerodermiform (Abbildung 1a–d) und pigmentiert zu nennen [27]. Am häufigsten ist der noduläre Subtyp zu finden [27]. Anhand des klinischen Bildes allein kann keine sichere Zuordnung zu einem histologischen Subtyp gemacht werden [28].
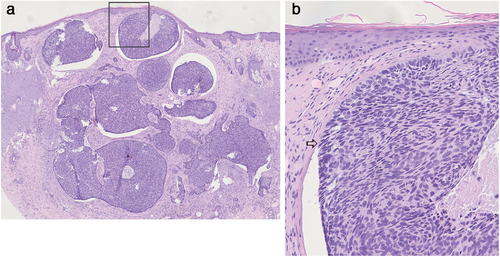
Histologisch werden zahlreiche Formen unterschieden. Dabei sind stets Nester basaloider Zellen mit hyperchromatischem Kern und schmalem Zytoplasma in palisadenartiger Anordnung vorhanden [27] (Abbildung 2a, b). Gemäß aktueller WHO-Klassifikation wird folgenden Subtypen ein niedriges Rezidivrisiko zugeschrieben: superfiziell, nodulär (Abbildung 2a, b), pigmentiert, infundibulozystisch, fibroepithelial. Die weiteren Unterformen werden mit hohem Rezidivrisiko als aggressiv eingestuft: sklerodermiform, infiltrativ, basosquamös, sarkomatoid und mikronodulär [2, 27]. Therapeutisch haben die Subtypen superfiziell, nodulär, sklerodermiform und infiltrativ die größte Relevanz [3, 4]. In vielen Fällen können in einem BZK mehrere histologische Subtypen nachgewiesen werden [29]. Andererseits besteht die Möglichkeit, dass bei einem kleinen Teil an Stanzbiopsien der aggressive Subtyp nicht erfasst wird [28, 29].
Neben klinischer und histologischer Klassifizierung wird das BZK in den aktuell publizierten Leitlinien nach Rezidivrisiko in Niedrig-Rezidivrisiko und Hoch-Rezidivrisiko unterteilt [2–4, 30]. Die entscheidenden Kriterien hierfür sind neben histologischem Subtyp und Vorliegen eines perineuralen Wachstumsmusters die Tumorlokalisation (Definition von H-Zone, M-Zone, L-Zone, siehe Tabelle 1) gekoppelt an den horizontalen Tumordurchmesser, die Tumorbegrenzung sowie positive Anamnese bezüglich Lokalrezidiv oder Radioderm [3, 4, 30]. Das Vorhandensein eines Risikofaktors ist ausreichend, um das BZK in die Hoch-Rezidivrisiko-Gruppe einzuordnen [3, 4, 30]. Diese komplexe Einteilung wird in der aktuellen deutschen S2k-Leitlinie in Form einer Tabelle zusammengefasst. Diese wird in dieser Arbeit geringfügig adaptiert übernommen (Tabelle 1). Der Vollständigkeit halber ist zu erwähnen, dass in den neuesten, online abrufbaren amerikanischen Leitlinien 2021 die Bezeichnungen H-Zone, M-Zone und L-Zone nicht mehr verwendet werden. Hier gelten inzwischen nur noch Rumpf und Extremitäten als Niedrig-Risiko-Lokalisation, sofern die BZK < 2 cm sind [31].
| Hohes Rezidivrisiko* | Niedriges Rezidivrisiko | |
|---|---|---|
| Horizontaler Tumordurchmesser und Lokalisation | H-Zone** > 6 mm M-Zone** > 10 mm L-Zone** > 20 mm |
H-Zone** < 6 mm M-Zone** < 10 mm L-Zone** < 20 mm |
| Begrenzung | Schlecht definiert | Gut definiert |
| Lokalrezidiv | Ja | Nein |
| Histologischer Subtyp |
|
|
| Tumor auf Radioderm | Ja | Nein |
| Perineurales Wachstum | Ja | Nein |
- * Bei Vorliegen von einem dieser Faktoren erfolgt die Einstufung in die Kategorie „hohes Rezidivrisiko“.
- ** H-Zone = Lokalisation mit hohem Rezidivrisiko: „zentrales“ Gesicht (periorbital, Augenlider, Augenbrauen, Nase, Oberlippe, Kieferwinkel, Schläfen, Ohren, prä- und postaurikulär), Genitale, Hände, Füße
- M-Zone = Lokalisation mit moderatem Rezidivrisiko: Wangen, Stirn, Kinn, Unterlippe, Capillitium, Hals, prätibial
- L-Zone = Lokalisation mit niedrigem Rezidivrisiko: Rumpf, Extremitäten.
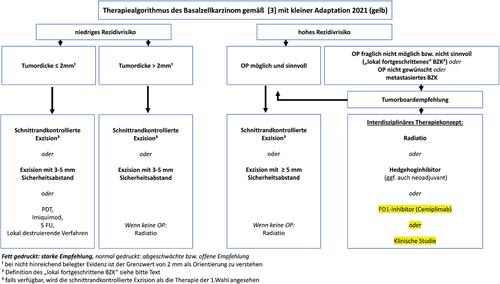
Die Stratifizierung nach Rezidivrisiko ist für die Therapieentscheidung maßgeblich. Ein entsprechender Therapiealgorithmus wurde ebenso in der aktuellen deutschen S2k-Leitlinie abgebildet und wird hier geringfügig modifiziert übernommen (Abbildung 3).
Von Seiten der Europäischen Gesellschaft für Dermatoonkologie (EADO) wird zudem eine Kategorisierung der BZK in easy to treat (> 95 % aller BZK) und difficult to treat vorgeschlagen [2]. Als difficult to treat werden sowohl alle lfBZK als auch gewöhnliche BZK, bei denen im therapeutischen Management Schwierigkeiten auftreten, klassifiziert. Dies kann folgende Ursachen haben: Neben einer durch die Operation zur erwartenden funktionellen oder auch ästhetischen Beeinträchtigung aufgrund der Tumorgröße und/oder Lokalisation werden schlecht definierte Tumorgrenzen, Zustand nach multiplen Rezidiven oder Radiatio sowie die fehlende Einwilligung beziehungsweise Komorbiditäten des Patienten angeführt [2]. Diese Klassifikation ist zum Zeitpunkt des Erstellens dieser Arbeit allerdings noch nicht publiziert [2].
Die TNM-Klassifikation spielt aufgrund des lokal destruierenden Wachstums und der seltenen Metastasierung beim BZK keine wesentliche Rolle [3, 4].
Diagnostik
Die Verdachtsdiagnose eines BZK kann, sofern charakteristische Merkmale vorliegen, mit freiem Auge klinisch gestellt werden (Abbildung 1a–d) [2-4]. Die Diagnosesicherung erfolgt histologisch mittels (Exzisions-)Biopsie [2–4, 32]. Ausnahmen, bei denen möglicherweise auf eine histologische Sicherung verzichtet werden kann, sind superfizielle und kleine noduläre (< 1 cm Durchmesser) BZK in Niedrig-Rezidivrisiko-Lokalisationen (L-Zone), die klinisch beziehungsweise mit nichtinvasiven Verfahren sicher diagnostiziert werden, insbesondere dann, wenn eine Therapie mit topischen Verfahren geplant ist [2].
Der histologische Befund sollte neben Angaben zu Tumordicke und Tumorrändern auch Informationen über den histologischen Subtyp beinhalten, da dies für das weitere therapeutische Management essenziell ist [3, 4]. Wie bereits erwähnt, gelingt es nicht immer, die aggressiven Subtypen mittels Stanzbiopsie zu detektieren [28, 29].
Nichtinvasive Untersuchungstechniken können die klinische Diagnostik von BZK verbessern [3, 4]. Hier sind insbesondere die Dermatoskopie, optische Kohärenztomographie (OCT) und konfokale Laserscanmikroskopie (KLSM) anzuführen [3, 4], wobei die OCT und KLSM spezieller technischer Geräte und Expertise bedürfen.
Die Dermatoskopie hat sich vor allem zur Differenzierung des BZK von Melanomen, kutanen Plattenepithelkarzinomen oder benignen Hauttumoren als sehr wertvoll erwiesen [2–4, 33, 34]. In einer rezenten Metaanalyse erzielte die Dermatoskopie bei der Diagnostik des BZK eine gepoolte Sensitivität von 91 % sowie Spezifität von 95 % [35], wobei sowohl Sensitivität als auch Spezifität bei pigmentierten BZK im Vergleich zu nichtpigmentierten BZK höher waren [35]. Des Weiteren konnte gezeigt werden, dass die Dermatoskopie bei der Differenzierung des superfiziellen BZK von anderen histologischen Subtypen hilfreich sein kann, was wiederum Einfluss auf die Therapieentscheidung haben kann [36].
Bei der OCT handelt es sich um ein nichtinvasives optisches Diagnostikverfahren, das in vivo innerhalb weniger Sekunden die Mikrostrukturen der Haut bis zu einer Tiefe von circa 1 mm darstellen kann. Die laterale Auflösung beträgt weniger als 7,5 μm [37]. Eine kürzlich erschienene Metaanalyse zur Diagnostik des BZK konnte zeigen, dass die konventionelle OCT eine höhere Sensitivität und Spezifität im Vergleich zur Inspektion mit freiem Auge plus Dermatoskopie hat und somit bei klinisch unklaren Läsionen hilfreich sein kann [38]. Die Tumordicke kann bis zu einer Tiefe von 1 mm gemessen werden [39]. Ferner können mittels OCT die einzelnen histologischen Subtypen mit moderater Genauigkeit diagnostiziert [40] und bei zusätzlicher Anwendung von OCT zu klinischer und dermatoskopischer Inspektion die lateralen Tumorränder präoperativ besser beurteilt werden [39, 41].
Die KLSM ist ein nicht invasives optisches Diagnostikverfahren, das in vivo innerhalb von einigen Minuten die Hautstrukturen auf zellulärer Ebene bis zur papillären Dermis darstellen kann. Aufgrund der hohen Auflösung wird das Verfahren auch als „optische Biopsie“ bezeichnet. Der limitierende Faktor ist allerdings die geringe Eindringtiefe (max. 250 μm) [42]. Eine aktuelle Metaanalyse sieht bei limitierter Datenlage den Nutzen der KLSM in der Diagnostik des BZK darin, dass diagnostische Biopsien bei Läsionen, die klinisch mit hoher Wahrscheinlichkeit einem BZK entsprechen, möglicherweise vermieden werden können [43].
Sowohl mit OCT als auch mit KLSM können Tumorreste nach Biopsie beziehungsweise Rezidive detektiert [44-46] und das Ansprechen auf nicht operative Therapien beurteilt werden [47-49].
Weitere Entwicklungen, die in der Zukunft möglicherweise eine Rolle spielen werden, sind die Ex-vivo-KLSM zur Schnittrandkontrolle nach mikroskopisch kontrollierter Chirurgie als schnellere Alternative zur histologischen Untersuchung am Gefrier- oder Paraffinschnitt [50, 51] sowie der kombinierte Einsatz von OCT und KLSM [52, 53].
Bei lfBZK beziehungsweise bei Verdacht auf Metastasierung oder perineuralem Wachstum wird eine weitere Diagnostik mittels Schnittbildgebung (Computertomographie, Magnetresonanztomographie) empfohlen [3, 4]. Zudem soll bei Diagnose eines BZK aufgrund des erhöhten Risikos für weitere epitheliale Hauttumoren eine klinische Untersuchung des gesamten Integuments erfolgen [3, 4].
Therapie
Wie bereits erwähnt, wurde in der aktuellen deutschen S2k-Leitlinie ein Algorithmus für die Therapie von BZK erstellt [3, 4]. Dieser beruht primär auf der Einteilung der BZK in Niedrig-Rezidiv- und Hoch-Rezidivrisiko-Typen. Weitere Unterscheidungskriterien sind im Falle eines niedrigen Rezidivrisikos die Tumordicke beziehungsweise im Falle eines hohen Rezidivrisikos die Operabilität (Abbildung 3) [3, 4].
Operative Therapie
Die Operation mit dem Ziel einer kompletten histologischen Entfernung des BZK inklusive aller subklinischer Ausläufer sowie dem Erreichen eines funktionell und ästhetisch adäquaten Ergebnisses ist bei allen BZK – sofern eine Operation möglich und sinnvoll ist – die Therapie der ersten Wahl [3, 4]. Eine rezente Metaanalyse zu Interventionen beim BZK bekräftigte, dass die operative Entfernung mit der geringsten Anzahl an Rezidiven assoziiert ist [54]. In der Literatur werden Rezidivraten von 2 %–8 % nach fünf Jahren angegeben [2].
Bei den operativen Verfahren wird im Wesentlichen zwischen der konventionellen Exzision mit risikoadaptiertem Sicherheitsabstand und stichprobenartiger histologischer Überprüfung der Resektionsränder (konventionelle Histologie) sowie der mikroskopisch kontrollierten Chirurgie (MKC) mit schrittweiser gewebesparender Operationstechnik und systematischer Randschnittkontrolle unterschieden [3, 4, 55]. Unter dem Begriff MKC werden unterschiedliche Techniken wie Mohs-Chirurgie, Münchner Methode oder 3D-Histologie (zum Beispiel Tübinger Torte) subsummiert [55].
Die Methode der MKC wird insbesondere bei Hoch-Risiko-BZK, Rezidiv-BZK und bei BZK an kritischen anatomischen Lokalisationen, bei denen ein gewebesparendes Operieren von Bedeutung ist, empfohlen [2–4, 55]. Eine prospektiv randomisiert kontrollierte Studie, die die konventionelle Exzision mit der MKC in Bezug auf die Rezidivhäufigkeit bei primär fazialen Hochrisiko-BZK und fazialen Rezidiv-BZK miteinander verglich, kam nach einem Beobachtungszeitraum von zehn Jahren zu dem Ergebnis, dass sowohl bei den primären BZK (4,4 % vs. 12,2 % Rezidive) als auch bei den Rezidiv-BZK (3,9 % vs. 13,5 % Rezidive) die MKC der konventionellen Exzision überlegen war. Eine statistische Signifikanz wurde jedoch nur für das Rezidiv-BZK festgestellt [56]. Zudem konnte gezeigt werden, dass die MKC aufgrund des gewebesparenden Operierens in einer Vielzahl von Fällen zu einem besseren kosmetischen Outcome führt [57]. Allerdings ist die MKC nur an spezialisierten Zentren verfügbar und mit höheren personellen und finanziellen Ressourcen verbunden [57-59].
Die Methode der konventionellen Exzision und Histologie ist sehr weit verbreitet [54]. Nachdem bei dieser Technik nur eine stichprobenartige histologische Kontrolle der Schnittränder erfolgt [3, 4], kann eine R0-Resektion möglicherweise auch vorgetäuscht werden [60]. Empfehlungen zu den Sicherheitsabständen sind abhängig vom Rezidivrisiko und variieren teilweise in den unterschiedlichen Leitlinien [2-4]. In der aktuellen deutschen S2k-Leitlinie wird im Falle eines niedrigen Rezidivrisikos ein Sicherheitsabstand von 3–5 mm und im Falle eines hohen Rezidivrisikos ein Sicherheitsabstand ≥ 5 mm empfohlen [3, 4]. Bei kleinen soliden BZK sind möglichweise auch knappere Sicherheitsabstände von 2–3 mm gerechtfertigt [61]. Das Rezidivrisiko bei soliden BZK < 2 cm, die mit konventioneller Exzision und einem Sicherheitsabstand von 3 mm entfernt werden, liegt bei unter 3 % [58].
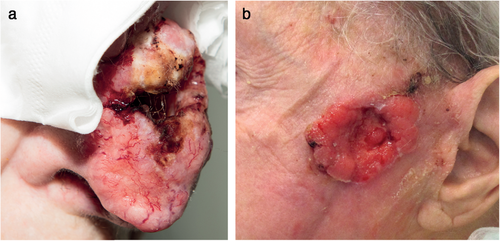
Bei inkompletter Exzision (R1-Resektion), die in der Literatur mit einer Häufigkeit von 4,7 %–24 % angegeben wird [2] und durch unterschiedliche Faktoren wie der Erfahrung des Operateurs, der Tumorlokalisation, dem histologischen Subtyp sowie der Exzision multipler Läsionen in einer Sitzung beeinflusst wird [2], wird in erster Linie eine Nachexzision empfohlen [2-4]. Diese sollte insbesondere bei BZK mit hohem Rezidivrisiko mittels MKC erfolgen [2-4]. Bei BZK mit niedrigem Rezidivrisiko können im Falle einer R1-Resektion auch nichtoperative Verfahren unter engmaschigen klinischen Verlaufskontrollen erwogen werden [3, 4]. Basalzellkarzinome, bei denen eine R0-Resektion nicht sicher erzielt werden kann (lfBZK) (Abbildung 4), sollen in einem interdisziplinären Tumorboard vorgestellt werden, um die Operabilität zu prüfen [3, 4].
Topische Therapie
Gemäß der aktuellen deutschen S2k-Leitlinie können BZK mit einem niedrigen Rezidivrisiko und einer Tumordicke ≤ 2 mm auch mit topischen Verfahren behandelt werden, wenngleich hierfür gegenüber der Operation nur eine abgeschwächte Empfehlung besteht [3, 4] (Abbildung 3).
Zu den topischen Therapien werden im Wesentlichen Externa (Imiquimod, 5-Fluoruracil [5-FU]), die photodynamische Therapie (PDT), die Kryochirurgie und die Lasertherapie gezählt [3, 4].
Externa
Imiquimod, das zur Gruppe der immune response modifier gezählt wird, ist für die Behandlung von superfiziellen BZK < 2 cm Durchmesser bei immunkompetenten Erwachsenen zugelassen [62] und wird in dieser Indikation als 5 % Creme 1 x täglich an fünf Tagen der Woche für insgesamt sechs Wochen appliziert [63]. Besonders in Niedrig-Risiko-Lokalisationen kann Imiquimod eine sinnvolle Alternative zur Operation bei superfiziellen BZK sein [3, 4]. Als Nebenwirkungen werden lokale Entzündungsreaktionen und in selteneren Fällen auch grippeähnliche Symptome berichtet [62, 63]. In einer randomisiert kontrollierten Studie, die die Effektivität von Imiquimod mit der Operation bei Niedrig-Risiko-BZK (superfiziell und nodulär) verglich, war Imiquimod nach drei und fünf Jahren Nachverfolgung mit rezidivfreien Raten von 84 % und 83 % der Operation (99 % und 98 %) deutlich unterlegen [64].
Für die Behandlung von nodulären BZK ist die Datenlage limitiert und es besteht dafür in Europa keine Zulassung [2]. In der oben genannten Studie erreichte Imiquimod beim nodulären BZK eine rezidivfreie Rate von 82 % und 81 % nach drei und fünf Jahren [64]. In der europäischen Leitlinie wird Imiquimod in der Behandlung von primären nodulären Niedrig-Risiko-BZK ein möglicher Nutzen eingeräumt [2].
Die topische Anwendung des Antimetaboliten 5-FU, auch als topische Chemotherapie bezeichnet, ist für die Behandlung von superfiziellen BZK zugelassen, wenn chirurgische oder radiologische Maßnahmen erfolglos waren oder nicht anwendbar sind und wird in dieser Indikation als 5 % Creme 2 x täglich für vier Wochen aufgetragen. Als Nebenwirkung werden lokale Entzündungsreaktionen beobachtet [65]. Eine randomisiert kontrollierte Studie, welche die Effektivität von topischem 5-FU mit Imiquimod und MAL-PDT (ein Zyklus mit zwei Behandlungen) beim superfiziellen BZK verglich, kam zu dem Ergebnis, dass 5-FU nach drei und fünf Jahren Nachbeobachtung im Vergleich zu Imiquimod weniger wirksam ist, der PDT jedoch nicht unterlegen ist [66].
Auch topische Hedgehog-Inhibitoren (HHI) werden bei der Therapie des BZK untersucht. In einer Phase-II-Studie konnte die topische Anwendung des HHI Patidegib bei Patienten mit BZK-Syndrom das Auftreten von BZK verhindern beziehungsweise deren Ausprägung abschwächen, ohne dass die klassenspezifischen und therapielimitierenden Nebenwirkungen der HHI wie Haarverlust, Geschmacksverlust und Muskelkrämpfe auftraten [67]. Kürzlich wurde dazu eine Phase-III-Studie abgeschlossen. Allerdings liegen dazu noch keine Ergebnisse vor (NCT03703310) [68].
Photodynamische Therapie (PDT)
Die konventionelle PDT – sowohl mit topischer Applikation von 5-Aminolaevulinsäure Nanoemulsion (ALA-PDT mit Ameluz®) als auch mit Methylaminolävulinat-Creme (MAL-PDT mit Metvix®) und anschließender Bestrahlung mit rotem Licht – ist für die Behandlung von superfiziellen und dünnen nodulären BZK (< 2 mm) in Europa zugelassen und sollte wie Imiquimod und 5-FU bevorzugt dann angewandt werden, wenn Kontraindikationen gegen eine Operation bestehen [2–4, 69]. Auch bei Patienten mit BZK-Syndrom bietet sich die PDT als Behandlungsoption an [69]. Basalzellkarzinome, die in der fazialen H-Zone lokalisiert sind, sowie seltene oder aggressive histologische Subtypen und pigmentierte BZK sollten hingegen nicht mit PDT behandelt werden [69].
Bei der PDT des BZK werden pro Behandlungszyklus zwei Therapiesitzungen im Abstand von einer Woche durchgeführt. Nach drei Monaten wird das Ansprechen evaluiert und bei partiell abgeheilten Läsionen üblicherweise ein weiterer Behandlungszyklus angeschlossen [70]. Es handelt sich um eine sehr sichere Behandlung, die generell gut vertragen wird. Während der Belichtung ist mit Schmerzen zu rechnen. Nach der Behandlung kommt es zu einem Erythem sowie Krustenbildung, wobei das Erythem auch mehrere Wochen bestehen kann.
Die Effektivität von MAL-PDT bei Niedrig-Risiko-BZK wurde in einer Vielzahl von Studien untersucht, mit Abheilungsraten von 82 %–97 % für das superfizielle und 33 %–91 % für das noduläre BZK [71-76]. Langzeitstudien berichten nach fünf Jahren eine Rezidivrate von 22 % für das superfizielle BZK und eine geschätzte fortbestehende Abheilungsrate von 76 % für das noduläre BZK [75, 76]. Hier ist nochmals anzumerken, dass die PDT ausschließlich für dünne noduläre BZK < 2 mm empfohlen wird [2-4]. Dies wurde nicht bei allen vorliegenden Studien berücksichtigt [3, 4]. Zudem spielt beim nodulären BZK das vorbereitende Abtragen von Krusten vor PDT eine wichtige Rolle [3, 4, 69].
In einer Phase-III-Studie wurde die Effektivität von ALA-PDT mit 5-Aminolaevulinsäure Nanoemulsion (Ameluz®) und MAL-PDT (mit Metvix®) bei Patienten mit Niedrig-Risiko-BZK verglichen [77]. Hier zeigte sich die Nichtunterlegenheit von Ameluz® im Vergleich zu Metvix® mit einer Gesamtabheilungsrate von 93 % versus 92 % [77]. Die Rezidivraten nach zwölf Monaten waren in beiden Gruppen mit < 10 % vergleichbar [77]. Basierend auf dieser Studie erfolgte die Zulassungserweiterung von Ameluz® für Niedrig-Risiko-BZK im Jahr 2017 [78].
In zahlreichen weiteren Studien wurde ALA in anderen Formulierungen verwendet [2]. Da in vielen Fällen nichtstandardisierte Rezepturen appliziert wurden, ist eine direkte Vergleichbarkeit nicht möglich [69].
Eine kürzlich durchgeführte Metaanalyse bestätigte die Wirksamkeit der PDT beim Niedrig-Risiko-BZK, wenngleich sie hinsichtlich Abheilungsrate und Rezidivfreiheit der Operation unterlegen ist [70]. Falls nur ein PDT-Zyklus mit zwei Behandlungen angewandt wird, ist auch Imiquimod wirksamer [66, 69, 70]. Allerdings ist die PDT mit einem besseren kosmetischen Ergebnis und mit weniger schweren Nebenwirkungen assoziiert [70]. Studien, welche die Kombinationstherapien mit Laser und nachfolgend PDT beziehungsweise PDT plus Imiquimod untersuchten, erbrachten tendenziell ein besseres Ansprechen beziehungsweise eine geringere Rezidivrate in der Kombinationsgruppe. Die Ergebnisse der meist kleinen Studien waren jedoch oft nicht signifikant, sodass weitere Daten erforderlich sind [70, 79].
Die Tageslicht-PDT spielt beim BZK bei limitierter Datenlage, begrenzter Wirksamkeit sowie fehlender Zulassung keine Rolle [2, 69, 70].
Lokal destruierende Verfahren
Bei kleinen superfiziellen BZK kann als Therapie der 2. Wahl eine Kryochirurgie durchgeführt werden, wenn Kontraindikationen gegen eine Operation oder andere topische Verfahren bestehen [3, 4]. In den Leitlinien wird explizit darauf hingewiesen, dass dies nur für extrafaziale Lokalisationen (Rumpf, Extremitäten) gilt [2-4].
Zur lokalen Destruktion von BZK mittels ablativen (CO2, Er:YAG) und nichtablativen (Farbstofflaser, Nd: YAG) Lasern liegen nur begrenzt Daten vor [2, 80, 81]. In Bezug auf Effektivität und kosmetisches Ergebnis sind die Daten vor allem für den 1064 nm Nd: YAG-Laser bei Niedrig-Risiko-BZK vielversprechend [80, 81].
Zudem wurde auch der kombinierte Einsatz von ablativ fraktionierten Lasern plus MAL-PDT, 5-FU oder Imiquimod (ablative fractional laser [AFL]-assisted drug delivery) bei Niedrig-Risiko-BZK untersucht. Die ersten Ergebnisse sind bei insgesamt limitierter Datenlage für 5-FU vielversprechend [82].
Für kleine Niedrig-Risiko-BZK an Stamm und Extremitäten kann als Therapie der 2. Wahl auch die Methode der Kürettage und Elektrodissektion durchgeführt werden. Ein internationaler Konsens zur optimalen Vorgehensweise fehlt jedoch [2].
Patienten mit einem hohen Rezidivrisiko, bei denen eine Operation nicht sicher möglich oder sinnvoll ist beziehungsweise solche, die eine Operation ablehnen sowie Patienten mit einem metastasierten BZK (mBZK) sollen in einem interdisziplinären Tumorboard besprochen werden, um die Operabilität zu prüfen beziehungsweise die Indikationen zur Strahlen- oder Systemtherapie zu stellen [3, 4] (Abbildung 3).
Strahlentherapie
Indikationen für eine Strahlentherapie sind lfBZK, bei denen eine R0-Resektion aufgrund einer Mitbeteiligung von vital oder funktionell wichtigen Strukturen nicht möglich ist, beziehungsweise Tumoren, deren Resektion aufgrund ihrer Größe und Lokalisation zu einem mutilierenden Ergebnis führen würde [2-4]. Darüber hinaus ist eine Radiatio indiziert, wenn Alter oder Komorbidität des Patienten gegen eine Operation sprechen beziehungsweise diese vom Patienten abgelehnt wird [2-4]. Auch nach einer inkompletten Resektion (R1, R2), bei der sich eine Nachresektion schwierig gestaltet sowie bei perineuralem Wachstum kann eine Radiatio zur Verbesserung der lokalen Tumorkontrolle durchgeführt werden [3, 4]. Es fehlen dazu jedoch prospektiv randomisierte Daten [2–4, 83]. Abhängig von Größe, Dicke, Lokalisation des Tumors und davon, ob es sich um einen Primärtumor beziehungsweise um eine R1- oder R2-Resektion handelt, werden unterschiedliche Bestrahlungsmodalitäten (üblicherweise Elektronen, Photonen, Orthovoltherapie) sowie Bestrahlungsdosen (übliche Gesamtdosen von 45–70 Gray), die fraktioniert oder hypofraktioniert verabreicht werden, gewählt [83]. Dabei sind die Rezidivraten nach Radiatio mit denen von konventioneller Exzision und Mohs-Chirurgie vergleichbar [84].
Die Strahlentherapie wird generell gut vertragen. Kurzfristig kann es zu einer akuten Radiodermatitis kommen, die nach einigen Wochen wieder abheilt [83]. Aufgrund von möglichen langfristigen trophischen Schädigungen der Haut beziehungsweise dem seltenen Risiko von Zweitmalignomen sollte eine Strahlentherapie jedoch älteren Patienten vorbehalten sein [2–4, 83]. Zudem sprechen Erkrankungen mit erhöhter Strahlenempfindlichkeit wie das BZK-Syndrom, Xeroderma pigmentosum oder Lupus erythematodes gegen die Durchführung einer Radiatio [3, 4].
Neu ist das Konzept der epidermalen Radioisotopentherapie mit Rhenium-188 (Rhenium-SCT® [Skin Cancer Therapy]). Bei dieser Form der Brachytherapie, die zur Behandlung von NMSC bis zu einer Tumordicke von 3 mm eingesetzt werden kann, wird Rhenium-188 – ein hochenergetisches, Beta-Strahlen-emittierendes Radioisotop – gebunden an flüssigen Kunststoff auf die zu behandelnde Läsion appliziert. Die Zieldosis von 50 Gray wird nach 45–180 min erreicht [85, 86]. In einer retrospektiven Studie mit 55 Läsionen (davon 32 BZK) konnte in allen Fällen nach einer Sitzung ein komplettes Ansprechen erreicht werden. Drei beziehungsweise zwölf Monate nach Therapie kam es zu keinem Rezidiv [86]. Die Behandlung, welche von Nuklearmedizinern durchgeführt wird, wird als sicher, effektiv, schnell und schmerzlos erachtet [86].
Systemtherapie
Aktuell sind in Europa zur Systemtherapie des BZK nur die Substanzklasse der Hedgehog-Inhibitoren (HHI) zugelassen [87]. Die Zulassung des PD1-Inhibitors Cemiplimab erfolgte vor kurzem in den USA als Zweitlinientherapie nach Vortherapie mit einem HHI beziehungsweise wenn ein HHI nicht in Frage kommt. Eine entsprechende Entscheidung der EMA wird für Mitte 2021 erwartet [88].
Vor der Ära der zielgerichteten molekularen Therapien und Checkpoint-Inhibitoren wurden in der Systemtherapie des metastasierten BZK bevorzugt Platin-haltige Chemotherapien eingesetzt. Die Datenlage dazu beschränkt sich auf Fallberichte ohne langdauerndes Ansprechen [89].
Hedgehog-Inhibitoren
Sowohl Vismodegib als auch Sonidegib sind spezifische Inhibitoren des onkogenen Proteins SMO, das im Hedgehog-Signalweg als Signaltransduktor fungiert [87].
Vismodegib war der erste verfügbare HHI und ist für die Therapie des mBZK und auch des lfBZK zugelassen, wenn eine Operation oder Strahlentherapie nicht in Frage kommen. Patienten mit BZK-Syndrom, die multiple BZK aufweisen, stellen auch eine Therapieindikation für HHI dar [2]. Die zugelassene Dosis beträgt 150 mg 1 x täglich [90]. Die Zulassung basiert auf der ERIVANCE-Studie, die im Langzeit-Follow-up nach 39 Monaten eine Remissionsrate von 49 % für das mBZK und von 60 % für das lfBZK bei einer medianen Ansprechdauer von 15 beziehungsweise 26 Monaten zeigte [91, 92]. Die Resultate der ERIVANCE-Studie wurden in einer weiteren internationalen Multicenterstudie (STEVIE) bestätigt, mit Ansprechraten von 69 % für das lfBZK und 37 % für das mBZK bei einer mittleren Ansprechdauer von 23 beziehungsweise 14 Monaten [92, 93].
Der zweite HHI Sonidegib ist für die Therapie des lfBZK zugelassen, wenn eine Operation oder Bestrahlung nicht in Frage kommen. Die zugelassene Dosierung beträgt 200 mg 1 x täglich [94]. Das Präparat ist seit 2017 in Deutschland und seit 2020 auch in Österreich verfügbar. Die Zulassung beruht auf der BOLT-Studie, die in der endgültigen Analyse nach 42 Monaten Follow-up eine Ansprechrate von 56 % für das lfBZK und 8 % für das mBZK bei einer mittleren Ansprechdauer von 26 beziehungsweise 24 Monaten zeigte [92, 95].
Direkte Vergleichsstudien zwischen den beiden Medikamenten gibt es nicht und in den Zulassungsstudien wurden unterschiedliche Designs verwendet [87, 92]. Die Effektivität von Sonidegib und Vismodegib beim lfBZK sowie ihr Nebenwirkungsprofil werden aber als ähnlich erachtet [87]. Typische Nebenwirkungen wie Muskelkrämpfe, Erhöhung der Kreatinkinase, Geschmacksstörungen, Gewichtsverlust und Haarausfall treten bei einem Großteil der Patienten auf, verlaufen in den meisten Fällen jedoch mild (Grad I und II) [87]. Allerdings wurde bei circa 30 % der Patienten aufgrund der Nebenwirkungen ein Therapieabbruch beobachtet [2, 93, 95]. Für das Nebenwirkungsmanagement werden sowohl kurzfristige Therapiepausen von 2–4 Wochen als auch eine Dosisreduktion (beispielweise durch Einnahme der Tabletten nur jeden zweiten Tag) empfohlen [90, 94, 96-98]. Für Patienten mit multiplen BZK inklusive Patienten mit BZK-Syndrom, die eine längerfristige Therapie benötigen, konnte gezeigt werden, dass im Vergleich zu der kontinuierlichen Therapie die intermittierende Gabe von Vismodegib (alternierend 12 Wochen Therapie und 8 Wochen Pause) zu weniger schweren therapieassoziierten Nebenwirkungen bei gleichzeitig anhaltender Effektivität führte (MIKIE) [99], während eine kontinuierliche Therapie über 36 Monate von nur 17 % der Patienten mit BZK-Syndrom toleriert wurde [100].
In Fallberichten wurde für lfBZK und mBZK, die initial auf HHI ansprachen, im Verlauf jedoch eine sekundäre Resistenz entwickelten, die Wirksamkeit einer Kombinationstherapie von Vismodegib beziehungsweise Sonidegib mit gepulstem Itraconazol, einem Triazol-Antimykotikum, für das auch eine Wirksamkeit als HHI nachgewiesen wurde [101], mit akzeptablem Sicherheitsprofil beschrieben [102, 103].
Die neoadjuvante Gabe von Vismodegib und Sonidegib beim lfBZK, die durch präoperative Schrumpfung des Tumors kleinere Resektionen mit weniger funktionellen und/oder ästhetischen Einbußen ermöglicht, wird aktuell in mehreren Phase-II-Studien (NCT03035188, NCT02667574, NCT03534947) untersucht [68]. Erste Ergebnisse der VISMONEO-Studie zeigten, dass 80 % der Fälle, die zuvor inoperabel waren beziehungsweise bei denen die Operation zu schweren funktionellen oder ästhetischen Beeinträchtigungen geführt hätte, durch die neoadjuvante Therapie wieder operabel wurden. Davon erreichten 49 % der Patienten ein histologisch bestätigtes komplettes Ansprechen [104].
Immuncheckpoint-Inhibitoren
Bei Patienten, die eine primäre oder sekundäre Resistenz auf HHI aufweisen beziehungsweise diese nicht vertragen, werden in den letzten Jahren zunehmend auch Immuncheckpoint-Inhibitoren, die bei Tumoren mit hoher Mutationslast bekanntlich gut ansprechen [105], eingesetzt. Erste Daten über die Wirksamkeit von Cemiplimab, Nivolumab und Pembrolizumab wurden seit 2016 in Form von Fallberichten und Fallserien publiziert [106].
Aktuell wird der PD1-Antikörper Cemiplimab (350 mg intravenös alle 3 Wochen) in einer Phase-II-Studie bei Patienten mit lfBZK oder mBZK, die unter HHI progredient waren oder nach neun Monaten nur eine stabile Tumorerkrankung erreichten beziehungsweise die Therapie nicht tolerierten, untersucht (NCT03132636). Präliminäre Daten für das lfBZK zeigten eine Ansprechrate von 31 %, ein Fortbestehen des Ansprechens nach zwölf Monaten wird auf 85 % geschätzt [107]. Das Sicherheitsprofil war vergleichbar mit dem von anderen PD1-Antikörpern und die PD-L1-Expression hatte keinen Einfluss auf die Effektivität der Therapie [107]. Cemiplimab stellt somit bei Patienten mit lfBZK in der Zweit- oder Drittlinientherapie eine sinnvolle Therapieoption dar [107].
Basierend auf diesen Daten erfolgte im Februar 2021 die FDA-Zulassung für Cemiplimab für Patienten mit lfBZK, die eine Vortherapie mit einem HHI hatten beziehungsweise bei denen ein HHI nicht anwendbar war [108]. Ferner wurde Cemiplimab von der FDA beim mBZK als Zweitlinientherapie zugelassen. In dieser Indikation zeigte Cemiplimab nach Interimsanalyse ein Ansprechen von 21 % [88, 108]. Wie bereits erwähnt, wird eine Entscheidung der EMA in diesem Jahr erwartet [88].
Für Pembrolizumab liegen außerdem positive Daten von einer kleinen Proof-of-Concept-Studie vor [109]. In dieser Studie konnte gezeigt werden, dass eine Kombinationstherapie von Pembrolizumab mit Vismodegib einer Pembrolizumab Monotherapie nicht überlegen war [109].
Weitere Studienergebnisse sind zu erwarten. Derzeit wird eine Phase-II-Studie mit Nivolumab alleine beziehungsweise in Kombination mit Ipilimumab bei Patienten mit nichtresektablen lfBZK beziehungsweise mBZK, die bereits systemische Vortherapien erhielten, (NCT03521830) durchgeführt. Kürzlich gestartet wurde auch eine Phase-II-Studie mit Cemiplimab in Kombination mit gepulstem Sonidegib (NCT04679480) [68]. Zuletzt wurden auch Fallberichte zu Nivolumab beziehungsweise Pembrolizumab als Erstlinientherapie bei lfBZK mit komplettem beziehungsweise partiellem Ansprechen publiziert [110]. Aufgrund möglicher immunvermittelter schwerer Nebenwirkungen bedarf es jedoch weiterer Studien, um belegen zu können, ob PD1-Inhibitoren in der Systemtherapie des fortgeschrittenen BZK als Therapie der ersten Wahl gerechtfertigt sind [110]. Aktuell wird eine Phase-I-Studie mit Pembrolizumab im neoadjuvanten Setting bei lokoregionär fortgeschrittenen, resektablen BZK durchgeführt (NCT04323202) [68].
Nachsorge und Prävention
Aufgrund der Möglichkeit von Lokalrezidiven beziehungsweise dem erhöhten Risiko, ein weiteres BZK beziehungsweise auch kutanes Plattenepithelkarzinom oder Melanom zu entwickeln, werden bei Patienten mit Zustand nach BZK regelmäßige Nachsorgeuntersuchungen empfohlen [2-4]. Die aktuelle deutsche S2k-Leitlinie empfiehlt diesbezüglich ein standardisiertes, risikostratifiziertes Vorgehen (Tabelle 2).
| Isolierte, chirurgisch therapierte BZK sowie niedriges Rezidivrisiko | Multiple BZK, hohes Rezidivrisiko, lfBZK, mBZK, Syndrome |
| ↓ | ↓ |
| Kontrolle nach 6 Monaten (Ausschluss Lokalrezidiv), anschließend 1 x jährliche Nachsorge | Nachsorge alle 3 Monate. Falls nach 2 Jahren kein neues BZK beziehungsweise Rezidiv aufgetreten ist, Kontrolle 1 x jährlich |
Bei der Prävention von Hautkrebs wird die Primärprävention von der Sekundärprävention unterschieden. Während man unter ersterer die Vermeidung einer übermäßigen UV-Exposition versteht, hat die Sekundärprävention das Ziel, Hautkrebs möglichst früh zu erkennen und dessen Fortschreiten zu verhindern. Hier sind insbesondere Hautkrebsscreenings beziehungsweise regelmäßige Selbstinspektionen von Bedeutung [111]. Zudem gibt es eine Empfehlung für die Einnahme von Nicotinamid als Sekundärprävention für Patienten, die bereits ein BZK gehabt haben [3, 4]. Aufgrund der insgesamt komplexen Thematik wird an dieser Stelle an die deutsche S3-Leitlinie Prävention von Hautkrebs verwiesen [111].
Danksagung
Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Interessenkonflikt
M. Seidl-Philipp: Kongressunterstützung von MSD und Sanofi. N. Frischhut: Kongressunterstützung MSD und Lilly. N. Höllweger: Kongressunterstützung von BMS und MSD. M. Schmuth: keine Interessenskonflikte. V. A. Nguyen: Empfang von Honoraren, Beratungsgebühren oder Kongressunterstützungen von BMS, MSD, Roche, Sanofi
Literatur
[CME Questions/Lernerfolgskontrolle]
-
Welche Aussage ist richtig?
-
Der Begriff Basaliom sollte gegenüber dem Begriff BZK bevorzugt verwendet werden, da es sich um einen semimalignen Tumor handelt.
-
Bei circa 50 % aller Hautkrebsfälle handelt es sich um BZK.
-
Eine primäre Manifestation eines BZK an Schleimhäuten, Handflächen oder Fußsohlen ist ungewöhnlich.
-
Basalzellkarzinome können nicht metastasieren.
-
Da BZK in der Regel unkompliziert exzidiert werden können, verursacht deren Behandlung im Gesundheitssystem keine wesentlichen Kosten.
-
-
Welche Aussage ist richtig?
-
Die höchsten Inzidenzraten von BZK werden in Skandinavien berichtet.
-
Für Deutschland wurde für 2020 eine rohe Inzidenz von > 500 pro 100 000 Einwohner vorausgesagt.
-
Patienten mit BZK haben im Vergleich zur Allgemeinbevölkerung eine erhöhte Mortalität.
-
In der Pathogenese des BZK spielt insbesondere die kumulative UV-Exposition eine große Rolle.
-
Beim lokal fortgeschrittenen BZK kann eine R0-Resektion aufgrund der Mitbeteiligung von vital oder funktionell wichtigen Strukturen nicht sicher erzielt werden.
-
-
Welcher Risikofaktor spielt beim BZK keine Rolle?
-
fortgeschrittenes Alter
-
heller Hauttyp
-
Ernährungsgewohnheiten
-
chronische Immunsuppression
-
Genodermatosen wie das BZK-Syndrom oder Xeroderma pigmentosum
-
-
Welche Aussage ist richtig?
-
Genetische Mutationen spielen in der Pathogenese des BZK eine untergeordnete Rolle.
-
Auf molekularer Ebene liegt in den meisten Fällen eine Downregulation des Hedgehog-Signalwegs vor.
-
Gene des Hedgehog-Signalwegs, die in der Pathogenese von BZK involviert sind, sind PTCH1, PTCH2, SMO und SUFU.
-
Die Hedgehog-Inhibitoren Vismodegib und Sonidegib sind spezifische Inhibitoren des onkogenen Proteins PTCH1.
-
Ein Hauptkriterium des BZK-Syndroms ist das Auftreten eines Katarakts vor dem 30. Lebensjahr.
-
-
Welche Aussage ist richtig?
-
Gemäß WHO Klassifikation 2018 werden histologisch vier verschiedene Subtypen (superfiziell, nodulär, sklerodermiform und infiltrativ) unterschieden.
-
In einem BZK wird stets ein histologischer Subtyp nachgewiesen.
-
Bei allen histologischen Unterformen liegen Nester von basaloiden Zellen mit hyperchromatischem Kern und schmalem Zytoplasma in granulomatöser Anordnung vor.
-
In den aktuellen Leitlinien werden BZK nach Rezidivrisiko stratifiziert.
-
Die TNM Klassifikation spielt beim BZK eine wichtige Rolle.
-
-
Bei der Stratifizierung der BZK nach Rezidivrisiko spielt folgender Parameter keine Rolle:
-
Tumorlokalisation
-
horizontaler Tumordurchmesser
-
Alter des Patienten
-
Vorliegen eines Lokalrezidivs
-
Histologischer Subtyp
-
-
Welche Aussage zur Diagnostik von BZK ist richtig?
-
Bei allen BZK, die klinisch beziehungsweise mit nichtinvasiven Methoden eindeutig als BZK identifiziert werden, ist eine histologische Sicherung der Diagnose nicht erforderlich.
-
Die Dermatoskopie von nichtpigmentierten BZK erreicht im Vergleich zu pigmentierten BZK eine höhere Sensitivität und Spezifität.
-
Mittels optischer Kohärenztomographie kann die Tumordicke bis zu 3 mm bestimmt werden.
-
Die konfokale Laserscanmikroskopie wird aufgrund der sehr hohen Auflösung auch als optische Biopsie bezeichnet.
-
Eine weitere Diagnostik mittels Schnittbildgebung wird beim lfBZK nicht empfohlen.
-
-
Welche Aussage ist falsch?
-
Die operative Entfernung von BZK ist die Therapie mit der geringsten Rezidivrate.
-
Die mikroskopisch kontrollierte Chirurgie wird insbesondere bei Hoch-Risiko-BZK, Rezidiv-BZK und bei BZK an kritischen anatomischen Lokalisationen empfohlen.
-
Im Falle einer konventionellen Exzision wird bei Hoch-Risiko-BZK ein Sicherheitsabstand von ≥ 5 mm empfohlen.
-
Im Falle einer R1-Resektion muss unabhängig vom Rezidivrisiko eine Nachresektion durchgeführt werden.
-
BZK, bei denen eine R0 nicht sicher erzielt werden kann (lfBZK), sollen in einem interdisziplinären Tumorboard vorgestellt werden, um die Operabilität zu prüfen.
-
-
Welche Aussage ist richtig?
-
Bei Niedrig-Risiko-BZK besteht in der Leitlinie eine gleichwertige Empfehlung für operative und topische Verfahren.
-
Imiquimod kommt insbesondere bei großen superfiziellen BZK (Durchmesser bis 5 cm) in Niedrig-Risiko-Lokalisationen als Alternative zur Operation in Frage.
-
Die konventionelle photodynamische Therapie (PDT) ist für die Behandlung von superfiziellen und dünnen (Tumordicke < 2 mm) nodulären BZK zugelassen.
-
Bei multiplen superfiziellen BZK wird der Einsatz von Tageslicht-PDT aufgrund der geringeren Schmerzen im Vergleich zur konventionellen PDT empfohlen.
-
Die Kryotherapie ist insbesondere bei dünnen nodulären BZK (Tumordicke < 2 mm) im Kopf-Hals-Bereich eine effektive und schnelle Behandlungsmethode.
-
-
Welche Aussage ist richtig?
-
Die Effektivität von Vismodegib und Sonidegib beim lfBZK sowie deren Nebenwirkungsprofil wird als ähnlich erachtet.
-
Typische Nebenwirkungen der Hedgehog-Inhibitoren (HHI) wie akneiformes Exanthem und Fieber treten bei einem Großteil der Patienten auf.
-
Bei Auftreten von Nebenwirkungen unter HHI-Therapie können intermittierende Therapiepausen aufgrund des möglichen Wirkungsverlustes nicht empfohlen werden.
-
Der PD1-Antikörper Cemiplimab ist den HHI in der Wirkung klar überlegen und wird in den USA als Erstlinientherapie eingesetzt.
-
Patienten, bei denen ein BZK mit einem hohen Rezidivrisiko behandelt wurde, sollen in den ersten beiden Jahren nach Therapie alle sechs Monate nachkontrolliert werden.
-
Liebe Leserinnen und Leser, der Einsendeschluss an die DDA für diese Ausgabe ist der 30. September 2021. Die richtige Lösung zum Thema „Primär kutane T-Zell-Lymphome im Kindes- und Jugendalter“ in Heft 4 (April 2021) ist: (1a, 2c, 3d, 4d, 5e, 6a, 7c, 8a, 9b, 10d).
Bitte verwenden Sie für Ihre Einsendung das aktuelle Formblatt auf der folgenden Seite oder aber geben Sie Ihre Lösung online unter http://jddg.akademie-dda.de ein.