Live-Imaging – Mikroskopieren in Echtzeit
Die Laborseite
Abstract
Zum Forschen gehört, dass die Ergebnisse festgehalten werden, und das kann ganz unterschiedlich aussehen. In der Zellbiologie wurde schon seit der Erfindung des Mikroskops zeichnerisch festgehalten, was man unter die Linse bekam. Heute stehen viele verschiedene Mikroskopiertechniken in den Laboren zur Verfügung, wobei das Live-Imaging sicherlich eine der Interessantesten ist, denn es ermöglicht das Mikroskopieren von Lebewesen in Echtzeit.
Live-Imaging bedeutet, dass das zu mikroskopierende Objekt nicht als einzelnes Bild, sondern als eine Sequenz von Bildern digital aufgezeichnet wird und dabei lebendig ist. Dies ist vor allem für biologische Prozesse interessant, in denen sich in kurzer Zeit viel verändert. Ein Paradebeispiel für einen solchen Prozess ist die Embryonalentwicklung, wo aus einer befruchteten Eizelle (Zygote) ein komplexer Organismus heranreift. Im Folgenden wollen wir uns dies am Beispiel der Embryonalentwicklung der Fruchtfliege Drosophila melanogaster anschauen.
Vom Ei zur Fliege
Nachdem das Ei befruchtet wurde, beginnt die rasante Entwicklung des Embryos. Im Gegensatz zu Säugetieren, ist die Entwicklung der Insektenembryonen durch ein so genanntes Synzytium gekennzeichnet: Die Zellkerne teilen sich zunächst im Zentrum und wandern dann in das kortikale Zytoplasma (Bereich unterhalb der Plasmamembran), ohne dass eine Zytokinese erfolgt. Im kortikalen Zytoplasma teilen sich die Kerne erneut und werden nach 14 Zyklen zusammen mit dem umgebenden Zytoplasma und den Organellen von einer Plasmamembran umhüllt (Zellularisierung). Im Anschluss folgt die Bildung der unterschiedlichen Gewebe und Organe, und nach bereits einem Tag schlüpft die Larve. Sie häutet sich drei Mal, verpuppt sich und die Fliegen schlüpfen nach ca. 10 Tagen.
Warum Live-Imaging?
Wie wir gesehen haben, geht in der Embryogenese der Fliege alles ganz schnell. Um diese dynamischen Prozesse darstellen zu können, macht es Sinn, nicht einzelne Embryonen als Momentaufnahme zu mikroskopieren, sondern einen einzelnen Embryo über einen längeren Zeitraum zu verfolgen. Wie verhalten sich die Zellkerne? Was passiert in der Zellularisierung? Wie sieht die Organbildung aus? Wo sind einzelne Proteine lokalisiert?
Proteine live verfolgen
Mittels moleklularbiologischer Methoden ist es möglich, Proteine mit einem fluoreszierenden „Anhängsel“, einem sogenanten Tag zu versehen (vgl. [1]) und sie in die Fliegen einzubringen. Diese gentechnisch veränderten Fliegen bilden in ihren Zellen nun jenes fluoreszierende Protein, das hell aufleuchtet, wenn es mit Licht einer bestimmten Wellenlänge bestrahlt wird. Mikroskopiert man die Embryonen mit einem Fluoreszenzmikroskop kann man mittels eines verbundenen PCs die Leuchtsignale detektieren. So wird klar, wann das Protein in der Embryogenese gebildet wird und wo es lokalisiert ist. In unserem Beispiel wollen wir Aktinfilamente verfolgen und haben daher das F-Aktin-bindende Protein Utrophin mit einem fluoreszierenden GFP (green fluorescent protein)-Tag versehen (vgl. [2]).
Live-Imaging in der Praxis
Die Fliegen leben im Labor in Röhrchen, die mit Apfelsaft-Hefe-Brei gefüllt sind. Vor dem Live-Imaging-Experiment werden die Fliegen auf Eiablageplatten gesetzt und die Eier mit einem feinen Pinsel aufgesammelt. Die Eier sind von einer Schutzhülle (Chorion) umgeben, die sie vor Austrocknung schützt. Damit das Imaging unter dem Fluoreszenzlicht funktionieren kann, muss diese Schutzhülle mittels Bleichmittel entfernt werden. Die dechorionisierten Embryonen werden dann aufgereiht und unter ein konfokales Laser-Scanningmikroskop gelegt (Weiterführender Link: https://www.spektrum.de/lexikon/physik/konfokalelaserscanning-mikroskopie).
Die Auflösung der Bilder ist dabei so hoch, dass sogar einzelne Strukturen des Zytoskeletts des Embryos live beobachtet werden können (Abbildung 1 zeigt Aktinkappen bestehend aus einzelnen Aktinfilamenten mit einem Durchmesser von ca. 7 µ m). Das Beste: Die Embryonen überleben auch ohne Chorion und entwickeln sich regulär weiter.
Ergebnis
Wir konnten mittels des Aktin-bindenden Utrophin-GFP verfolgen, wie die Aktinfilanmente die einzelnen Zellkerne überziehen und so eine sogenannte Aktinkappe ausbilden. Dies geschieht im Fliegenembryo bereits in jeder der frühen Teilungen vor der Zellularisierung. Wir analysierten hier die Bildung der Aktinkappen des 13. Zyklus im zeitlichen Verlauf (Abbildung 1).
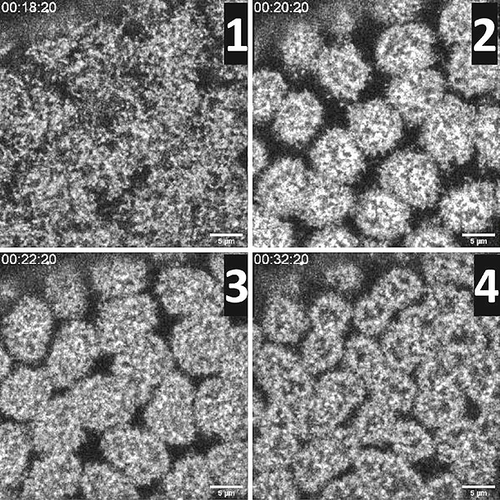
Live-Imaging eines frühen Fliegenembryos. In Zyklus 13 bilden sich Aktinkappen, die aus vielen Aktinfilamenten bestehen und sich über den Zellkernen im Fliegenembryo in den frühen Teilungen vor der Zellularisierung formen. (1) Beginn der Akkumulation von F-Aktin über den Zellkernen im kortikalen Zytoplasma. (2) Nach zwei Minuten maximale Kondensation der Aktinkappe (Durchmesser ca. 7 µm). (3) Weitere zwei Minuten später beginnen die Aktinkappen zu dekondensieren und (4) zwölf Minuten nach der maximalen Kondensation sind die Kappen nicht mehr abgrenzbar.
Das Live-Imaging ermöglicht Einblicke in verborgene Prozesse der Entwicklung der Lebewesen. Kombiniert mit den modernsten Mikroskopen liefert es detailreiche Bilder, die nicht nur in der biologischen Forschung, sondern auch in der medizinischen Forschung eine bedeutende Rolle spielen (z. B. Grundlagenforschung zu verschiedenen Proteinen, die an der Entstehung von Tumoren beteiligt sind und hinsichtlich ihrer Dynamik während des Zellzyklus untersucht werden sollen).




