Cycloadditionen von Diazoalkenen mit P4 und tBuCP: Ein Zugang zu Diazaphospholen
Abstract
Reaktionen von Diazoalkenen mit tert-Butylphosphaalkin (tBuCP) und weißem Phosphor (P4) führen zu neuen Phosphorheterocyclen, 3H-1,2,4-Diazamonophospholen und 1,2,3,4-Diazadiphospholen. Die erhaltenen Verbindungen sind seltene Beispiele für neutrale Heterophosphole. Der Bildungsmechanismus der formalen (3+2)-Cycloadditionsprodukte wurde quantenchemisch berechnet und die elektronischen Strukturen analysiert. Die neuen Phosphole bilden strukturell vielfältige Koordinationsverbindungen mit Übergangsmetallen und Hauptgruppenelementen. Angesichts der wachsenden Anzahl stabiler Diazoalkene bietet diese Arbeit einen unmittelbaren Zugang zu neutralen Aza(di-)phospholen als neue Ligandenklasse.
Die Aktivierung von weißem Phosphor durch Hauptgruppen- und Übergangsmetallverbindungen bietet die Möglichkeit der direkten Darstellung synthetisch nützlicher Synthesebausteine.1 Während die Aktivierung von P4 mit metallhaltigen Kohlenstoffnucleophilen unter Bildung von P4-Butterfly-Intermediaten gut bekannt ist, sind neutrale Kohlenstoffnucleophile weitaus weniger erforscht.2 In grundlegenden Arbeiten zeigten Bertrand und Mitarbeiter, dass die Reaktion stabiler Carbene mit P4 zu Organophosphorspezies mit P1-, P4-, P8- und sogar P12-Fragmenten führt (Schema 1a).3, 4
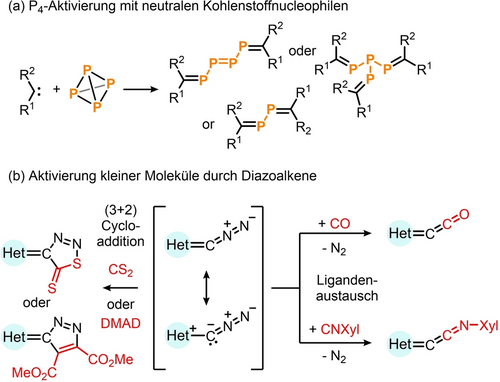
(a) Aktivierung von P4 durch stabile Carbene; (b) (3+2) Cycloadditionen und Ligandenaustausch mit Diazoalkenen. DMAD: Acetylendicarbonsäuredimethylester.
Im Jahr 2021 beschrieben die Gruppen von Hansmann und Severin unabhängig voneinander die ersten bei Raumtemperatur stabilen Diazoalkene (R2C=C=N2).5 Der erste Vertreter basierte dabei auf einem Imidazolgrundkörper, jedoch wurde die Klasse der Diazoalkene bald um 1,2,3-Triazole6 und 2-Pyridine7 erweitert.8 Bei der Aktivierung kleiner Moleküle gehen Diazoalkene Ligandenaustauschreaktionen am exocyclischen Kohlenstoffatom ein: Das N2-Fragment kann durch Kohlenmonoxid6, 9 oder Isocyanide ausgetauscht werden.5a, 6, 10 Mit Dipolarophilen finden hingegen (3+2)-Cycloadditionen statt, wie z. B. mit Kohlenstoffdisulfid oder Dimethylacetylendicarboxylat (Schema 1b).5b, 11 Während dieses Feld der Chemie rasch expandiert, liegen die meisten Anwendungen bisher im Bereich der Übergangsmetallchemie.8, 12 Seit letztem Jahr wird jedoch auch der Einsatz von Diazoalkenen in der Hauptgruppenchemie erforscht, u. a. ihre Kombination mit Germaniumkomplexen,13, 14 ihre Verwendung als Reagenzien für den Zugang zu Tetrelavinylidenen von Si und Ge,15 sowie die Reaktion mit einem Cobalt-Distiben-Komplex.16 In Anbetracht der Fähigkeit von Diazoalkenen, kleine Moleküle wie Kohlenmonoxid zu aktivieren, faszinierten uns mögliche Reaktionen von Phosphorverbindungen wie Phosphaalkinen (RC≡P) und P4.17 In dieser Arbeit beschreiben wir basierend auf diesen Reaktionen die Synthese von Diazadiphospholen und den entsprechenden Diazamonophospholen, die aromatische Eigenschaften aufweisen und als Liganden in der Übergangsmetall- und Hauptgruppenchemie eingesetzt werden können.
Zunächst untersuchten wir die Reaktivität der unterschiedlichen Diazoalkene 1 a–d mit Imidazol-, Triazol- und Pyridin-Heterocyclen gegenüber tBuCP (Schema 2a; die Synthese des neuen Diazoalkens 1 a ist in den Hintergrundinformationen beschrieben). 31P{1H}-NMR-Spektroskopie zeigte in allen Fällen (1 a--d) die quantitative Bildung der bisher nur als Intermediate postulierten 3H-1,2,4-Diazamonophosphole 2–5. Während die isomeren 1H-1,2,4-Diazamonophosphole wie A (Schema 2b) bekannt sind,18, 19 wurde die hier beschriebene Klasse der Heterocyclen 2–5 als flüchtiges Zwischenprodukt in Cycloadditionen postuliert, die typischerweise schnell über eine [1,5]-Verschiebung umlagern.20 Das 31P{1H}-NMR-Spektrum von 2 weist ein scharfes Singulett bei δ=79.6 ppm auf, das im Vergleich mit klassischen Heterophospholen (δ=65–178 ppm) stark hochfeldverschoben ist.21 Die Reaktion läuft vermutlich über eine (3+2)-Cycloaddition ab, bei der selektiv ein einziges Regioisomer gebildet wird.22
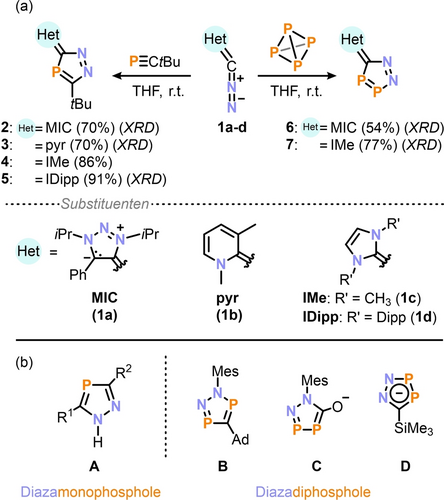
(a) (3+2)-Cycloadditionsreaktionen von Diazoalkenen mit PCtBu und P4unter Bildung von 2–5 bzw. 6 und 7. (b) Auswahl von literaturbekannten 1,2,4-Diazamonophospholen (A) und 1,2,3,4-Diazadiphospholen (B−D); R1≠R2=organischer Rest; MIC: mesoionisches Carben. Mes: 1,3,5-Trimethylphenyl.
Das Diazamonophosphol 2 wird in guter Ausbeute mit 70 % als kristalline, hellgelbe Nadeln erhalten. Die Einkristall-Röntgenstrukturanalyse (XRD) von 2 (Abbildung 1) ergab eine nahezu planare C2N2P-Einheit mit ähnlichen P1−C3- und P1−C4-Bindungslängen (1.754(2) Å bzw. 1.759(6) Å), die zwischen typischen P−C-Einfach- und P=C-Doppelbindungen liegen (∑rPC 1.86 Å vs. 1.69 Å),23 was auf eine π-Delokalisation hindeutet.24 Im Vergleich zum Diazoalken 1 a ist die C2−C3-Bindung zum exocyclischen Kohlenstoff länger (1 a: 1.407(1) Å vs. 2: 1.455(9) Å) und weist somit einen höheren Einfachbindungscharakter auf. Die XRD-Strukturdaten von 3 und 5 finden sich in den Hintergrundinformationen.
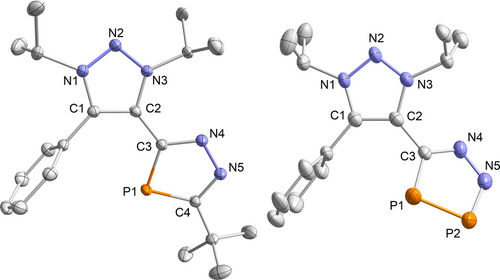
Molekülstrukturen von 2 (links) und 6 (rechts) im Festkörper. Wasserstoffatome und Fehlordnungen sind der Übersichtlichkeit halber nicht gezeigt. Die thermischen Ellipsoide sind mit einer Aufenthaltswahrscheinlichkeit von 50% abgebildet. Ausgewählte Bindungslängen [Å] und Winkel [°]: 2: P1−C4 1.7542(1), P1−C3 1.7596(1), C4−N5 1.3393(1), N4−N5 1.3495(1), N4−C3 1.3478(1), C2−C3 1.4559(2), C3−P1−C4 84.97(5), P1−C4−N5 115.01(8); 6: P1−P2 2.0877(1), P2−N5 1.669(4), P1−C3 1.752(4), N4−N5 1.336(4), N4−C3 1.347(5), C2−C3 1.466(5), C1−N1 1.339(5), C3−P1−P2 88.58(1), P1−P2−N5 97.64(1), P2−N5−N4 117.2(3).
Als nächstes wählten wir P4 als Substrat für den Transfer eines formalen [P≡P] Fragments. 1 a und 1 c reagierten mit hoher Selektivität bei Raumtemperatur zu den seltenen 5H-1,2,3,4-Diazadiphospholen 6 und 7 als orangefarbene Feststoffe in 54 % bzw. 77 % Ausbeute (Schema 2a). Verwandte 1,2,3,5-Diazadiphosphole (B)25 und 1,2,3,4-Diazadiphospholsalze (C, D)26, 27 sind bekannt (Schema 2b), ihre Chemie bleibt jedoch größtenteils unerforscht.28 Das isolierte Diazadiphosphol 6 zeigt zwei charakteristische Dubletts im 31P{1H}-NMR-Spektrum bei δ=364.2 ppm (P2) und δ=217.5 ppm (P1) mit einer großen Kopplungskonstante von 1JPP=444 Hz, die mit GIAO-Berechnungen auf dem M06 L/def2-TZVP//B3PW91-D3(BJ)/def2-TZVP-Theorieniveau, δ=359.0 ppm (P2) und δ=217.0 ppm (P1), gut übereinstimmen. Diese Resonanzen sind mit denen für das anionische D vergleichbar (δ=353 (P2), 231 (P1) ppm). Hingegen ist das Signal des kohlenstoffgebundenen P1-Atoms im Vergleich mit dem verwandten anionischen C deutlich tieffeldig verschoben (δ=97 ppm).26, 27 In der Molekülstruktur von 6 (Abbildung 1) deutet die P1−P2-Bindungslänge von 2.087(7) Å auf eine lokalisierte Doppelbindung hin. Dieser Wert liegt zwischen denen für die Diazadiphosphole des Anions C (2.102(8) Å) und des protonierten D (2.070(6) Å) beschriebenen P−P-Abständen.26, 27 Im Gegensatz zum koplanaren Diazamonophosphol 2 ist die CN2P2-Einheit in 6 relativ zum Triazolium-Grundgerüst um 43° abgewinkelt.
DFT-Rechnungen deuten darauf hin, dass der P4-Aktivierungsschritt durch eine (3+2)-Cycloaddition eingeleitet wird, bei der die C−P-Bindungsbildung – im Gegensatz zum P4-Aktivierungsmechanismus eines ambiphilen Carbens – konzertiert mit der Bildung der N−P-Bindung erfolgt (siehe Abbildung S93). Nach erfolgter Cycloaddition scheint ein intermolekularer P2-Transfer durch ein weiteres Äquivalent des Diazoalkens 1 am wahrscheinlichsten. Interessanterweise konnte eine Korrelation zwischen der Nucleophilie der Diazoalkene und der Fähigkeit zur P4-Aktivierung, festgestellt werden. Während das nucleophilste Diazoalken (1 a)29 schnell und sauber mit P4 reagiert, sind die Reaktionen mit 1 c und 1 d deutlich langsamer. Insbesondere die Reaktion des sterisch anspruchsvolleren 1 d mit P4 führte zu keiner selektiven Produktbildung, sondern zu einem nicht charakterisierbaren Gemisch (siehe SI). Außerdem führte das am wenigsten polarisierte, pyridinbasierte Diazoalken 1 b zu keiner Umsetzung. Diese Ergebnisse sind für weitere Entwicklungen von P4-Aktivierungsstrategien auf der Grundlage eines (3+2)-Cycloadditionsmechanismus von Bedeutung.
Wir führten DFT-Berechnungen für die synthetisierten Diazamonophosphole und -diphosphole (sowie für die Modellverbindungen E und F, Abbildung 2) durch, um den elektronischen Effekt der π-Elektronendonoren der N-Heterocyclen auf die P-Heterocyclen zu klären. Die Kohn–Sham–Orbitale HOMO-1 und das HOMO weisen über den C2N2P-Ring delokalisierte π-Elektronen auf (Abbildung 2).30 Die Energieniveaus der HOMOs steigen in der Reihenfolge E (−8.22 eV) <3 (−6.81 eV) ≈4 (−6.81 eV) <5 (−6.72 eV) <2 (−6.31 eV), was mit der Energie für die LP(π)-Orbitale in den entsprechenden Diazoalkenen korreliert. Ein ähnlicher Trend wurde für die Diazadiphosphole beobachtet [F (−8.58 eV) <7 (−6.96 eV) <6 (−6.60 eV)]. Der hohe Grad an π-Donierung führt zu einer Polarisierung der zentralen C=C-Bindung, was sich in der kleinen Mayer-Bindungsordnung (1.11–1.20) im Vergleich mit den Modellverbindungen E (1.78) und F (1.76) widerspiegelt. Darüber hinaus zeigt die NPA-Ladungsanalyse von 3 eine höhere negative Ladung am N4-Atom (−0.30e) im Vergleich zu N5 (−0.29e). Für 6 ist sie höher am N5-Atom (−0.55e) im Vergleich zum N4-Atom (−0.27e). Bei den NICS- oder NICSzz-Werten war kein Trend mit Bezug auf die unterschiedliche π-Donorfähigkeit von pyr, IPh, IMe und MIC oder die Verdrehung der zentralen C=C-Bindungen zu erkennen, sondern alle untersuchten Phosphole wiesen einen ähnlichen Grad an Aromatizität auf (2–4, NICS(1): −12.3 bis −11.1, NICSzz(1): −29.2 bis −25.9, 6–7, NICS(1): −13.7 bis −11.9, NICSzz(1): −34.0 bis −30.9; für Einzelheiten der NICS-Berechnungen siehe Abbildung S92 und Tabelle S4). Diese Werte sind deutlich höher als die der ursprünglichen Methylen-Azaphosphole E (NICS(1)=−7.8, NICSzz(1)=−13.6) und F (NICS(1)=−9.8, NICSzz(1)=−19.5), was darauf hinweist, dass die π-Donierung der N-Heterocyclen den 6π-aromatischen Charakter der P-Heterocyclen deutlich erhöht.
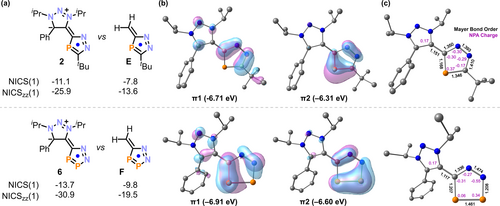
(a) Vergleich der NICS(1)- und NICSzz(1)-Werte der MIC-basierten Diazaphosphole 2 und 6 mit den Methylendiazaphospholen E und F. (b) Ausgewählte Kohn–Sham-Orbitale und Energieniveaus von 2 und 6, berechnet auf dem Theorieniveau M06-2X/def2-TZVP[P,N,C]&def2-SVP[H]//B3PW91-D3(BJ)/def2-TZVP. (c) Mayer Bindungsordnung und NPA Ladung von 2 und 6.
Die Cyclovoltammetrie des freien Liganden 2 zeigt eine irreversible Reduktion (E=−2.60 V) und irreversible Oxidation (E=+0.74 V; vs. Fc/Fc+, Abbildungen S64–66), wodurch ein großes Redox-Fenster für eine stabile Metallkoordination gegeben sein sollte. Die berechneten Ladungen und Grenzmolekülorbitale des neuen Heterocyclus 2 (Abbildung 2) deuten darauf hin, dass sowohl die Stickstoff- als auch die Phosphoratome potentielle Donoren sind. Tatsächlich haben wir kristallographisch drei Komplexe [W(CO)5}2(2)] (8), [W(CO)3{W(CO)5(2)}3] (9) und [W(CO)5(2)] (10) aus der Reaktion von 2 mit [W(CO)5(thf)] (1-3 Äquivalente) identifizieren können, die als Produktgemisch erhalten wurden.24 In diesen Komplexen koordiniert das Phosphol an das Metallzentrum über das Stickstoff- und zusätzlich das Phosphoratom (siehe die Hintergrundinformationen für Details zu 8 und 9). Im Gegensatz dazu führten die Reaktionen von 2 mit [Rh(cod)Cl]2 und AlEt3 selektiv zu 11 und 12, die eine ausschließliche Koordination durch das N4-Atom neben dem Triazoliumyl-Substituenten aufweisen (Schema 3a,b). Beide Komplexe ergeben scharfe 31P{1H}-NMR-Singuletts bei δ=86.7 ppm (11) und δ=90.3 ppm (12), welche im Vergleich zum freien Liganden 2 (δ=79.6 ppm) leicht zu tiefem Feld verschoben sind. Die Linienverbreiterung der iPr-Gruppen und der cod-Signale im 1H-NMR-Spektrum von 11 bei Raumtemperatur deuten auf ein dynamisches Verhalten hin, welches durch eine eingeschränkte Rotation entlang der C2−C3-Achse aufgrund des partiellen Doppelbindungscharakters sowie ein quadratisch planares Rhodiumzentrum erklärt werden kann (Abbildung S27).
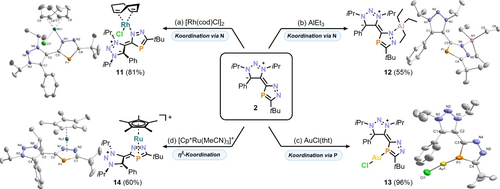
Koordination von Monophosphol 2. Je nach Metall können verschiedene Koordinationsmodi erreicht werden; Reagenzien/Nebenprodukte und Bedingungen: a) +0.5 Äq. [Rh(cod)Cl]2; Toluol, r.t., 6 h; b) +1.0 Äq. AlEt3; THF, −35 °C bis r.t., 2 h; c) +1.0 Äq. [AuCl(tht)]/-tht; Toluol, r.t., 7 h; d) +1.0 Äq. [Cp*Ru(MeCN)3]/- MeCN; THF, 65 °C, 1 d. In allen Fällen sind die entsprechenden Molekülstrukturen im Festkörper dargestellt. Wasserstoffatome, PF6− (14) und Fehlordnungen sind aus Gründen der Übersichtlichkeit nicht dargestellt, und die thermischen Ellipsoide sind mit einer Aufenthaltswahrscheinlichkeit von 50% abgebildet. Ausgewählte Bindungslängen [Å] und -winkel [°]: 11: Rh1−Cl1 2.3827(7), Rh1−N1 2.116(2), Rh1−C56centr. 2.014(2), P1−C4 1.755(3), N1−N2 1.359(3), C2−C3 1.474(4), Cl1−Rh−N1 91.30(6); 12: Al1−N4 1.9926(1), Al1−C5 1.9972(2), P1−C4 1.7608(2), N4−N5 1.3599(2), C2−C3 1.468(2), N1−N2 1. 3217(2), Al1−N4−C3 136.12(1); 13: Au1−P1 2.2232(1), Au1−Cl1 2.2841(9), P1−C3 1.735(3), P1−C4 1.739(4), N4−N5 1.370(5), C2−C3 1.449(5), P1−Au1−Cl1 173.18(5); 14: Ru1−Cp*centr. 1.8189(1), Ru1−C2N2Pcentr. 1.8219(8), P1−C1 1.779(2), N1−N2 1.383(2), C2−C3 1.464(3), N3−N4 1.321(3), N4−N5 1.315(3), C1−P1−C2 85.11(1); cod=1,5-Cyclooctadien, tht=Tetrahydrothiophen, Cp*=η5-C5Me5.
Um eine exklusive Koordination von Phosphor zu erreichen, haben wir 2 mit weicheren Lewis-Säuren umgesetzt. In Übereinstimmung mit dem HSAB-Konzept führte die Addition von [AuCl(tht)] selektiv zum Komplex [AuCl(2)] (13) in 96 % Ausbeute (Schema 3c). Bislang wurde erst ein verwandter P-koordinierter Komplex [W(CO)5(bdap)] (bdap=Bis(1H-1,2,4-diazaphosphol-1-yl)methan) aus einem Gemisch mehrkerniger Komplexe isoliert.31 13 zeigt ein leicht verbreitertes (Δν1/2 = 136 Hz) Singulett im 31P{1H}-NMR-Spektrum bei δ=58.5 ppm, das zu 2 (δ=79.6 ppm) und [W(CO)5(bdap)] (δ=80.7 ppm) hochfeldverschoben ist. Im Festkörper bildet 13 aufgrund der aurophilen Au−Au-Wechselwirkung (3.0705(4) Å) ein Dimer.32
Die bevorzugte Koordination über P- oder N-Donoren wird vermutlich durch das HSAB-Prinzip bestimmt, wenn man davon ausgeht, dass W(CO)5 und AuCl relativ weiche Lewis-Säuren im Vergleich zu [Rh(cod)Cl]2 und AlEt3 sind. Unsere Berechnungen für 2 sagen voraus, dass die beiden Stickstoffatome N4 und N5 ähnliche Ladungen aufweisen (siehe die NPA Ladungen in Abbildung 2 und die NRT-Analyse in Abbildung S94). Daher ist die in 11 und 12 beobachtete Koordination durch N4 gegenüber N5 vermutlich aufgrund der Sterik bevorzugt. Sterische Effekte beeinflussen auch die Konformation des Liganden, wie die Verdrillung der Monophospholeinheit gegenüber dem 1,2,3-Triazolium-Grundgerüst zeigt (56° für 11 und 74° für 12).
Wir untersuchten auch die Reaktivität von 2 mit Vorläufern für Sandwich-Komplexe. Die Zugabe von [Cp*Ru(MeCN)3]PF6 (Cp*=η5-C5Me5) zu 2 in C6D6 ergab eine selektive Reaktion zu dem Ruthenocen-Analogon 14 (Schema 3d). Die spektroskopische Reaktionsverfolgung mittels 31P{1H}-NMR zeigte, dass die Reaktion höchstwahrscheinlich über ein η1-N-koordinierendes Zwischenprodukt abläuft (Abbildung S85). Das postulierte Zwischenprodukt zeigt ein 31P{1H}-NMR-Singulett bei δ=87.7 ppm, das gut mit der chemischen Verschiebung der η1-N koordinierenden Komplexe 11 und 12 (siehe oben) übereinstimmt. Beim Erhitzen der Reaktion (65 °C, 1 d) nimmt dieses Signal ab, und es entsteht ein neues Signal bei δ=−48.9 ppm, das der in 60 % Ausbeute isolierten Verbindung 14 zugeordnet wurde. Nach unserem Wissen wurden bisher nur zwei verwandte Komplexe [Cp*M(3,5-R2C2N2P)] (M=Fe, Ru; R=H, tBu, Ph) beschrieben, die auf den entsprechenden 1H-Diazaphospholid-Anionen basieren.33 Die Strukturanalyse von 14 ergab eine Sandwich-Struktur mit zwei koplanaren (179°) 6π-Liganden in einer ekliptischen Konformation (Abbildung S82).24 Die Koordination führt zu einer Verlängerung der Bindungslängen des C2N2P-Fragments (siehe SI).
Als nächstes konzentrierten wir uns auf das Diazadiphosphol 6, da für diese Heterocyclenklasse bisher noch keine Komplexe bekannt waren. Überraschenderweise führten Versuche der Übergangsmetallkoordination (z. B. mit [Rh(cod)Cl]2, [AuCl(tht)], [Cp*Ru(MeCN)3]PF6) zu nicht verwertbaren Suspensionen, die keine beobachtbaren Signale in den 31P{1H}-NMR-Spektren aufwiesen. Bei Zugabe der Lewis-Säuren BPh3 oder AlEt3 zu einer Lösung von 6 konnten wir jedoch die saubere Bildung der Verbindungen 15 und 16 beobachten (Schema 4).24
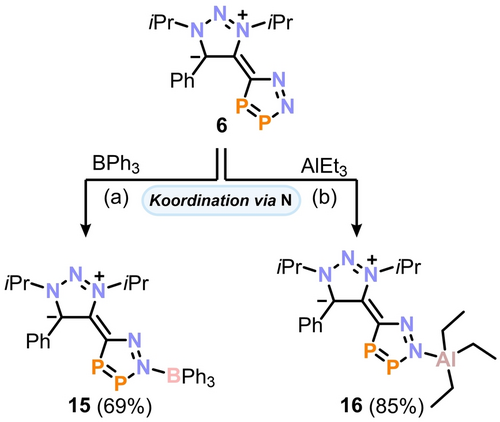
Die Koordination von Lewis-Säuren an Diphosphol 6 führt zu den Verbindungen 15 und 16; Reagenzien und Bedingungen: a) +1.0 Äq. BPh3; THF, −35 °C bis r.t., 1 h; b) +1.0 Äq. AlEt3; Toluol, −35 °C bis r.t., 2 h.
Die Bor-Koordination in 15 zeigt sich in der Beobachtung von zwei Dubletts im 31P{1H}-NMR-Spektrum bei δ=216.4 und 380.9 ppm und einem Singulett im 11B{1H}-NMR bei δ=2.8 ppm. Das 31P{1H}-NMR-Spektrum von 16 zeigt sehr ähnliche Dublettresonanzen bei δ=217.5 und 364.2 ppm. Die Strukturanalyse bestätigte das Vorliegen der CN2P2-Einheit, die jeweils mit dem äußeren Stickstoff N5 an BPh3 (15) bzw. AlEt3 (16) gebunden ist (Abbildung 3).
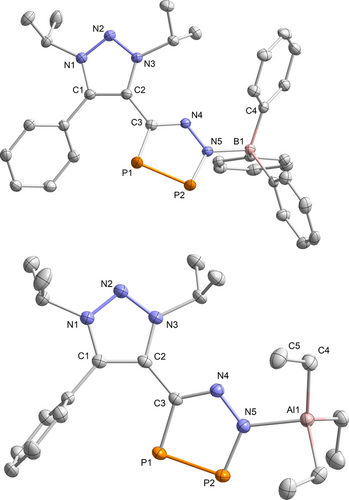
Molekülstrukturen von 15 (oben) und 16 (unten) im Festkörper. Die Wasserstoffatome sind aus Gründen der Übersichtlichkeit nicht gezeigt und die thermischen Ellipsoide sind mit einer Aufenthaltswahrscheinlichkeit von 50% abgebildet. Ausgewählte Bindungslängen [Å] und -winkel [°]: 15: B1−N5 1.6191(2), B1−C4 1.6360(2), P1−P2 2.0809(5), P2−N5 1.6885(1), N4−N5 1.3406(1), B1−N5−N4 115.70(9), C3−P1−P2 89.64(4), P1−P2−N5 95.78(4); 16: Al1−N5 1.9990(1), Al1−C4 1.9923(2), C5−C4 1.538(2), P1−P2 2.0739(6), P2−N5 1.6864(1), N4−N5 1.3395(2), Al1−N5−N4 120.17(9), C3−P1−P2 89.56(5), P1−P2−N5 96.44(5).
Der Wechsel der Koordination von N4 in 12 zu N5 in 15 und 16 steht im Einklang mit unseren quantenchemischen Rechnungen, die eine höhere Elektronendichte des N5-Atoms im Vergleich zum N4-Atom in 6 vorhersagen (siehe Abbildung 2, NPA Ladungen N5 −0.55e vs. N4 −0.27e, und die NRT-Analyse in Abbildung S94). 15 weist eine ähnlich zum 1,2,3-Triazol-Grundgerüst verdrehte Diphospholebene (43°) wie im Ausgangsmaterial 6 (43°) auf, während die Verdrehung in 16 nur 28° beträgt. Die B1−N5-Bindungslänge (1.6191(2) Å) übersteigt die Summe der kovalenten Radien für eine B−N-Einfachbindung (∑rBN 1.56 Å), was eine dative Wechselwirkung anzeigt.23 Im Vergleich dazu ähnelt die Al1−N5-Bindungslänge (1.9990(1) Å) dem berechneten Wert für eine Al−N-Einfachbindung (∑rAlN 1.97 Å), was auf eine vergleichsweise starke Wechselwirkung hindeutet.23
Zusammenfassend fanden wir heraus, dass Diazoalkene tBuCP und P4 aktivieren und dabei neuartige Phosphole bilden. Die Reaktion von Diazoalkenen mit P4 ist ein seltenes Beispiel für die Aktivierung von P4 durch neutrale, nicht metallierte Kohlenstoffverbindungen. Im Gegensatz zur Aktivierung durch Carbene werden die Produkte durch einen (3+2)-Cycloadditionsmechanismus gebildet, der mit der Nucleophilie des Diazoalkens korreliert. Stark polarisierte (mesoionische) Diazoalkene sind bei der P4-Aktivierung effektiver als schwach polarisierte Diazoalkene (z. B. solche mit einem Pyridin-Grundgerüst). Diese Ergebnisse liefern einfache Designkonzepte für zukünftige Aktivierungsverfahren mit weiteren Molekülen. Die resultierenden 3H-1,2,4-Diazamono- und 1,2,3,4-Diazadiphosphole wurden mittels XRD und Heterokern-NMR charakterisiert, und die Analyse ihrer elektronischen Eigenschaften wurde durch DFT-Berechnungen unterstützt. Insbesondere haben wir die Donorfähigkeiten und Koordinationsmodi der neuen Phosphole untersucht. Durch die Verwendung verschiedener Lewis-Säuren konnten wir nachweisen, dass die neuen Heterocyclen verschiedene nutzbare Koordinationsstellen aufweisen (η1-N-, η1-P- und η5-Koordination). Die ersten Bor- und Aluminiumkomplexe von Diazadiphospholen wurden charakterisiert. Diese Ergebnisse sind eine vielversprechende Grundlage für eine umfassendere Erforschung dieser neuen Organophosphorverbindungen im Rahmen der Übergangsmetall- und Hauptgruppenchemie.
Danksagung
Wir danken Gabriele Hierlmeier für initiale Experimente. Die Rechenressourcen wurden von LIDO3, dem Hochleistungsrechenzentrum der TU Dortmund, zur Verfügung gestellt (DFG-Projekt 271512359). Wir danken dem Europäischen Forschungsrat (ERC-StG “CC-CHARGED” 101077332 und ERC-CoG “Functional P4” 772299) und der Alexander von Humboldt-Stiftung (Stipendium für T.K.) für die finanzielle Unterstützung. Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Interessenkonflikt
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.
Open Research
Data Availability Statement
Die Daten, die die Ergebnisse dieser Studie unterstützen, sind in den Hintergrundinformationen zu diesem Artikel verfügbar.




