Das Diterpenoide Substratanalogon 19-nor-GGPP deckt ausgeprägte Methylgruppeneffekte bei Diterpencyclisierungen auf
Abstract
Das Substratanalogon 19-nor-Geranylgeranyldiphosphat (19-nor-GGPP) wurde synthetisiert und mit 20 Diterpensynthasen inkubiert, was in allen Fällen zur Bildung von Diterpenoiden führte. Aus diesen Enzymreaktionen wurden insgesamt 23 verschiedene Verbindungen isoliert und strukturell charakterisiert, wenn möglich einschließlich der experimentellen Bestimmung absoluter Konfigurationen durch einen stereoselektiven Deuterierungsansatz. In mehreren Fällen führte die fehlende 19-Me-Gruppe im Substratanalogon zur Eröffnung völlig neuer Reaktionswege hin zu Verbindungen mit neuartigen Gerüsten. DFT-Rechnungen wurden angewendet, um ein tieferes Verständnis dieser beobachteten Methylgruppeneffekte bei der Diterpenbiosynthese zu gewinnen.
Einleitung
Die Biosynthese von Terpenen ist ein faszinierender Prozess, der trotz der großen Zahl bekannter Verbindungen nur zwei Bausteine erfordert: Dimethylallyldiphosphat (DMAPP) und Isopentenyldiphosphat (IPP).1 Die ausgewogenen Reaktivitäten des Elektrophils DMAPP und des Nukleophils IPP ermöglichen ihre Fusion durch Prenyltransferasen zu Oligoprenyldiphosphaten,1, 2 die anschließend in strukturell komplexe, oft polycyclische und meist chirale Verbindungen umgewandelt werden. Während dieser Reaktion, die durch ein einzelnes Enzym namens Terpensynthase (TS) katalysiert wird, können mehr als die Hälfte der Kohlenstoffe im Substrat Veränderungen in ihren Hybridisierungszuständen und Bindungspartnern erfahren. Die Umwandlungen werden durch Substrationisierung entweder durch die Abstraktion von Diphosphat (Typ-I-TS) oder durch Protonierung (Typ-II-TS) initiiert.3 Die so gebildeten kationischen Spezies können dann eine Kaskadenreaktion mit Ringschlüssen durch Angriff einer olefinischen Doppelbindung am kationischen Zentrum, Wagner–Meerwein-Umlagerungen und intramolekulare Hydrid- oder Protonenverschiebungen eingehen. Die Kaskade kann durch Deprotonierung unter Bildung eines Terpenkohlenwasserstoffs oder durch Addition von Wasser unter Bildung eines Terpenalkohols beendet werden.4
Die kanonischen Terpenvorläufer bestehen aus n Isopreneinheiten: Geranyldiphosphat (GPP, n=2), Farnesyldiphosphat (FPP, n=3), Geranylgeranyldiphosphat (GGPP, n=4), Geranylfarnesyldiphosphat (GFPP, n=5) und Farnesylfarnesyldiphosphat (FFPP, n=6) folgen der allgemeinen Formel H−(C5H8)n−OPP und führen zu Terpenkohlenwasserstoffen C5nH8n oder -alkoholen C5nH8n+2O, die immer aus Vielfachen von fünf Kohlenstoffatomen bestehen.2, 5 Einige Fälle sind bekannt, in denen die Oligoprenyldiphosphat-Vorläufer vor der Terpencyclisierung durch S-Adenoylmethionin (SAM)-abhängige Methyltransferasen methyliert werden (Abbildung 1), darunter das methylierte Monoterpen 2-Methylisoborneol (1),6 die ein- oder sogar zweifach methylierten Sesquiterpene Sodorifen (2)7 und Chlororaphen (3),8 verwandte Verbindungen, die nach griechischen Philosophen benannt sind,9 und das zweifach methylierte Meroterpenoid Longestin (4).10 Aufgrund fehlender Vergleichsstudien sind die biologischen Auswirkungen der zusätzlichen Methylierungen in diesen Verbindungen unbekannt. Flüchtige methylierte Verbindungen wie 1–3 können strukturell einzigartige Signalmoleküle darstellen, die eine chemische Kommunikation durch die produzierenden Organismen ermöglichen, die nicht durch unmethylierte Terpenoidsignale anderer Organismen gestört wird. Auch in der medizinischen Chemie ist es ein bekanntes Phänomen, dass zusätzliche Methylgruppen die Wirksamkeit von Medikamenten deutlich steigern können.11 Bei Terpencyclisierungen sind die Methylverzweigungen in den kanonischen Terpenvorläufern von großer Bedeutung, um die Reaktionskaskade durch eine Reihe tertiärer Kationen zu leiten, und es wurde gezeigt, dass Substratanaloga mit verschobenen Methylierungsmustern neue Reaktionswege eröffnen können, die bei natürlichen Substraten nicht beobachtet werden, was zu Verbindungen mit neuartigen Gerüsten führt.12 In der vorliegenden Studie haben wir uns mit der Frage beschäftigt, ob desmethylierte Oligoprenyldiphosphate durch TSs umgewandelt werden können und ob diese Substratanaloga auch neue Reaktionswege zu Terpenen mit neuartigen Gerüsten eröffnen können. Hierzu wurde das C19-Substratanalogon 19-nor-GGPP synthetisiert und mit 20 Diterpensynthasen verschiedener Organismen umgesetzt. Die Ergebnisse dieser Arbeit werden hier vorgestellt.
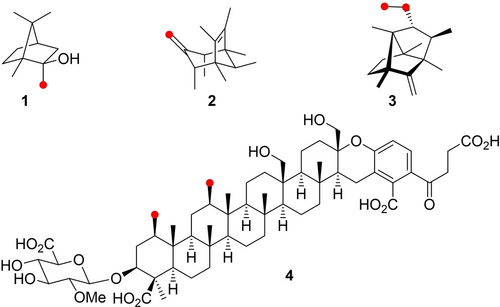
Strukturen methylierter Terpene. Rote Punkte zeigen Kohlenstoffe an, die durch Methylierungen eingeführt wurden.
Ergebnisse und Diskussion
Die Synthese von 19-nor-GGPP wurde in 14 linearen Schritten ausgehend von Geraniol durchgeführt (Schema S1). Anschließend wurde die Verbindung in enzymatischen Testreaktionen mit 20 gereinigten Diterpensynthasen eingesetzt, wobei in allen Fällen die erfolgreiche Umwandlung in Diterpene nachgewiesen wurde (Tabelle S1, Abbildungen S1–S20). Für alle Substrat-Enzym-Kombinationen wurden präparative Inkubationen mit 70 mg 19-nor-GGPP zur Isolierung der Verbindungen und NMR-basierten Strukturaufklärung durchgeführt. Viele der enzymatischen Reaktionen führten jedoch zur Bildung komplexer Kohlenwasserstoffgemische, was die Produktisolierung erschwerte. Trotz intensiver Versuche konnten aus den Rohprodukten, die mit der Spata-13,17-dien-Synthase (SpS) aus Streptomyces xinghaiensis,13 mit der Hydropyren-Synthase (HpS) aus Streptomyces clavuligerus14 und mit der Spiroalbaten-Synthase aus Allokutzneria albata15 erhalten wurden, keine reinen Verbindungen isoliert werden. In allen anderen Fällen war die Isolierung von diterpenoiden Produkten möglich. Die Strukturen der erhaltenen Produkte zeigten häufig interessante Effekte aufgrund der fehlenden Me-Gruppe.
Mehrere Enzyme wandelten 19-nor-GGPP in das entsprechende nor-Derivat des mit demselben Enzym aus GGPP erhaltenen Produkts um. Dazu gehört die Bildung von 19-nor-Micromonocyclol (5 a) durch die Micromonocyclol (5 b)-Synthase (McS) aus Micromonospora marina (Schema 1A, Tabelle S3, Abbildungen S21–S28)16 und von 17-nor-18-Hydroxydolabella-3,7-dien (6 a) durch die 18-Hydroxydolabella-3,7-dien (6 b)-Synthase (HdS) aus Chitinophaga pinensis (Schema 1B, Tabelle S4, Abbildungen S29–S36).17 Mit der Dolasta-1(15),8-dien (8 b)-Synthase aus Colletotrichum gloeosporioides (CgDS)18 wurde nicht nur 20-nor-Dolasta-1(15),8-dien (8 a) erhalten, sondern auch 17-nor-δ-Araneosen (7 a), das entsprechende nor-Derivat von δ-Araneosen (7 b), das ein neutrales Intermediat entlang der Cyclisierungskaskade von GGPP zu 8 b ist (Schema 1C, Tabellen S5 und S6, Abbildungen S37–S52). Ein drittes Produkt, zu dem kein natürliches Analogon von GGPP bekannt ist, wurde als 20-nor-Dolast-8-en-4-ol (9 a) identifiziert (Tabelle S7, Abbildungen S53–S60). Während die Umwandlung von 7 a in 8 a eine Reprotonierung an C6 und eine Cyclisierung zu einem tertiären Kation an C3 erfordert (blaue Pfeile), ist die Bildung von 9 a ungewöhnlich und verläuft mit Reprotonierung an C3, was zu einem sekundären Kation an C6 führt (rote Pfeile).
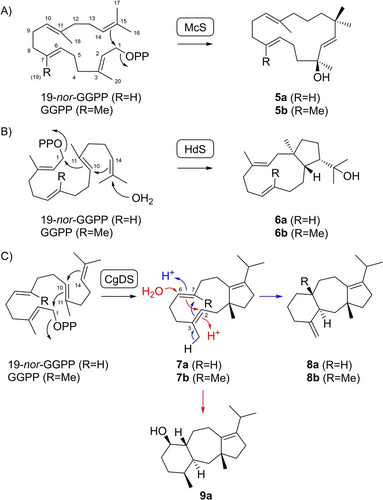
Biosynthese von 19-nor-Diterpenen aus 19-nor-GGPP. Biosynthese von A) 5 a durch McS, B) 6 a durch HdS und C) 7 a, 8 a und 9 a durch CgDS. In diesem Artikel stammt die “a”-Reihe von 19-nor-GGPP, die “b”-Reihe von GGPP.
Isotopenmarkierungsexperimente mit (R)- und (S)-(1-13C,1-2H)-19-nor-GGPP, synthetisiert wie in Schema S2 gezeigt, zeigten einen stereochemischen Verlauf für die Umwandlung in 5 a durch McS unter Beibehaltung des 1-pro-R-Wasserstoffs an C1, während der 1-pro-S-Wasserstoff wahrscheinlich zu C14 wandert, wie zuvor beim nativen Substrat GGPP beobachtet (Abbildung S61).16 Dieselben markierten Substrate wurden verwendet, um die absoluten Konfigurationen von 7 a und 8 a durch stereoselektive Deuterierung zu bestätigen (Abbildungen S62 und S63).19 Diese Methode nutzt die Einführung stereogener Zentren an deuterierten Kohlenstoffatomen, und die absoluten Konfigurationen können dann durch Lösen der relativen Konfiguration in Bezug auf die künstlichen stereogenen Anker bestimmt werden. Darüber hinaus basieren die absoluten Konfigurationen von 5 a, 6 a, 7 a und 8 a auf den gleichen Vorzeichen der optischen Drehung analog zu denen der nativen Enzymprodukte (Tabelle S2),16-18 während die absolute Konfiguration von 9 a basierend auf Überlegungen zur Biosynthese zugewiesen wurde.
In ähnlicher Weise wandelte die Variedien (10 b)-Synthase aus Aspergillus brasiliensis (AbVS)20 19-nor-GGPP in 19-nor-Variedien (10 a) als Hauptprodukt um (Schema 2A, Tabelle S8, Abbildungen S64–S71). Beide Produkte 10 a und 10 b entstehen durch eine anfängliche 1,11-10,14-Cyclisierung zu A1 a bzw. A1 b, gefolgt von einer Umlagerung zu B1 a/B1 b, einer Cyclisierung zu C1 a/C1 b und einer Deprotonierung. Während die Enzymreaktion mit GGPP als Substrat hochselektiv ist, werden mit 19-nor-GGPP zusätzliche Reaktionswege eröffnet. Interessanterweise kann B1 a alternative Cyclisierungen zu D1 a und E1 a, eine 1,2-Hydridverschiebung zu F1 a und eine Deprotonierung zu 19-nor-Variexenen (11 a) eingehen (Tabelle S9, Abbildungen S72–S79), einer Verbindung mit einem neuartigen bzw. für AbVS fremden Gerüst (griechisch ξϵνοσ=fremd).
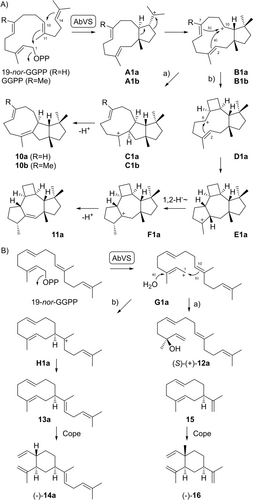
Biosynthese von 10 a, 11 a und 13 a aus 19-nor-GGPP durch AbVS und Cope-Umlagerung von 13 a zu 14 a und von 15 zu 16.
Darüber hinaus kann die Substrationisierung zu G1 a und der Angriff von Wasser zu 19-nor-Geranyllinalool führen (12 a, Tabelle S10, Abbildungen S80–S87). Eine nachgeschaltete 1,10-Cyclisierung zu H1 a und Deprotonierung kann zum Kohlenwasserstoff 13 a führen, der strukturell mit Germacren A verwandt ist. Diese Verbindung erfuhr während der Isolierung eine Cope-Umlagerung zu 19-nor-Prenyl-β-elemen I (14 a) (Tabelle S11, Abbildungen S88–S95), ähnlich der bekannten Umlagerung von Germacren A (15) zu β-Elemen (16).21 Die absolute Konfiguration von 10 a wurde anhand stereoselektiver Deuterierungen mit (R)- und (S)-(1-13C,1-2H)-19-nor-GGPP bestimmt (Abbildung S96). Diese Experimente zeigten auch den spezifischen Verlust des 1-pro-S-Protons bei der terminalen Deprotonierung zu 11 a (Abbildung S97). Darüber hinaus wurden die absoluten Konfigurationen von 10 a, 12 a und 14 a aus einem Vergleich der optischen Drehungen mit denen der strukturell eng verwandten Verbindungen 10 b, (−)-16 und (R)-(−)-Geranyllinalool deutlich (Tabelle S2),20, 22, 23 während die absolute Konfiguration von 11 a auf der Grundlage biosynthetischer Überlegungen bestimmt wurde.
Mit der Chryseodien (17 b)-Synthase aus Chryseobacterium polytrichastri (CpCS)24 wurde 19-nor-GGPP in das entsprechende Desmethylanalogon 19-nor-Chryseodien (17 a) umgewandelt (Schema 3A, Tabelle S12, Abbildungen S98–S105). Diese Verbindung entsteht über das gleiche Intermediat A1 a wie für 19-nor-Variedien (10 a), und in diesem Fall wurde auch das Deprotonierungsprodukt 19-nor-Chryseotrien (18 a) isoliert (Tabelle S13, Abbildungen S106–S113). Das aus dieser enzymatischen Reaktion isolierte Hauptprodukt war jedoch 19-nor-Prenyl-β-elemen II (20 a), das Cope-Umlagerungsprodukt des hypothetischen Kohlenwasserstoffs 19 a (Schema 3B, Tabelle S14, Abbildungen S114–S121). Verbindung 18 a wurde auch mit der Myrothec-15(17)-en-7-ol-Synthase aus Myrothecium gramineum (MgMS) erhalten.25 Die gemeinsame Bildung von 18 a durch CpCS und MgMS kann gut verstanden werden, da beide Enzyme GGPP durch 1,11-10,14-Cyclisierung zum gleichen Intermediat A1 b in ihre natürlichen Produkte umwandeln. Die absoluten Konfigurationen von 17 a und 20 a wurden experimentell auf der Grundlage stereoselektiver Markierungen zugeordnet (Abbildungen S122 und S123) und durch einen Vergleich der optischen Drehungen mit denen von 17 b24 bzw. (−)-1623 weiter gestützt. Die absolute Konfiguration von 18 a wurde aus der gemeinsamen Biosynthese mit 17 a geschlossen.
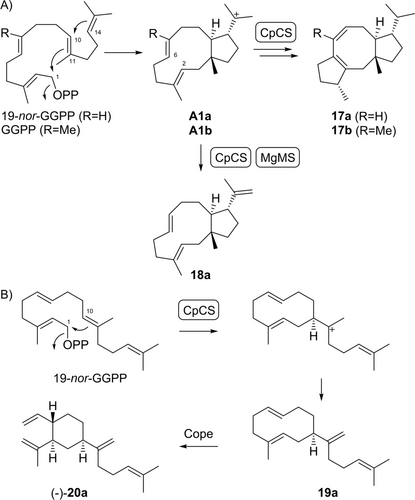
Biosynthese von nor-Diterpenen mit CpCS und MgMS. A) Umwandlung von 19-nor-GGPP in 17 a und 18 a durch CpCS und in 18 a durch MgMS. B) Umwandlung von 19-nor-GGPP in 19 a durch CpCS und Cope-Umlagerung zu 20 a.
Die Cembren A-Synthase aus Allokutzneria albata (CAS)15 wandelte 19-nor-GGPP in 19-nor-Cembren A (21 a), das Desmethylanalogon von Cembren A (21 b), um (Schema 4, Tabelle S15, Abbildungen S124–S131). Bemerkenswert ist, dass die gleiche Verbindung neben 19-nor-Thunbergen (22 a) auch mit der Bonnadiensynthase aus A. albata (BdS)26 aus 19-nor-GGPP erhalten wurde (Tabelle S16, Abbildungen S132–S139). Darüber hinaus wurde 21 a durch eine Enzymreaktion mit der β-Pinacen-Synthase aus Dictyostelium discoideum (DdTPS5)27 isoliert und mittels GC/MS als Nebenverbindung der Spiroalbaten-Synthase aus A. albata (SaS) beobachtet.15 Die Bildung von 21 a erfordert eine 1,14-Cyclisierung von 19-nor-GGPP zu A2 a und Deprotonierung, während 22 a aus dem Intermediat A2 a durch eine 1,3-Hydridverschiebung zu B2 a und Deprotonierung gebildet wird. Basierend auf den für 21 a gemessenen negativen optischen Drehungen, die mit CAS, BdS und DdTPS5 erhalten wurden (Tabelle S2) und einem Vergleich mit Literaturdaten für (R)-21 b ([α]D20=−12, c 0.85, CHCl3),28 wurde den Produkten aller drei Enzyme die absolute Konfiguration von (R)-21 a zugeordnet. Analog ergab die gemessene negative optische Drehung für 22 a im Vergleich zu veröffentlichten Daten für (S)-22 b ([α]D=+100.4, c 0.5, CHCl3),29 dass das BdS-Produkt (R)-22 a ist. Aufgrund der Schwierigkeiten bei der NOESY-basierten Wasserstoffzuordnung für das konformativ flexible Ringsystem von 21 a konnten stereoselektive Deuterierungsexperimente mit (R)- und (S)-(1-13C,1-2H)-19-nor-GGPP keine eindeutigen Einblicke in seine absolute Konfiguration liefern, ließen jedoch den Schluss zu, dass das durch CAS und BdS gebildete 21 a eine hohe Enantiomerenreinheit aufweist (Abbildung S140), während für DdTPS5 die Produktion von 21 a zu gering war, um aus diesen Markierungsexperimenten schlüssige Erkenntnisse zu gewinnen.
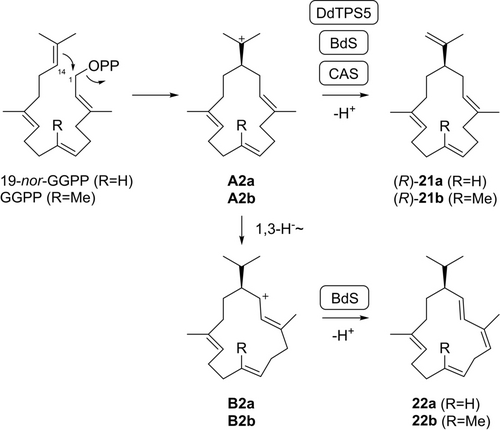
Biosynthese von nor-Diterpenen mit CAS, BdS, DdTPS5 und SaS. Umwandlung von 19-nor-GGPP in (R)-21 a durch CAS, BdS und DdTPS5 (die absolute Konfiguration von 21 a aus SaS ist unbekannt) und in (R)-22 a durch BdS.
Mit der kürzlich charakterisierten Collinodien (23 b)-Synthase aus Streptomyces collinus (ScCotB2),30 einer eng verwandten Homologen der Cyclooctat-9-en-7-ol-Synthase aus Streptomyces melanosporofaciens31 mit verändertem Produktprofil, ergab 19-nor-GGPP den hochgespannten und E,E,E-konfigurierten Kohlenwasserstoff 17-nor-Dolabella-3,7,10-trien (25 a) (Schema 5A, Tabelle S17, Abbildungen S141–S148). Die Biosynthese von 23 b durch ScCotB2 verläuft über eine anfängliche 1,11-10,14-Cyclisierung von GGPP zu A3 b. In einem Seitenzweig der Kationenkaskade führt eine 1,2-Hydridverschiebung durch Deprotonierung zu B3 b, dem Vorläufer von 24 b, wodurch ein Nebenprodukt der ScCotB2-Reaktion entsteht. Mit 19-nor-GGPP wurde kein Desmethyl-Analogon von 23 b erhalten, aber 25 a wurde isoliert, eine Verbindung, die – analog zu 24 b – vermutlich über die Intermediate A3 a und B3 a gebildet wird, gefolgt von einer weiteren 1,2-Hydridverschiebung zu C3 a und Deprotonierung. Die absolute Konfiguration von 25 a wurde basierend auf der Annahme eines gemeinsamen stereochemischen Verlaufs für die Cyclisierungen von 19-nor-GGPP und GGPP durch ScCotB2 zugewiesen und experimentell durch den stereoselektiven Deuterierungsansatz bestätigt (Abbildung S149).
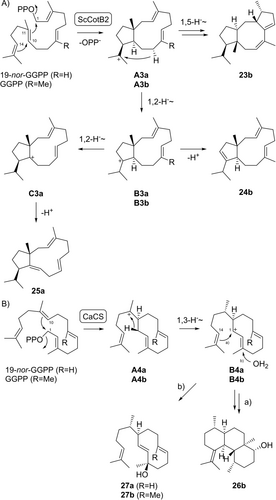
Biosynthese von nor-Diterpenen mit ScCotB2 und CaCS. A) Umwandlung von 19-nor-GGPP in 25 a durch ScCotB2. B) Umwandlung von 19-nor-GGPP in 27 a durch CaCS.
Die Catenul-14-en-6-ol (26 b)-Synthase aus Catenulispora acidiphila (CaCS)32 wandelte 19-nor-GGPP in 19-nor-Obscuronatin (27 a) um (Schema 5B, Tabelle S18, Abbildungen S150–S157), das Desmethyl-Analogon der bekannten Verbindung Obscuronatin (27 b) aus Xenia obscuronata33 und einer Diterpen-Synthase aus Streptomyces avermitilis.34 Die Biosynthese von 26 b beginnt mit einer 1,10-Cyclisierung von GGPP zu A4 b und einer 1,3-Hydridverschiebung zu B4 b, gefolgt von einer 1,14-Cyclisierung entlang der nachgeschalteten Kaskade. Bei der Biosynthese von 27 a können analoge Schritte zum Intermediat B4 a führen, das schließlich mit Wasser abgefangen wird. Die absolute Konfiguration von 27 a wurde basierend auf biosynthetischen Überlegungen zugewiesen, wobei davon ausgegangen wurde, dass das Zwischenprodukt A4 a die gleiche absolute Konfiguration wie A4 b haben sollte, das aus GGPP entsteht. Inkubationsexperimente mit (R)- und (S)-(1-13C,1-2H)-19-nor-GGPP zeigten die spezifische Wanderung des 1-pro-S-Wasserstoffs bei der 1,3-Hydridverschiebung zu B4 a (Abbildung S158). Dies ist der gleiche stereochemische Verlauf wie für die 1,3-Hydridverschiebung in der Biosynthese von 26 b,32 was die analogen absoluten Konfigurationen von 26 b und 27 a weiter unterstützt.
Die Cattleyen-(28 b)-Synthase aus Streptomyces cattleya (CyS)35 führte mit 19-nor-GGPP nicht nur zum Desmethylanalogon 19-nor-Cattleyen A (28 a), sondern auch zu dessen Regioisomer 19-nor-Cattleyen B (29 a) (Schema 6A, Tabellen S19 und S20, Abbildungen S159–S174). Beide Verbindungen können durch anfängliche 1,11-10,14-Cyclisierung zu A1 a und anschließende analoge Schritte zu den ursprünglich mit experimenteller Unterstützung für 28 b vorgeschlagenen Schritten35 zu B5 a gebildet werden. Während die Stereochemie an C2 des nativen Intermediates B5 b nicht mit Sicherheit aus der Struktur von 28 b abgeleitet werden kann, deutet die Bildung von 29 a auf eine zentrale cis-Ringverknüpfung in B5 a und B5 b hin. Dieser Befund steht im Einklang mit der Isolierung von 30 b aus der A190G-Variante von CyS.36 Basierend auf einem Vergleich der optischen Drehungen stimmt die absolute Konfiguration von 28 a mit der von 28 b überein (Tabelle S2). Die Doppelbindungsverschiebung in 29 a führt zu einem Wechsel des Vorzeichens der optischen Drehung, es kann jedoch vernünftigerweise von einer gemeinsamen absoluten Konfiguration mit 28 a/28 b ausgegangen werden. Eine Bestätigung dieser Zuordnungen wurde durch stereoselektive Deuterierungsexperimente erhalten (Abbildungen S175 und S176).
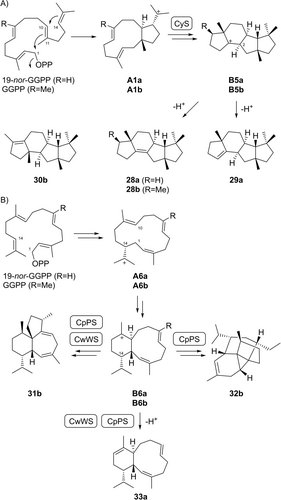
Biosynthese von nor-Diterpenen mit CyS, CwWS und CpPS. A) Umwandlung von 19-nor-GGPP in 28 a und 29 a durch CyS. B) Umwandlung von GGPP in die nativen Produkte 31 b und 32 b und von 19-nor-GGPP in 33 a durch CwWS und CpPS.
Die Wanjudien (31 b)-Synthase aus Chryseobacterium wanjuense (CwWS)24 wandelt GGPP in einer mehrstufigen kationischen Kaskade über die Zwischenstufen A6 b und B6 b in 31 b um (Schema 6B). Ein eng verwandtes Enzym ist die Multiprodukt-Polytrichastren-Synthase aus Chryseobacterium polytrichastri (CpPS),37 die Polytrichastren A (32 b) als Haupt- und 31 b als Nebenprodukt erzeugt. Gemäß einem experimentell und rechnerisch unterstützten Cyclisierungsmechanismus wird Verbindung 32 b auch über A6 b und B6 b gebildet. Beide Enzyme wandelten 19-nor-GGPP durch Deprotonierung von B6 a in 19-nor-Prewanjudien (33 a) um (Tabelle S21, Abbildungen S177–S184). Die absolute Konfiguration von 33 a wurde basierend auf biosynthetischen Überlegungen bestimmt.
Die Spinodiensynthase aus Saccharopolyspora spinosa (SoS)38 produziert den tricyclischen Kohlenwasserstoff Spinodien A (35 b) als Hauptprodukt aus GGPP (Schema 7A). Diese Verbindung wird über das neutrale Intermediat Dolabella-2,7,18-trien (34 b) gebildet, das auch als Nebenprodukt von SoS isoliert werden kann. Seine Reprotonierung an C2 induziert eine 1,6-Cyclisierung zu A7 b mit Bildung eines Kations an C7, gefolgt von nachgeschalteten Schritten über B7 b zu 35 b. Mit 19-nor-GGPP wird die analoge Bildung von 17-nor-Dolabella-2,7,18-trien (34 a) beobachtet (Schema 7B, Tabelle S22, Abbildungen S185–S192). Anstelle seiner weiteren Reaktion über die Intermediate A7 a und B7 a zu einem Desmethylanalogon von 35 b führt eine Reprotonierung an C6 zu einer 1,7-Cyclisierung zu C7 a, gefolgt von einer Deprotonierung zu Spinoxenen (36 a) (Tabelle S23, Abbildungen S193–S200), einer Verbindung mit neuartigem Skelett. Die unterschiedliche Reaktivität von 34 a im Vergleich zu 34 b kann durch die relative Stabilität der Kationen A7 a und C7 a erklärt werden: DFT-Berechnungen ergaben, dass das Kation C7 a eine um 6.9 kcal/mol niedrigere Energie als A7 a aufweist. Das Kation an C2 von C7 a (blauer Pfeil) wird durch C−C-Hyperkonjugation mit der benachbarten C1−C11-Bindung stabilisiert, was zu einer kationischen Ladung am tertiären C11 führt (roter Pfeil), während das Kation an C7 von A7 a (blauer Pfeil) eine C−C-Hyperkonjugation erfährt, die zu einer kationischen Ladung am primären C5 führt (roter Pfeil). Die absoluten Konfigurationen von 34 a und 36 a wurden basierend auf biosynthetischen Überlegungen und auf der gemeinsamen positiven optischen Drehung für 34 a und 34 b zugeordnet (Tabelle S2).
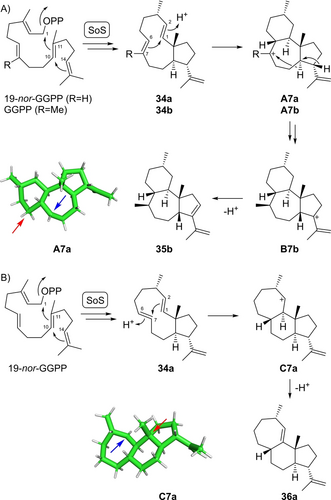
Biosynthese von nor-Diterpenen mit SoS. A) Umwandlung von GGPP über Intermediat 34 b in Spinodien A (35 b), B) Umwandlung von 19-nor-GGPP über Intermediat 34 a in Spinoxenen (36 a) durch SoS. Die grünen Strukturen in Stabdarstellungen wurden mit der Methode mPW1PW91/6-311+G(d,p)//B97D3/6-31 g(d,p) (298 K) berechnet. Blaue Pfeile zeigen auf kationische Zentren, rote Pfeile zeigen auf C−C-Bindungen, die die kationischen Zentren durch Hyperkonjugation stabilisieren, was zu kationischen Ladungen am primären C5 von A7 a und am tertiären C11 von C7 a führt.
Die Spiroviolen (39 b)-Synthase aus Streptomyces violens (SvS)19 und die bakterielle Terpensynthase für Phomopsen und Allokutzneren aus Allukutzneria albata (PmS)26 weisen eine Aminosäuresequenzidentität von 49 % auf und sind weiterhin basierend auf einer phylogenetischen Analyse26 eng verwandt. Auch die ersten Schritte der Cyclisierungskaskaden zu den Produkten sind identisch, die Kaskaden weichen jedoch zu einem späteren Zeitpunkt ab, um Diterpene mit unterschiedlichen Grundgerüsten zu produzieren. Während SvS 19-nor-GGPP in Xenoviolen (37 a) umwandelte, ein Diterpenoid mit einem neuartigen Gerüst, ergab PmS dessen Regioisomer Xenokutzneren (38 a); beide Verbindungen entstehen aus demselben Vorläuferkation J8 a (Schema 8, Tabellen S24 und S25, Abbildungen S201–S216). Darüber hinaus ergab PmS 18 a, die gleiche Verbindung wie mit CpCS und MgMS. Die absolute Konfiguration von 38 a wurde experimentell durch die stereoselektive Deuterierungsmethode unter Verwendung von (R)- und (S)-(1-13C,1-2H)-19-nor-GGPP bestimmt (Abbildung S217). Diese Methode schlägt für 37 a fehl, das durch eine terminale Deprotonierung von C1 mit spezifischem Verlust des 1-pro-S-Wasserstoffs gebildet wird (Abbildung S218), aber analoge absolute Konfigurationen können für 37 a und 38 a vernünftigerweise angenommen werden.
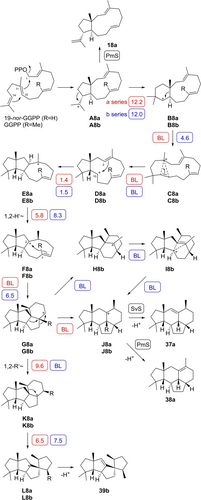
Biosynthese von nor-Diterpenen mit SvS und PmS. Die Zahlen in den Kästchen sind berechnete Gibbs-Reaktionsbarrieren (mPW1PW91/6-311+G(d,p)//B97D3/6-31 g(d,p), 298 K), dargestellt in rot für die Reaktionen der “a”-Reihe (R=H) und in blau für die Reaktionen der “b”-Reihe (R=Me). BL=barrierelose Reaktion.
Frühere DFT-Rechnungen (M062x/6-31+G**) für die Cyclisierungskaskade zu 39 b ergaben eine Umlagerung von A8 b, das sekundäre Kation B8 b wurde jedoch nicht als Äquilibriumstruktur gefunden.39 Mit einer anderen Berechnungsmethode einschließlich Dispersionskorrektur (mPW1PW91/6-311+G(d,p)//B97D3/6-31 g(d,p))40 konnte B8 b jedoch lokalisiert werden und wird mit einer Reaktionsbarriere von 12 kcal/mol aus A8 b gebildet (die Ergebnisse der Rechnungen sind in Schema 8, Tabellen S26 und S27 sowie Abbildungen S219 und S220 zusammengefasst). Auch in ähnlichen Rechnungen für Variedien wurde unter Berücksichtigung von Dispersionseffekten ein Konformer von B8 b erhalten.41 Die nachgeschalteten Schritte über C8 b und D8 b zu E8 b sind den in früheren Berechnungen beschriebenen sehr ähnlich.39, 41 Eine 1,2-Hydridverschiebung zu F8 b und eine 2,7-Cyclisierung führen zum sekundären Kation G8 b. Eine barrierefreie Migration der 1,2-Me-Gruppe zu K8 b, eine Wagner–Meerwein-Umlagerung zu L8 b und eine Deprotonierung führen zu 39 b.
Für die Cyclisierung von 19-nor-GGPP wurde eine analoge Schrittfolge von A8 a zu L8 a rechnerisch verifiziert. Hierbei sind die Schritte von B8 a zu C8 a und von F8 a zu G8 a barrierelose Prozesse, während sie mit niedrigen Reaktionsbarrieren für das native Substrat verbunden sind. Diese Unterschiede sind wahrscheinlich auf sterische Effekte, insbesondere sterische Hinderung zwischen den Me-Gruppen in der “b”-Reihe, zurückzuführen. Die Gleichgewichtsstrukturen der sekundären Kationen G8 a und G8 b zeigen deutliche Konformationsunterschiede (Abbildung 2). Während G8 a durch Hyperkonjugation mit der benachbarten C7−C8-Bindung stabilisiert wird, zeigt G8 b eine Hyperkonjugation mit C7−Me19, was die barrierelose Me-Gruppenwanderung zu K8 b erklärt. In G8 a ist die analoge 1,2-Hydridwanderung zu K8 a nicht bevorzugt und weist eine Reaktionsbarriere von 9.6 kcal/mol auf, da die C−H-Bindung des wandernden Wasserstoffs nahezu orthogonal zum leeren p-Orbital ausgerichtet ist. Stattdessen ist die C7−C8-Bindung gut auf das leere p-Orbital ausgerichtet, sodass eine barrierefreie Wagner–Meerwein-Umlagerung – mit zwei verschobenen C−C-Bindungen – direkt zu J8 a führt. Die Berechnungen zeigten auch einen leicht gangbaren Weg von G8 b über die Ringerweiterung zu H8 b und die weitere Umlagerung über I8 b zu J8 b. Der Grund, warum dieser Weg für die Umwandlung von GGPP praktisch irrelevant ist, ist derzeit unklar, es kann jedoch spekuliert werden, dass Enzym-Substrat-Wechselwirkungen die selektive Umwandlung in 39 b steuern. Zusammengenommen fungiert G8 als Verzweigungspunkt, der entweder von 19-nor-GGPP zu 37 a und 38 a oder von GGPP zu 39 b führt.
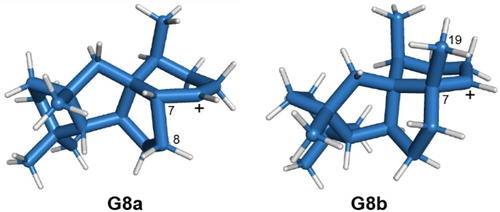
Berechnete Äquilibriumstrukturen der Intermediate G8 a und G8 b (mPW1PW91/6-311+G(d,p)//B97D3/6-31 g(d,p), 298 K).
Zusammenfassung
In dieser Studie wurde das GGPP-Analogon 19-nor-GGPP mit einer fehlenden Me-Gruppe als Substrat mit 20 zuvor charakterisierten Diterpensynthasen getestet, was zu einer erfolgreichen Umwandlung mit allen getesteten Enzymen führte. Aus den oft komplexen Produktgemischen wurden durch Inkubationen im präparativen Maßstab insgesamt 23 Verbindungen isoliert. Angesichts der strukturellen Komplexität der Enzymprodukte waren die erhaltenen Ausbeuten im Allgemeinen zufriedenstellend, obwohl die isolierten Ausbeuten normalerweise niedriger waren als mit GGPP (eine vergleichende Zusammenfassung findet sich in Tabelle S28). In einzelnen Fällen waren die isolierten Ausbeuten sogar denen von GGPP ähnlich, z. B. Mit CpCS wurde eine Gesamtausbeute von 10 % an drei Verbindungen (17 a, 18 a und 20 a) erhalten. Dieses Ergebnis zeigt auch, dass die Produktselektivität nicht so gut ist wie beim natürlichen Substrat GGPP. Beide Aspekte, die meist geringeren Ausbeuten und geringeren Selektivitäten, deuten auf eine evolutionäre Anpassung der Enzyme an ihr natürliches Substrat GGPP hin. Dennoch wird 19-nor-GGPP effizient umgewandelt und der in dieser Studie dargestellte enzymatische Ansatz zur Herstellung der Diterpenoide ist von praktischem Interesse.
Einige der isolierten Verbindungen stellen die 19-nor-Analoga der natürlichen, von GGPP abgeleiteten Enzymprodukte dar. In anderen Fällen wurden neue Reaktionswege eröffnet, die zur Bildung von Diterpenoiden mit neuartigen Gerüsten führten. Dieser überraschende Befund wurde durch DFT-Rechnungen mit der Methode mPW1PW91/6-311+G(d,p)//B97D3/6-31 g(d,p)42 einschließlich Grimmes empirischer D3-Dispersionskorrektur40 genauer untersucht. Diese Methode erwies sich zuvor als sehr zuverlässig für die Untersuchung Cyclisierungs- und Umlagerungsreaktionen von Carbokationen24, 43-45 und wurde in der vorliegenden Studie in Verbindung mit dem CREST-Programm für Konformationsanalysen angewendet.46 Die erhaltenen Computerdaten zeigten, dass die fehlende Me-Gruppe in 19-nor-GGPP tatsächlich die Konformationsstabilität wichtiger kationischer Zwischenprodukte entlang der Terpen-Cyclisierungskaskaden wesentlich beeinflussen kann. Die Hyperkonjugation des leeren p-Orbitals mit dem σ-Orbital einer benachbarten C−C-Bindung spielt häufig eine wichtige Rolle bei der Stabilisierung kationischer Intermediate, und wenn das σ-Orbital der C7−Me19-Bindung direkt an der Kationenstabilisierung auf dem Weg zu einem regulären Diterpen beteiligt ist, kann das Entfernen von Me19 zu einer anderen Konformation des entsprechenden Intermediates führen, um eine Stabilisierung durch Hyperkonjugation mit dem σ-Orbital einer anderen benachbarten C−C-Bindung zu erreichen, wodurch ein anderer Reaktionsweg für nachgeschaltete Cyclisierungsereignisse eröffnet wird.
Eine interessante Frage für die zukünftige Forschung betrifft die Auswirkung der Entfernung anderer Me-Gruppen als Me19 aus GGPP. Die Entfernung von Me20 wird wahrscheinlich einen starken Einfluss auf die Reaktivität des Allyldiphosphats in initialen Cyclisierungsschritten haben, und auch die Entfernung von Me16 oder Me17 kann starke Auswirkungen haben, da diese Me-Gruppen in vielen Cyclisierungskaskaden ein Kation an C15 stabilisieren, während die Entfernung von Me18 möglicherweise der beste Kandidat für vielversprechende Ergebnisse ist. Wir werden in weiteren Arbeiten untersuchen, ob diese oder andere geringfügige strukturelle Modifikationen der natürlichen Substrate ähnlich dramatische Folgen haben können wie die in dieser Studie beobachteten Methylgruppeneffekte.
Danksagung
Diese Arbeit wurde von der Deutschen Forschungsgemeinschaft (DFG) gefördert – Projektnummer 513548540. Wir danken dem Rechenzentrum der Universität zu Köln (RRZK) für die Bereitstellung von CPU-Zeit auf dem von der DFG geförderten Supercomputer CHEOPS. Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Interessenkonflikt
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.
Open Research
Data Availability Statement
Die Daten, die die Ergebnisse dieser Studie unterstützen, sind in den Hintergrundinformationen zu diesem Artikel verfügbar.




