Von lokalen kovalenten Bindungen zu langreichweitigen elektrischen Wechselwirkungen der Protonenhydratation
Abstract
Scheinbar einfache und doch überraschend schwierig ist die Untersuchung überschüssiger Protonen in Wasser, die ein komplexes Quantenobjekt mit starken Wechselwirkungen zum ausgedehnten und sich dynamischen ändernden Wasserstoffbrücken-Netzwerk der Flüssigkeit darstellen. Die auftretende Protonenhydratation spielt eine entscheidende Rolle im Energietransport von Brennstoffzellen und bei der Signalübertragung in Transmembranproteinen. Während Geometrie und Stöchiometrie bereits umfangreich in Experimenten und in der Theorie adressiert worden sind, ist die elektronische Struktur dieser spezifischen hydratisierten Protonenkomplexe bisher Verborgenen geblieben. In dieser Studie zeigen wir, Schicht für Schicht, wie der Einsatz neuer Flachstrahltechnologie für akkurate röntgenspektroskopische Messungen in Kombination mit Infrarot-Spektralanalyse sowie Berechnungen es uns ermöglicht, orbitalspezifische spektrale Signale zu finden, die es erlauben zwei Haupteffekte in der elektronsichen Struktur zu unterscheiden: Lokale Orbitalwechselwirkungen bestimmen kovalente Bindungen zwischen dem Proton und den benachbarten Wassermolekülen, während Verschiebungen der Orbitalenergien ein Maß für die Stärke des langreichweitigen elektrischen Feldes des Protons sind.
Einleitung
Protonentransport in wässriger Umgebung, allgegenwärtig in der Chemie und Biologie, involviert einzelne Wassermoleküle mit unterschiedlichen entscheidenden Rollen, wie es bereits für diverse Fälle wie den von Grotthuss-Mechanismus,1 Säure-Base-Neutralisierungsreaktionen,2 sowie Protonentransport in Wasserstoffzellen3 und Transmembranproteinen (die den Protonegradienten über biologische Membranen kontrollieren)4 gezeigt wurde. Zahlreiche experimentelle5 and theoretische Studien1, 6a-6e haben überzeugende Hinweise für strukturell wohldefinierte hydratisierte Protonenkomplexe mit spezifischen Stöchiometrien geliefert, die nach jetzigem Verständnis in unterscheidbaren Schritten des Protonentransports auftreten.
Konzeptionell ist die einfachste und kleinste Konfiguration eines wässrigen Protons das Oxonium-Ion, H3O+, mit seiner tripyramidalen Anordnung der OH-Bindungen und eines Elektronenpaares mit Ladungsmangel. H3O+ ist die zentrale Einheit des Eigen-Kations, H3O+(H2O)3,7 in dem die OH-Gruppen mittelstarke Wasserstoffbrückenbindungen zu den drei nächsten Wassermolekülen ausbilden, wobei der durchschnittliche O⋅⋅⋅O-Abstand bei 2.5–2.6 Å liegt.8 Alternativ kann ein Proton von zwei Wassermolkülen in der Form eines Zundel-Kations, H5O2+,9 geteilt werden. Für diese Konfiguration wurde über eine superstarke Wasserstoffbrückenbindung berichtet (mit einem O⋅⋅⋅H+⋅⋅⋅O-Abstand von 2.4 Å8, 10 zwischen den Sauerstoffatomen), mit schwächeren Wasserstoffbrückenbindungen zur ersten Solvatationshülle (O⋅⋅⋅O-Abstände von ≈2.7 Å, also näher an den O⋅⋅⋅O-Abständen von 2.8 Å im Inneren flüssigen Wassers). Während die Längenverteilungen von Wasserstoffbrückenbindungen und der Einfluss von Fluktuationen der Solvatationshülle auf ultrakurzen Zeitskalen bereits veröffentlicht wurden,5d, 5f, 5h, 5i, 11 ist wenig über die elektronische Struktur des hydratisierten Protons in Lösung bekannt, da geeignete experimentelle Sonden erst kürzlich verfügbar geworden sind. Röntgenabsorptionsspektroskopie (engl. XAS) im weichen Röntgenbereich ist ein mächtiges Werkzeug12 zur Verfolgung elektronischer Struktur mit einer atomar lokalen Perspektive und auf dem Niveau von Orbitalen durch Anregungen der 1s-Innerschalenelektronen des Sauerstoffs in die niedrigsten unbesetzten Molekülorbitale (engl. LUMOs). Während die höchsten besetzten Molekülorbitale (engl. HOMOs) offensichtlich für chemische Bindungen verantwortlich sind (wie durch entsprechende Wellenfunktionen beschrieben), sind die LUMOs nicht nur die anti-bindenden Partner der jeweiligen HOMOs, sie sind zudem stärker polarisierbar und reagieren dadurch empfindlicher auf Änderungen, die von Wechselwirkungen mit den nächsten Nachbarn verursacht werden. So wurde zum Beispiel der Einfluss von Wasserstoffverbrückung auf die elektronische Struktur ausgiebig mit XAS an der Sauerstoff-K-Kante von Wasser,13 Alkoholen and gelösten Stoffen14 untersucht. Hier berichten wir über unsere XAS-Messungen an hydratisierten Protonenkomplexen in Acetonitril-Lösung. Wir zeigen, dass wir mit diesem Ansatz die Sauerstoff-K-Kante des hydratisierten Protonenkomplexes ohne nennenswerte Beiträge des Lösungsmittels vollständig erfassen können. Im Gegensatz dazu sind die wesentlichen Spektralbereiche in sauerstoffhaltigen Lösungsmitteln undurchsichtig und somit unzugänglich. Unter Hinzunahme von FTIR-Messungen liefern wir Interpretationsbelege der Röntgenabsorptionsspektren für praktisch alle Wassermoleküle, die am hydratisierten Protonenkomplex teilnehmen, wobei die Größe des hydratisierten Protonenkomplexes durch das Verhältnis von Säure zu Wasser bestimmt wird. Eine detaillierte Charakterisierung der möglichen Stöchometrien (Speziierung) bei Einsatz starker Mineralsäuren wird im Folgenden angegeben, und im Zusammenspiel mit Ab-initio-Molekulardynamik-Simulationen (AIMD-Simulationen) zeigen wir, welche möglichen strukturellen Hierachien im hydratisierten Protonenkomplex auftreten. Quantenchemische Rechnungen der XAS-Beiträge einzelner Wassermoleküle in diesen hydratisierten Protonenkomplexen erhellen im Anschluss, in welchem Umfang die elektronsiche Struktur der beteiligten Wassermoleküle durch Hydratisierung des zusätzlichen Protons modifiziert wird, und über welchen räumlichen Bereich die positive Ladung des Protons einen Rolle in der Modifikation der Sauerstoff-K-Kantenspektren von Wassermolekülen im Vergleich zu unprotoniertem Wassers spielt.
Ergebnisse und Diskussion
In Abbildung 1 vergleichen wir die Absorptionsspektren an der Sauerstoff-K-Kante von H2O in der Gasphase, H2O-Monomeren in Acetonitril-Lösung und der Mineralsäure/Wasser/Acetonitril-Lösung, in der 86 % der Wassermoleküle in hydratisierten Protonenkomplexen H7O3+ vorliegen. Zu Details dieser Messungen verweisen wir auf den Methodenteil und die Abbildungen S1 and S2 im Abschnitt 1 des Zusatzteils (Hintergrundinformationen). Details zur Unterscheidung dieser Messungen von Beiträgen weiterer Wassermoleküle in größeren Protonenkomplexen werden im Abschnitt 2 des Zusatzteils diskutiert (s. auch Abbildung S3). Hierzu nutzen wir unsere Erkenntnise zur klaren Hierarchie der Wechselwirkungen in Wasserstoffbrücken hydratisierter Protonenkomplexe von bestimmter Größe. Diese Wasserstoffbrückenhierarchie ermöglicht es uns, die Protonenhydratation in Bezug auf assoziierte Strukturmotive und eine Unterscheidung von nahen und entfernten Wassermolekülen in den hydratisierten Protonenkomplexen zu diskutieren (siehe unten). Abbildung 1 gibt einen direkten Hinweis, wie unterschiedlich die elektronische Struktur in den drei Systemen ist. Das H2O-Monomerspektrum wurde mit einer Lösung von 0.75 mM H2O in Acetonitril gemessen. Anstatt wässriger Säurelösungen15 werden hydratisierten Protonenkomplexe in Acetonitril erzeugt. Starke Mineralsäuren können Wasser in Acetonitril protonieren und bilden hydratisierte Protonenkomplexe, deren durchschnittliche Komplexgröße vom Säure-Wasser-Verhältnis abhängt. Bei (sub)molaren Konzentrationen von Säure und Wasser sind praktisch alle Wassermoleküle an der Protonenhydratation beteiligt, wie frühere IR-spektroskopische Studien5b, 5f, 5i, 11 und unsere eigenen IR-Messungen zeigen (siehe Zusatzteil).
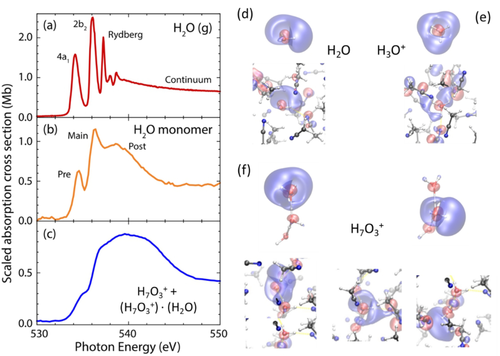
Absorptionsspektren der O−K-Kante von a) H2O in der Gasphase, b) H2O-Monomer in Acetonitril-Lösung und c) des hydratisierten Protonenkomplexes H7O3+ in Acetonitril als 50 % H7O3+ und 50 % H7O3+⋅H2O vorliegend, d.h. die H7O3+ Einheit, equivalent zum [w1⋅H3O+⋅w2]-Komplex, trägt mit ungefähr 86 % zum experimentellen O−K-Kantenspektrum bei und w3 nur mit 14 %. Die Gasphasenergebnisse an H2O wurden der Literatur entnommen.13b Snappschüsse des 4a1-LUMO, das zum Vorkantenmaximum beiträgt, sind für das Wassermonomer in (d) und H3O+ in (e) dargestellt. Die beide Moleküle liegen als isolierte und in Lösungmittel eingebettete Spezies in Acetonitril-Lösung vor. Die Ähnlichkeit der LUMOs von H7O3+ nach Sauerstoff-1s-Anregung in H2O bzw. der H3O+-Einheit sind deutlich erkennbar (f).
Das Spektrum des isolierten H2O-Moleküls (Abbildung 1a) wird von den beiden Hauptmaxima der 1s-zu-LUMO- und LUMO+1-Einzelelektronenübergängen (mit 4a1 bzw. 2b2 bezeichent) dominiert.13b, 16 Für das H2O-Monomer in Acetonitril (Abbildung 1b) beobachten wir ähnlich zu früheren Studien17 ein Vorkantenmaximum bei 534.6 eV, ein Hauptkantenmaximum bei 536.4 eV und eine breite Nachkantenbande bei 538.6 eV. Bei dieser Messung mit einem molaren Anteil x =0.038 besteht Wasserstoffverbrückung hauptsächlich zwischen Wasser und Acetonitril in Form zweier schwacher Wasserstoffbrückenbindungen.18 Die spektralen Signaturen des H2O-Monomers sind daher denen von isolierten H2O-Molekülen sehr ähnlich, und wir stellen insbesondere fest, dass das Vorkantenmaximum auch dem 1s-zu-4a1-LUMO-Übergang entspricht. Die Verbreiterung der Nachkante (dem Spektralbereich, in dem isolierte H2O-Molekülen Innerschalenübergänge in Rydberg-Zustände aufweisen) deutet auf Wasserstoffbrücken-Donierung von H2O- zu Acetonitril-Moleküle des Lösungsmittels hin, die deutlich schwächer sind als in reinem Wasser.18 Im Gegensatz zu reinem Wasser kann ein H2O-Monomer in einem aprotischen Lösungsmittel wie Acetonitril nicht als Wasserstoffbrücken-Akzeptor auftreten. Aufgrund schwacher Wasserstoffbrücken-Donierung und des Fehlens von Wasserstoffbrücken-Akzeptanz spiegeln die Sauerstoff-K-Kantenspektren des H2O-Monomers in Acetonitril eine elektronische Struktur wider, die der von gasförmigem H2O näher ist als der von reinem Wasser.
=0.038 besteht Wasserstoffverbrückung hauptsächlich zwischen Wasser und Acetonitril in Form zweier schwacher Wasserstoffbrückenbindungen.18 Die spektralen Signaturen des H2O-Monomers sind daher denen von isolierten H2O-Molekülen sehr ähnlich, und wir stellen insbesondere fest, dass das Vorkantenmaximum auch dem 1s-zu-4a1-LUMO-Übergang entspricht. Die Verbreiterung der Nachkante (dem Spektralbereich, in dem isolierte H2O-Molekülen Innerschalenübergänge in Rydberg-Zustände aufweisen) deutet auf Wasserstoffbrücken-Donierung von H2O- zu Acetonitril-Moleküle des Lösungsmittels hin, die deutlich schwächer sind als in reinem Wasser.18 Im Gegensatz zu reinem Wasser kann ein H2O-Monomer in einem aprotischen Lösungsmittel wie Acetonitril nicht als Wasserstoffbrücken-Akzeptor auftreten. Aufgrund schwacher Wasserstoffbrücken-Donierung und des Fehlens von Wasserstoffbrücken-Akzeptanz spiegeln die Sauerstoff-K-Kantenspektren des H2O-Monomers in Acetonitril eine elektronische Struktur wider, die der von gasförmigem H2O näher ist als der von reinem Wasser.
Für Protonenkomplexe, die in einer Lösung mit 0.50 M HI/1.75 M H2O in Acetonitril (Stöchiometrie [H+] : [H2O]=1.0 : 3.5) hergestellt wurden, beobachten wir ein Spektrum, das sich deutlich vom Spektrum des H2O-Monomers in Lösung unterscheidet: Die Protonenkomplexe weisen eine markante Absorptionsbande mit einem Zentrum bei 539.6 eV und Schultern bei 535.2, 537 und 542.0 eV auf (Abbildung 1c). Da keine für Wassermonomere typische Absorption in signifikanter Stärke auftritt (insbesondere das 1s-zu-4a1-Vorkantenmaximum bei 534.6 eV ist abwesend), zeigt dieses Ergebnis, dass bei dieser Lösungszusammensetzung alle Wassermoleküle – gemessen an der Stärke der elektronischen Wechselwirkungen (in Form der Vorkante) – stark mit dem Proton assoziiert sind. Diese Beobachtung stimmt mit früheren Schlussfolgerungen überein, die aus NMR- und FTIR-Messungen gezogen wurden. Die bezüglich des Monomerspektrums um 0.6 eV zu höherer Energie verschobene Vorkante des hydratisierten Protonenkomplexes (bei erheblicher Abnahme der relativen Absorptionsstärke) deutet die möglichen Positionen der Vor- und Hauptkantenübergänge des Protonenkomplexes an. Im Vergleich haben H2O-Monomer und hydratisierter Protonenkomplex eine Nachkante mit ähnliche Absorptionsstärke. Für letzteren ist diese um 1.0 eV zu 539.6 eV verschoben, wobei ein zusätzlicher Beitrag in der Nähe von 542 eV vorliegt. Basierend auf diesen Sauerstoff-K-Kantenergebnissen schließen wir, dass die elektronische Struktur für alle beteiligten Wassermoleküle signifikant verändert wird, wenn ein Proton von durchschnittlich 3.5 Wassermoleküle hydratisiert wird. Da sich die spektrale Form für das H2O-Monomer in Lösung über spektrale Verschiebungen der Maxima hinaus stark unterscheidet, zeigt dieses experimentelle Ergebnis in direkter Weise, dass bei der Hydratisierung des Protons der größte Teil der Wassermoleküle (oder gar alle) im hydratisierten Protonenkomplex starke Orbitalrehybridisierung erfahren.
Die weitere Hydratation des Protonenkomplexes in Acetonitril-Lösung kann durch eine höhere Wassermenge im Komplex erreicht werden. Dazu vergleichen wir in Abbildung 2a Messungen mit unterschiedlichen Stöchiometrien ([H+] : [H2O]=1.0 : 3.5 und 1.0 : 8.0). Durch Zugabe von 8-mal mehr Wasser als HI-Säure beobachten wir eine deutliche Absorptionszunahme der Vor- und Hauptkanten und eine Abnahme der Nachkante. Weiterhin zeigt das Sauerstoff-K-Kantenspektrum mit einer Vorkante bei 534.8 eV, einer Hauptkante bei 536.6 eV und einer dominanten Nachkante mit ihrem Maximum bei 539 eV noch immer eine Form, die sich deutlich von der des Wassermonomers unterscheidet. Dies zeigt, dass aus Sicht der Sauerstoff-K-Kanten eine vollständige Hydratation des Protons in Acetonitril selbst bei höherem Wassergehalt eine große (über 3.5 Wassermoleküle hinausgehende) Anzahl von Wassermolekülen umfasst.
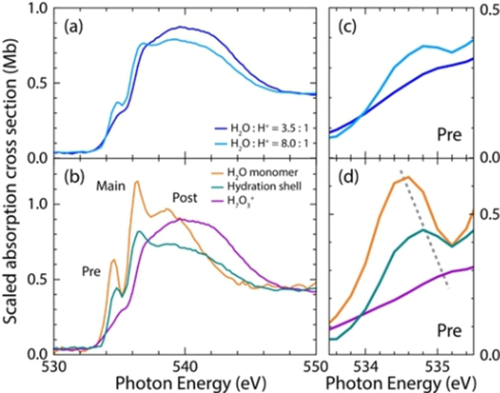
a) Gemessenes O−K-Kantenspektrum, skaliert auf die Sauerstoffanzahl gemäß der Messung für [HI] : [H2O]=1.0 : 3.5 und 1.0 : 8.0 (0.5 M HI : 1.75 M H2O bzw. 0.5 M HI 4.0 M H2O) in Acetonitril-Lösung. b) Vergleich der Spektrums von 0.75 M (orange) Wasser in Acetonitril mit dem für den inneren H7O3+-Komplex abgeleiteten Spektrum (purple) und dem Spektrum des Hydrathüllenwassers (dark cyan) um den inneren H7O3+-Komplex in Acetonitril. Tableaus (a, b) zeigen den in dieser Studie diskutierten Bereich der Energieanregung, und Tableaus (c, d) bieten eine Nahansicht der Vorkantenregion, um die signifikante Energieverschiebung der Vorkante des Hydrathüllenwasser (um den inneren hydratisierten Protonenkomplex) mit der von Wasser in Acetonitril zu verdeutlichen.
Für ein weitergehendes Verständnis der Auswirkungen der Protonenhydratation auf die elektronische Struktur der beteiligten Wassermoleküle nutzen wir folgenden Ansatz: 1) Bestimmung der Wasserstoffbrücken-Bindungsstärken mittels Ab-initio-Molekulardynamik (AIMD) in hydratisierten Protonenkomplexen unterschiedlicher Zusammensetzung in Acetonitril und wässriger Lösung, sowohl in der Art der Wasserstoffrückenbindung (superstark, stark, mittelstark und schwach) als auch in der möglichen Verteilung der Wasserstoffbindungsstärken aufgrund der Wechselwirkung mit dem umgebenden Lösungsmittel; 2) Quantenchemische Berechnungen zur Abschätzung des Einflusses von Wasserstoffbrückenbindungen auf die Röntgenabsorptionsbanden der einzelnen Wassermoleküle, die die hydratisierten Protonenkomplexe bilden; 3) Bestimmung möglicher Komplexierungskonstanten von hydratisierten Protonenkomplexen aus zusätzlichen FTIR-Spektren, aus denen die Stöchiometrie und die relativen Anteile dieser Komplexe abgeleitet werden können. Diese unterstützenden FTIR-Spektren wurden bei 4 °C aufgenommen, um einen besseren Vergleich mit Messungen an der Sauerstoff-K-Kante zu ermöglichen (da der Flachstrahl während der Röntgenmessungen ähnlich kalt ist).
Ein direkter Einblick in die Stärke von Wasserstoffbrückenbindungen ist über die Abstände von elektronegativen Atomen in einer Wasserstoffbrückenbindung möglich. Die aus unseren AIMD-Simulationen bestimmten O⋅⋅⋅O-Abstandsverteilungsfunktionen d(r) (siehe Abbildung S4 und Tabelle S1) zeigen, dass hydratisierte Protonenkomplexe in Acetonitril-Lösung einen breiten Bereich von superstarken bis schwachen Wasserstoffbrücken zwischen der zentralen H3O+-Einheit und den umgebenden Wassermolekülen abdecken. Unsere AIMD-Ergebnisse für H7O3+ in Acetonitril stimmen sehr gut mit bereits publizierten Werten aus QM/MM MD-Simulationen überein.11 Wichtigerweise ist anzumerken, dass in den O⋅⋅⋅O-Abstandsverteilungsfunktionen d(r) eine klare Hierarchie zu erkennen ist, die aufgrund der großen Ähnlichkeiten zwischen H7O3+ und H17O8+ in Acetonitril auf der einen, und der Verteilungsfunktionen des hydratisierten Protons in wässriger Lösung H+(aq) auf der anderen Seite (siehe Abbildung S4 und Tabelle S1) auf die Allgemeingültigkeit unseres Modells, wie Protonen hydratisiert werden, schließen lässt. Die architektonische Hierarchie mit entsprechenden Stärken der Orbitalwechselwirkungen und Längen der Wasserstoffbrückenbindungen ist im hydratisierten Protonenkomplex in Acetonitril daher ähnlich zur ersten Hydrathülle des hydratisierten Protons in wässriger Lösung (vgl. Ref. 6b) Der innere hydratisierte Protonenkomplex besteht unserer Erkenntnis nach aus einer zentralen H3O+-Einheit, in der das Proton eine superstarke Wasserstoffbrücke mit einem ersten Wassermolekül w1 ausbildet. Der sehr kurze O⋅⋅⋅O-Abstand von 2.48 Å dieser Wasserstoffbrücke ist durch ein Doppelmuldenpotential mit niedriger Barriere für das Proton mit klaren spektralen Signaturen in 1D-19 und 2D-FTIR spektren5f, 20a, 20b gekennzeichnet. Die zentrale H3O+-Einheit bildet eine starke Wasserstoffbrücke mit einem zweiten Wassermolekül w2 (O⋅⋅⋅O-Abstand 2.57 Å). Interessanterweise tritt eine deutlich schwächere Wasserstoffbrücke zwischen H3O+ und dem dritten Wassermolekül w3 auf (O⋅⋅⋅O-Abstand 2.68 Å), die sehr ähnlich zu den Wasserstoffbrückenabständen zwischen H7O3+ und der ersten Hydrathülle (O⋅⋅⋅O-Abstände: 2.67–2.86 Å) ist. Es bedarf zusätzlich mindestens fünf weiterer Wassermoleküle, um einen hydratisierten Protonenkomplex mit einer vollständigen ersten Hydrathülle um den H7O3+-Komplex – also H17O8+ in Acetonitril-Lösung – auszubilden. Aus diesem wichtigen Befund für hydratisierte Protonenkomplexe in flüssiger Lösung, sei es in Acetonitril oder in reinem Wasser, können wir schließen, dass aufgrund der Hierachie der Wasserstoffbrückenstärken das Wassermolekül w3 – im Gegensatz zum H3O+(H2O)3-Komplex in der Gasphase als symmetrischem Eigen-Kation mit drei gleichen Wasserstoffbindungen zwischen H3O+ und den drei H2O-Molekülen – eher als Teil der Wassermoleküle der ersten Hydrathülle statt als Bestandteil des inneren hydratisierten Protonenkomplexes zu klassifizieren ist.
Zu unserer Erkenntnis einer Strukturhierarchie sind drei Anmerkungen zu machen. Erstens wurden in den AIMD-Simulationen alle elektronischen Freiheitsgrade der hydratisierten Protonenkomplexe und der umgebenden Lösungsmittelmoleküle quantenmechanisch behandelt, während alle nuklearen Freiheitsgrade klassisch berücksichtigt wurden. Zweitens liegt das Proton in der superstarke Wasserstoffbrücke zwischen H3O+ und w1 im sogenannten Zundel-Motiv (d.h. H5O2+) vor. Eigentlich bedürfte es einer vollständigen quantenmechanischen Beschreibung unter Einbeziehung des Kern-Freiheitsgrade des Protons5f; angesichts der für die Sauerstoff-K-Kanten-Berechnungen notwendigen Sampling-Prozeduren wäre dies in der Implementierung numerisch zu teuer. Drittens ist der Wasserstoffbrückenabstand zwischen H3O+ und w3 viel näher am Abstand zwischen w3 und seinen nächsten Nachbarn in der Hydrathülle, wA,B (und ebenso an den Abständen zwischen w1 bzw. w2 mit ihren jeweiligen nächsten Hydrathülle-Nachbarn, wA,B), als an den Abständen zwischen H3O+ und w1 bzw. w2. Daher ist unsere Argumentation, dass aus struktureller Sicht die größeren hydratisierten Protonenkomplexe in Acetonitril (und in wässriger Lösung) als H7O3+ mit einer umgebenden Hydrathülle angesehen werden können. Folglich sollte H9O4+ eher in der Form (H7O3+)⋅(H2O) oder alternativ [(H5O2+)⋅(H2O)]⋅(H2O) verstanden werden sollte – definitiv nicht als Analogon eines symmetrischen Eigen-Kation in der Gasphase. Die Strukturhierarchie ist nicht statisch: Die Rollen der einzelnen Wassermoleküle in den hydratisierten Protonenkomplexen vertauschen sich aufgrund ultraschneller struktureller Umlagerungen der Wassermoleküle, die die superstarken, starken, mittelstarken und schwachen Wasserstoffbrückenbindungen bilden. Die Bildung und das Brechen von Wasserstoffbrücken zwischen dem hydratisierten Protonenkomplexen und den Wassermolekülen der Hydrathülle finden auf Pikosekunden-Zeitskalen statt.
Es ist wichtig anzumerken, dass die Hierarchie, die wir in den Stärken und Längen der Wasserstoffbrücken finden, auch in den Sauerstoff-K-Kantenspektren als deutlich unterscheidbare spektrale Beiträge erscheint und sich in den 1s-Innerschalenanregungen in die LUMOs der das Proton hydratisierenden Wassermoleküle zeigt (siehe Abbildungen S5 und S6). Diese Spektren wurden in der Näherung eines halben Innerschalenlochs21 berechnet. Für die hydratisierten Protonenkomplexe wurde eine Klassifizierung anhand des Abstands zwischen dem innerschalenangeregten O-Atoms und der zentralen H3O+-Einheit definiert (von H3O+ mit den nächsten Nachbarwassermolekül w1 beginnend, zum nächstnächsten Nachbarwassermolekül w2 usw.). Ein direkter Vergleich der berechneten Spektren von H3O+, H5O2+, H7O3+ und H17O8+ in Acetonitril (gemittelt über alle in unseren AIMD-Simulationen erzeugten molekularen Konfigurationen) mit dem berechneten Spektrum des Wassermonomers in Acetonitril-Lösung weist eine direkte Beziehung zwischen dem durchschnittlichen O⋅⋅⋅O-Abstände und Frequenzaufwärtsverschiebungen auf, die sich auch im Verhältnis der Vor- und Nachkantenabsorption widerspiegelt: Je stärker die Wasserstoffbrückenbindung ist, desto energetisch stärker verschoben stellt sich die Sauerstoff-K-Kante dar, und desto intensiver ist die Nachkante im Vergleich zur Vorkante. Dieses Ergebnis ähnelt den Beobachtungen an K-Kantenspektren von Wasser, die für verschiedenen Wasserstoffbrückenstärken gemessen wurden.13 Allerdings variieren diese Spektren in Anwesenheit des hydratisierten Protons deutlich stärker sowohl in Hinblick auf Frequenzverschiebungen als auch relativen Absorptionsstärken von Vor- und Hauptkanten der hydratisierten Protonenkomplexe. Dies ist insbesondere für die w1- und w2-Moleküle der Fall, die eine superstarke bzw. starke Wasserstoffbrücke mit der zentralen H3O+-Einheit bilden. Um zu verstehen, wie sich die XAS-Beiträge von H3O+ und w1 ändern, wenn das Proton in gleicher Weise zwischen w0 und w1 in der superstarken Wasserstoffbrücke (mit niedriger Potentialbarriere) geteilt wird, haben wir die jeweiligen XAS-Beiträge bei Verschiebung des Protons entlang der O⋅⋅⋅H+⋅⋅⋅O-Protonentransferkoordinate in der superstarken Wasserstoffbrücke berechnet (siehe Abbildung 3). Erwartungsgemäß sind die XAS-Beiträge sowohl in Acetonitril als auch in wässrigen Lösungen im Wesentlichen identisch, wenn das Proton sich innerhalb von 0.1 Å im Zentrum der superstarken Wasserstoffbrücke befindet, wobei die relative Stärke und spektrale Position der Vor-, Haupt- und Nachkante zwischen denen von H3O+ und w1 liegt (siehe Abbildung 3). Für w3 und den Wassermolekülen der Hydrathülle sind die spektralen Beiträge in Position und Form ähnlich. Dies ist auch für das hydratisierte Proton H+(aq) in wässriger Lösung der Fall, was der großen Übereinstimmung zwischen Protonenhydratation in Acetonitril und in wässriger Lösung geschuldet ist.
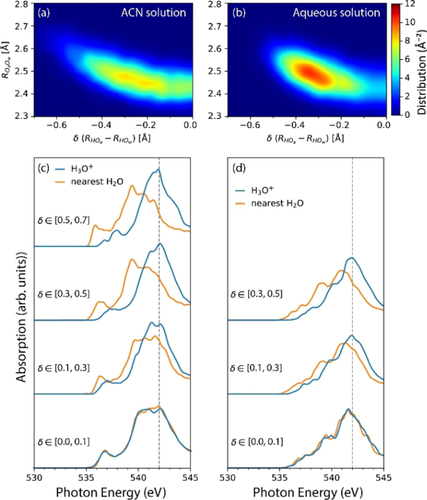
Structurelle Korrelationen in den Spezies H5O2+ (H3O+ und w1) und assoziierte Sensitivität der O−K-Kantenspektren. Tableaus (a) und (b) zeigen die Korrelation zwischen ROa-Ob-Abstand und dem Protonenasymmetrie-Parameter “δ=RHOa-RHOw” in der Zundel-Spezies für die Simulationen von H5O2+ in Acetonitril-Lösung bzw. H+(aq). Tableaus (c) und (d) enthalten die berechneten O−K-Kantenspektren für die zentrale Spezies H5O2+ (H3O+ and w1) aus Simulationen von H5O2+ in Acetonitril-Lösung bzw. H+(aq), zerlegt nach Klassen variiernder O−H+⋅⋅O δ-Asymmetrie von symmetrischen spezies nahe δ≈0 Å zu hoch-asymmetrischen Spezies mit δ≈0.5 Å.
Wir möchten feststellen, dass die Rollen und Wechselwirkungen der verschiedenen Wassermoleküle in und um die hydratisierten Protonenkomplexe schnellen Lösungsmittelschwankungen und Protonenbewegungen unterliegen. Wir verwenden daher Abstandskriterien, um strukturelle Hierarchien von Ensemblemitteln zu beschreiben, wobei jeder Schnappschuss eines Ensembles aus einer bestimmten Anordnung der Sauerstoffatome resultiert. In diesem Zusammenhang ist zu betonen, dass die Sauerstoff-1s-Anregungen in unbesetzte Molekülorbitale der Wassermoleküle Lebensdauern von wenigen Femtosekunden und doppelt so lange (transversale) Dephasierungszeiten aufweisen, also um Größenordnungen kürzer sind als (i) die wesentlichen Lösungsmittelfluktuationen, die mit Umlagerungen von Wasserstoffbrücken verbunden sind,5d, 5h (ii) mit dem inneren Proton wechelwirkende elektrische Feldfluktuationen5f, 5i, 11 und (iii) von Grotthuss-artiger Protonentransfer zwischen Wassermolekülen in den hydratisierten Protonenkomplexen.1, 6a-6e, 22 Die Röntgenschnappschüsse als gemessene Röntgenabsorptionsspektren werden somit schneller aufgenommen als die Lösungsmittelfluktuationen und durch sie angetriebene Protonenbewegungen die elektronischen Kohärenzen der Innerschalenanregungen in Form spektraler Diffusion beeinflussen können. Unsere experimentellen Röntgenabsorptionsergebnisse stellen Momentaufnahmen eines sich dynamisch verändernden Systems in Form der hydratisierten Protonenkomplexe dar; sie können daher direkt mit Ensemble-Mittelwerten aus unseren Berechnungen verglichen werden. Daraus folgt, dass die berechneten Sauerstoff-K-Kantenspektren eines einzelnen Wassermoleküls in einem hydratisierten Protonenkomplex direkt die augenblicklichen Verteilungsfunktionen der Waserstoffbrückenlängen widerspiegeln, wie sie aus den AIMD-Simulationen bestimmt wurden. Da die Sonde aufgrund des lokalisierten Sauerstoff-1s-Orbitals lokal ist, liefert sie außerdem Informationen zum räumlichen Umfang, über den das Proton elektronische Strukturen beeinflusst.
FTIR-Spektroskopie liefert wertvolle Informationen über die Stöchiometrien und Eigenschaften von Wasserstoffbrücken in hydratisierten Protonenkomplexen in Acetonitril-Lösung.5b, 5f, 5i, 11, 20a, 23 Die Hierarchie der Wasserstoffbrücken ist aus charakteristischen IR-Banden ersichtlich. Insbesondere das innere Zundel-Motiv, H5O2+ (d.h. w1⋅⋅⋅H+⋅⋅⋅w0), hat seinen ersten Übergang der Protonentransfermode bei 1250 cm−1, seine OH-Biegeschwingung bei 1725 cm−1 und seine OH-Streckschwingung im Spektralbereich von 2900–3400 cm−1. Diese Übergänge werden von einem breiten Hintergrund überlagert, der als Zundel-Kontinuum bekannt ist und seinen Ursprung in der Hyperpolarisierbarkeit des Protons entlang des niedrigen Barrierenpotentials hat.5i, 5f, 9, 11, 19, 20 Die zusätzlichen Wassermoleküle w2⋅⋅⋅w7 liefern weitere Beiträge zum FTIR-Spektrum mit ihren OH-Biege- und OH-Streckbanden, die bei 1635 cm−1 bzw. 3450–3480 cm−1 zentriert sind. Während die OH-Biegeübergänge dieser Wassermoleküle in den hydratisierten Protonenkomplexen denen der H2O-Moleküle in Acetonitril-Lösung (mit etwas reduzierter Oszillatorstärke5i) ähneln, sind die Übergänge der OH-Streckschwingungsmode für [HI] : [H2O] im Bereich von 1 : 3.5 bis 1 : 14 deutlich zu niedriegeren Frequenzen im Vergleich zu denen der OH-Streckschwingungsbande von H2O in Acetonitril-Lösung verschoben, was ein schlüssiger Beweis ist, dass die zusätzlichen Wassermoleküle als wesentlicher Teil der größeren hydratisierten Protonenkomplexe in die Acetonitril-Lösungsmittelumgebung eingebettet sind. Die Erkenntnis, dass es eine starke Korrelation zwischen Stärken/Längen von Wasserstoffbrückenbindungen und charakteristischen Sauerstoff-K-Kantenspektren gemäß unseren AIMD-Simulationen existiert, und die Tatsache, dass eine wohldefinierte Stöchiometrie für hydratisierte Protonenkomplexe in Acetonitril vorliegt (siehe FTIR-spektroskopische Analyse in den Hintergrundinformationen; Abbildungen S7 und S8 sowie Tabelle S2), erlaubt es uns, unsere experimentellen Sauerstoff-K-Kantenspektren von [H+] : [H2O]=1. 0 : 3.5 und [H+] : [H2O]=1.0 : 8.0 in Acetonitril zu zerlegen Im folgenden leiten wir Ensemble-gemittelte Spektren für den inneren H7O3+-Anteil (äquivalent zu einem [w1⋅H3O+⋅w2]/[H5O2+⋅w2]-Komplex) und für die Wassermoleküle der ersten Hydratationsschale ab (bestehend aus w3⋅⋅⋅w7, was in etwa [H7O3+⋅(H2O)5] entspricht; Abbildung 2b, und Abbildung S3). Unsere Vorstellung der elektronischen Struktur von w3 (dem Wassermolekül, das die dritte Wasserstoffbrücke mit H3O+ bildet) ist derart, dass seine Eigenschaften zwischen denen von w2 und denen der nächsten vier Hydratationsschalenmoleküle w4⋅⋅⋅w7 liegen, jedoch näher an denen von w4 als an denen von w2. Dies bedeutet, dass von der elektronischen Struktur her die drei Wassermoleküle w1, w2 und w3, die H3O+ am nächsten sind, folgenden Trend aufweisen: Je kleiner das Maximum der Verteilungsfunktion d(r) des O⋅⋅⋅O-Abstands, desto stärker sind die berechneten XAS-Beiträge zu höherer Energie verschoben. Wir vergleichen diese Beiträge mit dem des H2O-Monomers in Acetonitril-Lösung in Abbildung 2b und schließen daraus, dass im Gegensatz zum symmetrischen Eigenkomplex H3O+(H2O)3 in der Gasphase5e, 24 die Wasserstoffbrückenkonfiguration um das zentrale H3O+ in Acetonitril und in wässriger Lösung typischerweise eine große Variation der Wasserstoffbrückenlängen/-stärken aufweist. Unsere Ergebnisse stehen in vollem Einklang mit bereits veröffentlichen Abstandsverteilungsfunktionen,11 und auch mit FTIR-Studien von hydratisierten Protonenkomplexen in Acetonitril,5b in denen keine spektrale Signatur der OH-Streckmode eines symmetrischen Eigenkomplexes H3O+(H2O)3 gefunden wurde.
Unsere Ergebnisse zeigen Orbitalwechselwirkungen und Wasserstoffbrückenbindungen in der inneren H7O3+-Einheit, die sich deutlich von denen des Hydrathüllenwassers und des Wassermonomers unterscheiden. Darüber hinaus wird deutlich, dass die zu Grunde liegenden Wechselwirkungen in den Wassermolekülen der ersten Hydrathülle anders sind als die des H2O-Monomers, wie sich in deutlich reduzierten Vor- und Hauptkanten und einem signifikant verschobenen Vorkantenmaximum zeigt. Die spektralen Merkmale der Wassermoleküle der Hydrathülle scheinen zwischen denen des inneren H7O3+-Komplexes und denen des Wassermonomers zu liegen. Insbesondere korreliert die Energie des Vorkantenmaximums mit dem Grad der Wechselwirkungen mit höherer Energie für starke Wechselwirkungen und niedrigerer Energie für schwache Wechselwirkungen (dieser Effekt wird in den gemessenen Spektren in Abbildung 2c und d deutlich). Wir beobachten eine erhebliche Frequenzverschiebung des Vorkantenmaximums um 0.2 eV zu höherer Energie für das Wasser der Hydrathülle im Vergleich zum Wassermonomer (und zusätzlich eine Verschiebung des Hauptmaximums in gleicher Richtung um 0.1 eV bei verringertem Absorptionsquerschnitt von ≈30 % für diese beiden Maxima). Diese spektralen Unterschiede und Maximumsverschiebungen in der Vorkante können nicht allein durch stärkere Wasser-Wasser-Wasserstoffbrücken im Hydrathüllenwasser erklärt werden, da in diesem eine zusätzliche Verschiebung des Vorkantenmaximus von nur ungefähr 0.05 eV vorliegt sollte (siehe Abbildung S9).
Um die gemessenen spektralen Unterschiede und die Maximumsverschiebungen der Vorkanten in Abbildung 2 zu erklären, vergleichen wir berechnete Spektren von H7O3+ und H17O8+ in Acetonitril als Mittel über alle durch unsere AIMD-Simulationen erzeugten molekularen Konfigurationen mit dem berechneten Spektrum des Wassermonomers in Acetonitrillösung in Abbildung 4 (wobei die experimentellen Messungen der beiden Arten hydratisierter Protonenkomplexe über die Wasserkonzentration realisiert wurden).
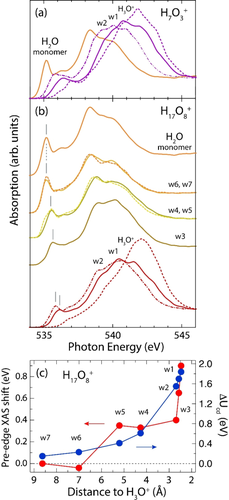
Theoretische O K-Kantenspektren, gemittelt über AIMD-Simulationen, berechnet in der Näherung eines halben Innerschalenlochs, zerlegt nach jeweiligen Beiträgen des inneren H3O+ (gestrichelte Linien), nächstes Nachbar-H2O (durchgezogene Linien), übernächstes Nachbar-H2O (gestrichelt-gepunktete Linie) und Wassermoleküle bei größeren Abständen (durchgezogene Linien) für a) H2O-Monomer (orange) und H7O3+ (lila), und b) H17O8+ (rot, gelb und orange), alle in Acetonitril gelöst. Die Stärken sind zu einander skaliert. Tableau c) zeigt als Funktion des Abstandes zum H3O+-Zentrum die Dipolewechselwirkungsenergie ΔUcd und die Vorkantenverschiebung einzelner Wassermoleküle von H17O8+ in Acetonitril im Vergleich zum Wassermonomer.
Die berechneten Spektren der verschiedenen Wassermoleküle im H7O3+-Komplex in Abbildung 4a stimmen gut mit unseren Messungen bei Verhältnissen von [H+] : [H2O]=1 : 3.5 überein (Abbildung 2a) und zeigen deutlich, dass die XAS-Beiträge der zentralen H3O+-Einheit und der beiden koordinierten Wassermoleküle w1 und w2 ein dominantes Maximum bei bzw. oberhalb von 540 eV bei einem vergleichsweise schwachen Vorkantenmaximum aufweisen (wobei die XAS-Beiträge der Haupt- und Nachkanten zu einem Maximum verschmelzen). Dieses Verhalten steht im deutlichen Unterschied zum Wassermonomerspektrum. Für H3O+ werden die Haupt- und Nachkantenmaxima durch interne Orbitalhybridisierung innerhalb der H3O+-Einheit und durch Hybridisierung zwischen H3O+ und den nächsten Wassermolekülen w1 und w2 verursacht. Die Vorkante ist in H3O+ gegenüber der des Wassermonomers durch interne Hybridisierung, die mit Änderungen der molekularen Symmetrie einhergeht, stark reduziert. Der Übergang von C2v-Symmetrie im Monomer zu C3v-Symmetrie in H3O+ verringert den p-Charakter der LUMOs, die durch Innerschalenanregungen aus dem Sauerstoff-1s-Orbital populiert werden13b). Wenn wir nun die nächste Schicht der Wassermolekülen betrachten, sind es die Orbitalwechselwirkungen von w1 und w2, die aufgrund ihrer superstarken bzw. starken Wasserstoffbrückenbindungen mit der zentralen H3O+-Einheit die nächstgrößten spektralen Unterschiede bezüglich des Wassermonomers aufweisen. Für ein exaktes Zundel-Motiv ist die Hybridisierung der beiden innersten Wassermoleküle, die das Proton in einer superstarken Wasserstoffbrücke teilen identisch, wie Berechnungen unter Verwendung einer quantenmechanischen Betrachtung der Kernkoordinate des inneren Protons bestätigen sollten. Dies unterstützt unsere experimentell abgeleitete Schlussfolgerung, dass alle drei Wassermoleküle in der H7O3+-Einheit eine starke Orbitalmischung erfahren. Da die spektralen Änderungen in der H3O+-w1-w2-Sequenz für die innere H7O3+-Einheit in der H17O8+-Simulation weitestgehend erhalten bleiben, wie in Abbildung 4b zu sehen ist, dominiert starke Orbitalmischung auch im Beitrag der H7O3+-Einheit im experimentell gemessenen Spektrum bei erhöhtem Wassergehalt (Abbildung 2b).
Für die Wassermoleküle der Hydrathülle (w3 und darüber hinaus) liefert die Simulation des H17O8+-Komplexes Informationen zur Modifikation ihrer elektronischen Struktur aufgrund der Wechselwirkungen durch Protonenhydratation, die langreichweitiger sind und keine starke Orbitalmischung verursachen. Interessanterweise haben die Spektren von w3 und weiterer Hydrathüllenmoleküle eine Form die dem Monomerspektrum ähnelt. Allerdings sind die Vor- und Hauptkanten nicht so intensiv, und das Vorkantenmaximum ist zu deutlich höheren Energien verschoben.
Für die spektrale Form beobachten wir sowohl im Experiment (Abbildung 2) als auch in der Theorie (Abbildung 4), dass das Spektrum eines Hydrathüllenmoleküls auf das des Wassermonomers zustrebt, je weiter es vom Proton entfernt ist. Die Wassermoleküle der Hydrathülle w3, w4, … sind offensichtlich über ihre freien Elektronenpaare mit der inneren H7O3+-Einheit verbunden, während ihre O−H-Gruppen mit den umgebenden Acetonitril-Lösungsmolekülen Wasserstoffbrücken bilden. Angesichts ihrer spektralen Form sind die damit verbundenen Orbitalwechselwirkungen deutlich schwächer als die für w1 und w2. Wir stellen fest, dass die berechneten Spektren von w6 und w7 nahezu identisch mit denen des Wassermonomers in Acetonitril sind. Dies lässt sich durch unsere H17O8+-AIMD-Simulationen erklären, in denen häufig Trajektorien mit einem intakten H13O6+-Komplex und w6 und w7 als Monomeren, deren freie Elektronenpaare nicht an Wasserstoffbrückenbindungen beteiligt sind. Aus unserer Analyse der experimentellen FTIR-Spektren (siehe Abbildung S8c und Tabelle S2) leiten wir zudem ab, dass intakte hydratisierte Protonenkomplexe mindestens 6 und durchschnittlich 7.5 Wassermoleküle für ein Mischungsverhältnis von [HI] : [H2O]=1 : 8 enthalten.
Desweiteren stellen wir fest, dass sich die Position des Vorkantenmaximums eines Wassermoleküls mit wachsendem Abstand zum Proton zu niedrigerer Energie verschiebt. Die berechneten Maximumverschiebungen der Vorkanten von H3O+, w1 und w2 in H7O3+ liegen im Bereich von 0.4–0.8 eV (bezogen auf das Wassermonomer) und die gemessene Verschiebung des experimentellen H7O3+-Spektrums bei 0.6 eV (ebenfalls bezogen das Monomerspektrum) stimmen gut überein. Darüber hinaus wiesen w4 und w5 in der H17O8+-Simulation Verschiebungen von 0.3 eV bzw. 0.2 eV in Bezug auf das Monomerspektrum auf. Diese Wassermoleküle entsprechen Beiträgen aus der Hydrathülle und zeigen eine zufriedenstellende Übereinstimmung mit dem Experiment (wieder bezogen auf das Monomerspektrum). Diese Beobachtungen motivieren die in Abbildung 4c aufgetragene Vorkantenverschiebung für die verschiedenen Wassermoleküle der H17O8+-AIMD-Simulation als Funktion des Abstands zur zentralen H3O+-Einheit. Es zeigt sich ein klarer Trend, in dem die Größe der durchschnittliche Energieverschiebung der Vorkante für die jeweilige Klasse von Wassermolekülen, w1, w2, …, im hydratisierten Protonenkomplex direkt vom Abstand dieser Klasse zur zentralen H3O+-Einheit abhängt. Bei kurzen Abständen wird das Spektrum von spektralen Änderungen aufgrund von Orbitalwechselwirkungen dominiert, während bei größeren Entfernungen die spektrale Form konstant ist, und der Einfluss der Hydratisierung sich überwiegend in der Vorkantenverschiebung mit der Entfernung zum Proton darstellt. Da für entferntere Moleküle der Einfluss von Orbitalwechselwirkungen und damit einhegehende Änderungen der Spektralform stark vermindert ist, weist die Energieposition des Vorkantenmaximums auf eine Korrelation durch einen zusätzlichen Wechselwirkungseffekt hin, der durch das Proton verursacht wird.
Die Vorkante entsteht durch einen Innerschalenübergang des Sauerstoff-1s-Elektrons in das räumlich sehr gerichtete und weit nach außen reichende 4a1-Orbital (siehe auch Abbildung 1d,e,f). Unsere berechneten Spektren zeigen, dass sich die Position dieses Orbitals zu höheren Energien verschiebt, je näher sich ein Wassermolekül am Proton befindet Wir halten fest, dass diese Verschiebung umso größer ist, je mehr eine Klasse von Molekülen dem elektrostatischen Feld des Protons ausgesetzt ist. Um diese Beobachtung zu quantifizieren, haben wir die Änderung der Dipolenergie ΔUcd durch Vorkantenanregung in einem Wassermonomer (isoliert und gasphasenartig) ausgewertet. Wir bringen ein solches Monomer in das elektrische Feld einer Protonenladung und berechnen ΔUcd als Funktion des Abstands zum Proton, d.h. wir verwenden ein innerschalenangeregtes Wassermonomer als Testdipol, um die Wirkung des elektrischen Feldes des Protons auf die Orbitalenergie der Vorkante abzuschätzen. In Abbildung 4c sind die berechneten Werte von ΔUcd als Funktion des Abstands zum Proton für die Wassermoleküleklassen der Form w1, w2, … aus unserer H17O8+-Simulation aufgetragen (ΔUcd sei Null für das feldfreie Monomer; Die Begriffe “Entfernung zum Proton” und “Entfernung zu H3O+” werden der Einfachheit halber synonymhaft verwendet). Wie zu sehen, gibt dieses einfache Modell qualitativ den Trend der berechneten Vorkantenverschiebungen von w1, w2, … wieder, und die daraus resultierende Korrelation lässt den Schluss zu, dass die beobachtete Vorkantenverschiebung ein Maß für die elektrische Feldstärke des Protons ist (mit Werteabschätzungen die zwischen 10 und 200 MV cm−1 variieren, siehe Abbildung S10 für elektrische Feldstärken in Abhängigkeit des Protonabstands). Die von den Dipolen der umgebenden Acetonitril-Lösungsmittelmoleküle aufgeprägten Felder betragen 20–30 MV cm−1.11 Die elektrischen Felder aufgrund der positiven Ladung des Protons übersteigen also die lösemittelinduzierten Felder deutlich (um mindestens das zweifache) für die Wassermoleküle der Hydrathülle bis w7, und für die beiden an H3O+ gebundenen Wassermoleküle im inneren H7O3+-Protonenkomplex um mehr als eine Größenordnung. Aus diesem Befund schließen wir, dass sich der Einfluss des Protons bei der Modifizierung der elektronischen Struktur von Wasser auf mindestens die erste Hydrathülle der inneren H7O3+-Einheit erstreckt. Die elektronische Struktur der Wassermoleküle in der Hydrathülle wird durch orbitale Wechselwirkungen nicht wesentlich verändert; es ist hauptsächlich das Coulomb-Potential und das damit verbundene elektrische Feld des Protons, das zu einer Verschiebung der LUMO-4a1-Orbitalenergie der Wassermoleküle in der Hydrathülle führt. Der graduelle Übergang, den wir für hydratisierte Protonenkomplexe finden – von dominanten Orbitalwechselwirkungen in definierten Molekülgeometrien in der Nähe des Protons zu Orbitalenergieverschiebungen aufgrund des elektrischen Felds des Protons bei größeren Abständen – wird die Art und Weise beeinflussen, wie wir Wechselwirkungen zwischen Wassermolekülen und Protonen in der Natur quantifizieren und ultraschnelle Protonentransferreaktionen in Lösung und in technologischen Anwendungen kontrollieren werden.
Zusammenfassung
Wir haben mittels weicher Röntgenspektroskopie Schicht für Schicht aufdecken können, wie Orbitale von Wassermolekülen durch die Hydratisierung eines Protons beeinflusst werden. In einer Studie, die Experiment und Theory kombiniert, finden wir orbitalspezifische spektrale Marker, mit denen zwei wesentliche Effekte, die die elektronische Struktur im Komplex beeinflussen, unterschieden werden können: Lokale Orbitalwechselwirkungen bestimmen die kovalente Bindung zwischen dem Proton und benachbarten Wassermolekülen, während orbitale Energieverschiebungen die Stärke des langreichweitigen elektrischen Feldes Protons anzeigen. Die spektroskopischen Schnappschüsse der Sauerstoff-K-Kante als Ensemble-Mittel lokaler Innerschalenanregungen liefert einen direkten Einblick in die Protonenhydratation jenseits der konventionellen Eigen- und Zundel-Bilder bestimmter Geometrien, d.h. H3O+( H2O)3 bzw. H5O2+. Unsere Studie bietet einen neuen Ansatz, der einen graduellen Übergang von starken Orbitalwechselwirkungen des hydratisierten Protons mit nächsten Wassermolekülnachbarn hin zu orbitalen Energieverschiebungen in ferneren Wassermolekülen verdeutlicht. Diese Erkenntnis wird bei Untersuchungen stationärer Zustände hydratisierter Protonen und zeitaufgelöster Studien zu grundlegenden Mechanismen des wässrigen Protonentransports von großem Nutzen sein.
Danksagung
Wir danken Stephan Figul (Advanced Microfluidic Systems GmbH) herzlich für die Unterstützung bei der Einrichtung und Temperaturkalibrierung des Acetonitril-Flachstrahlsystems. Förderung: M. Ekimova, C. Kleine, J. Ludwig und E.T.J. Nibbering danken der Deutschen Forschungsgemeinschaft (Projekt Nr. DFG – NI 492/11-1) und dem Europäischen Forschungsrat (ERC) im Rahmen des Forschungs- und Innovationsprogramms Horizon 2020 der Europäischen Union (ERC Grant Agreement Nr.788704; E.T.J.N.). M. Odelius dankt der Carl Tryggers-Stiftung (Vertrag CTS18 : 285) und dem Forschungs- und Innovationsprogramm Horizon 2020 der Europäischen Union im Rahmen der Marie-Skłodowska-Curie-Fördervereinbarung Nr.860553 für die Unterstützung. Die Berechnungen wurden durch Ressourcen der Swedish National Infrastructure for Computing (SNIC) ermöglicht, teilweise finanziert durch den Swedish Research Council über die Fördervereinbarung Nr. 2018-05973. N. Huse dankt der Deutschen Forschungsgemeinschaft (DFG) für die Förderung im Rahmen des Exzellenzcluster “CUI: Advanced Imaging of Matter” – EXC 2056 – project ID 390715994. E. Pines bedankt sich für die Unterstützung durch die Israel Science Foundation (Fördernummer 1587/16). Wir alle bedanken uns sehr für die Unterstützung der BESSYII-Mitarbeiterinnen und Mitarbeiter bei Röntgenmessungen am variablen Polarisationsstrahlrohr UE52-SGM des Helmholtz-Zentrums Berlin und danken dem Helmholtz-Zentrum Berlin für die Bereitstellung von Synchrotronstrahlung. Autorenbeiträge: M.E. und E.T.J.N. initiierten und planten das Projekt, mit frühen Beiträgen von Ph.W. und M.Od.; M.E., C.K., J.L. und M.Oc. führten die XAS-Experimente durch; M.E. und C. K. analysierten die experimentellen XAS-Daten; E.K., D.P. und E.P. haben die FTIR-Experimente durchgeführt und analysiert; T.E.G.A. und M.Od. führten die Analyse der AIMD-Simulationen durch; E.T.J.N. schrieb das Manuskript mit Beiträgen von M.E., C.K., E.P., Ph.W. und M.Od. und weitere Änderungen von J.L., M.Oc., T.E.G.A. und N.H. Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Interessenkonflikt
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.
Open Research
Data Availability Statement
Die Daten, die die Ergebnisse dieser Studie unterstützen, sind auf begründete Anfrage beim Autor erhältlich.




