Gestapelt, nicht geklebt: Enthüllung der π→π*-Wechselwirkung mithilfe des Benzofuran-Formaldehyd-Komplexes
Abstract
Der 1:1-Benzofuran-Formaldehyd-Komplex wurde als Modellsystem für π→π*-Wechselwirkungen in supramolekularen Umgebungen mit heteroaromatischen Ringen und Carbonylgruppen gewählt. Die Strategie einer gemeinsamen “Rotationsspektroskopie-Quantenchemie”-Analyse enthüllt die Rolle dominanter intermolekularer π→π*-Wechselwirkungen in solchen Addukten. Die Untersuchung der intermolekularen Potentialfläche identifiziert 14 tiefliegende Minima, wobei 4 gestapelte Isomere stabiler sind als die durch Wasserstoffbrücken oder “freies Elektronenpaar”→π-Wechselwirkungen verbundene. Alle lokalen Minima sind nur lose durch Übergangszustände getrennt, was unter den experimentellen Bedingungen eine effektive Relaxation zum globalen Minimum erwarten lässt. Der Nachweis nur einer Spezies, die dank Berechnung genauer spektroskopischer Parameter und Charakterisierung von 11 Isotopologen eindeutig zugeordnet werden konnte, bestätigt dies. Die große Isotopologenanzahl ermöglichte die Bestimmung der ersten semi-experimentellen Gleichgewichtsstruktur für einen Molekülkomplex dieser Größenordnung.
Aromatische Verbindungen spielen eine Schlüsselrolle bei der Strukturausbildung von Biomolekülen und beeinflussen Prozesse, die mit Ursprung und Entwicklung des Lebens (Photosynthese,1 Informationsspeicherung,2 DNA-Replikation3 etc.) diskutiert werden. Dabei sind durch nicht-kovalente Wechselwirkungen (NCI) vermittelte und von aromatischen Einheiten beherrschte Prozesse von größter Bedeutung,4 die so verschiedene Bereiche wie molekulare Erkennung,5 Katalyse,5c, 6 Crystal Engineering7 und Arzneimittelverabreichung abdecken.8 Die Vielseitigkeit der aromatischen Gruppen spiegelt sich in Anzahl, Arten und Spezifität der NCI wider.9 Darunter sind Heteroaromaten besonders wichtig, da sie als Teil der Nukleobasen Bausteine des Lebens sind und eine zentrale Rolle in der medizinischen Chemie spielen.10 In diesem Bereich ist das Benzofuran (BZF), welches das Heteroaromaten-Grundgerüst für eine große Reihe von Verbindungen mit pharmakologischen Aktivitäten bildet,11 interessant. In BZF-Derivaten konkurrieren das π-System und das freie σ-Elektronenpaar des Sauerstoffs bei der Bildung von NCIs.12 Ein Beispiel ist die Komplexbildung des aktivierten menschlichen Blutgerinnungsfaktors X (FXa) mit (S)-2-Cyano-1-(2-methylbenzofuran-5-yl)-3-(2-oxo-1-(2-oxo-2-(pyrrolidin-1-yl) ethyl)azepan-3-yl)guanidin (PDB:3HPT13 YET 2.D-Ligand). Die in der Proteindatenbank (PDB) veröffentlichte Struktur14 zeigt enge intermolekulare Kontakte (drei davon mit Abständen von weniger als 3.6 Å) zwischen dem BZF und den Carbonylanteilen (siehe Abbildung 1). Während intra- und intermolekulare Wechselwirkungen in Biomolekülen von großem Interesse sind, weil sie eine bestimmte Aktivität vermitteln und/oder dafür verantwortlich sind, ist ihre genaue Charakterisierung aufgrund der großen Dimensionen nicht einfach; oft ist es sogar schwierig, qualitative Bilder zu erhalten. Ein Ausweg ist die Untersuchung der dominierenden Wechselwirkung in einem kleineren Modellsystem. Wie in Abbildung 1 hervorgehoben, wird ein geeignetes Modellsystem durch BZF und Formamid gebildet. Der BZF-Formaldehyd (BZF-FA)-Komplex ist jedoch eine effektivere Wahl: i) Er erlaubt die Konkurrenz (einer begrenzten Anzahl) verschiedener NCI, die in Gegenwart starker N−H⋅⋅⋅π16 oder N−H⋅⋅⋅O NCI wie im Fall von Formamid gehemmt wäre; ii) die Größe von FA ermöglicht die Erforschung mehrerer spezifischer Wechselwirkungsstellen; iii) die Polarität des Moleküls könnte die Kooperativität zwischen verschiedenen Effekten verstärken, die bei Benzolkomplexen hingegen vernachlässigbar ist.17, 18
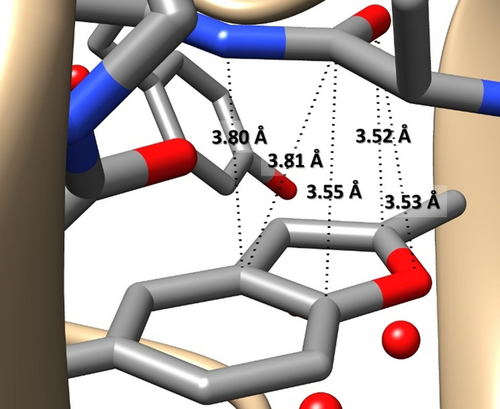
Bereich der PDB:3HPT[13, 14]-Struktur (Einzelheiten im Text) mit engen intermolekularen Kontakten zwischen einem (2-Methyl)-BZF-Teil des YET 2.D-Liganden und einer Carbonylgruppe. Die Struktur wurde mit der Software Chimera 1.14 visualisiert.15
Die oben angesprochenen Punkte legen das BZF-FA-Addukt als Modell für ein tieferes Verständnis spezifischer NCIs mit Heteroaromaten nahe. Dies erfordert die genaue Bestimmung der Strukturparameter und Wechselwirkungsenergien, da diese die Voraussetzungen für die Entflechtung verschiedener Beiträge zur Stabilisierung nicht-kovalenter Komplexe, zur Analyse kooperativer (oder antikooperativer) Effekte17-19 bei größeren Clustern und für Benchmark-Studien großer Systeme sind. Um dieses Ziel zu erreichen, wurde ein integrierter Ansatz aus Experiment und Theorie verwendet und die Untersuchung, um Störungen durch die Umgebung zu unterbinden, in der Gasphase durchgeführt. Die Messung basiert auf der Überschallexpansion (lösungsmittel- und matrixfreie Umgebung) interagierender Spezies (Bildung binärer Komplexe) in den Resonator hoher Güte eines Mikrowellenspektrometers. Die Rotationskohärenztechnik hat sich für die Charakterisierung schwach gebundener Isomere als exzellent erwiesen.20 Der Nutzen von Hochpräzisionsstudien dieser Art erhöht sich mit der Unterstützung durch hochpräzise quantenchemische Berechnungen. Da nahezu isoenergetische Isomere gleichzeitig vorhanden sein können, ist die Hilfe der Theorie nicht nur für die Interpretation der experimentellen Beobachtungen erforderlich,21 sondern auch für eine quantitative Energetik und strukturelle Charakterisierung der Isomere.
Auf der Grundlage früherer Studien22, 23 wurden die wichtigsten stationären Punkte auf der Potenzialfläche (PES) des BZF-FA-Addukts, d. h. die Gleichgewichts- und jene Übergangszustände, die deren Umwandlung regeln, unter Verwendung des B2PLYP-D3(BJ)-Doppelhybridfunktionals in Verbindung mit dem jun-cc-pVTZ-Basissatz24, 25, 26 (im Folgenden jB2) und unter Einbeziehung der Counterpoise-Korrektur (CP)27 (im Folgenden CP-jB2) ermittelt. Die verbesserten elektronischen Energien aller identifizierten stationären Punkte wurden unter Verwendung des zusammengesetzten Schemas jun-ChS berechnet, dessen Genauigkeit kürzlich validiert wurde.22 Das Gaussian16-Paket28 wurde durchgängig verwendet; eine vollständige Beschreibung der Berechnungsdetails findet sich in den unterstützenden Informationen (SI).
Die Strukturen der 14 auf der PES gefundenen niedrigsten Minima sind in Tabelle S1.1.1 zusammengestellt. Die für die spektroskopische Untersuchung erforderlichen Parameter (Rotationskonstanten und Komponenten des elektrischen Dipolmoments) sind für alle Isomere zusammen mit ihren relativen Energien in Tabelle S1.1.2 angegeben. Die vier Minima mit der niedrigsten Energie weisen eine nahezu gestapelte Anordnung der BZF- und FA-Anteile auf, wobei letzterer über den verbrückenden Atomen in BZF liegt (siehe Abbildung 2).
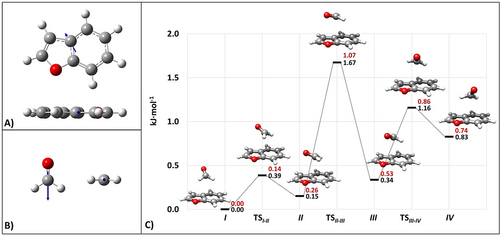
Tafeln A bzw. B zeigen BZF (μ=0.74 D) und FA ((μ=2.41 D) mit ihren elektrischen Dipolmoment-Vektoren (auf jB2-Niveau). Die Dipolmomentvektoren sind nicht maßstabsgetreu gezeichnet. Tafel C zeigt den auf die vier energieniedrigsten Minima beschränkten Teil der PES des BZF-FA-Komplexes und die entsprechenden Übergangszustände: Die relativen jun-ChS-Energien (schwarz) und die harmonisch ZPE-korrigierten Werte (rot) sind angegeben. Die ZPE-Korrekturen liegen auf CP-jB2-Niveau.
Diese vier Minima unterscheiden sich in der Ausrichtung des FA-Moleküls zum BZF. Der Dipolmomentvektor (DM) des isolierten BZF und die Projektion des DM von FA auf die BZF-Ebene sind von Isomer IV zu Isomer I zunehmend antiparallel. Letzteres weist, wie in Abbildung 2 gezeigt und durch eine symmetrieangepasste Störungstheorie (SAPT)-Analyse bestätigt (vide infra), den größten Dipol-Dipol-Energiebeitrag auf.29 Die Strukturen der anderen Isomere, die auf der PES identifiziert wurden, sind in den SI enthalten. Abbildung 2 (Minima der vier gestapelten Anordnungen) und Tabelle S1.1.2 (alle anderen Minima) zeigen niedrige Umwandlungsbarrieren (einschließlich der Barrieren des Relaxationspfads der stabilsten wasserstoffgebundenen Struktur, Isomer VII), sodass während der Überschallexpansion die Kollisionsrelaxation aller Isomere zur Spezies I möglich ist.30
Experimentell konnte mit einem Resonator-basierten Pulsstrahl-FTMW-Spektrometer31 (experimentelle Details in den SI) das Vorhandensein von nur einer Spezies (Isomer I) in der Helium-Überschall-Expansion von BZF und FA nachgewiesen werden, was die in der Berechnungsstudie vorhergesagte Relaxation zum stabilsten Isomer unterstützt. Die Spektren zeigen ein Intensitätsverhältnis von 1:3 (Abbildung 3 A), was typisch für Übergänge von Zuständen (gekennzeichnet als υ=0 und υ=1) ist, die durch den Austausch von äquivalenten Fermionen (Wasserstoffatome von FA mit Kernspin I=1/2) aufspalten. Diese Feinstruktur deutet damit auf ein “Rollen” der FA-Wasserstoffe bezüglich der Carbonylachse hin. Diese Tunnelaufspaltung war jedoch nicht immer auflösbar (Abbildung 3 B). Mit der Analyse der Spektren durch das Programm SPFIT von Pickett32 (S-reduzierter Hamiltonian von Watson in der IIIl-Darstellung)33 sind für jeden Zustand die Rotationsparameter, wie in Tabelle 1 aufgeführt, ermittelt worden. Die spektroskopische Zuordnung von Isomer I war auf der Basis des Vergleichs der experimentell bestimmten Rotationskonstanten mit den berechneten Gleichgewichtswerten jedoch keineswegs einfach. In der Tat liegen die experimentellen Werte zwischen denen, die auf CP-jB2-Niveau für die Isomere I und IV berechnet wurden (Tabelle S1.1.2). Erst nachdem die Schwingungsbeiträge in die berechneten Rotationskonstanten einfließen, besteht, wie aus Tabelle 1 hervorgeht, kein Zweifel mehr an der Zuordnung zu Isomer I. Die Schwingungsbeiträge wurden aus anharmonischen CP-korrigierten B3LYP-D3(BJ)/SNSD-Berechnungen25, 27, 33, 34 (im Folgenden CP-B3) im Rahmen der Schwingungsstörungstheorie zweiter Ordnung (VPT2) gewonnen35 (Einzelheiten in den SI). Nachdem Tabelle 1 bereits wenig Raum für Zweifel lässt, wurde die eindeutige Zuordnung zu Isomer I schließlich durch die Aufnahme, Zuordnung und Anpassung der Spektren der Komplexe aller 13C-monosubstituierten Isotopologen von BZF und FA in natürlicher Häufigkeit sowie 18O-FA, das in situ durch Isotopenaustausch (Zugabe einer kleinen Menge H218O zum Gasgemisch36) hergestellt wurde, erreicht. Im Falle des 18O-FA-Isotopologen wurden die Rotationsparameter beider Zustände (υ=0 und υ=1) erfolgreich angepasst, während für die 13C-Spezies nur die stärksten υ=1-Linien beobachtet wurden. Die experimentellen Rotationskonstanten aller Isotopenspezies (Abschnitt S2 in den SI) sind mit denen des Isomers I konsistent.
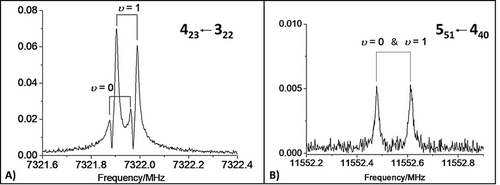
Beispiele für gemessene Rotationsübergänge zu Isomer I: Tafel A zeigt den a-Typ-J′Ka′ Kc′←J′′Ka′′ Kc′′=423←322-Übergang, der eine Tunnelaufspaltung zeigt (υ=0 und υ=1, Einzelheiten im Text); Tafel B zeigt den b-Typ-551←440-Übergang, bei dem die Zustände der Tunnelbewegung nicht aufgelöst sind.
Parameter |
Experiment |
Theorie[b] |
||
|---|---|---|---|---|
|
υ=0 |
υ=1 |
Isomer I |
Isomer IV |
A0 [MHz] |
1180.9038(2)[c] |
1180.9045(2) |
1180.17 |
1190.64 |
B0 [MHz] |
1096.1994(2) |
1096.2033(2) |
1103.11 |
1048.87 |
C0 [MHz] |
788.2780(1) |
788.2808(1) |
789.01 |
763.23 |
DJ[d] [kHz] |
3.902(2) |
3.903(2) |
2.5 |
2.5 |
DJK [kHz] |
−4.826(6) |
−4.822(6) |
−3.4 |
−3.2 |
DK [kHz] |
1.829(4) |
1.828(4) |
1.4 |
1.2 |
d1 [kHz] |
−0.448(2) |
−0.448(2) |
−0.2 |
−0.4 |
d2 [kHz] |
0.9641(8) |
0.9639(8) |
0.7 |
−0.1 |
N[e] |
204 |
|
|
|
σ[f] [kHz] |
2.7 |
|||
- [a] Watson-S-Reduktion, IIIl-Darstellung. [b] Schwingungsgemittelte Rotationskonstanten, die durch Korrektur der CP-jB2-Rotationskonstanten der Gleichgewichtsstruktur um Schwingungsbeiträge auf dem CP-B3-Niveau erhalten wurden (Einzelheiten in den SI). [c] Standardfehler in Einheiten der letzten Ziffer. [d] Quartische Zentrifugalverzerrungskonstanten (D und d). [e] Anzahl der Linien, die für die Anpassung verwendet wurden. [f] “Root-mean-square”-Fehler der Anpassung.
Der große Satz von Rotationskonstanten für Isomer I (elf Isotopologe für υ=1) ermöglicht die Bestimmung einer semi-experimentellen (SE) Gleichgewichtsstruktur (reSE)37 durch Kombination des SE- mit dem Template-Modell(TM)-Ansatz.38 Die Strukturen der BZF und FA Einheiten im Komplex wurden mithilfe des TM-Ansatzes ausgehend von den reSE der isolierten Fragmente genau bestimmt (Einzelheiten in den SI). Die reSE von FA wurde aus der SMART Lab Datenbank entnommen,39 während die reSE von BZF beabsichtigt auf der Grundlage der experimentellen Daten aus Lit. 40 in dieser Arbeit evaluiert wurde. Anschließend wurden die intermolekularen SE-Parameter des Komplexes mittels Minimierung der Abweichungsquadrate zu den SE-Gleichgewichtsrotationskonstanten ermittelt. Letztere wurden durch Korrektur der experimentellen Grundzustandsrotationskonstanten mit Schwingungsbeiträgen, die auf CP-B3-Niveau berechnet wurden, gewonnen. Mit dem Fokus auf den intermolekularen Parametern, welche die NCI beschreiben, und weil der TM-Ansatz sehr genaue Strukturen gewährleistet, wurden die intramolekularen Parameter im Anpassungsverfahren festgehalten und drei intermolekulare Strukturparameter bestimmt (Abbildung 4): Der Abstand CFA⋅⋅⋅Cβ (3.2257±0.0006 Å), der Winkel CFA⋅⋅⋅Cβ-C4 (90.18±0.04°), der Diederwinkel CFA⋅⋅⋅Cβ-C4-C3 (−98.31±0.03°). Die gute Übereinstimmung zwischen den intermolekularen SE-Parametern und den CP-jB2-Werten mit Abweichungen von weniger als 1 % (Abbildung 4) beweist die Zuverlässigkeit der CP-jB2-Geometrien und so der Gleichgewichtsrotationskonstanten. Die Wechselwirkung von BZF und FA wird durch den C(FA)⋅⋅⋅Cβ-Abstand widergespiegelt, der deutlich geringer als die Summe der Van-der-Waals-Radien der Kohlenstoffatome (3.40 Å) ist.41
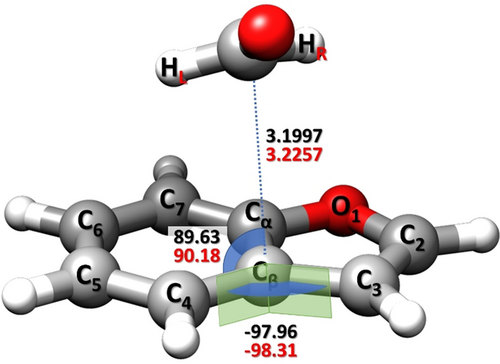
Intermolekulare SE-Gleichgewichtsparameter (rot) des Isomers I im Vergleich zu den CP-jB2-Werten (schwarz).
Die intermolekularen Parameter folgen den Trends der “natural bond orbital”(NBO)-Analyse42 auf B3LYP-D3(BJ/maug-cc-pVTZ-dH-Niveau)25, 35, 43 (im Folgenden mB3) unter Verwendung der CP-jB2-Geometrie sowie der reSE-Struktur. Die NBO-Analyse (beide Geometrien liefern nahezu identische Ergebnisse) zeigt, dass Isomer I den größten Teil seiner Stabilität durch eine π-π*-Wechselwirkung erhält (Abbildung 5 A und Tabelle 2), begleitet von (schwachen) C−H⋅⋅⋅π-Wasserstoffbrückenbindungen (HB) (Tabelle 2 nennt Beiträge >0.5 kJ mol−1; vollständige Liste in den SI). Dieselbe CP-jB2-Struktur wurde für die Analyse des reduzierten Dichtegradienten (Abbildung 5 B) und die Visualisierung des so genannten NCI-Plots44 (Abbildung 5 C) verwendet; beide zeigen eine breite attraktive Wechselwirkungszone oberhalb der BZF-Ebene. Quantitativ zeigt die natural energy decomposition analysis (NEDA),45 die auf mB3-Niveau durchgeführt wurde, dass die elektrischen (−22.6 kJ mol−1) und Ladungstransfer-Beiträge (−18.3 kJ mol−1) die Kernabstoßung (24.2 kJ mol−1) überwiegen, was zu einer Gesamtwechselwirkungsenergie von −16.7 kJ mol−1 führt (für die CP-jB2-Geometrie; −16.6 kJ mol−1 bei der reSE-Struktur; weitere Details in den SI). Da Dispersionswechselwirkungen in der NEDA nicht explizit berücksichtigt werden, haben wir zusätzlich eine SAPT2+(3)δmp2/aug-cc-pVTZ-Energiezerlegung46, 47 auf den CP-jB2-Geometrien durchgeführt (Beschreibung der Analyse und Erklärung des Akronyms in den SI). Unter Berücksichtigung aller Isomere (Tabelle S1.5.1) und des reduzierten Modells der PDB:3HPT-Struktur (Tabelle S1.6.1) unterstreicht die SAPT-Analyse die herausragende Rolle, die Dispersion stets bei der Stabilisierung des Komplexes spielt. Für Isomer I beträgt dieser Term −20.9 kJ mol−1, gefolgt von einem elektrostatischen Beitrag (−11.8 kJ mol−1) und einem kleinen Induktionsterm (−3.4 kJ mol−1), sodass eine Gesamtwechselwirkungsenergie von −16.3 kJ mol−1 resultiert. Somit zeigen die NEDA- und SAPT-Analysen eine bemerkenswerte Übereinstimmung mit der Jun-ChS-Wechselwirkungsenergie (−16.1 kJ mol−1, siehe SI). Die größere Wechselwirkungsenergie des BZF-FA-Komplexes im Vergleich zum gestapelten Benzoldimer (−11.6 kJ mol−1 auf dem jun-ChS-Niveau22a) weist auf die Rolle der dipolaren Wechselwirkungen bei der Verstärkung der π⋅⋅⋅π*-Wechselwirkungen hin.
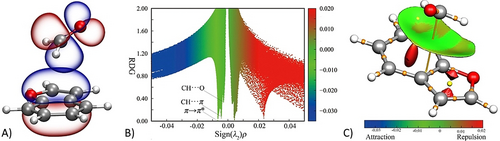
Isomer I: Tafel A zeigt die NBO-Darstellung des höchsten besetzten π-Orbitals von BZF und des antibindenden (π*) Orbitals von FA; Tafel B zeigt die Darstellung des reduzierten Dichtegradienten (RDG); Tafel C ist das NCI-Diagramm: blaue und grüne Flächen zeigen das Vorhandensein starker bzw. schwacher anziehender Wechselwirkungen, während die rote Fläche abstoßende Wechselwirkungen anzeigt.
Spender-NBO |
Akzeptor-NBO |
E(2) [kJ mol−1] |
|---|---|---|
BD(2) Cβ-Cα |
BD*(1) C-O (FA) |
4.3 (4.0) |
BD(2) C7-C6 |
BD*(1) C-HL(FA) |
0.6 (0.6) |
Zusammengefasst wurde ein π-π*-gebundener Komplex von BZF mit FA in der Kombination von Rotationsspektroskopie an Überschallexpansionen mit quantenchemischen Berechnungen auf hohem Niveau charakterisiert. Die Wechselwirkungsenergie (−16.1 kJ mol−1) ist größer als beim prototypischen aromatischen Benzoldimer (−11.6 kJ mol−1),22a aber viel niedriger als bei klassischen HBs wie die im Pyridin-Wasser-Komplex gebildete O−H⋅⋅⋅N NCI (−29.8 kJ mol−1).22a
Die Rotationszuordnung elf einfach substituierter Isotopologer birgt eine große Menge an Strukturinformationen (siehe z. B. Lit. 20f, 20k), welche die Bestimmung der SE-Gleichgewichtsstruktur ermöglichte, der genauesten Geometrie für mittlere bis große Systeme.37 Dies ist bedeutsam, da in mehreren früheren Studien über nicht-kovalente Komplexe (z. B. Lit. 20a, 20f, 20g, 20k) die Mikrowellenuntersuchungen verschiedener Isotopenspezies zur Ableitung gemittelter Strukturen des Schwingungsgrundzustands verwendet wurden (ohne die berechneten Gleichgewichtswerte mit den experimentellen Werten des Schwingungsgrundzustands zu vermischen). Im Gegensatz dazu führt unser Ansatz zur Bestimmung einer genauen Gleichgewichtsstruktur, indem die experimentellen Rotationskonstanten rigoros um die berechneten Schwingungsbeiträge korrigiert werden (Beispiele für intermolekulare Komplexe sind in Lit. 20i, 20l, 23 zu finden). Letztere wurden aus anharmonischen Berechnungen gewonnen, die für ein so großes System wie BZF-FA teuer sind. Die gute Übereinstimmung der CP-jB2-Struktur mit der reSE (Abbildung 4) sowie der CP-jB2-Energetik mit den jun-ChS-Werten unterstreicht die Zuverlässigkeit der CP-jB2-Ebene bei der Beschreibung eines Systems mit π-π*-Wechselwirkungen unter isolierten Bedingungen.
Schließlich lassen sich anhand der Kristallstruktur in Abbildung 1 und ihres Vergleichs mit den BZF-FA-Isomeren einige Schlussfolgerungen ziehen:
-
Die stabilste Struktur in einer matrix- und lösungsmittelfreien Umgebung, die bei Überschallexpansion beobachtet wurde, zeigt eine andere Ausrichtung des FA-Teils bezüglich PDB:3HPT (YET 2.D), die eher Isomer II entspricht.
-
Der Vergleich zwischen der PDB:3HPT (YET 2.D)-Modellstruktur (Abbildung 1 und Tabelle S1.6.1) und Isomer II (CP-jB2-Geometrie) zeigt ähnliche O(FA)⋅⋅⋅O(BZF) und O(FA)⋅⋅⋅C2(BZF)-Abstände (3.53 Å gegenüber 3.64 Å bzw. 3.52 Å gegenüber 3.59 Å). Stattdessen ist der C(FA)⋅⋅⋅Cα-Kontakt im Isomer II viel kürzer als in PDB:3HPT (3.09 Å bzw. 3.55 Å).
-
Die obigen Überlegungen sowie die NBO-Analyse eines ausgewählten Teils des PDB:3HPT-Kristalls (auf demselben Niveau wie BZF-FA), der so gewählt wurde, dass er den Rahmen nachahmt, in den BZF (YET 2.D-Fragment) eingefügt ist, zeigen deutlich, dass der Stabilisierungsbeitrag dieser π-π*-Wechselwirkung (≈1 kJ mol−1) im Kristall weniger stark ist als ihr Beitrag zur Modellstruktur in der Gasphase (≈4 kJ mol−1; Tabelle 2) und mit C−H⋅⋅⋅π-NCIs vergleichbar ist (NBO-Ergebnisse in Tabelle S1.6.2 der SI).
-
Unsere Ergebnisse ermöglichen eine unverfälschte strukturelle und energetische Charakterisierung von π-π*-Wechselwirkungen zwischen einer Carbonylgruppe und einer heteroaromatischen Einheit und erlauben so die Entflechtung der verschiedenen Beiträge, die das Verhalten komplexerer Systeme bestimmen.
Danksagung
Wir bedanken uns für die finanzielle Unterstützung durch das italienische Ministerium für Universität und Forschung (Förderungsnr. 2017A4XRCA), die Universität Chongqing, das Land Niedersachsen und die Deutsche Forschungsgemeinschaft (DFG). X. Li dankt dem China Scholarships Council (CSC) für die Unterstützung. K. G. Lengsfeld dankt dem Fonds der Chemischen Industrie (FCI) für ein Promotionsstipendium. Open Access Funding provided by Scuola Normale Superiore within the CRUI-CARE Agreement.
Interessenkonflikt
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.




