Gold lässt Fibrillen wachsen: der Mechanismus der oberflächenunterstützten Amyloid-Aggregation
Abstract
Die Frage, wie Amyloidfibrillenbildung von Oberflächen beeinflusst wird, ist entscheidend für das Verständnis des Prozesses in vivo. Wir haben eine Kombination von kinetischen Experimenten und Moleküldynamiksimulationen angewendet, um aufzuklären, wie (Modell-)Oberflächen die Fibrillenbildung der amyloidbildenden Sequenzen des Prionenproteins SUP35 und des Insel-Amyloid-Polypeptids beeinflussen. Kinetische Daten legen nahe, dass eine Restrukturierung der initialen Peptidkorona um die kolloidalen Goldnanopartikel der zeitlimitierende Schritt ist. Moleküldynamiksimulationen zeigen, dass partielle Physisorption an der Oberfläche zur Bildung von geordneten Monolagen führt, die die Bildung von parallelen, kritischen Oligomeren stimuliert. Der generelle Mechanismus beinhaltet, dass die zugrundeliegende Peptid-Peptid- und die Peptid-Oberflächen-Wechselwirkung in der gleichen Größenordnung liegen müssen, um die Fibrillenbildung zu beschleunigen.
Unsichtbar für das bloße Auge, sind wir überall von Nanopartikeln (NP) umgeben. Heutzutage gelangen NP über die Produkte, die wir nutzen, über die Nahrung, die wie essen, oder über die Luft, die wir atmen, (Aerosole) in unseren Körper. Ob das mit potenziellen Gesundheitsrisiken verbunden ist, ist ein Thema von wachsendem Interesse. Beispielsweise wird der Einfluss von Metall-NPn auf die Fibrillierung von Amyloidpeptiden in der Literatur intensiv diskutiert.1, 2 Die beobachteten Effekte der verschiedenen NP auf Amyloidpeptide und -proteine (sind verantwortlich für Krankheiten wie Alzheimer, Parkinson, Diabetes II, …) reichen von starker Beschleunigung der Fibrillenbildung bis zu Inhibierung der Peptidaggregation und Zerstörung zuvor gebildeter Fibrillen (umfassende Literaturübersicht siehe Tabelle S5). Verschiedene Modelle zur Erklärung der Fibrillenbildung sowohl in freier Lösung als auch in der Nähe von Oberflächen wurden vorgeschlagen: Das Modell der “keimbildenden Konformationskonversion” postuliert, dass sich Peptide in freier Lösung zunächst zu losen, unstrukturierten Oligomeren zusammenfinden, die sich dann in einem zweiten, zeitlimitierenden Schritt zu geordneten, β-Faltblatt-reichen Fibrillen umwandeln.3 Das Kondensations-Ordnungs-Modell geht davon aus, dass in Gegenwart von NPn, die Anziehung durch die Oberfläche zu einem Anstieg der lokalen Peptidkonzentration führt und in der Folge einen sekundären Ordnungsschritt erleichtert.4 Mahmoudi et al. haben herausgefunden, dass NP die Sekundärstruktur von Peptiden und Proteinen verändern5 und haben deshalb die “oberflächeninitiierte Keimbildung” vorgeschlagen.6 Vachá et al. und Radic et al. haben unabhängig voneinander hervorgehoben, dass die Stärke der Wechselwirkung zwischen den Peptiden und der Oberfläche bestimmt, ob und wie die Fibrillenbildung beeinflusst wird.7 Dennoch erklärt keines dieser Modelle im Detail, wie und warum der zeitlimitierende Konversions- oder Ordnungsschritt von unstrukturierten Oligomeren (deren Bildung durch den Kondensationseffekt an der Oberfläche begünstigt wird) zu β-Faltblatt-reichen Fibrillen von der Oberfläche beeinflusst wird.
Wir haben kürzlich die Kinetik der Fibrillenbildung der amyloidbildenden Sequenzen des humanen Insel-Amyloid-Polypeptids (hIAPP) – NNFGAIL – und des Prionenproteins SUP35 – GNNQQNY – in Gegenwart von negativ geladenen citratstabilisierten Gold-NPn mithilfe eines In-vitro-Aufbaus untersucht (Abbildung 1).2 Die Gold-NP haben das Fibrillenwachstum deutlich beschleunigt – sie haben die charakteristische Verzögerungszeit von ungefähr 50 min (in einem Kontrollexperiment in Abwesenheit von NPn) auf 15 min reduziert (Details siehe Abbildung S14, Tabelle S3/S4 und Lit. 2). Diese Fibrillen waren deutlich länger und dicker als Fibrillen, die in Abwesenheit von NPn inkubiert wurden. Um die Metall-NP konnte die sofortige Bildung einer Korona beobachtet werden (siehe Abbildung 2 B).2 Um zu klären, ob die beobachtete Korona die Kinetik der Fibrillenbildung beeinflusst, haben wir die NP bei einer Peptidkonzentration inkubiert, die a) niedrig genug ist, um die Fibrillenbildung zu unterdrücken und b) hoch genug ist, um die Koronabildung zu ermöglichen. Die Fibrillenbildung wurde durch einen plötzlichen Anstieg der Peptidkonzentration nach verschiedenen Inkubationszeiten t1 initiiert. Fibrillen wurden nach einer Zeit t2 detektierbar. Diese Zeit wurde mit der normalen Verzögerungszeit t0 (von nichtverdünnten Peptidlösungen in Gegenwart von NPn) verglichen. Überraschenderweise fanden wir, dass die Fibrillenbildung immer dann ohne Verzögerung einsetzte, wenn die Inkubationszeit t1 die Verzögerungszeit des Systems (t0) überschritt. Dagegen war in Abwesenheit von NPn die Detektionszeit t2 (≈50 min) vollständig unabhängig von der Inkubationszeit t1 (siehe Tabelle S4 und Abbildung S16). Der geschwindigkeitsbestimmende Schritt der Fibrillenbildung in der Nähe von Goldoberflächen ist demnach ein “Umstrukturierungsprozess” innerhalb der Peptidkorona. Die umstrukturierte Korona fungiert dann als Keim für die Fibrillenbildung (Abbildung 1).
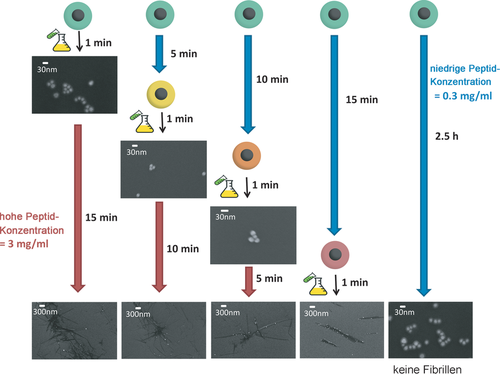
Experimentelle Trennung der Peptidstrukturierungseffekte nahe der NP-Oberfläche von Peptid-Peptid-Wechselwirkungen, die zu schnellem Fibrillenwachstum führen. Die zunächst niedrige Peptidkonzentration wurde nach verschiedenen Inkubationszeiten t1 (blaue Pfeile) erhöht und die Zeit t2 (rote Pfeile), bis Fibrillen detektierbar waren, wurde gemessen. Fibrillenbildung wurde in allen Fällen nach t1+t2=15 min beobachtet. Hinweis: Die Maßstabsskalen sind verschieden. Die große Vergrößerung beweist, dass keine (Proto)Fibrillen an den NPn zu wachsen beginnen. Die kleine Vergrößerung verdeutlicht die langgestreckte Struktur der Fibrillen.
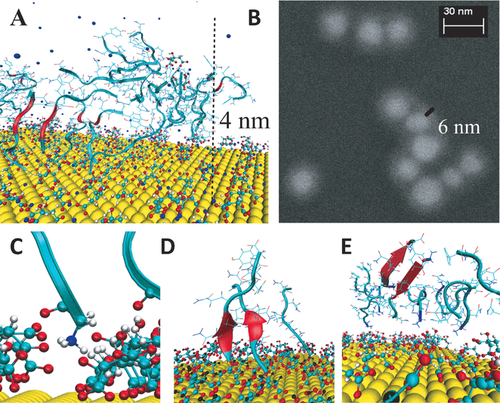
Adsorption von GNNQQNY-Peptiden auf einer citratbedeckten Goldschicht. A) Dimension der Peptidoligomere senkrecht zur Goldschicht beobachtet in MD-Simulationen. B) Peptidhalo um citratbedeckte Gold-NP, gemessen mit Rasterelektronenmikroskopie (REM). C) An Sauerstoffanionen des Citrat bindender N-Terminus. D) Drei Peptide “stehen” auf der Oberfläche und binden mit ihrem N-Terminus (blau) an die Citratanionen und strecken den C-Terminus in die Lösung. Zwei von ihnen bilden ein paralleles Dimer. E) Bildung eines Dimers in antiparalleler β-Faltblatt-Struktur in der zweiten Adsorptionsschicht eines adsorbierten Peptidclusters.
Hier zeigen wir einen molekularen Mechanismus basierend auf atomistischen Moleküldynamiksimulationen, der erklärt, wie die Oberflächenwechselwirkungen das Wachstum von Amyloidfibrillen beeinflussen. Das System besteht aus einer explizit solvatisierten, citratbedeckten Goldoberfläche8 mit isotonischer NaCl-Konzentration und variierender Anzahl Peptide (technische Details siehe die Hintergrundinformationen). Während der Simulationen (100 ns) adsorbierten beide Peptidspezies (Sequenzen von hIAPP und SUP35) vollständig entweder direkt an der citratstabilisierten Goldoberfläche oder an anderen oberflächengebundenen Peptiden. Diese initiale Peptidadsorption an der peptidfreien Oberfläche wird durch Coulomb-Kräfte zwischen den positiv geladenen N-Termini und den Sauerstoffanionen der Citratmoleküle ermöglicht (Abbildung 2). Wenn bereits mehrere Peptide an der Oberfläche gebunden sind, verändert sich dieses Bild jedoch. Jetzt wird vor allem ein Wettbewerb zwischen Peptid-Peptid- und Peptid-Oberflächen-Wechselwirkungen beobachtet. Wenn die Oberfläche zu ungefähr 10 % mit Peptiden bedeckt ist, binden nur noch wenige neu adsorbierende Peptide direkt an die Oberfläche und die meisten an bereits adsorbierte Peptide. Entsprechend wurde eine sehr schnelle Bildung von Oligomeren beobachtet. Diese haben eine Ausdehnung von rund 2.5 nm bis 4.5 nm senkrecht zur Goldschicht. Das stimmt gut mit der experimentell gemessenen Dicke der Korona von ca. 4 nm bis 7 nm überein (Abbildung 2 A und B).
Obwohl unsere Simulationen die experimentell beobachtete Koronabildung um die NP reproduzieren und erklären, ist noch nicht klar, warum die Fibrillenbildung beschleunigt wird und was in den 15 min passiert in denen der Halo restrukturiert wird, sodass er ein effizienter Keim für die Fibrillenbildung wird.
Zunächst überprüften wir die Möglichkeit, dass die Beschleunigung mit einem Kollaps der kolloidalen NP-Suspension einhergeht – stabilisierende Citratmoleküle könnten durch adsorbierende Peptide verdrängt werden. Diese Hypothese wurde auf der Grundlage von drei Argumenten ausgeschlossen (siehe die Hintergrundinformationen): i) REM-Aufnahmen zeigen, dass die NP nicht signifikant agglomerieren, sondern stattdessen als einzelne Partikel (oder in kleinen Gruppen von wenigen Partikeln), entweder adsorbiert an den Fibrillen oder in größeren Peptidaggregaten eingeschlossen, (siehe Abbildung S13) gefunden werden, ii) die Zeta-Potentiale der reinen citratbedeckten NP und der peptidbedeckten, kolloidalen NP sind nahezu identisch, und iii) sowohl eine reine Goldoberfläche als auch die citratbedeckte Oberfläche beeinflussen das Verhalten der anhaftenden Peptide letztlich in ähnlicher Weise.
Deshalb sind wir davon ausgegangen, dass der Halo als eine Strukturvorlage dient, die eine nachfolgende, orthogonale Aufreihung der Peptide ermöglicht. Der zugrundeliegende Mechanismus ist offensichtlich mit der langsamen Bildung des entscheidenden Nukleationskeims (kritische Oligomere innerhalb des 4 nm bis 7 nm dicken Halo) verbunden.
Um ein solches Scenario besser imitieren zu können, haben wir zusätzlich das Verhalten von einer Vielzahl von zuvor gebildeten Oligomeren in der Nähe von i) der citratbedeckten Goldoberfläche und ii) einer Oberfläche, die bereits dicht mit N-terminal gebundenen Peptiden bedeckt ist, untersucht. Wir haben herausgefunden, dass die Wechselwirkung mit entweder der citratbedeckten Goldoberfläche oder mit der Peptidmonolage, zur vollständigen Dissoziation von kleinen, losen Oligomeren (Dimere, Trimere) führt (Abbildung S6), wohingegen größere Oligomere (lineare Hexamere, Oktamere und Dodecamere (teilweise bestehend aus zwei β-Faltblättern) ihre Originalstruktur beibehielten (Abbildung 3 A und B). Oligomere, die aus N-terminal gebundenen Peptiden innerhalb der (ersten) Peptidmonolage gebildet wurden, bestehen zwangsläufig aus Peptiden, die parallel zueinander angeordnet sind (Abbildung 2 D und 3 A). Das erklärt, warum kleinere, lose antiparallele Oligomere (Dimere und Trimere)9 relativ instabil sind, wenn sie an der citratbedeckten Goldoberfläche angelagert sind, wohingegen parallele Dimere spontan gebildet werden (Abbildung 2 D). Das elektrische Feld innerhalb des Halo verhindert in unseren Simulationen aber nicht die Bildung von antiparallelen Dimeren aus Peptiden in der “zweiten” Schicht (Abbildung 2 E). Deshalb schreiben wir die Zerstörung der losen Oligomere durch die dicht gepackten Peptidmonolagen hauptsächlich konkurrierenden Peptid-Peptid-Wechselwirkungen und nur teilweise einer erzwungenen Anordnung zu. Augenscheinlich bietet eine überwiegend unstrukturierte Monolage kein passendes Gerüst um Oligomere weiter zu Fibrillen wachsen zu lassen. Daher stellen wir fest, dass für beschleunigtes Fibrillenwachstum Strukturbildung schon innerhalb der ersten Peptidmonolage notwendig ist.
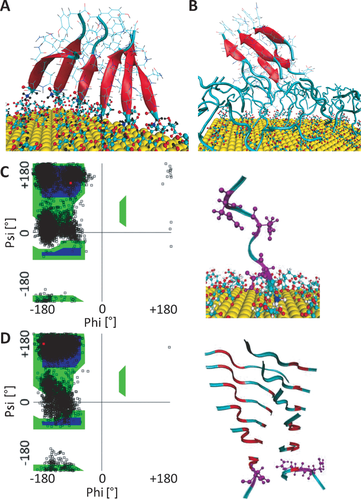
Ramachandran-Diagramme und typische Strukturen. A) Ein zuvor gebildetes lineares Hexamer bestehend aus durch N-terminale Adsorption der Peptide angeordneten parallelen β-Strängen. B) Ein zuvor gebildetes “Steric-zipper”-Hexamer (bestehend aus zwei β-Faltblättern mit jeweils drei parallelen Peptidsträngen innerhalb eines Faltblattes und antiparalleler Orientierung der zwei Faltblätter zueinander) lagert sich an einem (zuvor gebildeten) Peptidhalo in der zweiten Adsorptionsschicht an. C) Ein an der Oberfläche adsorbiertes Peptidmonomer (links) und das dazugehörige Ramachandran-Diagramm von ASN6 während einer 100-ns-Trajektorie (rechts). Das Ramachandran-Diagramm ist bei sehr kleinen Phi-Winkeln und Psi-Winkeln um 0° sehr dicht besetzt. Dieses ungewöhnliche Muster wird für alle Aminosäuren, die in lila markiert sind beobachtet (C, D rechts). D) Ein zuvor gebildetes “Steric-zipper”-Dodecamer und das zugehörige Ramachandran-Diagramm der markierten Aminosäuren (lila) an seinem wachsenden Ende, hier gezeigt für GLN5 (rechts) während einer 100-ns-Trajektorie.
Keimbildungsabhängiges Kristallwachstum wird stark von Translations- und Rotationsentropie kontrolliert. Die Aufkonzentration der Peptide nahe einer anziehenden Oberfläche überwindet großenteils die Barrieren, die mit Translationsentropie verbunden sind – es überwindet aber nicht notwendigerweise die Barrieren, die mit Rotationsentropie verbunden sind. Es kann, im Gegenteil, sehr wohl auch die notwendige Ausrichtung von Monomeren behindern und damit dem Fibrillenwachstum entgegenstehen. Dagegen überwindet die hier beobachtete N-terminale Physisorption an der Oberfläche Rotationsentropie indem es die Peptide geeignet ausrichtet und das Wachstum von Oligomeren, die aus parallelen β-Strängen bestehen, verstärkt. Frühere Simulationsarbeiten haben gezeigt, dass sich GNNQQNY-Dimere vordergründig in antiparalleler Orientierung zusammenfinden,9 während weitere Monomere hauptsächlich in paralleler Orientierung hinzugefügt werden, was mit der Kristallstruktur der entsprechenden Mikrokristalle, die von Sawaya et al. veröffentlicht wurde,10 übereinstimmt. Entsprechend beobachten wir in der “zweiten” Adsorptionsschicht und in freier Lösung initiale β-Faltblätter, die vorwiegend antiparallel orientiert sind, wohingegen die N-terminale Anordnung in der ersten Monolage direkt zu parallelen Oligomeren führt. Deshalb führen wir die experimentell beobachtete Verzögerungszeit auf die relativ langsame Bildung von regulären, stabilen β-Faltblättern in der Nähe der NP-Oberfläche zurück.11
Des Weiteren verdeutlichen unsere Simulationen, dass oberflächengebundene Peptide eine sehr spezielle Verteilung im Diederwinkelraum (Ramachandran-Diagramm) mit einer sehr hohen Wahrscheinlichkeit für sehr kleine Phi-Winkel (<−155°) und Psi-Winkel um 0° zeigen (Abbildung 3 C). Diese Winkel zeigen einen hohen Grad an Flexibilität und besetzen häufig Regionen im Phi-Psi-Raum, die charakteristisch für β-Faltblätter sind. Diese Zustände im Ramachandran-Diagramm werden auch an den losen Enden von verschiedenen zuvor gebildeten Oligomeren mit β-Faltblatt-Struktur beobachtet (Abbildung 3 D und S11). Diese Beobachtung legt nahe, dass die ungewöhnlichen Phi- und Psi-Zustände während des Wachstums von Amyloidfibrillen durch Monomeraddition am Ende der Fibrille auftreten.12 Fibrillenkompatible Strukturen werden also sowohl auf dem Niveau der Monomere als auch der Oligomere gebildet.
Letztlich haben wir untersucht, wie der hier beschriebene Mechanismus von der Gegenwart von angelagerten Citratmolekülen, die eine dominierende Rolle für die N-Terminus-Oberflächen-Wechselwirkung spielen, abhängt. Zu diesem Zweck haben wir unser Simulationsprotokoll mit einer reinen Goldoberfläche wiederholt (siehe Abbildung S7). Wir fanden heraus, dass sich die Endergebnisse stark ähneln, obwohl der initiale Adsorptionsmechanismus deutlich unterschiedlich ist: Als Resultat von permanenten Peptid-Peptid- und Peptid-Oberflächen-Wechselwirkungen stellen sich die Rückgrate der Peptide letztlich auf. Bei GNNQQNY ermöglicht der aromatische Ring von Tyrosin (Y) eine vorwiegend C-terminale Bindung. Die Ramachandran-Diagramme dieser Peptide zeigen ein sehr ähnliches Muster wie in Abbildung 3 C und D für citratgebundene Peptide (siehe Abbildung S7). Entsprechend schlussfolgern wir, dass die Wechselwirkung von mehreren Peptiden mit einer polarisierbaren Metalloberfläche letztlich zu ähnlichen Strukturen führen würde wie auf citratstabilisierten Goldoberflächen, was auch mit früheren experimentellen Untersuchungen mit unterschiedlich stabilisierten Gold- und Silber-NPn übereinstimmt.2
Unser Modell zeigt weiterhin, dass im Wettbewerb zwischen der zugrundeliegenden Peptid-Peptid- und der Peptid-Oberflächen-Wechselwirkung ein Gleichgewicht erreicht werden muss, um das Fibrillenwachstum zu beschleunigen.4 Wenn die Peptid-Oberflächen-Wechselwirkung zu stark ist, findet keine Umstrukturierung der initial adsorbierten Peptide statt, und das Fibrillenwachstum wird verlangsamt oder inhibiert.13 Im Fall einer sehr schwachen Peptid-Oberflächen-Wechselwirkung dominieren die Peptid-Peptid-Wechselwirkungen und die NP-Oberfläche beeinflusst das System kaum.14 Nur wenn beide Wechselwirkungen konkurrieren, kann partielle N- oder C-terminale Physisorption stattfinden, und der Diederwinkelraum der Peptide ähnelt dem einer wachsenden Fibrille. Hier scheinen genau abgestimmte Wechselwirkungen zwischen der Oberfläche der NP und den terminalen Gruppen der Peptide, egal ob sie auf Polarisierbarkeit, Ladung, Pi-Stapelung oder Van-der-Waals-Wechselwirkungen beruhen, essentiell zu sein, um die Rotationsentropie zu überwinden und die Bildung von parallelen, fibrillenkompatiblen Oligomeren zu verstärken. Die Notwendigkeit für gut abgestimmte Peptid-Peptid- und Peptid-Oberflächen-Wechselwirkungen bestätigt und erweitert die weitverbreitete Hypothese eines Kondensations-Ordnungs-Mechanismus.4
Um die Hypothese weiter zu testen, haben wir den Einfluss von sauerstoffterminierten Nanodiamanten (Carboxyl- und Hydroxygruppen) und Polyethylenglykol(PEG)-bedeckten Gold-NPn untersucht (siehe Tabelle S3).
Die Nanodiamanten haben sehr ähnliche Eigenschaften wie citratstabilisierte Gold-NP. Genauer sind das Zeta-Potential und die Durchschnittsgröße (Gold-NP: d≈20 nm, ζ=−40±5 mV, Nanodiamanten: d≈29 nm, ζ=−40±5 mV) sehr ähnlich. Entsprechend erwarten wir den gleichen N-terminalen Bindungsmechanismus für beide NP. Allerdings ist die Stärke der Wechselwirkung unterschiedlich. Die Polarisierbarkeit der Goldoberfläche induziert eine positive Ladung, die der negativen Oberflächenladung der Citratmoleküle entgegensteht. Da das Zeta-Potential für beide NP identisch ist, muss die negative Ladungsdichte auf der Goldoberfläche größer sein (mehr Carboxylgruppen) als die entsprechende Ladungsdichte der Nanodiamanten. Entsprechend erwarten wir im Fall der Nanodiamanten eine schwächere Wechselwirkung mit den N-Termini der Peptide und eine dominierende Rolle der Peptid-Peptid-Wechselwirkung. Dagegen haben PEGylierte Gold-NP den gleichen polarisierbaren Goldkern wie die citratstabilisierten Gold-NP. Allerdings führt die PEG-Schicht zu einem Anstieg des Zeta-Potentials von −40±5 mV auf −23±5 mV. Deshalb wird eine schwächere Anziehungskraft zwischen dem positiv geladenen N-Terminus der Peptide und der Goldoberfläche erwartet.
Entsprechend sollte der beschleunigende und strukturbildende Effekt der Nanodiamanten und der PEGylierten Gold-NP klein oder sogar nicht detektierbar sein. Unsere Experimente zeigen in der Tat, dass beide NP-Spezies an den Peptidaggregaten adsorbieren, aber keinen signifikanten Einfluss auf die Kinetik oder Strukturbildung haben (siehe Abbildung S14, S15). Das stützt die These, dass das Verhältnis zwischen der Peptid-Peptid- und der Peptid-Oberflächen-Wechselwirkung essentiell ist, um die Fibrillierung zu beschleunigen.
Hier haben wir einen umfassenden und konsistenten Mechanismus dafür vorgeschlagen, wie (Metall-)Oberflächen die Fibrillenbildung der amyloidbildenden Sequenzen von hIAPP und SUP35 beeinflussen. Paradoxerweise könnten NP, indem sie die Bildung von großen, stabilen Fibrillen beschleunigen, die Bildung von kleineren, stärker toxischen Oligomerspezies verhindern, und dabei den (initialen) Verlauf von amyloidassoziierten Krankheiten letztlich positiv beeinflussen. Weiterhin könnte unser vorgeschlagener Mechanismus – spezifische Oberflächenwechselwirkungen stabilisieren charakteristische Reaktionsintermediate der Fibrillenkeimbildung – nützlich sein, um die Wechselwirkung von Amyloidpeptiden mit Oberflächen im Allgemeinen besser zu verstehen und zu nutzen. Er könnte erklären, wie Plasmamembranen aktiv Amyloidoligomerisierung oder Fibrillenwachstum fördern, und warum chemische Modifizierungen wie zum Beispiel Lipidperoxidation die Fibrillenbildung beeinflussen. Weiterhin könnten wir alternativ die oberflächenbasierte Katalyse für die industrielle Herstellung von funktionalen Fibrillen nutzen und verbessern.
Acknowledgements
Wir danken G. Brancolini und S. Corni für aufschlussreiche Diskussionen, hilfreiche Hinweise und insbesondere für die Bereitstellung der Kraftfeldparameter für Gold und Citrat. Des Weiteren danken wir F. Cichos, D. Huster, W. Jancke und W. Paul für die Diskussionen mehrerer wesentlicher Aspekte dieser Arbeit. Wir danken der Deutschen Forschungsgemeinschaft für finanzielle Unterstützung im Rahmen des SFB/TRR 102 und dem Land Niedersachsen für Unterstützung im Rahmen der life@nano-Initiative.




