Aktuelle Diagnostik und Behandlung des Basalzellkarzinoms
Für das Komitee „Epitheliale Tumoren“ der Arbeitsgemeinschaft Dermatologische Onkologie (http://ado-homepage.de/projekte/)
Prädilektionsstellen sind in etwa 50 % der Fälle der Kopf-Hals-Bereich, in ca. 50 % Stamm und Extremitäten.
Eine zentrale Rolle bei der Entwicklung des BCC spielt die chronische Aktivierung des Sonic-Hedgehog-Signaltransduktionsweges.
Die Therapie der ersten Wahl stellt die vollständige operative Resektion des BCC dar.
Beim Gorlin-Goltz-Syndrom ist eine Bestrahlung aufgrund der Induktion von Zweittumoren kontraindiziert.
Auf der Basis der pathogenetischen Erkenntnisse mit Aktivierung des SHH-Signalwegs wurden zielgerichtete Substanzen entwickelt, die den SHH wieder inhibieren und die therapeutisch eingesetzt werden können.
Bei der Anwendung der Hedgehog-Inhibitoren ist deren potenzielle Teratogenität zu beachten.
Bei der Nachsorge von Patienten mit einem primären BCC sollten das Risiko für die individuelle Entstehung eines Lokalrezidivs und die Ausbildung weiterer BCC an anderen Körperlokalisationen berücksichtigt werden.
Zusammenfassung
Das Basalzellkarzinom ist der häufigste Tumor des hellhäutigen Menschen, altersstandardisiert liegt die Inzidenz bei 63 (Frauen) bzw. 80 (Männer) pro 100 000 Einwohner pro Jahr in Deutschland. Frühe Läsionen können klinisch eine diagnostische Herausforderung darstellen, hier können nichtinvasive Diagnoseverfahren wie die optische Kohärenztomographie und die konfokale Laserscanmikroskopie hilfreich sein. Die klinische Verdachtsdiagnose wird in der Regel mittels Gewebeuntersuchung histologisch bestätigt. Die Standardtherapie besteht in einer histologisch gesicherten, kompletten Resektion, wahlweise mittels mikrographisch Schnittrand-kontrollierter Chirurgie oder entsprechend der Tumorgröße, -lokalisation und Infiltration mit 3–5 und mehr Millimetern Sicherheitsabstand, um das Rezidivrisiko zu mindern. Therapeutisch können insbesondere multiple Basalzellkarzinome (wie beim Gorlin-Goltz-Syndrom) oder lokal fortgeschrittene bzw. selten auch metastasierende Basalzellkarzinome ein Problem darstellen. Bei oberflächlichen Basalzellkarzinomen können nichtoperative Verfahren wie die photodynamische Therapie oder topische Medikamente erwogen werden. Bei lokal inoperablen oder metastasierenden Basalzellkarzinomen sollten in einer interdisziplinären Tumorkonferenz Therapieempfehlungen ausgesprochen werden, zu den Optionen zählen in dieser Situation eine Strahlentherapie oder eine Systemtherapie miteinem Hedgehog-Inhibitor.
Einleitung
Das Basalzellkarzinom (BCC), das zunehmend als solches und nicht mehr als „Basaliom“ bezeichnet wird, ist die häufigste Tumorerkrankung des hellhäutigen Menschen. Im Bereich von Diagnose und Therapie gibt es verschiedene Entwicklungen, der aktuelle Stand wird in dieser Arbeit dargestellt.
Definition und Epidemiologie
Das BCC ist eine lokal destruierende epitheliale Neoplasie mit basaloider Differenzierung. Es ist der häufigste Hauttumor weltweit und macht 80 % der nichtmelanozytären Hauttumoren aus. Der Tumor wächst langsam, entwickelt sich meist über Jahre und tritt durchschnittlich im Alter von 60 Jahren auf, wobei zunehmend auch jüngere Patienten (< 40 Jahre) erkranken.
Prädilektionsstellen sind in etwa 50 % der Fälle der Kopf-Hals-Bereich, in ca. 50 % Stamm und Extremitäten 1. Eine Metastasierung tritt in 0,0028–0,55 % der Fälle und damit extrem selten auf, jedoch ist durch lokal destruierendes Wachstum in Vitalstrukturen ein letaler Verlauf möglich 2. Vorwiegend sind helle Hauttypen (Typ I–II nach Fitzpatrick) betroffen, das BCC tritt bei Männern häufiger auf 3. Da nichtmelanozytäre Hauttumoren in den nationalen Krebsregistern oft nicht systematisch registriert werden, geht man von einer Untererfassung aus. In Europa stieg die altersstandardisierte Inzidenzrate um das 3fache in den letzten 30 Jahren (1978 bis 2007 von 27,1 auf 96,6 Fälle pro 100 000 Einwohner/Jahr bei Frauen und von 34,2 auf 91,2 Fälle pro 100 000 Einwohner/Jahr bei Männern) 4; ähnliche Zahlen gelten für Deutschland 5. Hier beträgt die rohe Inzidenzrate für BCC 96,2 pro 100 000 Einwohner/Jahr bei Männern und 95,3 pro 100 000 Einwohner/Jahr bei Frauen, die altersstandardisierten Raten sind etwas niedriger (Tabelle 1). Da bei den nach der europäischen Standardbevölkerung altersstandardisierten Raten die älteren Geburtsjahrgänge herausgerechnet werden, diese aber besonders häufig Basalzellkarzinome entwickeln, wurde explizit die rohe Rate angegeben, da diese die tatsächlichen Zahlen besser widerspiegelt. Im Jahr 2011 betrug die Zahl der Neuerkrankungen in Deutschland bei Männern 67 527 und bei Frauen 59 420. Im Vergleich hierzu sind die Inzidenzraten in den USA 10fach und in Australien 20fach höher (Tabelle 1). In den USA (New Mexico) erhöhte sich von 1977/78 bis 1998/99 die Inzidenzrate um 50 % bei Männern und 20 % bei Frauen. Die Mortalitätsrate für das BCC ist sehr gering und hat über einen Zeitraum von 20 Jahren sowohl in den USA als auch in Europa weiter abgenommen. Im Zeitraum 1988–2000 betrug diese 0,05/100 000 Einwohner/Jahr in den USA, in Finnland wurden 1995 identische Zahlen berichtet, in Deutschland lagen diese mit 0,24 (Männer) und 0,11 (Frauen) 1999 etwas niedriger 2.
Tabelle 1. Inzidenzraten des BCC in New Mexico, USA, in Queensland, Australien und Deutschland. Die Inzidenzraten sind jeweils pro 100 000 Einwohner/Jahr angegeben, altersstandardisiert nach der Europäischen Standardpopulation, der US Population sowie der Weltstandardpopulation 5, 6
| Deutschland 2004 | New Mexico, USA 1998/1999 | Queensland, Australien 2006 | |||
|---|---|---|---|---|---|
| Männer | Frauen | Männer | Frauen | Männer | Frauen |
| 80,8 | 63,3 | 920 | 486 | 1 541 | 1 070 |
Pathogenese und Risikofaktoren
Lange wurde der Ursprung des BCC in Zellen des Haarfollikels oder in epidermalen Stammzellen der äußeren Haarwurzelscheide vermutet. In einem Mausmodell wurde gezeigt, dass BCC sich auch aus Zellen der interfollikulären Epidermis entwickeln können. Eine zentrale Rolle bei der Entwicklung des BCC spielt die chronische Aktivierung des Sonic-Hedgehog-Signaltransduktionsweges (SHH). Die Hedgehog-Familie ist von Bedeutung für das Wachstum, die Differenzierung, Morphogenese und Funktion verschiedener Zellen und Organe. Des Weiteren ist sie an epithelialen und mesenchymalen Interaktionen beteiligt. Eine Mutation des SHH-Inhibitors Patched (PTCH) führt zur kontinuierlichen Aktivierung von Smoothened (SMO), das nachfolgend die GLI-Familie (Transkriptionsfaktoren) aktiviert 6, die u. a. eine Apoptoseresistenz von Keratinozyten induziert. Sporadisch auftretende BCC zeigen in 10 % eine aktivierende Mutation von SMO, in 90 % eine inaktivierende PTCH-Mutation, die auch bei Patienten mit Gorlin-Goltz-Syndrom und Xeroderma pigmentosum nachgewiesen wurde 7. Punktmutationen sowohl in p53 als auch in PTCH sind vorwiegend UV-spezifischen Transitionen zuzuordnen 8, eine Assoziation, welche auf Grund der genetischen Hinweise die UV-Strahlung als einen Hauptrisikofaktor in der Pathogenese der BCC unterstreicht.
Der Hauptrisikofaktor ist die UV-Exposition, wobei diese wesentlich komplexer und weniger mit der kumulativen Dosis assoziiert ist als beim kutanen Plattenepithelkarzinom. Beim BCC scheint die Art der UV-Exposition (intermittierend vs. chronisch), der Zeitpunkt (Kindheit vs. Erwachsenenalter), die Quelle (natürlich vs. künstlich) und Menge (Zahl der schweren Sonnenbrände) das Risiko zu variieren. Weitere Risikofaktoren beinhalten Immunsuppression, Traumata, Exposition mit Arsen und Steinkohleteer, ionisierende Strahlen sowie Genodermatosen wie z. B. das Gorlin-Goltz-Syndrom oder Xeroderma pigmentosum. Hier können sich schon in der Kindheit multiple BCC entwickeln (Tabelle 2).
Tabelle 2. Risikofaktoren für die Entwicklung von Basalzellkarzinomen
| Risikofaktoren | RR (95 %-KI) | |
|---|---|---|
| Heller Hauttyp (I–II) | Typ I vs. Typ IV | 5,1 (1,4–11,3) |
| UV-Exposition | 1,34 (1,01–1,87) | |
▸ Intermittierend ▸ Solariumsbesuche |
> 6 Sonnenbrände | |
| Exposition mit | ||
| ▸ Arsen | 1,44 (0,74–2,81) | |
| ▸ Steinkohleteer | ||
| ▸ ionisierenden Strahlen | 3,0 (1,6–5,5) | |
Genodermatosen ▸ Albinismus ▸ Xeroderma pigmentosum ▸ Gorlin-Goltz-Syndrom ▸ Bazex-Dupré-Christol-Syndrom ▸ Rombo-Syndrom ▸ multiple familiäre Trichoepitheliome |
Auftreten multipler BCC in der Kindheit möglich | |
Immunsuppression ▸ organtransplantierte Patienten |
||
Chronische Traumata ▸ Radioderm ▸ Narben ▸ Ulzera |
||
- Abk.: RR, relatives Risiko; KI, Konfidenzintervall
Diagnostik und Klassifikation
- ▸ superfizielles Basalzellkarzinom,
- ▸ noduläres (solides) Basalzellkarzinom,
- ▸ mikronoduläres Basalzellkarzinom,
- ▸ infiltratives Basalzellkarzinom,
- ▸ fibroepitheliales Basalzellkarzinom (Pinkus-Tumor),
- ▸ Basalzellkarzinom mit Adnexdifferenzierung,
- ▸ basosquamöses Karzinom,
- ▸ keratotisches Basalzellkarzinom.
Das BCC ist histologisch charakterisiert durch Zellen, die dem embryonalen Haarkeim ähnlich sind (Abbildung 1a, b). Basaloide Zellen haben einen basophilen ovalen Kern mit unauffälligem Nukleolus und schmalem Zytoplasma. Die Tumorzellen sind von einem fibromuzinösen Stroma umgeben. Typisch ist eine palisadenartige Anordnung der Tumorzellen am Rand der Tumorzellaggregate. Die Tumorzellen zeigen einen Kontakt zum Oberflächenepithel. Immunhistochemisch reagieren BCC mit Panzytokeratinmarkern wie MNF116 und sind Zytokeratin-5/6- und Zytokeratin-17-positiv. Zur differenzialdiagnostischen Abgrenzung von Spinaliomen wird der monoklonale Antikörper BerEP4 eingesetzt, BCC färben in der Regel durchgängig mit dem Antikörper an.
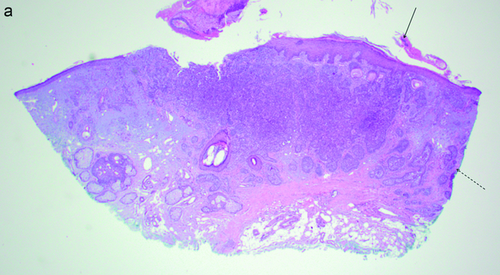
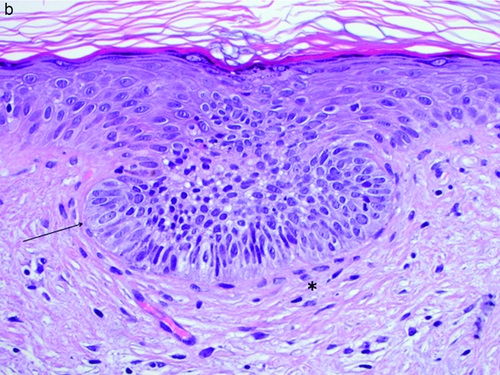
Das superfizielle Basalzellkarzinom ist gekennzeichnet durch scheinbar voneinander getrennt liegende, sich in die papilläre Dermis vorschiebende, meist rundliche Tumorzellknospen. Zwischen Tumorzellen und umgebendem Bindegewebe findet sich ein charakteristischer Retraktionsartefakt. Bei einem länger bestehenden Tumor können sich die Tumorknospen in die tieferen Lagen der Dermis ausdehnen und ein sekundär knotiges Wachstum zeigen.
Das noduläre BCC besteht aus großen Knoten peripher palisadierter basaloider Zellen, die sich bis in die retikuläre Dermis oder tiefer vorschieben. Innerhalb der Tumorzellaggregate können als Folge von degenerativen Veränderungen muzinös- zystische Hohlräume vorhanden sein. Es finden sich peritumorale Retraktionsartefakte und ein fibromuzinöses Stroma.
Das mikronoduläre BCC zeigt im Vergleich zum nodulären BCC kleinere Tumorzellknoten. Die typischen peritumoralen Spaltbildungen fehlen.
Das infiltrative BCC besteht aus kleinen Strängen basaloider Tumorzellen, die nur ein bis zwei Zelllagen breit sein können. Eine peritumorale Spaltbildung und eine Palisadierung der peripheren Tumorzellen fehlen. Die sklerodermiforme (morpheaartige) Variante ist gekennzeichnet durch eine ausgeprägte Stromafibrose oder -sklerose.
Das fibroepitheliale BCC, der sogenannte Pinkus-Tumor, zeigt von der Epidermis ausgehende, netzartig verzweigte schmale Tumorzellstränge, die basaloide Haarkeim-artige Strukturen tragen und von einem fibrovaskulären Stroma umgeben sind.
Das Basalzellkarzinom mit Adnexdifferenzierung ist durch Tumoranteile charakterisiert, die in Richtung der Hautanhangsgebilde differenziert sind. Dabei können apokrine, ekkrine, sebaceöse und follikuläre Differenzierungen vorkommen.
Das basosquamöse Karzinom ist ein seltener Subtyp des Basalzellkarzinoms, das eine squamöse Differenzierung aufweist. Histologisch haben die Tumorzellen ein breiteres Zytoplasma, ein offeneres Chromatin und sind pleomorph. Die für das BCC typische Palisadierung ist nicht durchgängig vorhanden. Immunhistochemisch fehlt eine durchgängige Expression von BerEP4. Die Prognose des basosquamösen Karzinoms ist schlechter und entspricht eher dem Plattenepithelkarzinom als einem BCC.
Das keratotische Basalzellkarzinom hat die Architektur eines nodulären BCC, ist durch eine prominente Verhornung mit Ausbildung von Hornzysten innerhalb der Tumorzellverbände charakterisiert. Zudem sieht man häufig eine dystrophe Kalzifikation.
Jedes exzidierte BCC soll histologisch untersucht werden. Die Art der histologischen Aufbereitung ist im Kontext mit dem operativen Verfahren zu betrachten. Im Fall einer mikrographisch kontrollierten Chirurgie werden die Absetzungsränder histologisch lückenlos aufbereitet. So ist eine topographische Zuordnung von subklinischen Ausläufern möglich, deren Nachweis gezielte Nachexzisionen erfordern, bis die Exzidataußenfläche tumorfrei ist. Auch bei kleinen unproblematischen Tumoren kann das Verfahren von Vorteil sein, da wegen der hohen diagnostischen Sicherheit gesunde Haut geschont werden kann und nur entsprechend der histologisch festgestellten Tumorinfiltration exzidiert wird 10. Eine histographische Schnittrandkontrolle wird in der deutschen Leitlinie für alle „Problemlokalisationen“ wie das Gesicht (Lider, Lippe, Nase, Ohr) in Verbindung mit Größe und histologischem Typ sowie für Rezidivtumoren empfohlen. Eine konventionelle Histologie ist bei Operation von kleinen Tumoren in jeder Lokalisation und größeren Tumoren an Stamm und Extremitäten obligat 10.
Nichtinvasive Diagnostik
Bei der klinischen Untersuchung können verschiedene Verfahren hilfreich sein. Dazu gehört die Auflichtmikroskopie, die optische Kohärenztomographie (OCT) sowie die konfokale Laserscanmikroskopie, welche eine spezielle apparative Ausstattung und eine spezielle Erfahrung erfordern. Im Rahmen von Studien wurden Kriterien definiert, welche die Sensitivität und Spezifität der Diagnose eines BCC erhöhen können 10-14. Darüber hinaus können diese Verfahren auch bei der präoperativen Festlegung der Exzisionsränder sowie bei der Verlaufskontrolle nach topischen Therapieverfahren sinnvoll sein. Bei der konfokalen Laserscanmikroskopie gelten elongierte, monomorphe Zellkerne mit Polarisierung entlang einer Achse, ein ausgeprägtes Entzündungsinfiltrat mit vermehrten und dilatierten Gefäßen sowie der Verlust der epidermalen Honigwabenstruktur als Hauptkriterien für ein BCC. Bei der OCT treten scharf abgegrenzte subepidermale rundlich-ovaläre Läsionen auf, die signalärmer sind als das umgebende Gewebe. In der Umgebung finden sich oft signalarme längliche Strukturen 15.
Therapie
Die Therapie der ersten Wahl stellt die vollständige operative Resektion des BCC dar. Bei superfiziellen BCC sind auch topische Therapien zugelassen. Bei lokal fortgeschrittenen oder metastasierenden BCC kann eine Strahlentherapie oder eine Systemtherapie diskutiert werden 10, 14.
Operative Therapie
Bei der operativen Therapie gibt es verschiedene Möglichkeiten. Insbesondere im Gesichtsbereich ist eine mikroskopisch-kontrollierte (synonym: mikrographische) Chirurgie (MKC, Mohs surgery) mit systematischer histologischer Randschnittkontrolle etabliert 10. Durch eine Kennzeichnung der Resektionsränder können gezielte Nachexzisionen erfolgen. Hierdurch kann zugunsten ästhetisch-funktioneller Aspekte beim Defektverschluss so viel gesunde Haut wie möglich eingespart werden. Eine große niederländische Studie hat die Exzision mit kleinem (ca. 3 mm) Sicherheitsabstand mit der MKC verglichen. Es wurden entweder primäre BCC (203 pro Gruppe) oder Rezidiv-BCC (102 pro Gruppe) im Gesichtsbereich behandelt. In der Langzeit-Nachbeobachtung nach zehn Jahren zeigte sich bei den Rezidiv-BCC ein signifikanter Vorteil zugunsten der mikrographisch-kontrollierten Chirurgie (3,9 % vs. 13,5 % Rezidive, p = 0,023). Bei den primären BCC war der Unterschied nicht signifikant (4,4 % vs. 12,2 % Rezidive, p = 0,10) 16. Die mikrographische Chirurgie sollte also insbesondere an Lokalisationen angewendet werden, in denen eine möglichst sparsame Exzision mit möglichst geringem Sicherheitsabstand notwendig ist, wie dem Gesichtsbereich. Eine Operationstechnik mit tumoradaptiertem Sicherheitsabstand und konventioneller Histologie kann an unproblematische Lokalisationen, z. B. am Rumpf, gewählt werden. Da bei den infiltrativen Subtypen mit höheren Rezidivquoten gerechnet werden muss, wird bei der konventionellen Chirurgie ein Sicherheitsabstand von 0,3–1 cm empfohlen. Bei multizentrisch-oberflächlichen BCC im Stamm- und Extremitätenbereich kann in Ausnahmefällen eine horizontale Exzision (Shave-Exzision) mit konventioneller Histologie erwogen werden, insbesondere bei multiplen Läsionen.
Auch wenn es keine kontrollierten randomisierten Studien zur Operation des BCC im Vergleich zu nichtoperativen Therapieoptionen gibt, wird die Operation als Therapie der ersten Wahl in den Leitlinien empfohlen. Neben der geringen Rezidivrate bei histologischer Schnittrandkontrolle besteht der Vorteil der chirurgischen Therapie in dem zeitlich effektiven und kontrollierten Eingriff unabhängig von der Compliance der Patienten. Nachteile sind die üblichen Operationsrisiken (insbesondere Nachblutungen, Infektionen und Wundheilungsstörungen) sowie ästhetisch oder funktionell störende Narben (z. B. Ektropiumbildung) und Pigmentierungsverschiebungen. Zudem stellen die häufig in Lokalanästhesie durchgeführten Eingriffe, insbesondere bei Eingriffen im Gesichtsbereich, für den Patienten oft eine erhebliche Belastungssituation dar. Die Lokalanästhesie muss oft großflächig durchgeführt werden und wird lokalisationsabhängig (u. a. an der Nase) als sehr schmerzhaft empfunden. Als Grundlage für eine gute operative Therapie sollte daher eine auch juristisch absichernde Aufklärung über Art des Eingriffes mit Erläuterung der Operationstechnik inklusive der Art der Anästhesie und das Auftreten von möglichen Komplikationen dazugehören. Von einer operativen Therapie sollte abgesehen werden, wenn eine vollständige Exzision unwahrscheinlich erscheint, der Eingriff zu einer starken Deformierung und Morbidität führen würde und wenn den Patienten aufgrund des Allgemeinzustandes die operative Therapie zu sehr belasten würde. Dennoch kann auch bei fortgeschrittenen Tumoren eine operative Tumorverkleinerung in Kombination mit anderen Therapieoptionen wie Radiatio nützlich sein. Der Begriff postoperative Deformierung wird subjektiv von den Patienten sehr unterschiedlich wahrgenommen, dieses sollte im präoperativen Gespräch sorgfältig herausgearbeitet werden.
Topische Therapien
Zur Behandlung des BCC sind drei topische Therapien zugelassen: Imiquimod, 5-Fluorouracil (5-FU) und die photodynamische Therapie (PDT). In einer Vergleichsstudie zu diesen drei Verfahren bei oberflächlichen BCC (189–196 Patienten pro Gruppe) schnitt Imiquimod am besten ab (83,4 % Behandlungserfolg), gefolgt von 5-FU (80,1 %) und der PDT (72,8 %), der Unterschied zwischen Imiquimod und der PDT war signifikant 17. Diese Verfahren kommen bevorzugt bei superfiziellen BCC zum Einsatz. So konnte eine Studie zeigen, dass die Rezidivrate nach einer Imiquimod-Behandlung ab einer Eindringtiefe von 0,4 mm ansteigt. Nach einer mittleren Nachbeobachtung von 34 Monaten hatten 108 behandelte Patienten mit superfiziellen BCC bis zu 0,4 mm Tumordicke kein Rezidiv, aber 11/19 (58 %) mit einer Tumordicke > 0,4 mm 18. Für alle topischen Therapien gilt, dass der Patient über die Möglichkeit einer Operation aufgeklärt werden muss und dass regelmäßige Kontrollen vereinbart werden müssen, da die Rezidivraten höher sind als bei der Operation und ein Rezidiv früh erkannt werden sollte. Im Folgenden werden die Therapien detailliert dargestellt.
Imiquimod
Imiquimod gehört zur Gruppe der immune response modifier. Die Wirkung erfolgt durch Stimulierung der Toll-Like-Rezeptoren 7 und 8. Über die Aktivierung von nuclear factor-κB (NFκB) kommt es zu einer Induktion verschiedener proinflammatorischer Mediatoren und zur Migration von Entzündungszellen.
Imiquimod ist zugelassen für die Behandlung kleiner superfizieller Basalzellkarzinome bei immunkompetenten Erwachsenen. Die Behandlung ist auf eine maximale Tumorgröße von 2 cm2 außerhalb der „Risikolokalisationen“ (Nase, Ohren, Augenlider, Anogenitalregion, Hände und Füße) beschränkt. Die Anwendung erfolgt 5 x/Woche über einen Zeitraum von 6 Wochen, der Therapieerfolg sollte 12 Wochen nach Therapieende überprüft werden.
Bei Patienten mit Gorlin-Goltz-Syndrom gibt es Berichte über einen effektiven Einsatz von Imiquimod bei multiplen Basalzellkarzinomen, zudem existieren auch Fallberichte über den erfolgreichen Einsatz von Imiquimod bei Patienten mit Xeroderma pigmentosum 19. Organtransplantierte Patienten stellen nach der aktuell gültigen Zulassung explizit eine Anwendungsbeschränkung dar.
Als Nebenwirkungen treten insbesondere Lokalreaktionen mit Erythem, Juckreiz, Brennen, Erosionen, Ulzerationen und Krustenbildung auf. Es besteht jedoch eine positive Assoziation zwischen Nebenwirkung und Therapieerfolg 20. Neben Lokalreaktionen können systemische Reaktionen (grippeartige Symptome) auftreten.
5-Fluorouracil
5-Fluorouracil (5-FU) gehört zu den Pyrimidinanaloga. Die Metabolite von 5-FU werden als fehlerhafte Bausteine in DNA und RNA eingebaut und hemmen die Thymidylatsynthetase. Diese Mechanismen führen zu einer Hemmung des Zellwachstums und zur Apoptose. Dadurch, dass diese Mechanismen insbesondere an Gewebe mir hoher Proliferation wirken, besteht eine gewisse Selektivität für maligne Tumorzellen. 5-FU ist in einer Cremegrundlage mit einer Konzentration von 5 % zugelassen zur Therapie von aktinischen Keratosen, Morbus Bowen und superfiziellen Basalzellkarzinomen, wenn bei diesen eine chirurgische oder radiologische Maßnahme erfolglos war oder nicht anwendbar ist. Die Anwendung erfolgt 2 x täglich über einen Zeitraum von 3–6 Wochen, wobei die Behandlung bis zum Auftreten einer Erosion erfolgen sollte und der Einsatz ggf. verlängert werden kann. An Nebenwirkungen treten insbesondere Erytheme, Juckreiz, Schmerzen, Erosionen und Ulzerationen auf.
Photodynamische Therapie
Die Photodynamische Therapie (PDT) wird mit Sensibilisatoren (5-Aminolävulinsäure [ALA] bzw. dem Methylester Methyl-5-Amino-Oxopentotat [MAL]) durchgeführt, welche das Stratum corneum und die Epidermis durch die geringe Molekülgröße penetrieren und selektiv in Tumorzellen akkumulieren. Daher ist der Gewebeschaden weitgehend auf die Tumorzellen beschränkt und umliegendes Gewebe kann geschont werden, hierdurch kommt es selten zur Narbenbildung und somit zu einem guten kosmetischen Ergebnis.
Während der Inkubationszeit kommt es zur Umwandlung von ALA/MAL in Protoporphyrin IX (PpIX). Licht mit einer geeigneten Wellenlänge (s. u.) aktiviert PpIX und führt zur Bildung von reaktiven Sauerstoffspezies, insbesondere Singulett-Sauerstoff (ROS). Bei einer ausreichenden Menge von ROS in den Tumorzellen führt dies zur Nekrose oder Apoptose. Porphyrine weisen ein Absorptionsspektrum mit einem Maximum bei etwa 405 nm auf, es existieren jedoch weitere Banden mit verschiedenen Absorptionsmaxima; beispielsweise bei 635 nm, welches im Bereich des roten Lichts liegt, eine höhere Eindringtiefe aufweist und daher bevorzugt verwendet wird.
Als Lichtquellen werden Laser und inkohärente Lichtquellen verwendet. An inkohärenten Lichtquellen existieren LED-Lampen und Halogen-Lampen. LED-Lampen emittieren ein schmales Wellenlängenspektrum, wodurch niedrigere Lichtdosen möglich sind und Hitzeeffekte durch Wellenlängen vermieden werden können, die für die phototoxischen Reaktionen nicht notwendig sind. Gepulstes Laserlicht mit einer Wellenlänge von 585 nm oder der langgepulste Farbstofflaser sind ebenfalls für eine photodynamische Therapie geeignet, durch die kurze Zeitexposition ist die Behandlung weniger schmerzhaft. Der Vorteil in der Verwendung der inkohärenten Lichtquellen besteht in der Größe des Behandlungsfeldes, dieses ist bei einer Feldkanzerisierung häufig notwendig. In unkontrollierten Fallserien wurde weiterhin die sogenannte „Tageslicht“-PDT angewendet, in welcher die behandelte Läsion direkt nach dem Auftragen von MAL für ca. zwei Stunden kontinuierlich dem Tageslicht ausgesetzt wurde. Nach einem Jahr Nachbeobachtung waren 74 % der behandelten Läsionen weiterhin in kompletter Remission, so dass die Durchführung kontrollierter Studien sinnvoll erscheint 21.
Zugelassen für die Behandlung von superfiziellen und (nach Debulking) nodulären BCC ist die MAL-PDT, wobei die Zulassung der Therapie auf die Behandlung von BCC beschränkt ist, die aufgrund einer möglichen Morbidität und ggf. eines schlechteren kosmetischen Ergebnisses für andere therapeutische Verfahren nicht geeignet sind. Sollte die vertikale Tumordicke größer als 3 mm sein, muss zuvor eine Abtragung der exophytischen Tumoranteile durchgeführt werden. Auch hier gilt, je größer die Tumordicke desto höher die Rezidivgefahr, daher sollte der Patient immer über die Möglichkeit einer Operation aufgeklärt und die Notwendigkeit einer Nachkontrolle besprochen werden. Als Standard für die Beleuchtung gilt derzeit die Verwendung von inkohärenten Lichtquellen mit Lampen oder LEDs. Hierbei sollte eine Lichtdosis bei Verwendung von Lampen mit einem breiten Wellenlängenspektrum (580–700 nm) von 100 bis 150 J/cm2 und bei Verwendung von LEDs von 37–50 J/cm2 eingestellt werden. Eine zweimalige Behandlung im Abstand von ca. einer Woche ist effektiver als eine einmalige Behandlung.
Die häufigsten Nebenwirkungen der PDT sind Schmerzen und brennende Sensationen. Diese sind bei der Behandlung von BCC deutlich geringer ausgeprägt als bei der Therapie von aktinischen Keratosen, insbesondere in Fällen einer Feldkanzerisierung. Ein Auftragen von topischen Lokalanästhetika wird explizit nicht empfohlen, da es durch Veränderung des pH-Wertes zu einer Inaktivierung des Photosensibilisators kommt, zudem hemmt die Vasokonstriktion den sauerstoffabhängigen Effekt der PDT.
Die PDT ist geeignet zur Behandlung von BCC beim Gorlin-Goltz-Syndrom. Auch der Einsatz einer wiederholten PDT zur Prävention von häufigen BCC-Rezidiven wurde beschrieben 22. Zudem ist die PDT eine Therapieoption von BCC bei organtransplantierten und immunsupprimierten Patienten.
Strahlentherapie
Die Strahlentherapie ist eine Therapieoption, wenn eine Operation aufgrund der Lokalisation oder Ausdehnung des BCC oder aufgrund von Komorbiditäten nicht möglich oder sinnvoll ist. Sie kann auch bei inkompletter R1- oder R2-Resektion erwogen werden. Üblicherweise werden Elektronen oder Photonen bis zu einer Gesamtdosis von 60–70 Gy (Primärtumoren und R2-Resektion) oder 50–60 Gy (R1-Resektion) angewendet 10, 14, 23. Eine kürzlich erschienene Metaanalyse hat 5-Jahres-Abheilungsraten von 83–95 % für die Strahlentherapie ergeben 21. Es gibt Hinweise darauf, dass die Strahlentherapie bei sklerodermieformen BCC weniger effektiv ist als bei nodulären BCC 24. Beim Gorlin-Goltz-Syndrom ist eine Bestrahlung aufgrund der Induktion von Zweittumoren kontraindiziert.
Systemische Therapie
In seltenen Fällen können Patienten BCC aufweisen, die metastasiert haben oder lokal soweit fortgeschritten sind, dass primär eine operative, topische oder strahlentherapeutische Behandlung nicht in Frage kommt. In dieser Situation kann eine systemische medikamentöse Therapie erwogen werden. Verschiedene Chemotherapien, wobei keine Substanz entsprechend in Studien geprüft und zugelassen wurde, zeigten nur kurzzeitige Erfolge 25. Auf der Basis der pathogenetischen Erkenntnisse mit Aktivierung des SHH-Signalwegs wurden zielgerichtete Substanzen entwickelt, die den SHH wieder inhibieren und die therapeutisch eingesetzt werden können. Es handelt sich dabei vor allem um Cyclopamin-Derivate, die SMO blockieren. Mit Vismodegib (Erivedge®) ist eine erste Substanz zugelassen zur Behandlung des metastasierenden oder lokal fortgeschrittenen BCC, welches für eine Bestrahlung oder eine Operation nicht in Frage kommt. Für eine weitere Substanz (Sonidegib) liegen Daten aus klinischen Phase-I- und -II-Studien vor 26. Es handelt sich um einen weiteren Hedgehog-Signalweg-Inhibitor, welcher wie Vismodegib oral verabreicht werden kann. Der Einsatz sollte nach sorgfältiger Abwägung in einer interdisziplinären Tumorkonferenz erfolgen.
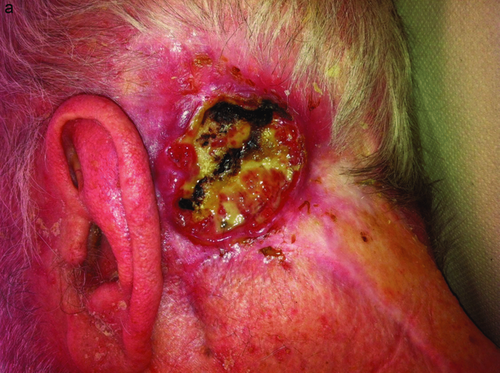
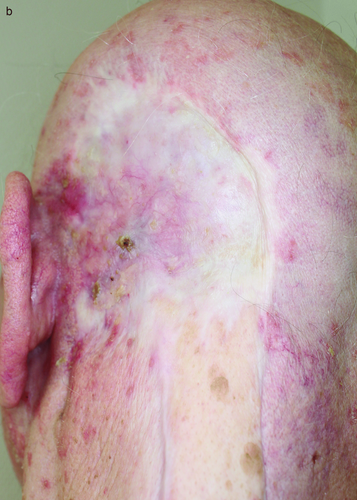
Die Zulassungsstudie für Vismodegib wurde 2012 publiziert 27, im Jahr 2014 wurden Daten einer Nachbeobachtungszeit von 30 Monaten auf Kongressen berichtet. Von den 33 Patienten mit metastasierendem BCC zeigten 48,5 % ein Ansprechen, die mediane Dauer des Ansprechens war 14,8 Monate. Von 66 Patienten mit lokal fortgeschrittenem BCC zeigten 60,3 % ein Ansprechen mit einer medianen Ansprechdauer von 26,2 Monaten. Die Wirkung wird auch durch einen Fall (Abbildung 2a, b) illustriert.
Sonidegib wurde in einer Phase-II-Studie in zwei unterschiedlichen Dosierungen untersucht. Neunundsiebzig Patienten wurden 200 mg verabreicht, 151 Patienten 800 mg 26. Nach 13,9 Monaten medianer Nachbeobachtung hatten 36 % der Patienten in der Gruppe mit 200 mg und 34 % der Patienten in der Gruppe mit 800 mg ein objektives Ansprechen. In der Gruppe mit 200 mg benötigten 32 % der Patienten eine Dosismodifikation aufgrund von Nebenwirkungen, in der Gruppe mit 800 mg waren es 60 % der Patienten.
Zu beachten ist, dass die Studien zu Vismodegib und Sonidegib nicht vergleichbar sind, insbesondere aufgrund unterschiedlicher Ansprechkriterien und Nachbeobachtungszeiten. Die Nebenwirkungen waren jedoch für beide Substanzen vergleichbar, so dass von Klasseneffekten auszugehen ist.
Als Nebenwirkungen können bereits in den ersten Tagen der Behandlung Muskelprobleme (Muskelschmerzen, Muskelkrämpfe) und Geschmacksstörungen (Dysgeusie) bis zu einem vollständigen Geschmacksverlust (Ageusie) auftreten. Im weiteren Verlauf kann es zu gastrointestinalen Problemen wie Diarrhoen und Gewichtsabfall kommen. Alle diese Nebenwirkungen sind reversibel und bilden sich in einigen Wochen nach Absetzen zumeist zurück. Innerhalb der ersten Therapiemonate kommt es häufig zu Haarausfall. Dieser kann auch nach Absetzen persistieren, bei einigen Patienten kam es zu keinem Haarwachstum mehr 28.
Bei der Anwendung der Hedgehog-Inhibitoren ist deren potenzielle Teratogenität zu beachten 29. Patienten müssen darüber im Vorfeld aufgeklärt werden und während sowie bis zu zwei Jahre nach der Therapie eine wirkungsvolle Empfängnisverhütung betreiben.
Nachsorge und Prävention
Bei der Nachsorge von Patienten mit einem primären BCC sollten das Risiko für die individuelle Entstehung eines Lokalrezidivs und die Ausbildung weiterer BCC an anderen Körperlokalisationen berücksichtigt werden. Davon abzugrenzen sind Patienten mit Genodermatosen, einer medikamentösen Immunsuppression (vgl. Tabelle 2) oder bereits aufgetretenen Lokalrezidiven.
Die Lokalrezidivrate hängt von dem histologischen BCC-Typ sowie von der erfolgten Behandlung ab. Die Empfehlung der aktuellen deutschsprachigen BCC-Leitlinie hinsichtlich einer jährlichen Hautuntersuchung basiert auf einer Übersichtsarbeit von Rowe et al., nach der 41–66 % der Rezidive in diesem Zeitraum diagnostiziert werden 10, 30, 31.
Das kumulative Risiko für die Ausbildung weiterer Basalzellkarzinome an anderen Körperlokalisationen beträgt innerhalb der ersten drei Jahre durchschnittlich 44 % (33–70 %) 32. In diesem Zeitraum werden zunächst halbjährliche, später jährliche Hautuntersuchungen empfohlen (vgl. Tabelle 3). Nicht jeder Patient mit einem primären BCC hat das gleiche Risiko, weitere BCC zu entwickeln. In einer kürzlich publizierten Kohortenstudie mit annährend 1 300 Patienten bildeten sich in 40 % der Fälle mit primärem BCC innerhalb der nächsten zehn Jahre keine weiteren BCC aus. Dieser Trend zeichnete sich bereits nach zwei bzw. vier Jahren ab. Hatten die Patienten nach dieser Zeit keine weiteren BCC entwickelt, wiesen sie ein niedrigeres Risiko für die Entstehung weiterer BCC auf 31.
Tabelle 3. Empfohlenes Nachsorgeschema für Patienten mit einem Basalzellkarzinom (adaptiert nach 9, 22, 24)
| Risikotypen | Nachsorge (Hautuntersuchungen) | |||
|---|---|---|---|---|
| Jahr 1 | Jahr 2 | Jahr 3 | ab Jahr 4 | |
| Primäres BCC | Jährlich | |||
| Rezidiv-BCC | Halbjährlich | Jährlich | ||
| Basosquamöses BCC | Individuell* | Individuell | ||
| Medikamentöse Immunsuppression | ||||
| Genodermatosen | ||||
| Chronische Traumata | ||||
| (vgl. Tab. 2) | ||||
- *Risikoadaptiertes Vorgehen, ggf. zusätzliche sonographische/radiologische Staginguntersuchungen
Aktuelle Studiendaten deuten darauf hin, dass Patienten mit einem basosquamösen Karzinom (vgl. Kapitel Diagnostik und Klassifikation) eine individuelle Nachsorge erhalten sollten. Dieser seltene BCC-Typ weist zwar Gemeinsamkeiten mit einem BCC auf, erinnert jedoch hinsichtlich seines biologischen Verhaltens und aggressiven Wachstums eher an ein Plattenepithelkarzinom 33.
Im Vordergrund der Hautkrebsprävention steht die Vermittlung einer maßvollen UV-Licht-Exposition unter Berücksichtigung der üblichen Verhaltensregeln. Betroffene Patienten sollten zur regelmäßigen Teilnahme an den Untersuchungen motiviert werden und die eigenständige, regelmäßige Selbstuntersuchung der Haut erlernen. Verhaltenspräventive Schulungsmaßnahmen sind darauf auszurichten, dass den in Tabelle 3 genannten Personengruppen ihr individuelles Risikoprofil, die Wirkungen von UV-Strahlung auf die Haut und entsprechende Schutzmaßnahmen vermittelt werden 34 (S3-Leitlinine Prävention von Hautkrebs 2014, www.awmf.de).
Interessenkonflikt
MA: Honorare für Vortragstätigkeit von Roche. UH: Honorare für Vortrags- und Beratungstätigkeit von Roche. UL: Honorare für Vortragstätigkeiten von Roche und Novartis. MS: Keine. RG: Honorare für Vortrags- und Beratungstätigkeit von Roche und Novartis. Unterstützung für Kongressteilnahmen von Roche.
Literatur
Fragen zur Zertifizierung durch die DDA
- Die Metastasierung beim Basalzellkarzinom tritt auf in …
- < 1 % der Patienten
- 1–5 % der Patienten
- 5–10 % der Patienten
- 10–20 % der Patienten
- > 20 % der Patienten
- Das Basalzellkarzinom …
- hat eine altersstandardisierte Inzidenz von > 100/100 000 Einwohner pro Jahr in Deutschland.
- betrifft häufiger Männer als Frauen.
- zeigte einen 10fachen Häufigkeitsanstieg in Deutschland in den letzten 30 Jahren.
- wird in der Regel mittels optischer Kohärenztomographie diagnostiziert.
- tritt vornehmlich bei jüngeren Personen unterhalb des 60. Lebensjahres auf.
- Welcher Subtyp des Basalzellkarzinoms findet sich in der WHO-Klassifikation nicht?
- fibroepitheliales BCC
- superfizielles BCC
- mikronoduläres BCC
- aggressives BCC
- basosquamöses BCC
- Welche Komponente gehört nicht zum Hedgehog-Signalweg?
- EGFR (epidermal growth factor receptor)
- PTCH (Protein der Patched-Familie im Hedgehog-Signaltransduktionsweg)
- SMO (Smoothened-Protein im Hedgehog-Signaltransduktionsweg)
- GLi (Transkriptionsfaktoren der GLi-Familie)
- Sonic (Ligand des Hedgehog-Proteins)
- Die Standardtherapie für das Basalzellkarzinom ist …
- die Strahlentherapie.
- die Exzision mit Sicherheitsabstand.
- die histologisch gesicherte vollständige Exzision.
- die photodynamische Therapie.
- die topische Therapie mit Imiquimod.
- Zu den zugelassenen Therapien für bestimmte Untergruppen von Basalzellkarzinomen gehört nicht …
- die photodynamische Therapie.
- die Lokaltherapie mit Imiquimod.
- die Lokaltherapie mit 5-Fluorouracil.
- die Lokaltherapie mit Ingenolmebutat.
- die PDT mit Methylaminolävulinsäure.
- Die Behandlungsempfehlung zur Systemtherapie bei inoperablen Basalzellkarzinomen sollte erfolgen durch …
- den Dermatologen.
- den Strahlentherapeuten.
- den internistischen Hämato-Onkologen.
- den Chirurgen.
- alle Fachexperten im Rahmen der interdisziplinären Tumorkonferenz.
- Zu den Nebenwirkungen der Hedgehog-Inhibitoren gehören nicht …
- Leukopenie.
- Muskelschmerzen.
- Dysgeusie.
- Alopezie.
- Gewichtsverlust.
- In der Nachsorge der Basalzellkarzinom-Patienten sollten nicht durchgeführt werden:
- Ganzkörperinspektion.
- Anleitung zur Selbstuntersuchung.
- Anleitung zum Lichtschutz.
- bildgebende Untersuchungen.
- Auflichtmikroskopische Beurteilung auffälliger Hautveränderungen.
- Welches sind Risikofaktoren für die Entwicklung eines BCC?
- chronische intermittierende UV-Exposition
- Genodermatosen
- Immunsuppression
- ionisierende Strahlen
- Alle Antworten sind richtig.
Liebe Leserinnen und Leser, der Einsendeschluss an die DDA für diese Ausgabe ist der 17. Oktober 2016. Die richtige Lösung zum Thema „Mykologie - ein Update Teil 3: Dermatomykosen: topische und systemische Behandlung“ in Heft 5 (Mai 2015) ist: (1e, 2a, 3c, 4b, 5a, 6b, 7e, 8a, 9c, 10e).
Bitte verwenden Sie für Ihre Einsendung das aktuelle Formblatt auf der folgenden Seite oder aber geben Sie Ihre Lösung online unter http://jddg.akademie-dda.de ein.




