Ein funktioneller Wechsel zwischen Asperfumen- und Fusicoccadien-Synthase und Eintritt in die Asperfumen-Biosynthese durch einen vicinalen Deprotonierungs-Reprotonierungsprozess
Abstract
Die Diterpensynthase AfAS wurde aus Aspergillus fumigatiaffinis identifiziert. Ihre Aminosäuresequenz und – einem Strukturmodell zufolge – die Architektur des aktiven Zentrums sind denen der Fusicocca-2,10(14)-dien-Synthase PaFS sehr ähnlich, AfAS produziert jedoch ein strukturell viel komplexeres Diterpen mit einem neuartigen 6–5–5–5 tetracyclischen Gerüst namens Asperfumen. Der Cyclisierungsmechanismus von AfAS wurde durch Isotopenmarkierungsexperimente und DFT-Rechnungen aufgeklärt. Die Reaktionskaskade verläuft in ihren ersten Schritten über ähnliche Intermediate wie die PaFS-Kaskade, divergiert dann aber durch einen ungewöhnlichen vicinalen Deprotonierungs-Reprotonierungsprozess, der eine Skelettumlagerung am Startpunkt der Stufen auslöst, die zum einzigartigen Asperfumen-Gerüst führen. Das Strukturmodell zeigte nur einen wesentlichen Unterschied zwischen den aktiven Zentren: Der PaFS-Rest F65 ist in AfAS durch I65 ersetzt. Interessanterweise zeigten ortsspezifische Mutageneseexperimente mit beiden Diterpensynthasen, dass Position 65 als bidirektionaler funktioneller Schalter für die Biosynthese von tetracyclischem Asperfumen im Vergleich zu strukturell weniger komplexen Diterpenen dient.
Einleitung
Diterpene vom Typ der Fusicoccane (FC) werden durch eine konzertierte 1,11–10,14-Cyclisierung, gefolgt von einer 2,6-Cyclisierung, die zu einem gemeinsamen 5–8–5-tricyclischen Gerüst führt, gebildet und sind die Vorläufer bioaktiver Naturstoffe wie des Fusicoccins A, das 14–3–3-Protein-Protein-Wechselwirkungen effizient moduliert.1 PaFS aus Phomopsis amygdali, das eine Prenyltransferase (PT)-Domäne für die Biosynthese von Geranylgeranylpyrophosphat (GGPP) und eine Typ-I–Diterpensynthase-Domäne (DTS) für die Terpencyclisierung trägt, war die erste identifizierte FC-Typ-DTS und katalysiert die Bildung von Fusicocca-2,10(14)-dien (Abbildung 1).2 Anschließend wurden mehrere weitere DTS vom FC-Typ durch Genom-Mining und heterologe Expression entdeckt.3 Die Röntgenstrukturanalyse von PaFS ergab, dass F65 an der Formung des aktiven Zentrums und der Stabilisierung carbokationischer Intermediate während der Terpencyclisierung beteiligt ist.4 Interessanterweise zeigte ein Sequenzalignment, dass F65 in den meisten Di- und Sesterterpensynthasen von Pilzen konserviert ist (Abbildung S1), aber mehrere DTS-Kandidaten, die zur Klasse der FC-Typ-DTSs gehören, weisen kleine Aminosäuren (I/L/V) in der entsprechenden Position auf (Abbildungen S1 und S2), was zu der Frage führt, ob diese Enzyme noch funktionsfähig sind oder außergewöhnliche Funktionen besitzen.
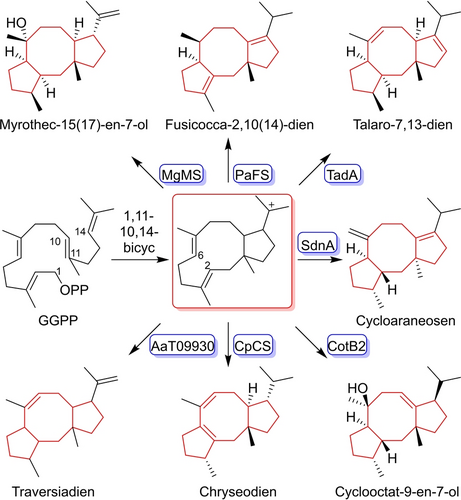
Charakterisierte DTSn vom FC-Typ und ihre Produkte.
In dieser Arbeit haben wir die Funktion des Kandidatengens AfAS aus Aspergillus fumigatiaffinis CNM-CM8980 charakterisiert, das ein beispielloses 6–5–5–5 tetracyclisches Diterpengerüst produziert. Isotopenmarkierungsexperimente in Kombination mit DFT-Rechnungen zeigten, dass die Cyclisierungskaskade einen einzigartigen vicinalen Deprotonierungs-Reprotonierungsprozess beinhaltet. Darüber hinaus wurde eine funktionelle Austauschbarkeit zwischen AfAS und seinem Homologen PaFS durch Austausch des Rests 65 beobachtet.
Ergebnisse und Diskussion
Um das oben genannte Problem zu lösen, wurde ein Kandidat mit einem I65-Rest von Aspergillus fumigatiaffinis CNM-CM8980 (Zugangsnummer BK065787) für die Funktionsanalyse ausgewählt. Dieser Kandidat ist phylogenetisch den Fusicocca-2,10(14)-dien-Synthasen, einschließlich PaFS, PgFS, BscA und AbFS (Abbildung S2), am nächsten und weist eine Aminosäuresequenzidentität von 62 % mit der Terpencyclase-Domäne von PaFS auf. Die heterologe Expression in A. oryzae NSAR15 führte zur Produktion eines Diterpenkohlenwasserstoffs 1 (Abbildungen 2A und S3). Die Struktur von 1 wurde durch NMR-Spektroskopie aufgeklärt und enthüllte dessen beispielloses 6–5–5–5-tetracyclisches Gerüst (Abbildung 2C, Tabelle S2, Abbildungen S4–S11). Verbindung 1 wurde Asperfumen genannt und folglich wurde ihre DTS als Aspergillus fumigatiaffinis Asperfumen-Synthase (AfAS) identifiziert. Die Struktur von 1 wurde durch die Umwandlung in seco-Asperfuminsäure (2) durch Ozonolyse weiter gesichert, die alle Stereozentren beibehält und weniger überlappende Signale in den NMR-Spektren aufweist (Abbildung 2C, Tabelle S3, Abbildungen S12–S19). Insbesondere ergab die Analyse der NOE-Korrelationen eine relative Konfiguration für 2, die mit der Zuordnung für 1 übereinstimmt. Im Gegensatz zu vielen zuvor beschriebenen bifunktionellen und UbiA-verwandten pilzlichen DTS6 ist AfAS eine Typ-I–DTS mit nur einer Domäne, wofür es nur wenige früher berichtete Fälle gibt.3c, 3h, 7 Darüber hinaus ist bisher nur eine begrenzte Anzahl von pilzlichen DTS vom Typ I bekannt, die in der Lage sind, die strukturelle Komplexität tetracyclischer Diterpene einzuführen.7, 8
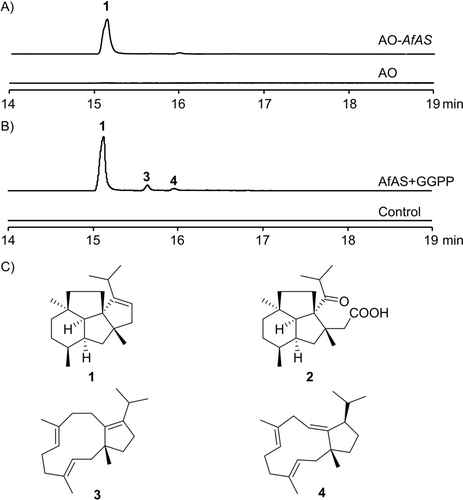
Analyse der Funktion von AfAS. Extrahierte Ionenchromatogramme (GC/MS, m/z 272) von Extrakten aus A) einer heterologen Expression von AfAS in A. oryzae NSAR1 (AO) und B) einer In vitro-Inkubation von GGPP mit AfAS. C) Strukturen von 1–4.
Um die Funktion von AfAS zu validieren, wurde ein enzymatischer In vitro-Test durchgeführt. Das in Escherichia coli BL21 (DE3) produzierte rekombinante His6-markierte AfAS wurde gereinigt (Abbildung S20) und anschließend mit GPP, FPP, GGPP und GFPP inkubiert. AfAS zeigte die beste Umsetzung mit GGPP als Substrat und die GC-MS-Analyse der Produkte bestätigte dessen effiziente Umwandlung in 1 (Abbildung 2B). Zusätzlich wurden zwei Nebenprodukte nachgewiesen (Abbildungen 2B und S3), die isoliert und als die bekannte Verbindung (+)-(1R)-δ-Araneosen9 (3, Abbildungen S21 und S22) und dessen Doppelbindungsisomer (3E,7E,10E)-Dolabellatrien (4) identifiziert wurden, dessen relative Konfiguration durch NOE-Analyse und quantenchemische Berechnungen der 13C NMR-Verschiebungen für beide möglichen Diastereomere bestimmt wurde (Tabelle S4, Abbildungen S23–S32). Aus GPP und FPP wurde eine geringe Bildung acyclischer und monocyclischer Mono- und Sesquiterpene beobachtet, während aus GFPP nur Spuren unbekannter Sesterterpene nachgewiesen wurden (Abbildung S33, Tabelle S5).
Stereoselektive Deuterierungsexperimente (Markierungsexperimente sind in Tabelle S6 zusammengefasst) wurden verwendet, um die absoluten Konfigurationen von 1 und 4 zu bestimmen. Die Enzymmischung aus E. coli-Isopentenyldiphosphat-Isomerase (IDI), Farnesylpyrophosphat-Synthase (FPPS) aus Streptomyces coelicolor,11 und GGPP-Synthase (GGPPS) aus S. cyaneofuscatus12 wurde verwendet, um (R)- oder (S)-(1-13C,1-2H)IPP13 zu GGPP mit einer stereoselektiven Deuterierung an C5, C9 und C13 mit bekannten Konfigurationen umzusetzen.14 Die anschließende Umwandlung durch AfAS führte die deuterierten Stereozentren in 1 ein. Die 13C-Markierungen an den deuterierten Kohlenstoffatomen ermöglichten eine hochempfindliche Analyse mittels HSQC-Spektroskopie, um für jedes Substrat zu bestimmen, welche der beiden Wasserstoffpositionen durch Deuterium besetzt war. Zusammen mit der NOESY-basierten Zuordnung der relativen Orientierung zwischen den Wasserstoffatomen der CH2-Gruppen und den Wasserstoffatomen natürlich vorkommender Stereozentren ermöglichten diese Daten Rückschlüsse auf die absolute Konfiguration von (2S,3S,6S,7S,10S,11S)-1 (Abbildung S34). Zusätzliche Experimente mit (Z)- oder (E)-(4-13C,4-2H)IPP15 und DMAPP in Verbindung mit FPPS, GGPPS und AfAS bestätigten die obige Zuordnung (Abbildung S35). Dieselben Experimente deuteten auf die absolute Konfiguration von (1R,12R)-4 hin (Abbildungen S36 und S37).
Trotz der hohen Sequenzidentität zwischen AfAS und PaFS katalysieren diese Enzyme die Bildung unterschiedlicher Produkte, was auf erhebliche Unterschiede in ihren Cyclisierungskaskaden hinweist. Der Cyclisierungsweg von PaFS wurde bereits zuvor durch eine kombinierte experimentelle und rechnerische Studie aufgeklärt (Schema 1).16 Ausgehend von einem Konformer von GGPP, in dem alle Wasserstoffe an C2 (magenta), C6 (gelb) und C10 (blau) nach hinten zeigen,16 verläuft die Reaktionskaskade über eine anfängliche 1,11–10,14-Cyclisierung zum Intermediat A. Eine anschließende 1,2-Hydridverschiebung führt zu B, das dann eine ungewöhnliche Sequenz aus einem 1,4-Protonentransfer zu C, einem 1,5-Protonentransfer zu I und einer 1,2-Hydridverschiebung zu J durchläuft. Letztendlich ergeben eine 2,6-Cyclisierung zu K und Deprotonierung Fusicocca-2,10(14)-dien (5). Angesichts der hohen Ähnlichkeit der Aminosäuresequenzen zwischen AfAS und PaFS könnte GGPP eine ähnliche Konformation im aktiven Zentrum von AfAS annehmen und über ähnliche Schritte mit dem Intermediat C reagieren. Ursprünglich gingen wir davon aus, dass C über eine 1,2-Hydridverschiebung und 2,6-Cyclisierung zu D1 reagieren könnte. In diesem Intermediat zeigt Me19 nach oben, während diese Me-Gruppe in 1 nach unten zeigt. Daher ist vor der Ringerweiterung zu E eine Konformationsänderung durch Rotation um C6−C7 zu D2 erforderlich, was ein ähnlicher Schritt wie bei der Astellifadien-Biosynthese ist.17 Eine weitere 6,10-Cyclisierung führt zu F als direktem Vorläufer von 1 (Schema 1). Die einfachste Erklärung für die Bildung des Nebenprodukts 4 ist eine 1,2-Hydridverschiebung von B zu G und Deprotonierung.
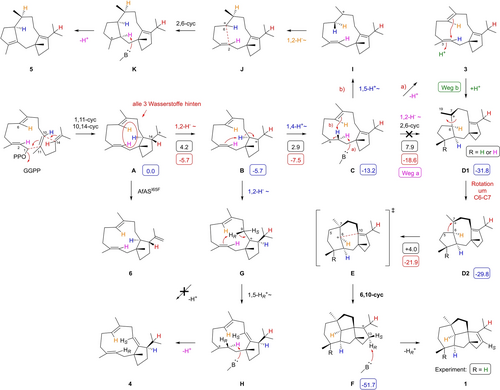
Biosynthese von 1, 3, 4 und 6 durch AfAS (diese Studie) und die zuvor berichtete Bildung von Fusicocca-2,10(14)-dien (5) durch PaFS.16 Die Zahlen in den blauen Kästchen sind die freien Gibbs-Energien relativ zu A (eingestellt auf 0.0 kcal/mol), die Zahlen in den schwarzen Kästen sind Reaktionsbarrieren und die Zahlen in den roten Kästen sind die freien Energien der einzelnen Reaktionen (alle in kcal/mol, berechnet mit der Methode mPW1PW91/6-311+G(d,p)//B3LYP/6-31G(d), 298K, geeignet für Berechnungen typischer Reaktionen von Carbokationen).3f, 18
Um den AfAS-Cyclisierungsmechanismus zu 1 zu untersuchen, wurde eine Reihe von Isotopenmarkierungsexperimenten durchgeführt. Zunächst wurden alle 20 Isotopomere von (13C)GGPP, die entweder durch chemische Synthese oder durch enzymatische Herstellung aus entsprechend markierten kürzeren Oligoprenylpyrophosphaten unter Verwendung von FPPS und GGPPS erhalten wurden, einzeln mit AfAS inkubiert. Die 13C NMR-Analyse der erhaltenen Produkte bestätigte den Gesamtmechanismus in Bezug auf die Herkunft jedes Kohlenstoffs und lieferte eine experimentelle Validierung der Gerüstumlagerung von D2 nach E (Abbildungen S38–S40).
Um die anfängliche 1,2-Hydridverschiebung von A nach B in der Biosynthese von 1 zu untersuchen, wurde (15-13C,14-2H)GGPP enzymatisch aus (3-13C,2-2H)DMAPP19 und IPP mit FPPS und GGPPS hergestellt und anschließend mit AfAS in 1 umgewandelt. Die GC-MS-Analyse des Produkts zeigte den Verlust eines 2H- und 13C-markierten Isopropylfragments (m/z 229, [M-45]+⋅, Abbildung S41), während das 13C NMR-Spektrum ein hochfeldverschobenes Triplett (▵δ=−0.41 ppm, 1JC,D=19.1 Hz) für C15 als Folge der 13C−2H-Spinkopplung aufwies (Abbildung S42). Beide Experimente stützen die 1,2-Hydridverschiebung, die auch für die Biosynthese von 3 und 4 relevant ist, wie durch die Fragmentionen bei m/z 229 ([M-45]+⋅) für die aus (15-13C,14-2H)GGPP) erhaltenen Verbindungen belegt wird (Abbildungen S43 und S44). Die Bildung von 3 kann durch die Deprotonierung von B erklärt werden, dieser Mechanismus ist jedoch nicht relevant. Dies wurde durch die Inkubation von (10-2H)GGPP, enzymatisch hergestellt aus (2-2H)GPP20 und IPP mit FPPS und GGPPS, mit AfAS gezeigt. Beide Produkte 1 und 3 wiesen ein Molekulargewicht von 273 Da auf, was darauf hindeutet, dass Deuterium während der Cyclisierungskaskade nicht verloren geht (Abbildung S45). Daher kann davon ausgegangen werden, dass die 1,4-Protonenverschiebung von B nach C auch für die Biosynthese von 1 und 3 relevant ist und 3 aus C durch Deprotonierung unter Verlust des ursprünglichen C2-Protons (magenta) entsteht. Diese Hypothese wurde durch die Inkubation von (3-13C,2-2H)GGPP12 mit AfAS überprüft und zeigte den Verlust von Deuterium für beide Produkte 1 und 3 (Abbildung S46). Mit der zusätzlichen 13C-Markierung im Substrat sollte untersucht werden, ob eine 1,2-Hydridverschiebung C und D1 direkt verbinden kann, was durch das letztgenannte Ergebnis ausgeschlossen wird. Die 1,4-Protonenwanderung von B nach C wurde weiter mit (2,6-13C2,10-2H)GGPP untersucht, das mit FPPS und GGPPS aus (2-2H)GPP und (2-13C)IPP erhalten wurde.21 Die Umwandlung mit AfAS führte zu markiertem 1, das ein hochfeldverschobenes Dublett von Tripletts zeigte (▵δ=−0.49 ppm, 1JC,D=19.3 Hz, 1JC,C=31.5 Hz), was die Verschiebung von Deuterium zu C2 von 1 bestätigte (Abbildung S47, entsprechende Signale für die Nebenverbindung 3 lagen unterhalb der Nachweisgrenze). Ein analoges Experiment mit (3,7-13C2,10-2H)GGPP, erhalten aus (2-2H)GPP und (3-13C)IPP,12 führte zu einem hochfeldverschobenen Singulett für 3, das Deuterium in einer benachbarten Position von C3 bestätigte (▵δ=−0.11 ppm), und auch die Signale für C3 und C7 von 1 wurden erwartungsgemäß beeinflusst (Abbildung S48). Die Erkenntnis, dass D1 nicht direkt aus C entsteht, warf die Frage auf, wie dieses Intermediat gebildet werden kann. Die Inkubation von (3-13C)GGPP11 mit AfAS in einem D2O-Puffer verlief unter Einbau von Deuterium an C3 von 1 (Abbildungen S49 und S50). Der stereochemische Verlauf des letzten Deprotonierungsschritts war aus den stereoselektiven Deuterierungsexperimenten mit (R)- und (S)-(1-13C,1-2H)IPP ersichtlich und zeigte den spezifischen Verlust des pro-R-Protons von C13 (Abbildung S51).
Darüber hinaus zeigten GC-MS-Daten für das aus (10-2H)GGPP erhaltene Nebenprodukt 4 die Beibehaltung von Deuterium (Abbildung S45), was mit der 1,2-Hydridverschiebung von B zu G übereinstimmt. Allerdings wird 4 nicht durch Deprotonierung von G gebildet, stattdessen geht Deuterium aus (3-13C,2-2H)GGPP verloren (Abbildung S46). Dieser Befund lässt sich durch eine 1,5-Protonenverschiebung von G zu H und anschließende Deprotonierung zu 4 mit Entfernung des ursprünglichen C2-Protons (magenta) erklären. Die HSQC-spektroskopische Analyse von 4, das durch Inkubation von (R)- oder (S)-(1-13C,1-2H)IPP mit IDI, FPPS, GGPPS und AfAS hergestellt wurde, ergab eine spezifische Verschiebung des 9-pro-R-Protons zu C2 (Abbildung S52).
Um den Cyclisierungsmechanismus von 1 weiter zu untersuchen, wurden Berechnungen der Dichtefunktionaltheorie (DFT) durchgeführt (Schema 1, Tabelle S7, Abbildung S53). Die Schritte von A nach C verlaufen über niedrige Reaktionsbarrieren und sind exergonisch. Trotz der experimentellen Beobachtung, dass C nicht direkt zu D1 reagiert, konnte rechnerisch ein konzertierter, aber hoch asynchroner Prozess aus 1,2-Hydridtransfer und 2,6-Cyclisierung realisiert werden, was eine relativ niedrige Energiebarriere von 7.9 kcal/mol für dieses hoch exergonische System ergab Schritt (ΔG=−18.6 kcal/mol, Weg a). Nach der Konformationsänderung wird eine weitere konzertierte, aber stark asynchrone Transformation gefunden, die die Ringerweiterung und die dritte 6,10-Anellierung zu F umfasst. Dabei vermeidet der konzertierte asynchrone Prozess das sekundäre Kation E als Intermediat. Bemerkenswert ist, dass die Aktivierungsbarriere für diesen stark exergonischen Schritt (ΔG=−21.9 kcal/mol) nur 4.0 kcal/mol beträgt.
Insgesamt zeigten die Markierungsexperimente, dass die Biosynthese von 1 und seinen Nebenprodukten unter ausgedehnten Wasserstoffwanderungen verläuft und auch eine Deprotonierungs-Reprotonierungs-Sequenz statt einer direkten 1,2-Hydridverschiebung beinhaltet. Hier ist die Situation anders als im prominenten Fall der Pentalenen-Biosynthese, für die zunächst eine durch eine Aminosäure (H309) vermittelte vicinale Deprotonierung/Reprotonierung über das neutrale Intermediat Humulen vorgeschlagen wurde,22 dieses Modell wurde jedoch später experimentell durch ortsspezifische Mutagenese ausgeschlossen.23 Quantenchemische Berechnungen deuteten stattdessen auf eine 1,2-Hydridverschiebung hin,24 und eine aktuelle Strukturstudie ergab, dass diese Hydridverschiebung durch den Rest F76 im aktiven Zentrum gesteuert wird.25 Interessant ist auch, dass alle Deprotonierungsschritte zum neutralen Intermediat 3 und zu allen Endprodukten von derselben Seite ausgehen, d. h. von der Unterseite der Moleküle, wie in Schema 1 ausgerichtet.
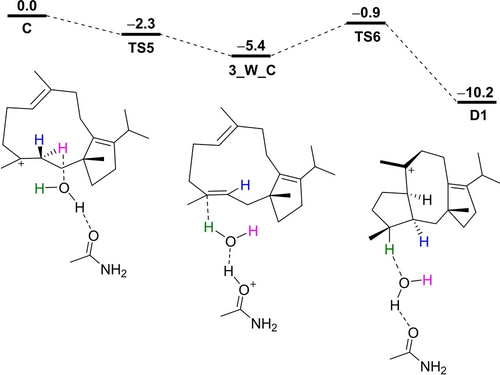
Bemerkenswert ist, dass Experiment und Theorie wie oben dargestellt im Widerspruch zu den Transformationen von C zu D1 stehen, weshalb weitere Anstrengungen unternommen wurden, um diesen Schritt rechnerisch besser zu verstehen. Um die experimentellen Beobachtungen zu erklären, wurde ein wasservermittelter Prozess ins Auge gefasst, ähnlich unseren früheren mechanistischen Erkenntnissen für die Biosynthese von Myrothec-15(17)-en-7-ol, Guai-4-en-11-ol und Selina- 4(15),7(11)-dien.3e, 26, 27 Ein Wassermolekül kann die Barriere(n) für die C-zu-D1-Umwandlung grundsätzlich auf zwei Arten verringern: Entweder der Übergangszustand einer 1,2-Hydridverschiebung kann durch Wasserstoffbrücken stabilisiert werden, oder die Reaktion kann über ein Hydronium-Intermediat ablaufen. Die erste Option wäre nicht im Einklang mit dem Experiment, da hier Wasser nur die 1,2-Verschiebung des Wasserstoffs in magenta steuern würde (Weg a), während die Reaktionen über ein Hydronium-Intermediat unter Abstraktion und Einführung eines anderen Protons ablaufen können (Weg b). Umfangreiche DFT-Rechnungen (Tabellen S8–S11, Abbildungen S54–S57) zeigten, dass die letztere Option praktikabler ist, insbesondere wenn das Hydronium durch eine Amidcarbonylgruppe stabilisiert wird (Abbildung 3), ähnlich dem mechanistischen Modell für die Biosynthese von Selina-4(15),7(11)-dien.27 Bei diesem Modell ist der Protonentransfer zu Wasser (3_W_C) barrierefrei und exergonisch, und der Rücktransfer, der die 2,6-Cyclisierung zu D1 induziert, erfolgt über eine niedrige Barriere von nur 4.5 kcal/mol. Zukünftige strukturbasierte Studien könnten den zugrunde liegenden Mechanismus weiter aufklären.
Trotz ihrer hohen Aminosäuresequenzidentität und des gemeinsamen katalytischen Mechanismus in den frühen Stadien erzeugen AfAS und PaFS unterschiedliche Produkte. Um die molekulare Grundlage dieser Beobachtung aufzuklären, wurde mit AlphaFold2 ein Strukturmodell von AfAS erstellt, an das 3 angedockt wurde (AfAS-3, Abbildung S58). Dieser Ansatz ermöglichte die Identifizierung der Reste des aktiven Zentrums von AfAS (Abbildungen 4A und S59). Der Abgleich des AfAS-3-Modells mit der Kristallstruktur von PaFS, an das 3 angedockt ist, ergab, dass beide Enzyme in allen Positionen die gleichen Reste im aktiven Zentrum aufweisen, mit Ausnahme von Position 65, die in AfAS von I65 und in PaFS von F65 besetzt ist. Um festzustellen, ob der Rest an dieser Position eine entscheidende Rolle bei der funktionellen Divergenz zwischen AfAS und PaFS spielt, wurden ortsgerichtete Mutageneseexperimente durchgeführt, um diese Reste auszutauschen. Die I65F-Variante von AfAS (AfASI65F) bildete immer noch das Hauptprodukt 1, produzierte aber auch mehrere zusätzliche Verbindungen, darunter 3, Fusicocca-2,10(14)-dien (5)28 und (+)-6, das Deprotonierungsprodukt von A und Enantiomer der bekannten Verbindung (−)-3,7,18-Dolabellatrien29 (Schema 1, Abbildungen 4B, S60 und S61). Die AfASI65Y-Variante ergab 5 als Hauptprodukt bei verringerter Ausbeute an 1 und zusätzlicher Bildung von 3, 6 und nicht identifizierten Spurenverbindungen. Der Austausch gegen den größeren Trp-Rest in der AfASI65W-Variante führte dazu, dass die Produktion von 1 nahezu aufgehoben wurde und stattdessen eine Mischung aus Verbindungen einschließlich 3, 5 und 6 entstand. In der entgegengesetzten Richtung wurde F65 in PaFS durch Ile, Val oder Ala ersetzt (Abbildung S62), was zur Bildung von 1 führte, während 5 vollständig verschwand (Abbildung 4C). Um den Einfluss des Aminosäurerests an Position 65 auf die Produktselektivität eingehend zu untersuchen, wurde eine Sättigungsmutagenese sowohl für AfAS als auch für PaFS durchgeführt (Abbildungen S63 und S64). Die Ergebnisse zeigten, dass ein aromatischer Rest (F, Y, W) an Position 65 für die Bildung des tricyclischen Produkts 5 entscheidend ist, während eine verzweigtkettige Aminosäure (I, L, V) für die Bildung der tetracyclischen Verbindung 1 bevorzugt ist, wobei auch einige andere Aminoreste teilweise 1 ergaben. Darüber hinaus zeigte die Inkubation von GGPP in D2O-Puffer, dass die Biosynthese von 5 durch AfASI65Y nicht unter Aufnahme eines Protons aus dem Medium verläuft, während dies bei der Bildung von 1 durch PaFSF65I der Fall ist (Abbildung S65).
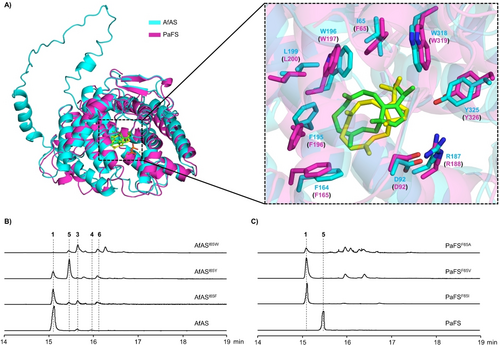
Analyse der Fuktionen von AfAS- und PaFS-Enzymvarianten. A) Überlagerung der Strukturen von AfAS (cyan) und PaFS (magenta) und Detailansicht der Architektur des aktiven Zentrums. Gelbe und grüne Stäbchen stellen das Intermediat 3 dar, das an AfAS bzw. PaFS angedockt ist. Extrahierte Ionenchromatogramme (m/z 272) von Extrakten aus In vitro-Reaktionen von B) AfAS und C) PaFS und ihren Varianten.
Diese Ergebnisse zeigen, dass der Rest 65 eine entscheidende Rolle bei der funktionellen Divergenz zwischen AfAS und PaFS spielt. Allerdings sind I65/F65 von den Reaktionszentren von C und seinen direkten Produkten D1 bzw. I recht weit entfernt. Basierend auf diesen Ergebnissen wird vorgeschlagen, dass der aromatische Rest bzw. die verzweigtkettige Aminosäure an Position 65 die Konformation des Carbokations C so bestimmen, dass die nachgeschalteten Reaktionen entweder in Richtung D1 und 1 (AfAS und PaFSF65I) oder I und 5 (PaFS und AfASI65Y) gesteuert werden. In Übereinstimmung mit dieser Hypothese wurde eine spezifische Konformation des Intermediats 3 sowohl in AfAS als auch in PaFS beobachtet, und die F65I-Mutagenese von PaFS führte in dieser Enzymvariante zu einer identischen Konformation wie in AfAS (Abbildungen 4A und S66). Die Relevanz der Position 65 wurde zuvor für andere Terpensynthasen vom Typ I getestet. Die F65L-Variante der pilzlichen Sesterterpensynthase FgMS produziert ein tetracyclisches Sesterterpen mit einem anderen Gerüst als das native Produkt Mangicdien,30 während die F65A- und F65L-Varianten der pilzlichen Typ-I-Triterpensynthase TvTS nur eine reduzierte Produktion von Talaropentaen zeigen.31 Der Austausch aliphatischer Reste gegen Phe wurde für die pilzliche Aristolochen-Synthase PrAS (V88F) getestet, was zu einer Verschiebung vom Hauptprodukt Aristolochen zu Germacren A32 und für die bakterielle Polytrichastren-Synthase CpPS (I66F) zu einem veränderten Produktprofil mit Bildung diverser neuer Produkte führte.33 Auch der Wechsel anderer Positionen kann die Funktionen von Terpensynthasen verändern, wie für die G188A-Variante von Gd11olS gezeigt, die hauptsächlich Isolepidozen anstelle von Germacradien-11-ol produziert,34 oder für die A167S-Mutante von BjKS, die statt ent-Kaur-16-en ent-Pimaradien produziert.35 Der Wechsel einzelner Reste kann auch zu einer Änderung der Substratpräferenz führen, wie für die A224I-Variante des A2-Vorfahren von SvS gezeigt wurde, die von einer Diterpen- zu einer Sesquiterpensynthaseaktivität wechselt.36 Durch die Vergrößerung der Kavität des aktiven Zentrums von SvES in der F77A-Variante wurde dieses Enzym sogar von einer Sesquiterpensynthase in ein Enzym mit Di- und Sesterterpensynthaseaktivität umgewandelt.37
Im Gegensatz zu PaFS zeigt AfAS eine entfaltete C-terminale Schleife (Abbildung 4A). Seine Relevanz für die katalytische Aktivität von AfAS wurde durch die Erzeugung einer verkürzten AfAS-Variante ohne die Reste 341–417 untersucht. Ein In vitro-Assay ergab, dass die verkürzte Variante die Fähigkeit beibehielt, 1 mit leicht verringerter Ausbeute zu produzieren (Abbildung S67), was zeigt, dass die C-terminale Schleife nur einen minimalen Einfluss auf die katalytische Aktivität ausübt.
Schlussfolgerungen
Zusammenfassend haben wir die DTS AfAS aus A. fumigatiaffinis identifiziert, die in ihrer Aminosäuresequenz und modellierten Struktur hochgradig homolog zur Fusicocca-2,10(14)-dien-Synthase PaFS ist, aber anstelle von 5 produziert dieses Enzym das neue tetracyclische Diterpen 1. Isotopenmarkierungsexperimente und DFT-Rechnungen lieferten detaillierte mechanistische Einblicke in die Bildung von 1. In den ersten Schritten nutzt AfAS die gleichen Reaktionen wie PaFS, um ein bicyclisches kationisches Intermediat C zu erzeugen, das als Verzweigungspunkt entweder durch 1,5-Protonenverschiebung zu 5 (PaFS) oder durch eine ungewöhnliche durch Deprotonierung und Reprotonierung vermittelte Carbokation-Verschiebung gefolgt von einer 2,6-Cyclisierung zu 1 (AfAS) dient. Interessanterweise weisen die aktiven Zentren beider Enzyme nur einen großen Unterschied an Position 65 auf, die in AfAS von I65 und in PaFS von F65 besetzt ist. Ortsgerichtete Mutageneseexperimente ergaben, dass diese Position als Schalter zwischen den verschiedenen Enzymfunktionen dient, was zeigt, dass Funktionsvorhersagen für Terpensynthasen auf der Grundlage der Sequenzidentität äußerst fehlerhaft sein können. Zusammen mit den Ergebnissen früherer Studien zeigen diese Ergebnisse, dass der Rest in Position 65 als vorrangiger Kandidat für die Prüfung in zukünftigen Enzym-Engineerings von Terpensynthasen betrachtet werden sollte.
Danksagung
Wir danken Prof. K. Gomi (Tohoku University) und Prof. K. Kitamoto (The University of Tokyo) für die Bereitstellung des A. oryzae NSAR1-basierten Systems für heterologe Expressionen. Diese Arbeit wurde finanziell gefördert durch das National Key Research and Development Program of China (2024YFE0102000, 2018YFA0903200), die National Natural Science Foundation of China (81925037, 82321004, U22A20371, 32170060, 22177037, 22207039, 32070042, 32200034), das Guangdong Major Project of Basic and Applied Basic Research (2023B0303000026), den Guangdong Natural Science Funds for Distinguished Young Scholars (2019B151502014, 2022B1515020028, 2022B1515020080, China), die Guangdong International Science and Technology Cooperation Base (2021A0505020015, China), die Guangdong Basic and Applied Basic Research Foundation (2023B1515040016), das Local Innovative and Research Teams Project of Guangdong Pearl River Talents Program (2017BT01Y036, China), das Innovative and Research Teams Project of Guangdong Higher Education Institution (2021KCXTD001, China), das Guangzhou Science and Technology Project (202206010020, 2023A04J0080, China), die China Postdoctoral Science Foundation (2022M713672), den Fundamental Research Funds for the Central Universities (21623105), und die Deutsche Forschungsgemeinschaft (513548540). Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Interessenkonflikt
Die Autoren geben an, dass kein Interessenkonflikt besteht.
Open Research
Data Availability Statement
Die Daten, die die Ergebnisse dieser Studie unterstützen, sind in den Hintergrundinformationen zu diesem Artikel verfügbar.




