Von Benzoborirenen zu Benzoborol-basierenden 1,2-Diiminen und antiaromatischen Boroldiiden
Abstract
Die Reaktion von Benzoborirenen mit einem Äquivalent Isocyanid führt zu benzolkondensierten Boreten mit einer Iminfunktion, während die Reaktion mit zwei Äquivalenten Isocyanid 2,3-Dihydro-2,3-diiminoborole mit perfekter Regioselektivität ergibt. Die Isocyanid-Doppelinsertionsprodukte stellen einen neuen Typ von 1,2-Diiminen mit einem Benzoborol-Rückgrat dar. Die Reduktionschemie des Benzoborol-basierenden 1,2-Diimins wurde untersucht. Die Reduktion mit einem und zwei Elektronen ermöglicht die Isolierung und vollständige Charakterisierung eines radikalischen Anions bzw. eines Dianions. Im Gegensatz zu gewöhnlichen Borolen, die durch die Aufnahme von zwei Elektronen aromatisch werden sollten, wird der antiaromatische Charakter des Benzoborol-Rückgrats bei der Reduktion verstärkt und stellt somit ein seltenes Beispiel für ein antiaromatisches Borol-Dianion dar. Detaillierte quantenchemische Berechnungen liefern eine Erklärung für die beobachtete Regioselektivität und die elektronische Struktur der reduzierten Borol-Diimin-Spezies.
Einleitung
1H-Boriren ist isoelektronisch mit dem entsprechenden 2π-Cyclopropeniumkation und bildet eine Klasse von dreigliedrigen Boracyclen.1 Das anfängliche Interesse an Borirenen beruhte auf Neugier hinsichtlich der 2π-Aromatizität und der erheblichen synthetischen Herausforderungen, die sich durch die vorgegebene Ringspannung ergeben.1b-2 Die Zahl der vollständig charakterisierten Borirene hat in den letzten zwei Jahrzehnten zugenommen und die meisten Beispiele wurden durch Borylentransferreaktionen mit Alkinen synthetisiert.3 Zu den beschriebenen Reaktivitätsmustern gehören Lewis-Säure-Base-Reaktionen,4 Übergangsmetallkoordination,3e, 5 Photoisomerisierung6 und Ringöffnung durch protische Substrate4c, 6b oder Hydroborane.7 Benzoborirene, auch benzanellierte Borirene genannt, sind noch stärker gespannte Boracyclen,8 die erst seit kurzem synthetisch zugänglich sind. Bettinger und Mitarbeiter wiesen die Existenz der schwer zugänglichen Stammverbindung des Benzoborirens in der Gasphase9 und unter kryogenen Matrixbedingungen nach.10 Nach dieser Pionierarbeit dauerte es jedoch weitere 16 Jahre, bis erstmals über die Identifizierung eines durch ein N-heterocyclisches Carben (NHC) stabilisierten Benzoborirens in Lösung berichtet wurde.8 Das erste isolierbare Benzoboriren wurde in unserem Labor durch die Reaktion des Zirkonocen-Benzin-Komplexes mit dem Aminodibromboran Br2BN(SiMe3)2 synthetisiert.11 Die erste einkristalline strukturelle Charakterisierung eines Benzoborirens wurde erst kürzlich, ebenfalls von der Bettinger-Gruppe, veröffentlicht.12 Der sterisch stark anspruchsvolle 2,6-Trip2C6H3 (Trip=2,4,6-iso-Pr3C6H2) Substituent am Bor bietet nicht nur eine kinetische Stabilisierung, sondern erleichtert auch die Kristallisation. Als Erweiterung dieser vorangegangenen Studien haben wir kürzlich den Einsatz eines B-Aminobenzoborirens für die Synthese eines Iminoborans demonstriert,11, 13 sowie die Dimerisierung eines NHC-koordinierten Benzoborirens zur Herstellung von 9,10-Diboraanthracen nachgewiesen.8
Borole wiederum sind isoelektronisch mit dem Cyclopentadienylkation C5H5+, das 4π-Elektronen aufweist, und nach der Hückelschen Regel somit antiaromatisch.14 Dementsprechend sind unkondensierte und unkoordinierte Borole hochreaktive Verbindungen, die eine vielfältige Chemie aufweisen und hochinteressante elektronische und optische Eigenschaften besitzen.15 Jüngste Studien haben gezeigt, dass die Fusion der Boroleinheit mit Arenen die Stabilität verbessert, während der antiaromatische Charakter erhalten bleibt.15d Außerdem sind antiaromatische Borole anfällig für die Reduktion mit einem oder zwei Elektronen, wodurch die Radikalanionen bzw. die 6π-aromatischen Boroldiid-Spezies entstehen (Schema 1b).15a, 16 Strukturanalysen der reduzierten Borol-Spezies zeigten eine planare Geometrie mit ausgeprägter Delokalisierung der negativen Ladung innerhalb des C4B-Rings oder, im Falle fusionierter Arene, im gesamten π-System.17 Nach unserem Kenntnisstand wurde bisher noch nicht über Boroldiid-Derivate berichtet, die Antiaromatizität innerhalb des Borol-Fragments aufweisen. In Anbetracht der hochgespannten Struktur von Benzoborirenen und der daraus resultierenden Bereitschaft zur Ringerweiterung stellten wir die Hypothese auf, dass diese Verbindungen als nützliche Vorstufen für die Konstruktion neuartiger Borolgerüste nach Insertion von zwei ungesättigten Kohlenstoffen dienen könnten. Zu diesem Zweck verwenden wir Isocyanide, die als C1-Synthone bekannt sind,18 und etablieren einen Syntheseweg, der zu den Benzoboreten 2, den 2,3-Dihydro-2,3-diiminobenzoborolen 3 (s. Schema 2) sowie den Einfach- und Doppelreduktionsprodukten [3 a]⋅K und [3 a]K2 führt. Letzteres ist ein seltenes Beispiel für ein Boroldiid, das innerhalb des Borolfragments Antiaromatizität aufweist.
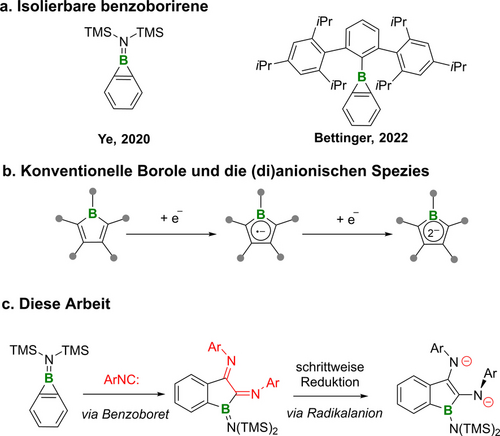
(a) Zuvor beschriebene isolierbare Benzoborirene; (b) Die Grundstruktur herkömmlicher neutraler und (di)anionischer Borole; (c) Diese Arbeit: ein Weg von Benzoborirenen zu atypischen Borol-Dianionen.
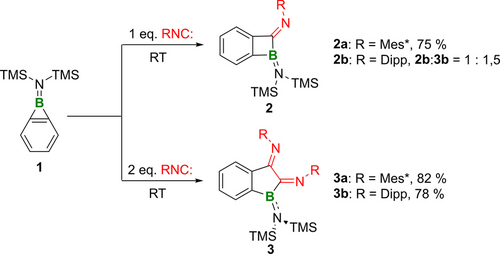
Reaktion von Benzoboriren 1 mit einem oder zwei Äquivalenten des Isocyanids.
Ergebnisse und Diskussion
In unserer früheren Studie wurde das Benzoboriren 1 durch wiederholte Ausfällung des Cp2ZrBr2-Nebenprodukts bei niedriger Temperatur aus der konzentrierten Pentanlösung von 1 gereinigt, eine Methode, die unter geringer Effizienz litt.11 Aufgrund seiner thermischen Stabilität konnten wir 1 jedoch durch Vakuumdestillation effizienter aufreinigen und als farblose Flüssigkeit im Gramm-Maßstab isolieren. Anschließend wurde 1 mit einem Äquivalent Mes*NC in C6D6 in einem NMR-Röhrchen umgesetzt. Die Reaktion wurde mittels 11B NMR -Spektroskopie untersucht, und innerhalb weniger Minuten wurde die nahezu quantitative Umsetzung von 1 (δB 25.9) zu Benzoboret 2 a (δB 48.3, 75 % isolierte Ausbeute) beobachtet (Schema 2). Entsprechend zeigte das 1H NMR -Spektrum vier Signalsätze (δH 7.59, 6.90, 6.78 und 5.92) mit einem Integralverhältnis von 1 : 1 : 1 : 1 für den Phenylring, was sich vom 1H NMR -Signal des Benzoborirens 1 (δH 7.60, 2H; δH 7.37, 2H) unterscheidet. Einkristalle von 2 a, die für die Röntgenbeugungsanalyse geeignet sind, wurden aus einer Pentanlösung durch langsames Verdampfen bei −30 °C gewonnen. Die Einkristallstruktur von 2 a bestätigt eindeutig die atomare Konnektivität und zeigt ein planar anelliertes Paar aus Benzol- und Boretringen.
Der Diederwinkel Si1−N1−B1−C3 von −8.4(4)° sowie der kurze B1−N1 Abstand von 1.408(4) Å deuten auf eine starke N→B π-Donierung hin. Die B1−C1 (1.638(4) Å) und B1−C3 (1.591(4) Å) Bindungsabstände sind vergleichbar mit denen der endocyclischen B−C-Bindungen von Boreten.20 Die exocyclische C1−N2-Bindungslänge von 1.275(3) Å fällt in den Bereich der C=N-Doppelbindungen. In deutlichem Gegensatz dazu führt die Reaktion von 1 mit einer äquimolaren Menge des sterisch weniger anspruchsvollen Isocyanids DippNC (Dipp=2,6-Diisopropylphenyl) zur Bildung eines Gemischs aus 2 b und dem Doppelinsertionsprodukt 3 b in einem Verhältnis von 1 : 1.5, wie die 1H NMR -Spektren belegen (Abbildung S1–2). Offensichtlich hemmt die sterische Hinderung des sperrigen Mes*-Substituenten die Insertion des zweiten Isocyanids erheblich, was für die erfolgreiche Isolierung von 2 a entscheidend ist.
Als selektive Route zu 3 b wurde das Benzoboriren 1 mit zwei Äquivalenten DippNC bei Raumtemperatur umgesetzt. In gleicher Weise führte die doppelte Insertion des sterisch wesentlich anspruchsvolleren Mes*NC zu 3 a. Bei der Reaktion von 1 mit DippNC färbte sich das Gemisch sofort rötlich-braun, während mit Mes*NC die farblose Lösung sofort gelb wurde und sich dann über einen Zeitraum von 30 min langsam rötlich-braun färbte. In beiden Fällen führte die Reaktion zu einer nahezu quantitativen Bildung des doppelten Insertionsprodukts, d. h. des Benzoborol-2,3-diimins 3 a (82 % isolierte Ausbeute) und 3 b (78 % isolierte Ausbeute) (Schema 2). Die 11B NMR -Signale von 3 (3 a: 47.8 ppm, 3 b: 53.1 ppm) ähneln stark denen von 2 (2 a: 48.3 ppm, 2 b: 47.5 ppm). Die Einkristall-Röntgenstrukturanalyse zeigt das erhoffte Benzoborolgerüst (Abbildung 1): Die kurzen exocyclischen CN-Bindungen (1.284(3)/1.280(3)/1.278(4)/1.278(4) Å vs. CN-Doppelbindungen 1.27 Å) und die langen endocyclischen C1−C2-Bindungen (1.524(3)/1.496(4) Å vs. CC–Doppelbindungen 1.33 Å) stimmen mit der 2,3-Dihydro-2,3-diiminoborolstruktur überein.
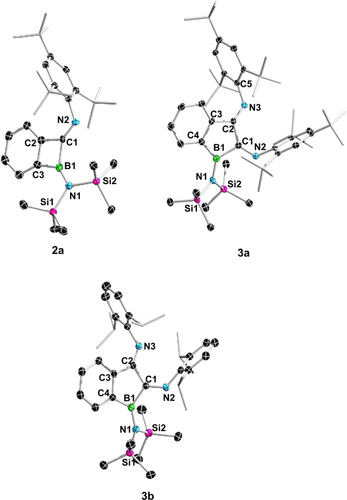
Einkristallstrukturen von 2 a, 3 a und 3 b.19 Wasserstoffatome wurden aus Gründen der Übersichtlichkeit entfernt. Die thermischen Ellipsoide sind mit einer Wahrscheinlichkeit von 50 % gezeichnet. Ausgewählte Bindungslängen (Å), Winkel (°): Für 2 a: B1−C1 1.638(4), B1−C3 1.591(4), C1−C2 1.494(4), B1−N1 1.408(4), C1−N2 1.275(3), C3−B1−C1 84.9(2), B1−C1−C2 86.3(2), C1−C2−C3 97.5(2), C3−C2−C1−N2 179.6(3); Für 3 a: B1−C1 1.607(4), C1−C2 1.524(3), C2−C3 1.495(3), B1−C4 1.575(4), B1−N1 1.417(3), C1−N2 1.284(3), C2−N3 1.280(3), C4−B1−C1 101.37(19), B1−C1−C2 106.48(19), C1−C2−C3 105.65(19); Für 3 b: B1−C1 1.590(4), C1−C2 1.496(4), C2−C3 1.492(4), B1−N1 1.415(4), C1−N2 1.278(4), C2−N3 1.278(4), C4−B1−C1 101.4(2), B1−C1−C2 108.4(2), C1−C2−C3 106.9(2).
Um die zugrundeliegenden Reaktionsmechanismen aufzuklären haben wir quantenchemische Berechnungen mit dem vollständigen Molekülmodell von 1 und den beiden Isocyaniden durchgeführt. Auf Grundlage von DFT-optimierten Strukturen und Gibbs-Energie-Beiträge aus entsprechenden Frequenzanalysen wurden verbesserte Einzelpunkt-Energien mit Hilfe hochkorrelierter Coupled-Cluster-Wellenfunktionstheorie erhalten, nämlich mit dem DLPNO(5,6)-CCSD(T1)/cc-pV(T,Q)Z-Ansatz, der eine Extrapolation zum vollständigen PNO-Limit sowie zum vollständigen Basissatzlimit umfasst. Die im Folgenden diskutierten relativen Energien beziehen sich auf dieses Theorieniveau; weitere Details zu den Rechnungen finden sich in den Hintergrundinformationen. Insgesamt handelt es sich bei den untersuchten Reaktionswegen um zwei Reaktionssequenzen, die beide auf denselben zwei elementaren Schritten beruhen, nämlich der Adduktbildung zwischen Boran und Isocyanid und der anschließenden Insertion des Isocyanids in eine Bor-Kohlenstoff-Bindung (Schema 3 und 4 für DippNC, siehe Hintergrundinformationen für Mes*NC). Sowohl bei DippNC als auch bei Mes*NC ist die anfängliche Adduktbildung leicht endergon, und die Insertion in die Bor-Kohlenstoff-Bindung über TSB ist geschwindigkeitsbestimmend und irreversibel. Die Addition eines weiteren Isocyanid-Äquivalents zu 2 b, wodurch B entsteht, ist thermoneutral und reversibel.
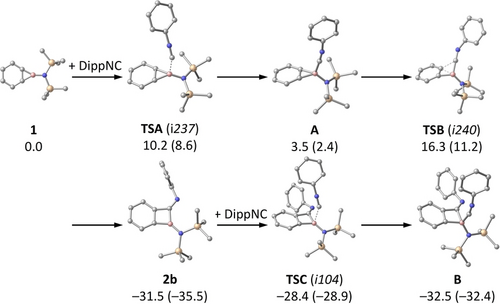
Berechneter Mechanismus für die Reaktion von Benzoboriren 1 mit DippNC, Wasserstoffatome und Alkylgruppen des Isocyanids zur Verdeutlichung weggelassen, Energien für Mes*NC in Klammern angegeben, Details siehe SI.
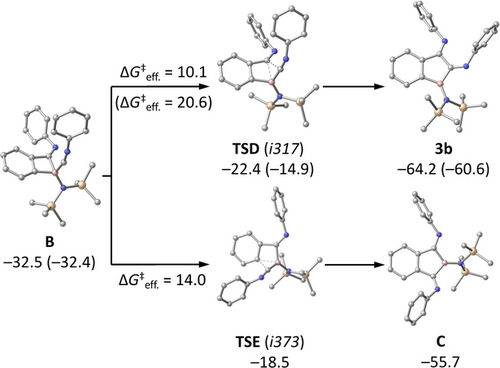
Berechneter Mechanismus für die Reaktion von Benzoboriren 1 mit dem DippNC, Wasserstoffatome und Alkylgruppen des Isocyanids aus Gründen der Übersichtlichkeit weggelassen, ausgewählte Energien für Mes*NC in Klammern angegeben, Einzelheiten siehe SI.
B stellt einen Verzweigungspunkt mit zwei ungleichwertigen C−B-Bindungen dar, die für die Ringerweiterung relevant sind, und in Übereinstimmung mit experimentellen Beobachtungen wird die Bildung von 3 b sowohl thermodynamisch als auch kinetisch gegenüber der alternativen Bildung von C begünstigt. Dementsprechend zeigt die Natürliche Populationsanalyse (NPA) eine stärkere Ladungspolarisation im Übergangszustand TSE, was im Vergleich zu TSD auf größere elektronische Umordnungen hinweist, der Unterschied geht vermutlich auf die in TSD begünstigten benzylischen Positionen des Bor- und Kohlenstoffatoms zurück, die an der Bindungsaktivierung beteiligt sind (vgl. Schema S4 in den Hintergrundinformationen). Die für die zweite Insertion berechnete niedrigere Barriere erklärt die Bildung einer Mischung aus 2 b und 3 b in den Experimenten mit einem Äquivalent DippNC (Schema 2). Im Gegensatz dazu wird bei der Reaktion mit einem und zwei Äquivalenten Mes*NC selektiv das erste bzw. das zweite Insertionsprodukt gebildet. Dies stimmt mit den quantenchemischen Ergebnissen überein: die erste Insertion hat eine wesentlich niedrigere Barriere als die zweite (ΔG≠=11 bzw. 21 kcal mol−1; vgl. Hintergrundinformationen). Mit einem Isocyanid-Äquivalent ergibt die kinetische Kontrolle also nur das Insertionsprodukt 2 a, während die Verwendung von zwei Isocyanid-Äquivalenten und eine verlängerte Reaktionszeit zu 3 a führt.
Das Redoxverhalten von 3 a wurde durch Cyclovoltammetrie und Differentialpulsvoltammetrie (DPV) in THF untersucht. Wie in Abbildung 2 dargestellt, wurden die beiden reversiblen Reduktionswellen für 3 a sowohl durch CV als auch DPV identifiziert. 3 a zeigt ein quasi-reversibles Reduktionsereignis, das bei E1/2=−2.12 V gegen Fc/Fc+ zentriert ist und die Bildung des stabilen Radikalanions [3 a]⋅K angibt. Der zweite Reduktionsprozess fand bei −3.22 V gegenüber Fc/Fc+ statt, also bei deutlich negativerem Potential. Die beiden gut voneinander getrennten Wellen deuteten darauf hin, dass die einfach und doppelt reduzierten Produkte [3 a]⋅K und [3 a]K2 selektiv erhältlich sein könnten. Hierzu wurde eine THF-Lösung von 3 a mit 1 Äquivalent KC8 bei Raumtemperatur gerührt (Schema 5a), wobei ein sofortiger Farbumschlag von Rotbraun nach Purpurrot auftrat. Nach der Filtration wurden durch langsame Diffusion von trockenem Pentan in das Filtrat bei −30 °C für die Röntgenstrukturanalyse geeignete Einkristalle gewonnen. Die Einkristallstruktur von [3 a]⋅K ist in Abbildung 3 (oben) dargestellt. Das Gegenkation K+ wird durch Koordination mit den N2- und N3-Atomen sowie zwei THF-Molekülen stabilisiert. Die beiden exocyclischen C−N-Bindungen (C1−N2 1.357(5), C2−N3 1.310(5) Å) sind nach der Reduktion beide leicht verlängert (3 a: C1−N2 1.284(3), C2−N3 1.280(3) Å), während die endocyclische C1−C2-Bindung von 1.524(3) Å auf 1.491(5) etwas verkürzt vorliegt. Der B1-N1-Abstand von 1.495(5) Å ist länger als der in 3 a (1.417(3) Å), was auf eine geschwächte B−N π-Wechselwirkung hinweist. Das EPR-Spektrum (schwarz) des Radikalanions [3 a]⋅K zeigt ein Drei-Linien-Signal (giso=2.0035) (Abbildung 4). Die Best-Fit-Simulationsparameter deuten auf eine delokalisierte Spinverteilung über die N1B1C1C2N2N3-Atome mit Hyperfeinkopplungen zu Bor (a(B)=5.5 MHz) und drei Stickstoffkernen (a(14 N)=23.9, 3.9 bzw. 5.0 MHz) hin.
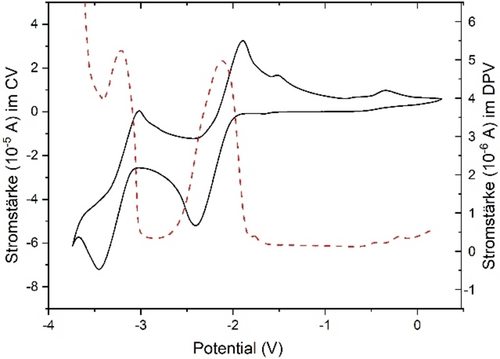
Voltammogramme wurden in THF, das 0.2 M TBA-PF6 enthält, unter Argonatmosphäre aufgenommen und auf das Ferrocen/Ferrocenium-Redoxpaar bezogen. CV- und DPV-Diagramme von 3 a. Die durchgezogene Linie: CV-Plot (Abtastrate=100 mV s−1); die rote gestrichelte Linie: DPV-Plot; der erste Reduktionsprozess von 3 a bei E1/2=−2.12 V gegen Fc/Fc+, der zweite Reduktionsprozess von 3 a bei E1/2=−3.22 V gegen Fc/Fc+.
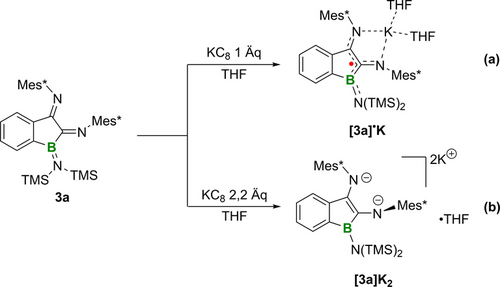
Synthese des radikalischen Anions [3 a]⋅K und des Dianions [3 a]K2.
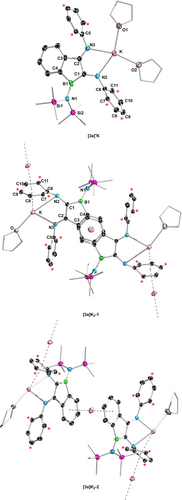
Einkristallstrukturen von [3 a]⋅K (oben) und [3 a]K2 (Mitte und unten). Zur Verdeutlichung wurden Wasserstoffatome entfernt, und die mit einem Sternchen gekennzeichneten Kohlenstoffatome tragen eine tBu-Gruppe. Die thermischen Ellipsoide sind mit einer Wahrscheinlichkeit von 50 % gezeichnet. Ausgewählte Bindungslängen (Å), Winkel (°): Für [3 a]⋅K: B1−C1 1.551(6), C1−C2 1.491(5), C2−C3 1.495(6), B1−N1 1.495(5), C1−N2 1.357(5), C2−N3 1.310(5), N2−C6 1.418(4), N3−C5 1.421(4), C6−C7 1.432(5), C7−C8 1.394(5), C8−C9 1.380(5), C9−C10 1.387(5), C10−C11 1.392 (5), C11−C6 1.440(5), K−N2 2.821(3), K−N3 2.789(3), C4−B1−C1 104.1(3) B1−C1−C2 105.9(3), C1−C2−C3 110.1(4); Für [3 a]K2: B1−C1 1.501(3), C1−C2 1.443(2), C2−C3 1.521(2), C1−N2 1.418(2), C2−N3 1.315(2), B1−N1 1.497(2), N2−C6 1.313(2), N2−C5 1.411(2), C6−C7 1.477(2), C7−C8 1.397(3), C8−C9 1.409(3), C9−C10 1.414(3), C10−C11 1.393 (3), C11−C6 1.479(3), K−N2 3.1608(15), K−N3 2.7311(14), C4−B1−C1 105.75(15), B1−C1−C2 108.22(14), C1−C2−C3 109.45(14).
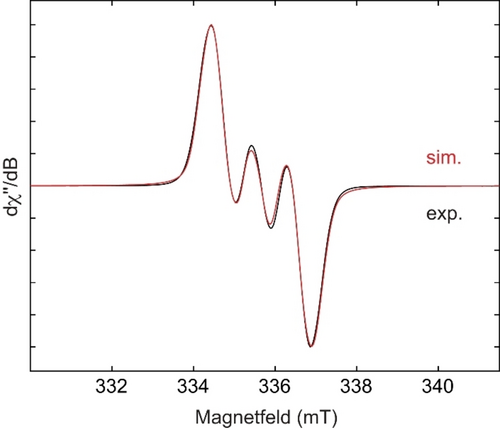
Experimentelle (schwarz) und simulierte (rot) kontinuierliche (CW) X-Band-EPR-Spektren von [3 a]⋅K. Die besten Simulationsparameter sind: giso=2.0035, a(B)=5.5 MHz (1.96 G), a(14N)=23.9 (1N) (8.54 G), 3.9 (1N) (1.39 G), und 5.0 MHz (1 N) (1.78 G). Die EPR-Messungen wurden in THF bei Raumtemperatur durchgeführt. Die Spektralsimulationen wurden mit MATLAB 9.12.0.1884302 (R2022a) und der EasySpin 5.2.33 Toolbox durchgeführt.22
Die Umsetzung von 3 a mit 2.2 Äquivalenten KC8 in THF bei Raumtemperatur führte zu einer dunkelgrünen Suspension (Schema 5b). Nach Filtration wurden dunkelgrüne Einkristalle des Dianions [3 a]K2 in 75 % Ausbeute durch langsame Diffusion von trockenem n-Pentan in das Filtrat bei −30 °C erhalten. Die Verbindung [3 a]K2 wurde mit Hilfe der 1H-, 11B- und 13C NMR -Spektroskopie charakterisiert. Die 1H NMR -Signale des Ar-H Restes (δH 7.09, Mes*-H; 6.43, Mes*-H; 6.23, 5.78, 5.00 Ph-H) sind im Vergleich zu 3 a deutlich hochfeldverschoben (δH 7.94, Ph-H; 7.29, Mes*-H und Ph-H; 7.22, Mes*-H; 6.95, 5.60, Ph-H). Das Dianion [3 a]K2 kristallisiert in der monoklinen Raumgruppe P21/n als kaliumverbrücktes Polymer (Abbildung 3, unten). Die exocyclische C1−N2-Bindung (1.418(2) Å) wird bei der zweiten Reduktion um ca. 6 pm verlängert ([3 a]⋅K:1.357(5) Å) und der C2−N3-Abstand (1.315(2) Å) ist mit dem von [3 a]⋅K (1.310(5) Å) vergleichbar. Die C1−C2-Bindung von 1.443(2) Å in [3 a]K2 wird bei der zweiten Reduktion um ca. 5 pm verkürzt (3 a: 1.524(3) Å, [3 a]⋅K 1.491(5) Å) und ist nun vergleichbar mit der des berichteten Benzoborol-Dianions (1.446(18) Å).21 Die beiden N-Mes*-Bindungslängen sind erheblich unterschiedlich, wobei N2−C6 (1.313(2) Å) signifikant verkürzt ist, während N3−C5 (1.411(2) Å) bei der zweiten Reduktion fast unverändert bleibt ([3 a]⋅K N2−C6 1.418(4) Å, N3−C5 1.421(4) Å). Darüber hinaus ist der N2-gebundene Mes*-Ring nicht planar (C6 steht um 14.7° aus der Ebene), was darauf hindeutet, dass die N2-Mes*-Einheit an der Delokalisierung der negativen Ladung beteiligt ist. Dies wird auch durch ausgeprägte Bindungslängenalternanzen innerhalb des Arylrings bestätigt.
Die UV/Vis-NIR-Absorptionsspektren von 3 a, [3 a]⋅K und [3 a]K2 wurden in Toluol unter Argon aufgenommen (Abbildung 5). Die niedrigsten Energiebanden von [3 a]⋅K und [3 a]K2 erscheinen bei 529 bzw. 592 nm, die beide im Vergleich zu denen der neutralen Verbindung 3 a (422 nm) deutlich rotverschoben sind.

UV/Vis-NIR-Absorptionsspektren von 3 a, [3 a]⋅K und [3 a]K2 in Toluol.
Eine detaillierte Analyse zeigt, dass sich das zusätzliche Elektron in [3 a]⋅K in einem SOMO befindet, das dem LUMO von 3 a sehr ähnlich ist (Schema 6a). Da dieses Orbital in Bezug auf die C−C−B-Einheit bindend und in Bezug auf die beiden exocyclischen Stickstoffatome antibindend ist, führt seine Besetzung zu Variationen der Bindungslängen (siehe Tabelle S3–5 in den Hintergrundinformationen für einen detaillierten Vergleich der berechneten und experimentell bestimmten Strukturparameter). Durch die Einbringung eines zweiten Elektrons in dasselbe Orbital werden diese Effekte in [3 a]K2 noch verstärkt. Im Gegensatz zu [3 a]⋅K trägt jedoch das π-System eines der Mes*-Substituenten nun wesentlich zum HOMO bei. Die berechneten Gruppen-NPA-Ladungen veranschaulichen die lokalisierte Ladungsakkumulation bei der Reduktion in der Serie 3 a, [3 a]⋅K und [3 a]K2 (Schema 6c). Die zusätzliche Elektronendichte, die im ersten Reduktionsschritt eingebracht wird, befindet sich hauptsächlich im bicyclischen System und an den benachbarten Stickstoffatomen der beiden Mes*-Imin-Substituenten (Einzelheiten siehe SI). Der deutliche Ladungsunterschied zwischen den beiden Mes*-Gruppen nach der ersten Reduktion (Δq=0.14) wird jedoch im zweiten Reduktionsschritt (Δq=0.50) stärker ausgeprägt, zusammen mit einer erheblichen Ladungszunahme im Benzoborolteil. Insgesamt erfährt die Mes*-Gruppe des Imins neben dem Bor-Zentrum eine Redution um −0.50 Elektronen, was zu einer ausgeprägten Strukturverzerrung führt.

Elektronische Strukturanalyse: a) Grenzorbitale von 3 a, [3 a]⋅K und [3 a]K2, die an der Reduktion mit KC8 beteiligt sind, b) Fragmentierungsschema der Ladungsanalyse am Beispiel von 3 a, c) NPA-Gruppenladungen für die jeweiligen Anteile und Änderungen der NPA-Ladungen relativ zu 3 a, Isoflächen bei ±0.05 a0−3/2.
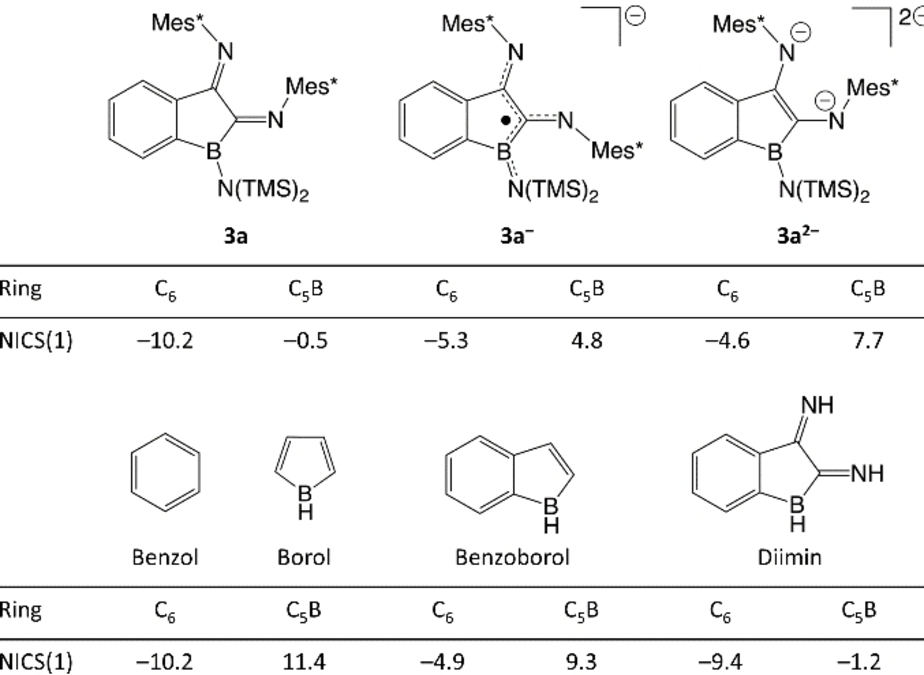
Zur weiteren Charakterisierung der Benzoborolreste in 3 a wurden [3 a]⋅K und [3 a]K2 kernunabhängige chemische Verschiebungen (NICS) an beiden Ringmittelpunkten sowie 1 Å über der Ringebene berechnet; zur Übereinstimmung mit Ref. 11 wurde zu diesem Zweck die B3LYP/6-311+G* Methode verwendet, vgl. Hintergrundinformationen. Die auf diese Weise erhaltenen NICS(0)- und NICS(1)-Werte werden im Allgemeinen als Maß für die Aromatizität verwendet, wobei negative Werte auf Aromatizität und positive Werte auf Antiaromatizität hindeuten; während der vollständige Datensatz als Hintergrundinformation vorgelegt wird, konzentrieren wir uns hier auf die aussagekräftigeren NICS(1)-Werte.23 Unter Verwendung von Benzol als Referenz mit NICS(1)=−10.2 ppm kann der 6-gliedrige Ring von 3 a als aromatisch eingestuft werden, während der 5-gliedrige Ring weder einen aromatischen noch einen antiaromatischen Charakter aufweist (Tabelle 1), was im Einklang mit den für ein 2,3-Dihydro-2,3-diiminobenzoborol erhaltenen Werten steht. Die Bildung von [3 a]⋅K geht mit einem Anstieg der NICS(1)-Werte für beide Ringe einher, was auf eine entstehende Antiaromatizität im 5-gliedrigen Ring hinweist. Eine weitere Reduktion zu [3 a]K2 erhöht wiederum beide NICS(1)-Werte, die nun denen des Ausgangsbenzoborols und denen der in der Literatur bekannten Verbindungen ähneln (siehe SI). Der ungewöhnliche antiaromatische Charakter der Boroleinheit in [3 a]K2 spiegelt sich in den berechneten NPA-Ladungen der Gruppe wider, die eine erhebliche Anhäufung negativer Ladungen an den exocyclischen Substituenten (Schema 6) und nicht am Borolkern zeigen.
Was die UV-Spektroskopie betrifft, so stellen wir fest, dass die erste Anregung von 3 a bei 445 nm einem HOMO–LUMO-Übergang von einem der Mes*-Substituenten zum Ringsystem und den benachbarten Stickstoffatomen entspricht (siehe SI). Für [3 a]⋅K wird ein erster Übergang bei 896 nm berechnet. Der zweite Übergang bei 514 nm ist wiederum ein HOMO–LUMO-Übergang von einem der Mes*-Substituenten zum Ringsystem. Für das doppelt reduzierte [3 a]K2 ist der erste Übergang ein HOMO–LUMO-Übergang innerhalb des Ringsystems.
Zusammenfassung
Zusammenfassend haben wir die Reaktionen von Benzoboriren 1 mit Isocyaniden untersucht. Die neuen Bor-Heterocyclen, die ein oder zwei Imine tragen, wurden durch 1,1-Insertion von Isocyaniden erhalten. Die experimentell beobachtete Regioselektivität konnte durch quantenchemische Berechnungen der Reaktionswege erklärt werden. Anschließend haben wir das Benzoborol-2,3-diimin 3 a schrittweise reduziert und das radikalische Anion [3 a]⋅K und das Dianion [3 a]K2 erhalten. Diese Spezies wurden isoliert und sowohl strukturell als auch spektroskopisch mittels CV, EPR, UV/Vis-NIR sowie quantenchemischer Bindungsanalyse charakterisiert. Zweifellos ist Benzoboriren 1 ein äußerst wichtiges Synthon für Borole und andere verwandte Strukturen. Darüber hinaus haben detaillierte quantenchemische Berechnungen gezeigt, dass das benzanellierte Boroldiid [3 a]K2 im Gegensatz zu typischen Boroldiiden eine Antiaromatizität innerhalb der Boroleinheit aufweist. Dieser Befund spiegelt sich in einer erheblichen Verschiebung der negativen Ladung weg vom Borolkern hin zu den exocyclischen Substituenten wider. Weitere Untersuchungen zur Anwendung von Benzoborol-2,3-diimin in der Koordinationschemie werden derzeit in unserem Labor durchgeführt.
Danksagung
Q.Y. dankt der DFG (Grant No. 517941121, 520987585) für die finanzielle Unterstützung. Q.Y. bedankt sich auch bei der Julius-Maximilians-Universität Würzburg (JMU) für die großzügige Unterstützung. Xiaocui Liu dankt der Guangdong Basic and Applied Basic Research Foundation (2022A1515110370). Quantenchemische Berechnungen wurden am Center for Scientific Computing (CSC) Frankfurt auf dem Goethe-HLR-Hochleistungsrechencluster durchgeführt. Wir danken Dr. Ivo Krummenacher für die Durchführung der EPR-Spektralsimulationen. Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Interessenkonflikt
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.
Open Research
Data Availability Statement
Die Daten, die die Ergebnisse dieser Studie unterstützen, sind in den Hintergrundinformationen zu diesem Artikel verfügbar.




