Perfekt Isotaktisches Polypropylen nach In Situ Aktivierung von Ultrarigiden meso Hafnocenen
Abstract
Für über 40 Jahre basierte die Synthese von racemischen C2-symmetrischen indenyl-Metallocenen für die isospezifische Polymerisation von Propylen auf einer sehr aufwändigen Trennung der beiden hergestellten rac und meso Isomere. Bis heute gelten letztere als unerwünscht, da sie ataktisches Polypropylen (aPP) anstatt isotaktischem Polypropylen (iPP) produzieren, wenn sie mit Methylaluminoxan (MAO) aktiviert werden. Überraschenderweise lieferte die in situ Aktivierung des meso Hafnocens I perfekt isotaktisches Polypropylen. Über Kernspinresonanzspektroskopie (NMR) konnten wir eine Isomerisierung der meso Verbindung zur entsprechenden rac Verbindung nach Zugabe von Triisobutylaluminum (TIBA) nachweisen und ein praktisches Polymerisationsprotokoll etablieren, welches vergleichbare Produktivitäten für reines meso-I und Isomerengemische verglichen mit reinem rac-I lieferte. Durch dieses Isomerisierungsprotokoll wurde die potentielle Ausbeute an iPP um mehr als 400 % gesteigert. Es wurde gezeigt, dass dieses Protokoll auf weitere meso Verbindungen anwendbar ist und erste mechanistische Einblicke wurden erhalten.
Die Entdeckung von Brintzinger und Kaminsky im Jahr 1985 zur Herstellung von isotaktischem Polypropylen (iPP) mit enger Molekulargewichtsverteilung durch Verwendung racemischer ansa-Zirconocene läutete neben der heterogenen Polymerisation ein neues Kapitel in der stereospezifischen Polymerisation von Propylen ein.1 Mit Hilfe der pionierenden Vorarbeit von Spaleck,2 erzielte unsere Gruppe das bisher höchste Molekulargewicht und den höchsten Schmelzpunkt von iPP ex reactor durch das Verwenden ultrarigider ansa-Hafnocenen.3 Nachdem diese Hafnocene eine schwache Performance bei erhöhten Temperaturen zeigten, untersuchten Voskoboynikov und Mitarbeiter Zirconocene, welche bei Hochtemperaturen eine verbesserte Leistung aufwiesen.4 Nichtsdestotrotz, alle ansa-Metallocene besitzen einen großen Nachteil: die notwendige und sehr aufwendige Trennung der rac und meso Isomere. Diese benötigt normalerweise mehrere Umkristallisationen,3b wohingegen bisher für manche Metallocene noch keine geeigneten Trennungsbedingungen gefunden wurden.5 Neben der sehr aufwändigen Trennung, wird viel meso Katalysator als unerwünschtes Nebenprodukt ohne nützliche Anwendungen akkumuliert und bleibt damit ungenutzt im Polymerisationsprozess. In der Literatur sind manche meso-zu-rac Isomerisierungsprozesse beschrieben, beispielsweise durch das Anwenden von ultraviolett (UV) Licht6 – diese Protokolle führen jedoch oft zu Gleichgewichtszuständen oder sind für manche Katalysatorsysteme nicht geeignet. 2007 beschrieben Jordan und Mitarbeiter eine Anion-induzierte meso-zu-rac Isomerisierung durch Chloridsalze, wie etwa LiCl, in refluxierendem THF.7 Dieses Verfahren wurde von Voskoboynikov und Mitarbeitern für unterschiedliche Metallocene untersucht und angewendet.5, 8 Obwohl die Anion-induzierte meso-zu-rac Isomerisierung die Ausbeute an reinem rac-Katalysator erhöhen kann, stellen der zusätzliche synthetische Schritt (beispielsweise Refluxieren und Abtrennen von LiCl) und damit verbundene Zeitaufwand schwerwiegende Nachteile dar.
Meso-Metallocene erfuhren bisher kaum Aufmerksamkeit und wurden eher als unerwünschte Nebenprodukte anstatt ernstzunehmender Katalysatoren für die Polymerisation von Propylen angesehen. Nach den Ewen′schen Symmetrie-Regeln wird davon ausgegangen, dass meso-Katalysatoren ataktisches Polypropylen (aPP) produzieren, da das Katalysatorsystem keine Vorzugsrichtung in Bezug auf das enatiomorphic-site-model besitzt.9 Tatsächlich erhielt Ewen eine iPP/aPP-Mischung (Verhältnis 2 : 1) durch Polymerisation von rac/meso Et-(Ind)2-TiCl2 mit Methylaluminoxan (MAO).9a
Neugierig über die Performance unseres Referenz-Katalysatorsystems rac-I von unserer Gruppe,4 isolierten wir das Hafnocen meso-I (Schema 1) und untersuchten dessen Polymerisation von Propylen nach in situ Aktivierung.10
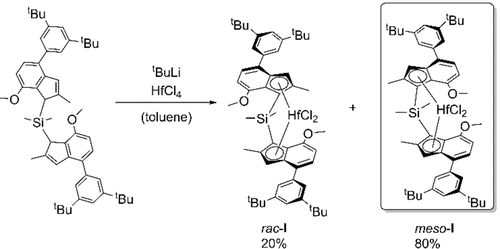
Synthese von rac-I und meso-I.
Anstatt aPP lieferte die Polymerisation von meso-I bei 30 °C perfekt isotaktisches Polypropylen nach in situ Aktivierung mit Triisobutylaluminum (TIBA) und anschließender Initiierung mit [Ph3C][B(C6F5)4] (TrBCF).
Dennoch zeigte reiner meso-I eine reduzierte Produktivität und Molekulargewicht sowie eine leichte Bimodalität verglichen zu reinem rac-I (siehe Tabelle 1, Einträge 1–4). Bei der Polymerisation mit einem rac/meso-Gemisch wurden Literaturwerte ohne Bimodalität und ohne Verringerung des Molekulargewichts erhalten.
Eintrag |
Katalysator |
n[b] |
Aktivierung[c] |
[mmmm][d] |
Mw[e] |
Tm[f] |
Ð[g] |
P[h] |
|---|---|---|---|---|---|---|---|---|
1 |
meso-I |
1.65 |
TIBA/TrBCF |
>99 |
900 |
165.9 |
2.5 |
500 |
2 |
rac-I |
1.65 |
TIBA/TrBCF |
>99 |
1600 |
165.1 |
1.6 |
6000 |
3 |
rac-I/meso-I (1/4) |
3.30 |
TIBA/TrBCF |
>99 |
1800 |
165.6 |
1.4 |
400 |
4[i] |
meso-I[j] |
1.65 |
TIBA/TrBCF |
>99 |
700 |
165.0 |
2.4 |
7000 |
5 |
rac-I/meso-I (1/4) [j] |
1.65 |
TIBA/TrBCF |
>99 |
1300 |
165.0 |
1.6 |
5000 |
6 |
meso-I |
3.30 |
MMAO |
23[k] |
500 |
163.4[k] |
1.8 |
130 |
- [a] tp=30 min; Tp=30 °C; Vtoluol=120 mL; p=pAr+ppropylen=4 bar, pAr=1.5 bar. [b] in μmol. [c] TIBA/TrBCF: Initiator [Ph3C][B(C6F5)4]=5.0 Äquiv., Aktivator (TIBA)=200 Äquiv., scavenger (TIBA)=0.55 mmol; modifiziertes MAO (MMAO): scavenger=Aktivator (MMAO)=2000 Äquiv. [d] I n %, bestimmt via 13C NMR Spektroskopie in der Annahme des enantiomorphic site Models. [e] In kg mol−1, absolut bestimmt via SEC-GPC in 1,2,4-Trichlorobenzol bei 160 °C mit dn/dc=0.097 mL g−1. [f] in °C. [g] Đ=Mw/Mn. [h] In kgPP [molcat h]−1. [i] Tp ±15 °C. [j] Vor-isomerisiert mit 1.00 Äquiv. TIBA bei 100 °C für 15 h. [k] aPP/iPP blend.
Voskoboynikov und Mitarbeiter erzielten für die Anion-induzierte meso-zu-rac Isomerisierung von meso-I zu rac-I eine Ausbeute von 95 %.8 Durch die Tatsache, dass meso-I unter unseren Umständen perfekt isotaktisches Polypropylen ([mmmm] >99 %) lieferte, schlussfolgerten wir, dass eine Aluminium-induzierte Isomerisierung von meso-I zu rac-I – ähnlich der assoziativen Chlorid-Anion induzierten – während der Aktivierung erfolgt. Dies wurde durch Kernspinresonanzspektroskopie (NMR) bestätigt.
Das 29Si NMR von meso-I nach der Reaktion mit 20.0 Äquiv. TIBA deutete eine Isomerisierung und anschließende Alkylierung von meso-I zu rac-Ialk an. Hierbei wurde zwischen mehreren nicht-identifizierbaren Signalen das gleiche Signal wie für das Aktivierungsprodukt beobachtet (Abbildung S4). Allerdings führten 200 Äquiv. TIBA zu einer Zersetzung von meso-I und damit konnte keine saubere NMR Analyse durchgeführt werden (Abbildung S5). Dieser Abbau konnte sogar visuell beobachtet werden (siehe Abbildung S2), wurde mittels UV/Vis-Analyse überwacht (Abbildung S1) und ist wahrscheinlich für die leichte Bimodalität der Polymere verantwortlich. Um die Isomerisierung noch detaillierter zu untersuchen, nutzten wir die 1H NMR Spektroskopie, anfänglich mit 1.00 Äquiv. TIBA, um Signalunterdrückung zu vermeiden.
Da der Reaktionsfortschritt bei 60 °C träge war, erhöhten wir die Temperatur auf 100 °C. Die Isomerisierung wurde anhand der 5-H-Inden und 4-Methoxy Gruppen beurteilt, und eine Zunahme des rac-Signals bei einer Abnahme des entsprechenden meso Signals (Abbildung 1 und S6) beobachtet.
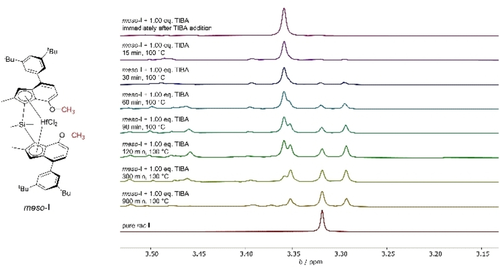
Ausschnitte der 1H NMR Spektren der Isomerisierung von meso-I zu rac-I nach Zugabe von 1.00 Äquiv. TIBA bei 100 °C.
Neben den rac-Signalen wurden nach 15 h bei 100 °C weitere Signale sichtbar, die meisten davon können nicht identifizierbaren Abbauprodukten zugeordnet werden. Ein Signal (δ=−1.15 ppm, 1H NMR) kann jedoch der alkylierten Spezies rac-Ialk Hf-iBu zugewiesen werden, da diese für die Reaktion von rac-I mit 1.00 Äquiv. TIBA unter den gleichen Bedinungen zu beobachten ist. (Abbildung S7). Das 1H NMR Spektrum zeigte nach Erhitzen der Reaktion für 15 h bei 100 °C ohne TIBA Signale, die möglicherweise rac-I entsprechen. Die vorwiegende Spezies war jedoch weiterhin meso-I, zusammen mit nicht identifizierbaren Nebenprodukten, was die Bedeutung von TIBA für eine effiziente Isomerisierung unterstreicht. Bei 60 °C mit 10.0 Äquiv. TIBA wurde ebenfalls eine Isomerisierung von meso-I beobachtet (Abbildung S8). Die Signale der alkylierten Spezies rac-Ialk (δ=−1.15 ppm) waren im Vergleich zur Reaktion mit nur 1.00 Äquiv. TIBA. wie erwartet verstärkt ausgeprägt – die Signale von Nebenprodukten waren jedoch ebenfalls verstärkt. Wir schlussfolgerten daher, dass die Isomerisierung von meso-I mit dessen Abbau konkurrieren und dass höhere TIBA-Konzentrationen den Abbau fördern würden. Des weiteren wurde die Isomerisierung und anschließende Aktivierung mit 200 Äquiv. TIBA mittels 29Si NMR verfolgt (Abbildung S9). Wir beobachteten, dass sowohl meso-I als auch rac-I das gleiche Aktivierungsprodukt ausbildeten, wenn meso-I vor dessen Aktivierung isomerisiert wurde (1.00 Äquiv. TIBA, 100 °C, 16 h). Da die Isomerisierung mit 1.00 Äquiv. TIBA bei 100 °C effektiver war, haben wir ein praktisches Protokoll für Polymerisationen unter Verwendung von meso-I erstellt, um iPP mit erhöhter Produktivität zu erhalten. Zunächst wurde meso-I über Nacht bei 100 °C isomerisiert – die Isomerisierung wurde über NMR Spektroskopie bestätigt – und anschließend wurde die etablierte in situ Aktivierung mit 200 Äquiv. TIBA durchgeführt.10b Dieses Verfahren lieferte für ein meso/rac Gemisch perfekt isotaktisches PP mit Molekuargewichten, Polydispersitäten und Produktivitäten vergleichbar zu reinem rac-I, während eine hohe Aktivität und der damit einhergehende Temperatursprung für reines meso-I zu einer verbreiterten Polydispersität führte (siehe Tabelle 1, Einträge 4 und 5).
Außerdem untersuchten wir die Polymerisation von Propylen mit meso-I nach MAO Aktivierung. Das erhaltene Polymer war ein chemisch und mechanisch trennbares iPP/aPP Gemisch (Abbildung S29). Ein geeignetes 1H NMR Experiment konnte nicht durchgeführt werden, da keine definierten Katalysatorspezies zu unterscheiden waren. Wir schlussfolgerten, dass die kurze Kontaktzeit von MAO mit meso-I im Reaktor zu einer unvollständigen Isomerisierung führte, während meso-I teilweise direkt aktiviert wurde – die isomerisierte Spezies lieferte iPP, während die direkte Aktivierung aPP ausbildete. Nachdem kommerzielles MAO immer nicht-hydrolysiertes Trimethylaluminium (TMA) enthält,11 wurde die Isomerisierung von meso-I mit TMA bei 100 °C untersucht (Abbildung 2).
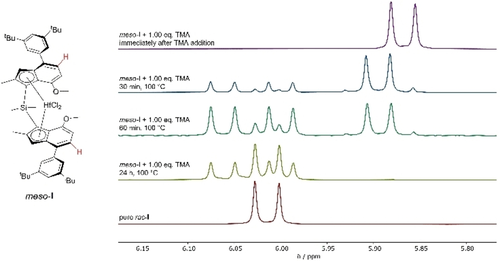
Ausschnitte des 1H NMR Spektrums der Isomerisierung von meso-I zu rac-I nach Zugabe von of 1.00 Äquiv. TMA bei 100 °C.
Die 1H NMR Spektren bestätigen die Isomerisierung von meso-I nach Zugabe von TMA, die sogar schneller als mit TIBA abläuft – vermutlich aufgrund des geringeren sterischen Anspruchs von TMA. Neben rac-I wurden mehrere Nebenprodukte gebildet, wenn die Reaktion in Toluol durchgeführt wurde. Wurde dem Reaktionsgemisch jedoch THF zugesetzt, waren weder Alkylierungs- noch Zersetzungprodukte zu beobachten – nur Signale von meso-I oder rac-I. Wir vermuten, dass THF die Reaktivität von TMA abschwächt, was wahrscheinlich auf dessen koordinierenden Charakter zurückzuführen ist (Abbildung S10). Dennoch war noch unklar, ob die Isomerisierung durch den Lewis-sauren Charakter (z. B. Koordination an das Hafnocen) der Aluminiumalkyle oder durch die Alkylierung und damit die Erhöhung des sterischen Anspruchs der neu gebildeten Diisobutylgruppe initiiert wird. Deshalb haben wir meso-I mit Grignard-Verbindungen nach Literaturvorschriften umgesetzt.12 Während die Addition von MeMgBr an meso-I in reinem meso-IMe resultierte, lieferte die Reaktion von meso-I oder rac-I mit iBuMgBr weder meso-IiBu noch rac-IiBu, selbst für unterschiedliche Reaktionsbedingungen. Im Vergleich zu meso-I zeigte Einkristall-Röntgenbeugung (SC-XRD) für meso-IMe einen erhöhten C−Si−C Winkel, Hf−Cpcentroid Bindungslänge und D-Wert, was auf den erhöhten sterischen Anspruch der Methylgruppen zurückzuführen ist und zu einem kleineren bite angle führt (Tabelle 2, Abbildung 3).
|
bite angle [deg] |
dihedral angle [deg] |
Hf-Cpcentroid [Å] |
D [Å] |
|---|---|---|---|---|
rac-I |
57.8 |
42.63 |
2.218 |
0.926 |
meso-I |
57.1 |
31.6/44.0 |
42.230±0.003 |
0.927±0.009 |
meso-IMe |
56.6 |
32.3/44.4 |
2.239±0.002 |
0.961±0.004 |
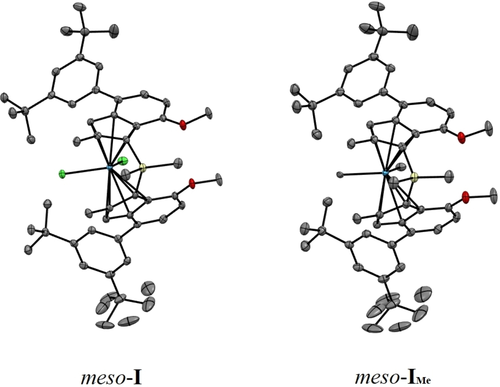
ORTEP Darstellung von meso-I und meso-IMe mit Ellipsoiden mit 50 % Wahrscheinlichkeit gezeichnet. Wasserstoffatome wurden der Übersichtlichkeit nicht dargestellt.
Außerdem weisen meso-I und meso-IMe zwei Konfigurationen der 4(3,5tBu)-Aryl-Substituenten auf, was wahrscheinlich auf die sterische Abstoßung der Indenyl-Substituenten zurückzuführen ist. Dies erklärt das Fehlen einer perfekten Symmetrie der meso-Isomere, was zu einer Variation von Hf−Cpcentroid und des dihedral angle führt, was ebenfalls für das entsprechende meso-Zirkonocen in einer früheren Studie beobachtet wurde.3a Die Isolierung von meso-IMe zeigt jedoch, dass die sterische Abstoßung im Zuge der Aktivierung nicht für die Isomerisierung verantwortlich ist und dass Grignard-Reagenzien nicht in der Lage sind, meso-I zu isomerisieren.
Die Polymerisation mit rac/meso-Gemischen unter Verwendung der in situ Aktivierung mit TIBA/TrBCF ermöglicht ein praktisches Screening für die Leistungsfähigkeit von ultrarigiden Hafnocenen, da keine mühsame Trennung erforderlich ist und vergleichbare Molekulargewichte wie für reine rac-Isomere erhalten werden. Darüber hinaus wird durch die Verwendung des etablierten Isomerisierungsprotokolls die potenzielle Ausbeute an iPP pro verwendetem Liganden für die Katalysatorsynthese um ein Vielfaches erhöht (mehr als 400 % für I).
Bis jetzt können wir nicht feststellen, ob die Isomerisierung durch Einflussnahme der Substituenten im Katalysatorgerüst – insbesondere der Methoxygruppe – auf die Koordination von Aluminiumalkyle zurückzuführen ist. Es zeigte sich jedoch, dass die 4(3,5R)-Aryl-Substituenten keine entscheidende Rolle spielen, da ein isomeres rac/meso-Gemisch (1/3) eines 4-Ph-Inden-Hafnocens3b ebenfalls perfekt isotaktisches PP lieferte. Bisher konnten wir das reine meso Isomer nicht isolieren, aber im 1H NMR-Spektrum waren keine dem jeweiligen meso-Isomer entsprechenden Signale sichtbar, nachdem das Gemisch nach unserem Protokoll isomerisiert worden war. Zusätzlich war die Produktivität des Katalysators bei der Polymerisation von Propylen für das isomerisierte Gemisch im Vergleich zu dem nicht isomerisierten Gemisch erhöht.
Zusammenfassend lässt sich sagen, dass wir die Isomerisierung von meso-I zu rac-I mit Aluminiumalkylen nachgewiesen haben, wodurch perfekt isotaktisches Polypropylen mit makromolekularen Eigenschaften entstand, die denen von reinem in situ aktivierten rac-I entsprechen. Darüber hinaus führte das etablierte Isomerisierungsprotokoll vor der in situ Aktivierung zu einer Produktivität von reinem meso-I, die mit der von reinem rac-I vergleichbar ist und auf Isomerengemische übertragbar ist. Schließlich konnten wir durch die Synthese von meso-IMe den sterischen Anspruch im Zuge der Aktivierung als Initiator der Isomerisierung ausschließen, da reines meso-IMe sowohl in Lösung als auch als Einkristall ohne Spuren von einer Isomerisierung isoliert wurde. Um den von uns angenommenen assoziativen Mechanismus weiter zu belegen, müssen in Zukunft weitere Katalysatorsysteme mit unterschiedlichen Liganden und zentralen Metallatomen untersucht, sowie Dichtefunktionaltheorieberechnungen (DFT) durchgeführt werden.
Danksagung
Die Autoren danken Dr. Sergei Vagin für konstruktive Diskussionen und Jonas Bruckmoser, Moritz Kränzlein und Dr. Thomas Pehl für das Korrekturlesen des Manuskripts und für wertvolle Diskussionen. Außerdem danken wir Fabrizio Napoli aus der Forschungsgruppe von Prof. Roland Fischer für die LIFDI-Massenspektren. Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Interessenkonflikt
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.
Open Research
Data Availability Statement
SC-XRD-Daten sind unter https://www.ccdc.cam.ac.uk/products/csd mit den Ablagerungsnummern 2179591 (meso-I) und 2179592 (meso-IMe) verfügbar.13




