Ein gemischtes, schwereres Si=Ge Analogon eines Vinylanions
Professor Rainer Streubel zum 62. Geburtstag gewidmet
Abstract
Die vielseitigen Reaktivitäten von Disileniden und Digermenid, schwereren Analoga von Vinylanionen, haben den Pool an Silicium- und Germaniumverbindungen in den letzten zwei Jahrzehnten mit verschiedensten unerwarteten Strukturmotiven erheblich erweitert. Wir berichten nun über die Synthese eines cyclischen, heteronuklearen Vinylanionanalogons mit einer Si=Ge Bindung, dem Kaliumsilagermenid als stabiles THF- und 18-c-6-Solvat durch KC8 Reduktion von Germylen- oder Digermenvorläufern. Seine Eignung als Baustein für die Synthese von funktionellen Silagermenen wird durch die jeweiligen Reaktionen mit Chlorsilan und Chlorphosphan unter Bildung der entsprechenden Silyl- und Phosphanylsilagermenen nachgewiesen. Röntgenkristallographische Analyse, UV/Vis Spektroskopie und DFT Berechnungen zeigten einen erheblichen Grad an π-Konjugation zwischen N=C und Si=Ge Doppelbindungen in der Titelverbindung.
Stabile, ungesättigte Verbindungen zwischen zwei schwereren Elementen der Gruppe 14 sind weiterhin ein stark erforschtes Thema in der zeitgenössischen Hauptgruppenchemie.1 Mehrfachbindungen zwischen den schwereren Kohlenstoffkongeneren verleihen intrinsisch kleine HOMO–LUMO Lücken, Konformationsflexibilität, hohe Reaktivität und besondere Bindungssituationen.1 Seit den bahnbrechenden Entdeckungen eines stabilen Digermens von Lappert2 und eines Disilens von West3 wurde eine Vielzahl schwererer Alkene (R2E=ER2, E=Si-Pb) I–III (Schema 1) synthetisiert und deren ungewöhnliche Strukturen und Eigenschaften gründlich untersucht.1 Im Vergleich zu den homonuklearen Spezies (R2E=ER2) sind die Synthesewege zu heteronuklearen, schwereren Alkenen (R2E=E′R2) begrenzt, jedoch wurden eine Handvoll cyclischer4 und acyclischer5 Silagermene III hergestellt.
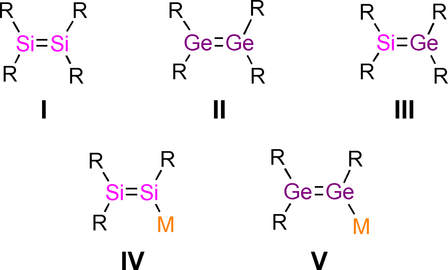
Literaturbekannte Strukturmotive von nicht funktionalisierten (I bis III) und metallierten, schwereren Alkenen (IV bis V, R=organischer Substituent; M=Alkalimetall).
Das Aufkommen schwererer Alkene (R2E=ER-M) mit Metallfunktionalität6, 7 in Vinylposition ermöglichte verschiedene Transformationen unter Beibehaltung der unkompromittierten schwereren Mehrfachbindungen,8 erweiterte aber auch erheblich das Repertoire an Siliciumverbindungen als Ausgangsmaterialien für heteronukleare und funktionalisierte schwerere Alkene,9, 10 Heterocyclen11 und Cluster.12 In den letzten zwei Jahrzehnten wurden verschiedene Methoden zur Herstellung von Metalldisileniden IV entwickelt,6 aber nur ein Beispiel für ein Alkalimetalldigermenid V ist bekannt.7 Vinylanionen, die aus zwei verschiedenen schwereren Elementen der Gruppe 14 bestehen, sind weiterhin schwer fassbar, obwohl die Apeloig Gruppe über Lithiumsilenide (R2C=SiR-M) mit mindestens einem schwereren Terminus der Gruppe 14 berichtete.13 Tokitoh et al. beschrieben Germenyl- und Stannenylanion-Einheiten als Teil der delokalisierten Germaphenyl-14 und Stannaphenylkalium15 Gerüste.
Wir haben das NHC-koordinierte, viergliedrige Germylen 1 mit einer exocyclischen Iminofunktionalität und einem Chlorsubstituenten in α-Position zum Germaniumzentrum16 als Vorstufe für die Synthese eines beispiellosen Vinylanionanalogons mit einer Si=Ge Doppelbindung ausgewählt, je nach Position der negativen Ladung in der Doppelbindung entweder als Silagermenid oder als Germasilenid. Berechnungen sagten die etwas höhere Stabilität von Silagermenid [(CH3)2Si=Ge(CH3)]− um ΔG=4.7 kcal mol−1 im Vergleich zum Positionsisomer [(CH3)2Ge=Si(CH3)]− voraus.17 Das NHC kann durch BPh3 reversibel aus Germylen 1 entfernt werden, um das entsprechende Dimerisierungsprodukt, Digermen 2, zu erhalten (Schema 2). Durch erneute Zugabe von NHC wird Digermen 2 wieder in das Ausgangsgermylen 1 umgewandelt.16 Aufgrund der so offensichtlichen Schwäche sowohl der koordinativen Bindung des NHCs als auch der Ge=Ge Doppelbindung erwarteten wir, dass die 2 e− oder 4 e− Reduktion von 1 bzw. 2 zur Spaltung zu einem schwereren gemischten Vinylanionanalogon führen würde unter gleichzeitigem Ausstoßen eines Chloridanions. In der Tat liefert die Umsetzung von Germylen 1 mit zwei Äquivalenten KC8 in THF selektiv das Kaliumsilagermenid 3⋅K(THF) (Schema 3, Route I). Das Kaliumsilagermenid 3⋅K(THF) kann auch durch Umsetzung von Digermen 2 mit vier Äquivalenten KC8 synthetisiert und in Form roter Kristalle in 76 % Ausbeute isoliert werden (Route II). Das 29Si NMR Spektrum von 3⋅K(THF) zeigt zwei Signale bei δ=140.2 und 12.3. Ersteres ist im Vergleich zu Germylen 1 (δ=5.6, −13.5) stark tieffeldverschoben, was auf das Vorhandensein eines niedrig koordinierten Siliziumatoms hinweist.16 Leider können aufgrund des Kernspins von 73Ge von I=9/2, gepaart mit seinem niedrigen gyromagnetischen Verhältnis, aussagekräftige 73Ge NMR Spektren nur in den symmetrischsten Fällen erhalten werden. Ein Tieffeldsignal im 13C{1H} NMR Spektrum von 3⋅K(THF) bei δ=222.5 wird der N=C Einheit zugeordnet (cf. δ=216.05 für 116), was auf die Integrität des Iminrückgrats hinweist. Die Freisetzung von NHC in Route I wurde durch NMR Spektroskopie bestätigt.
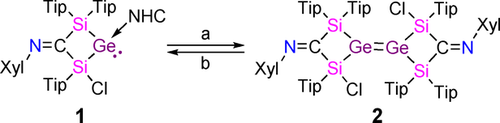
Reversible Dimerisierung von Germylen 1 zu Digermen 2; (a)+BPh3, -[NHC-BPh3], (b)+NHC (NHC=N-heterocyclisches Carben) (Tip=2,4,6-iPr3C6H2, Xyl=2,6-Me2C6H3).16
(NHC=N-heterocyclisches Carben) (Tip=2,4,6-iPr3C6H2, Xyl=2,6-Me2C6H3).16
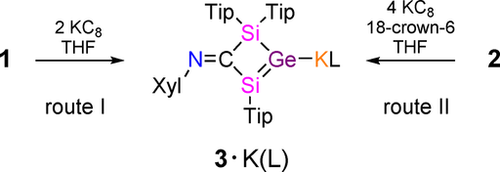
Synthese von Kaliumsilagermeniden 3 als stabile thf- und 18-c-6 Solvate (Tip=2,4,6-iPr3C6H2, Xyl=2,6-Me2C6H3, L=thf, 18-Krone-6).
Um den Effekt der Kalium-Co-Liganden auf die NMR spektroskopischen Eigenschaften, die thermischen Stabilitäten und die Art der Kation-Anion-Wechselwirkung zu untersuchen, wurde die Reduktion von 1 in Gegenwart von 18-Krone-6 wiederholt, was zur Isolierung von 3⋅K(18-c-6) aus Benzol (Route I) in Form von roten Kristalle in 65 % Ausbeute führte (Abbildung S26 b). Die Ausbeute an 3⋅K(18-c-6) steigt mit dem NHC-freien Digermen 2 als Vorstufe (Route II) auf bis zu 90 % an, da keine Kristallisation erforderlich ist, um das freigesetzte NHC abzutrennen. Das Kaliumsilagermenid 3⋅K(18-c-6) ist selbst bei 180 °C überraschend thermisch stabil. Die 29Si NMR Resonanzen von 3⋅K(18-c-6) sind leicht lösungsmittelabhängig (δ=142.9, 12.4 in C6D6 und δ=138.5, 13.4 in [D8]THF), was auf die unterschiedliche Stärke der Lösungsmittelwechselwirkung mit dem Kaliumkation hinweist. Das Tieffeldsignal bei δ=142.9 in C6D6 diente aufgrund seiner Nähe zur Tieffeld-Resonanz des neutralen NHC-stabilisierten Silagermenylidens (δ29Si=158.9) als erster Hinweis auf die Bildung der Si=Ge Doppelbindung.18 Das UV/Vis Spektrum in THF zeigt die Absorptionsbande mit der längsten Wellenlänge bei λmax=490 nm (ϵ=8690 L mol−1 cm−1) für 3⋅K(THF) und bei λmax=495 nm (ϵ=9200 L mol−1 cm−1) für 3⋅K(18-c-6), wobei beide Werte im Vergleich zu einem Lithiumdisilenid [λmax=417 nm (ϵ=760 L mol−1 cm−1)]6a und einem Lithiumdigermenid [λmax=435 nm (ϵ=11 800 L mol−1 cm−1)]7 signifikant rotverschoben sind. Außerdem sind zusätzliche Absorptionsbanden bei λ=413 nm (ϵ=5470 L mol−1 cm−1) für 3⋅K(THF) und bei λmax=417 nm (ϵ=6130 L mol−1 cm−1) für 3⋅K(18-c-6) vorhanden. Zwei ähnliche UV/Vis Absorptionsbanden wurden für ein Silagermen [(tBuMe2Si)2Si=Ge(SiMe2tBu)2] [λmax=413 nm (ϵ=5000 L mol −1 cm−1), 359 nm (ϵ=2000 L mol−1 cm−1)] beobachtet.5e
Die Röntgenbeugungsanalyse an Einkristallen ergab, dass beide Solvate von Silagermenid 3 im Festkörper als Koordinationspolymere vorliegen (Abbildung 1). Die Ge−K Bindungen in 3⋅K(18-c-6) (Ge1−K1 3.5546(3) Å, Ge2-K2 3.5372(3) Å) sind länger als in Digermanyldikaliumsalzen (3.40–3.52 Å)[19 und ähnlich dem Trikaliumsalz des Trianions, das aus der KC8-Reduktion eines Germaantracens (3.5490 Å) erhalten wurde.20 Die Ge1−Si1 Bindung von 2.2590(3) Å ist signifikant kürzer als die Ge1−Si2 Bindung (2.4361(3) Å) und von vergleichbarer Länge wie die von Silagermenen (tBu3Si)2Si=GeMes2 (2.2769 Å; Mes=2,4,6-Me3C6H2)5b und (tBuMe2Si)2Si=Ge(SiMe2tBu)2 (2.2208 Å),5e was seine Doppelbindungsnatur deutlich widerspiegelt. Der viergliedrige Ring ist nahezu planar (Summe der Innenwinkel=359.92°) mit einem Torsionswinkel von Si1-Ge1-Si2-C1 von 1.913(2)°.
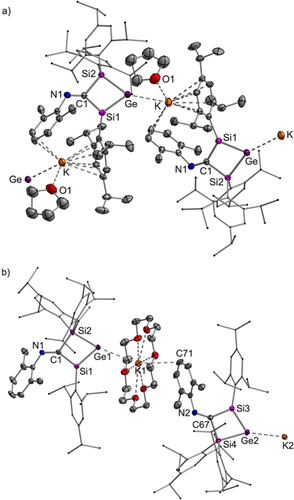
Strukturen der beiden Koordinationspolymerketten [3⋅K(THF)]n (a) und [3⋅K(18-c-6)]n (b) im Festkörper. Wasserstoffatome und co-krsitallisiertes Lösemittel wurden der Übersichtlichkeit halber weggelassen. Thermische Ellipsoide sind mit einer Wahrscheinlichkeit von 50 % dargestellt. Ausgewählte Bindungslängen [Å]: 3⋅K(THF) Ge-K 3.4066(9), Ge-Si1 2.2457(10), Ge-Si2 2.4295(10), Si1-C1 1.855(3), Si2-C1 1.938(3), C1-N1 1.287(4); Si1-Ge-Si2 72.44(3); 3⋅K(18-c-6) Ge1-K1 3.5546(3), Ge2-K2 3.5372(3), Ge1-Si1 2.2590(3), Ge1-Si2 2.4361(3), Ge2-Si3 2.2586(3), Ge2-Si4 2.4372(3), Si1-C1 1.8633(11), Si2-C1 1.9261(11), C1-N1 1.2928(13), C71-K1 3.3125(16).26
Die Innenwinkel am anionischen Germaniumzentrum [Si1-Ge1-Si2 71.793(11)°, Si3-Ge2-Si4 71.816(11)°] sind vermutlich aufgrund der negativen Ladung am Ge-Atom signifikant spitzer als bei Germylen 1 (79.22°).16 Während die C1−N1 Bindung von 1.2928(13) Å etwas länger ist als die des Germylenvorläufers 1 (1.276 Å), ist die Si1−C1 Bindung von 1.8633(11) Å deutlich kürzer (1: 1.979 Å).16 Ein vergleichbarer Grad an Bindungsausgleich wurde bei einem phenylen-verbrückten Bis(1,2,3-trisilacyclopentadiens) beobachtet und als Hinweis auf die π-Konjugation zwischen den beiden Doppelbindungen herangezogen.21 Zusammen mit der beträchtlichen Rotverschiebung (λmax, exp=495 nm) im UV/Vis Spektrum kann ein signifikanter Grad an π-Konjugation zwischen den N=C und Si=Ge Doppelbindungen in 3⋅K(18-c-6) angenommen werden, im Gegensatz zu den entgegengesetzten Schlussfolgerungen bei einer Struktur vom Silol-Typ4b mit benachbarten Si=Ge und C=C Doppelbindungen und bei einem Trisilacyclopentadiens22 mit Si=Si und C=C Doppelbindungen.
Um einen besseren Einblick in die Bindungssituation von 3⋅K(18-c-6) zu erhalten, wurden Dichtefunktionaltheorie (DFT) Berechnungen auf dem M06-2X(D3)/def2-SV(P)//BP86(D3BJ)/def2-SVP-Niveau durchgeführt. Ausgewählte Kohn–Sham Orbitale von 3⋅K(18-c-6) sind in Abbildung 2 dargestellt. In Übereinstimmung mit den früheren Beobachtungen für 1,2,3-Trisilacyclopentadien21 wird das am höchsten besetzte Molekülorbital (HOMO) von den π-Orbitalen der Si=Ge Doppelbindung dominiert, zeigt jedoch auch einen signifikanten, wenn auch geringeren Beitrag am Iminstickstoff. Das niedrigste, unbesetzte Molekülorbital (LUMO) ist über den Ge=Si-C=N Pfad vollständig delokalisiert, was eindeutige Hinweise auf eine ausgeprägte Konjugation liefert. Das HOMO−1 zeigt einen Teilbeitrag des freien Elektronenpaares des Imins (N=C) im Gegensatz zu einem Lithiumdigermenid,7 bei dem das HOMO-1 der Ge-Li Bindung entspricht. In 3⋅K(18-c-6) wird die Ge−K Bindung als HOMO-2 mit Beiträgen der Si(sp3)−Ge(sp2) σ-Bindung identifiziert. Störungstheorie zweiter Ordnung (SOPT) bestätigt eine starke Konjugation zwischen Ge=Si und C=N mit einer Wechselwirkungsenergie von 23.6 kcal mol−1 für πGeSi→π*CN.23 Der im Vergleich zu Si2−C1 (0.762) erhöhte Wiberg-Bindungsindex (WBI) von Si1−C1 (0.904) bestätigt diese Interpretation weiter. Das simulierte TD-DFT UV/Vis Spektrum (Abbildung S31) bestimmt die Absorptionsbande mit der längsten Wellenlänge zu λmax, calc=505 nm in guter Übereinstimmung mit dem experimentellen Wert (λmax, exp=495 nm). Wie erwartet ergibt es sich überwiegend aus dem HOMO→LUMO Übergang (82 % Beitrag). Eine weitere intensive Absorptionsbande bei λmax, calc=382 nm ist gegenüber dem experimentellen Wert von λmax, exp=417 nm blauverschoben und wird drei Übergängen vergleichbarer Oszillatorstärke bei 411, 385 und 373 nm zugeschrieben (Für Einzelheiten siehe Hintergrundinformationen).
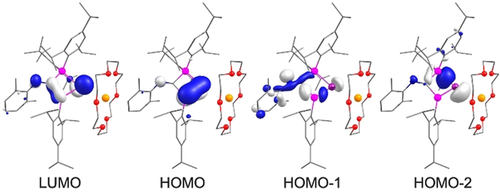
Ausgewählte Kohn–Sham-Molekülorbitale von 3⋅K(18-c-6) (Konturwert=0.052).
Um die Reaktivität von Silagermenid 3⋅K(THF) zu untersuchen und mit der von Disileniden6a und einem Digermenid7 zu vergleichen, wurden zwei nukleophile Substitutionsreaktionen als Machbarkeitsnachweis durchgeführt (Schema 4). Die Umsetzung von 3⋅K(THF) mit einer äquimolaren Menge Ph3SiCl bei Raumtemperatur ergibt Silylsilagermen 4 a in 81 % Ausbeute. Die 29Si NMR Resonanz von 4 a bei δ=136.6, −1.6 und −7.6 ist verglichen mit 3⋅K(THF) hochfeldverschoben. Das der Ph3Si Einheit zugeordnete Signal bei δ=−1.6 ist im Vergleich zu Triphenylsilyl-substituiertem Digermen (Tip2Ge=GeTip(SiPh3); δ29Si=1.9)24 leicht hochfeldverschoben.
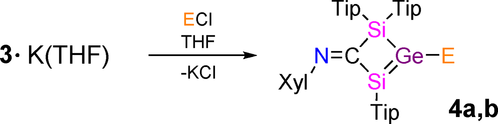
Synthesen von Silylsilagermen 4 a und Phosphanylsilagermen 4 b (Tip=2,4,6-iPr3C6H2, Xyl=2,6-Me2C6H3; 4 a: E=SiPh3; 4 b: E=P(NiPr2)2).
Die UV/Vis Absorption mit der längsten Wellenlänge liegt bei λmax=436 nm (ϵ=10 570 L mol−1 cm−1). Die Blauverschiebung in 4 a im Vergleich zu 3⋅K(THF) (λmax=490 nm, zum Vergleich mit TD-DFT Ergebnissen siehe Hintergrundinformationen) erinnert an ähnliche Beobachtungen für die Reaktion von Tip2Ge=Ge(Tip)Li mit dem gleichen Ph3SiCl Substrat.24 Durch Röntgenbeugung an Einkristallen wurde die Konstitution von 4 a als silylsubstituiertes Silagermen (Abbildung 3 a) bestätigt. Die Ge1−Si1 Bindung von 2.2020(2) Å ist etwas kürzer als in 3⋅K(18-c-6). Ähnlich wie bei 3⋅K(18-c-6) ist der viergliedrige Ring nahezu perfekt planar (Summe der Innenwinkel=359.99°) mit einem Torsionswinkel von Si1-Ge1-Si2-C1 von 0.219(1)°. In der neutralen Spezies 4 a wird eine leichte Pyramidalisierung von Ge1 wiederhergestellt (Winkelsumme 357.34°).

Molekülstruktur von 4 a (a) und 4 b (b) im Festkörper. Wasserstoffatome und co-krsitallisiertes Lösemittel wurden der Übersichtlichkeit halber weggelassen. Thermische Ellipsoide sind mit einer Wahrscheinlichkeit von 50 % dargestellt. Ausgewählte Bindungslängen [Å]: 4 a Ge1-Si1 2.2020(2), Ge1-Si2 2.3613(2), Ge1-Si3 2.3544(3), Si1-C1 1.8869(8), Si2-C1 1.9437(8), C1-N1 1.2824(11). 4 b Ge1-Si1 2.2252(4), Ge1-P1 2.3645(4), Ge1-Si2 2.3861(4), Si1-C1 1.8839(15), Si2-C1 1.9269(14), C1-N1 1.2853(18).26
Schließlich liefert die Reaktion von 3⋅K(THF) mit einer äquimolaren Menge an (iPr2N)2PCl das Phospanylsilagermen 4 b in 79 % Ausbeute (Schema 4). Die 31P NMR Resonanz bei δ=94.9 ist im Vergleich zu einem berichteten Bis(diisopropylamino)phosphanyldisilen (δ=58.4)9b tieffeldverschoben. Im 29Si NMR Spektrum werden zwei Sätze von Dubletts bei δ=104.5 und −6.8 beobachtet. Interessanterweise ist in 4 b die Größe der 2JP,Si Kopplungskonstante für das sp2 hybridisierte Siliciumatom (9.8 Hz) kleiner als für das sp3 hybridisierte Siliciumatom (14.6 Hz). Die rote Farbe von 4 b ist auf die UV/Vis Absorption mit der längsten Wellenlänge bei λmax=453 nm (ϵ=11 710 L mol−1 cm−1) zurückzuführen, die der eines Phosphanyldisilens (λmax=441 nm)9b sehr ähnlich ist (für berechnete Werte siehe Hintergrundinformationen). Die Einkristallröntgenanalyse von 4 b bestätigte die molekulare Konstitution eines Phosphanylsilagermens (Abbildung 3 b). Die Ge1-Si1 Bindung von 2.2252(4) Å ist etwas kürzer als in 3⋅K(18-c-6), was den oben diskutierten Trend widerspiegelt.
Zusammenfassend haben wir die Synthese und strukturelle Charakterisierung der ersten Silagermenide als stabiles thf-Solvat [3⋅K(THF)] und 18-Kronen-6-Solvat [3⋅K(18-c-6)] etabliert. Ihre Eignung als Bausteine für die Synthese von funktionalisierten Silagermenen wurde durch Reaktion mit Elektrophilen wie Ph3SiCl und (iPr2N)2PCl gezeigt. Röntgenkristallographie, UV/Vis- und DFT-Berechnungen zeigten eine deutliche π-Konjugation zwischen den N=C und Si=Ge Doppelbindungen in Kaliumsilagermenid. Das Silagermenid könnte daher auch als schwereres Analogon eines Butadiendianions angesehen werden, vom dem ein Beispiel kürzlich dokumentiert wurde,25 das jedoch aufgrund einer Zersetzung über −50 °C strukturell nicht charakterisiert ist. Derzeit laufen Reaktionen des Silagermenids 3⋅K(THF) mit einer Vielzahl anderer Elektrophilen und kleinen Molekülen.
Acknowledgements
Diese Arbeit wurde von der Europäischen Kommission (Marie Skłodowska-Curie Stipendium für PKM) und der Alexander von Humboldt-Stiftung (Forschungsstipendium für PKM). PKM dankt Lukas Klemmer für die Hilfe bei der Durchführung von DFT-Berechnungen. Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Conflict of interest
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.




