Mechanische Verstärkung von Coiled Coils mit Lactam und Histidin-Metall-Klammern
Abstract
Coiled Coils (CCs) sind vielversprechende Proteinbausteine für biomimetische Materialien, die aufgrund ihrer mechanischen Eigenschaften vermehrt genutzt werden. In dieser Arbeit wurden Helix-induzierende makrozyklische Klammern in ein CC-Heterodimer eingefügt, um die thermodynamische und mechanische Stabilität dieses CCs zu erhöhen. Die thermodynamische Stabilisierung des CCs wird durch die Anzahl der Klammern bestimmt, während die mechanische Stabilisierung gegen Helixentfaltung primär von der Position der Klammer abhängt. Wird an einem Kraftangriffspunkt eine kovalente Lactam-Klammer eingefügt, erhöht dies die Energiebarriere der Entfaltung und führt zu einer verringerten Deformierbarkeit der Helix. Eine reversible His-Ni2+-His Koordinationsklammer hingegen erhöht zwar die Energiebarriere, bricht jedoch bei hoher mechanischer Belastung und erlaubt so die Entfaltung der Helix vom Kraftangriffspunkt aus. Dies verdeutlicht, dass sowohl die Art der Klammer als auch ihre Position und Anzahl wichtige Schlüsselfaktoren für die Entwicklung von mechanisch stabilen CC-Bausteinen für biomimetische Materialen darstellen.
Coiled Coils (CCs) sind in der Natur vorkommende superhelikale Proteindomänen, die beispielsweise in Transkriptionsfaktoren vorkommen oder als mechanische Bausteine in der extrazellulären Matrix und im Zytoskelett essentielle Aufgaben erfüllen.1 CCs bestehen aus zwei bis sieben α-Helices. Sie besitzen eine hoch repetitive Sequenz von sieben Aminosäuren (Heptade), in der die einzelnen Positionen auch mit abcdefg bezeichnet werden (Abbildung 1 A).2 In den Positionen a und d befinden sich vorrangig hydrophobe Aminosäuren, die den hydrophoben Kern des CCs darstellen. Geladene Aminosäuren in den Positionen e und g bilden ionische Wechselwirkungen aus. Die Aminosäuren in den Lösungsmittel-exponierten Positionen b, c und f sind gut für Modifikationen geeignet, da sie die Gesamtstruktur von CCs kaum beeinflussen.3 Synthetische CCs und strukturell ähnliche helikale Moleküle können als Gerüststruktur für Kondensationsreaktionen4 oder für den Transfer funktionaler Gruppen5 verwendet werden. Des Weiteren werden CCs erfolgreich zur Entwicklung molekularer Schalter zur Detektion von Rezeptorbindung6 oder einer Änderung der Ionenstärke7 eingesetzt. Mechanische Eigenschaften sind wichtig für die Entwicklung und Anwendung von CCs als molekulare Bausteine in Hydrogelen,8 Protein-Origami Strukturen,9 künstlichen Membranfusionsdomänen10 und molekularen Kraftsensoren.11 Um die mechanischen Eigenschaften von CCs gezielt zu kontrollieren und zu optimieren, ist ein grundlegendes Verständnis der mechanischen Struktur-Funktionsbeziehungen unverzichtbar. Vor kurzem wurde gezeigt, dass die Helixpropensität der Lösungsmittel-exponierten Aminosäuren die mechanische Stabilität eines CCs Heterodimers unter Krafteinwirkung in Schergeometrie beeinflusst.12 Mittels Molekulardynamiksimulationen konnte darüber hinaus visualisiert werden, dass CC-Heterodimere und Heterotimere auf Scherkräfte mit Helixentfaltung an den Kraftangriffspunkten reagieren.13 Simulationen mit fixierten, α-helikalen Dihedralwinkeln führten hingegen zur Dissoziation der intakten Helices. Die Dissoziation der Helices trat hier schon bei einer geringeren Deformation auf, erforderte jedoch höhere Kräfte.13b In diesem Artikel wird experimentell untermauert, dass eine Stabilisierung von Helixwindungen durch makrozyklische Klammern (Abbildung 1) hoch effektiv ist, um die thermodynamischen und mechanischen Eigenschaften von CC-Heterodimeren gezielt zu verstärken.
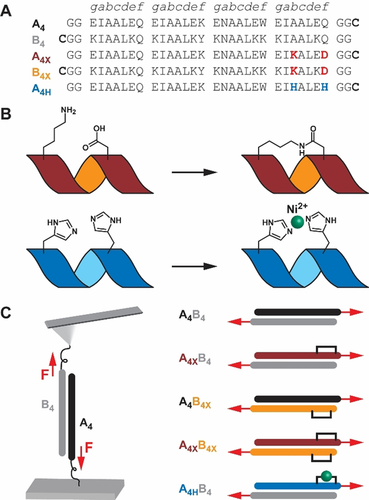
Coiled Coil Design. A) Peptidsequenzen. Die Kraftangriffspunkte sind durch Cys am C-Terminus der A4 Peptide und am N-Terminus der B4 Peptide definiert. B) Klammerdesign. Ein Helix-induzierender Makrozyklus wurde durch eine Amid-Bindung zwischen den Lys und Asp Seitenketten (X) erzeugt, oder mittels Ni2+-Koordination zwischen zwei His (H). C) AFM Experiment. Die Peptide wurden mittels Cys auf den Oberflächen immobilisiert, so dass eine Scherkraft (F) auf die CC-Heterodimere wirkt.
Das Klammern von Peptiden ist eine fest etablierte Methode, um eine stabile α-helikale Struktur in Peptiden zu induzieren.14, 15 Als Klammer eignen sich ionische Wechselwirkungen (z. B. Glu-Lys16), Metall-Koordinationsbindungen (z. B. His-[Metall]2+[17]) oder auch kovalente Bindungen.14, 15, 18 Um eine Helixwindung effektiv zu stabilisieren, werden die beteiligten Aminosäuren häufig in einem i→i+4 Abstand eingefügt.14c, 15a, 15e-17, 18b, 18d, 18f, 18g Ursprünglich wurden geklammerte Peptide zur Erforschung der Nukleation, Faltung und Stabilität von α-Helices entwickelt.16, 17, 18 Inzwischen werden geklammerte Peptide zur Medikamentenentwicklung eingesetzt, da die lokale Stabilisierung der helikalen Struktur die Bindung an das Zielmolekül und die Resistenz gegenüber Proteasen erhöht.3a, 3c, 15b-15d In einigen Fällen wurde auch eine Verbesserung der Zellpenetration beobachtet.15b, 15d Während die Effekte von Helixklammern bei singulären Helices gut untersucht sind, wurde diese Methode bei Helixbündeln bisher nur selten eingesetzt. Einige wenige Beispiele zeigen eine thermodynamische Stabilisierung von CCs3, 8d, 10, 18c, 18e, 19 und Helixbündeln20 durch makrozyklische Klammern. Dieser Artikel zeigt, dass durch gezieltes Einfügen von Klammern auch die mechanische Stabilität von CCs erhöht werden kann. Dazu wurde eine kovalente Lactam-Klammer in ein CC-Heterodimer eingefügt und der Effekt der Klammer mittels Rasterkraftmikroskopie (AFM)-basierter Einzelmolekülkraftspektroskopie untersucht. Die Position der Klammer wurde relativ zum Kraftangriffspunkt variiert (Abbildung 1), um die jeweiligen Auswirkungen auf die thermodynamische und mechanische Stabilität des CCs im Detail zu ermitteln. Des Weiteren wurde die kovalente Lactam-Klammer durch eine reversible His-Ni2+-His Koordinationsklammer ersetzt. Dies ermöglichte es, den Effekt der mechanischen Belastung auf den Entfaltungsprozess auf molekularer Ebene zu untersuchen.
Als Modellsystem wurde ein gut charakterisiertes CC-Heterodimer (A4B4) verwendet (Abbildung 1). A4B4 besitzt eine hohe thermodynamische Stabilität (Tm=81 °C und KD <1.0×10−10 M bei 20 °C21) und eine niedrige Dissoziationsrate (koff=3.2×10−4 s−1 bei 25 °C13a). Trotz der hohen Stabilität weist A4B4 einen Abschnitt mit geringer Helixpropensität am C-Terminus von A4 auf22 (Abbildung S1). Um die Stabilität des CCs zu erhöhen, wurde in den Lösungsmittel-exponierten b und f Positionen am C-Terminus von A4 (A4x) eine kovalente Lysi→Aspi+4 Lactam-Klammer eingefügt14g, 18d (Abbildung 1 B; Abbildung S2, S3). Im Vergleich zu N-terminalen Klammern zeigen C-terminale Klammern einen größeren Effekt auf die Helixnukleation und die thermodynamische Stabilität.10, 18f Das geklammerte CC wurde mechanisch in der Schergeometrie untersucht. Dazu wurden der geklammerte C-Terminus von A4x und der N-Terminus von B4 als Kraftangriffspunkte gewählt und entsprechend ein Cys zur Immobilisierung eingefügt23 (Abbildung 1). Es wird erwartet, dass die Klammer in A4XB4 den größten Effekt auf die mechanische Stabilität hat, da der Terminus mit der geringsten Helixpropensität direkt am Kraftangriffspunkt geklammert ist. Daher ist dort eine erhöhte Resistenz gegen Helixentfaltung und eine Separation der Stränge zu erwarten. Um die Designprinzipien für Helix-Klammern im Modellsystem genauer zu untersuchen, wurde zudem eine Lactam-Klammer am C-Terminus von B4 eingefügt (Abbildung S4, S5), während die Angriffspunkte der Kraft unverändert blieben (A4B4X). Des Weiteren wurde das System A4XB4X untersucht, um mögliche synergistische Effekte zu ermitteln. Schließlich wurde die kovalente Lactam-Klammer an der b und f Position der C-terminalen Heptade von A4 durch eine reversible His-Ni2+-His Klammer8d, 17a, 17b ersetzt (A4HB4, Abbildung 1 B, Abbildung S6).
Zunächst wurde die Struktur und die thermodynamische Stabilität der einzelnen geklammerten und nicht geklammerten CC-formenden Peptide, sowie der CC-Heterodimere, mittels Zirkulardichroismus (CD) Spektroskopie untersucht. Die geklammerten Peptide A4X und B4X zeigten eine höhere Helizität (88 % und 85 %) als die nicht geklammerten Peptide A4 und B4 (31 % und 65 %, Abbildung S7A). Das größtenteils ungefaltete A4 besitzt ein Minimum bei 205 nm, während das geklammerte A4X die für eine α-Helix typischen Minima bei 208 nm und 222 nm zeigt. B4 wies die typischen Minima für α-helikale CCs auf, was auf eine Homodimerisierung hindeutet.8c, 21 Die Tendenz zur Homodimerbildung wurde durch die C-terminale Klammer in B4X weiter erhöht. Das Einfügen der Lactam-Klammern erhöhte zudem die Helixstabilität der CCs (Abbildung 2 A). Für das nicht geklammerte Referenz-CC A4B4 war das Verhältnis der gemittelten molaren Elliptizität pro Aminosäure [Θ]MRE bei 222 nm und 208 nm >1 (Tabelle 1). Dies deutet auf die Bildung einer stabilen CC Struktur hin.24 Bei 23 °C betrug die Erhöhung der Helizität des CCs 4 %, wenn die Lactam-Klammer nur in Peptid A oder B eingefügt wurde, während eine Kombination der Klammern zu einer Erhöhung von 8 % führte. Die Lactam-Klammer führte auch zu einer Erhöhung der thermodynamischen Stabilität. Bei CCs mit einer Klammer wurde ein Anstieg der Schmelztemperatur Tm von 77 °C (A4B4) auf 81 °C (A4XB4) bzw. 83 °C (A4B4X) festgestellt (Tabelle 1, Abbildung S10, Tabelle S1). Wenn beide Helices eine Lactam-Klammer besaßen (A4XB4X), stieg Tm von 77 °C auf >95 °C an. Dies deutet darauf hin, dass der stabilisierende Effekt mehr als additiv ist. Die reversible His-Ni2+-His Klammer in A4H führte zu einem Anstieg der Helizität um ≈10 % (Abbildung S8A). Nichtdestrotz, war die Helizität und die Tm des Ni2+-koordinierenden CCs A4HB4 nicht höher als die des Referenz-CCs A4B4 (Abbildung 2 B, Tabelle 1, Abbildung S10). Während für alle Messungen von A4HB4 nicht-koordinierende PIPPS-gepufferte Salzlösung (PIPPS-BS) verwendet wurde, wurden die Lactam-geklammerten CCs in Phosphat-gepufferter Salzlösung (PBS) gemessen. Die Tm des Referenz-CCs A4B4 unterschied sich in beiden Puffern nur wenig (Tabelle 1, Abbildung S9 und S10).
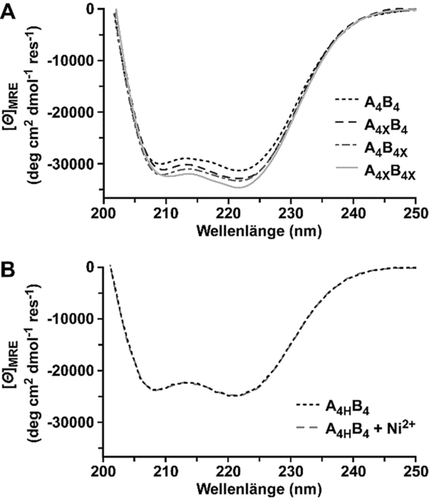
Zirkulardichroismus Spektren der geklammerten Coiled Coils (CCs). A) Spektren der CCs mit Lactam-Klammer A4XB4, A4B4X und A4XB4X, sowie des Referenz-CCs A4B4. Alle Spektren wurden bei 23 °C in PBS (pH 7.4) gemessen. B) Spektren des CCs A4HB4 mit His-Ni2+-His Koordinationsklammer in An- und Abwesenheit von Ni2+ (150 μM NiCl2) in PIPPS-BS bei 23 °C (pH 7.4). Bei allen Messungen wurde das Reduktionsmittel Tris(2-carboxyethyl)phosphin (TCEP) hinzugefügt, um eine Bildung von Disulfidbrücken zu verhindern.
Coiled Coil |
[Θ]MRE 222/ [Θ]MRE 208 |
Tm (°C)[a] |
F (pN)[b] |
Δx (nm)[c] |
koff (s−1)[c] |
|---|---|---|---|---|---|
A4B4 (PBS) |
1.05 |
76.9±0.9 |
28.4 |
1.77 |
1.08×10−3 |
A4XB4 (PBS) |
1.09 |
81.1±0.0 |
41.9 |
1.38 |
1.04×10−4 |
A4B4X (PBS) |
1.05 |
83.1±1.0 |
33.4 |
1.53 |
5.96×10−4 |
A4XB4X (PBS) |
1.11 |
>95.0 |
40.2 |
1.50 |
4.36×10−5 |
A4B4 (PIPPS-BS) |
1.01 |
80.3±0.2 |
24.5 |
1.77 |
1.46×10−3 |
A4HB4 + Ni2+ (PIPPS-BS)[d] |
1.04 |
78.9±0.7 |
34.0 |
1.90 |
3.08×10−5 |
- [a] Mittelwert ± Standardfehler des Mittelwertes (n=3 unabhängige Messungen). [b] Wahrscheinlichste Abrisskraft für einen Beispieldatensatz bei einer Zuggeschwindigkeit von 400 nm s−1. Alle wahrscheinlichsten Abrisskräfte und die jeweiligen Kraftladungsraten sind in Tabelle S2 zusammengefasst. [c] Δx und koff aus dem Bell-Evans Fit aller Datenpunkte (n=3, siehe SI für Details zur statistischen Analyse). [d] Für die CD Spektroskopie wurde 150 μM NiCl2 und für die AFM Experimente ≥500 μM NiCl2 verwendet.
Um die mechanische Stabilität der geklammerten CCs zu untersuchen, wurde Einzelmolekülkraftspektroskopie genutzt (Abbildung 1 C). Da die Kraft-induzierte Trennung der CC-Stränge in Schergeometrie von der Kraftladungsrate r=dF/dt abhängt,8d, 12, 13 wurden Kraftkurven bei sechs verschiedenen Zuggeschwindigkeiten in jeweils drei unabhängigen Experimenten aufgenommen. Bei einer Zuggeschwindigkeit von 400 nm s−1 zeigen repräsentative Kraft-Abstandskurven (Abbildung S11) und Histogramme der Abrisskraft (Abbildung 3 A), dass alle Lactam-geklammerten CCs eine höhere Abrisskraft aufweisen als das Referenz-CC A4B4. Befand sich die Lactam-Klammer direkt am Kraftangriffspunkt (A4XB4), erhöhte sich die Abrisskraft um 15 pN (Tabelle S2). Bei Einfügen der Lactam-Klammer in die komplementäre Helix (A4B4X) war nur ein Anstieg von 7 pN zu beobachten. Wurden beide Helices geklammert (A4XB4X), stieg die Abrisskraft um 13 pN, was vergleichbar mit dem Anstieg bei A4XB4 ist. Dies ist ein erstes Anzeichen dafür, dass die kovalente Lactam-Klammer thermodynamisch und mechanisch verschieden wirkt. Eine synergistische mechanische Stabilisierung durch mehrere Klammern konnte nicht beobachtet werden. Dies deutet darauf hin, dass die lokale Helixstabilität an den Kraftangriffspunkten für die mechanische Stabilität des CCs essentiell ist.
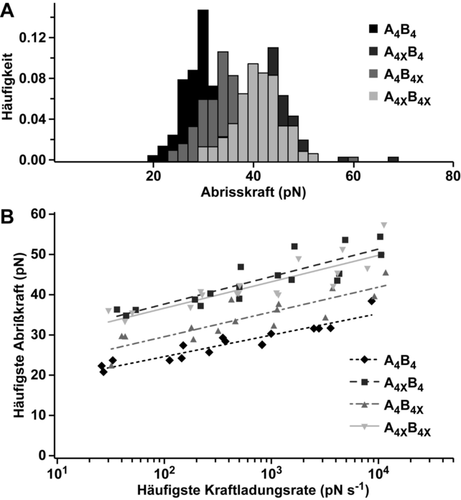
Einzelmolekülkraftspektroskopie der Coiled Coils mit Lactam-Klammer. A) Histogramme der Abrisskraft bei einer Zuggeschwindigkeit von 400 nm s−1. B) Dynamische Kraftspektroskopie, durchgeführt in drei unabhängigen Experimenten. Die Daten wurden mit dem Bell-Evans Modell gefitted (durchgehende und gestrichelte Linien). Alle Messungen wurden in PBS (pH 7.4, 23 °C) durchgeführt.
Zur Ermittlung der Kraft-freien Dissoziationsrate koff und der Potentialweite Δx wurden zunächst die häufigsten Abrisskräfte F und die entsprechenden Kraftladungsraten r aus den Daten extrahiert (Abbildung S12–S15, Tabelle S2). Das Bell-Evans Modell25 wurde genutzt um die erhaltenen Daten zu fitten (Abbildung 3 B, Tabelle 1). Ein Peacock-Test zeigte, dass sich alle Lactam-geklammerten CCs signifikant vom Referenz-CC A4B4 unterscheiden (Tabelle S3, Abbildung S18). Die Lactam-Klammer führte zu einer Verringerung von koff bei gleichzeitiger geringerer Deformierbarkeit (verringerte Δx). Dieses Ergebnis stimmt mit vorherigen Simulationen von CCs mit fixierten Dihedralwinkeln überein, bei denen höhere Abrisskräfte kombiniert mit geringerer Helixentfaltung beobachtet wurden.13b Vergleicht man die beiden CCs mit einer Lactam-Klammer (A4B4X vs. A4XB4) wird deutlich, dass sich die Position der Klammer auf die mechanische Stabilisierung auswirkt. Der stabilisierende Effekt der Klammer war am größten, wenn diese direkt am Kraftangriffspunkt platziert wurde (A4XB4). Jedoch hatte auch das Einfügen der Klammer in der komplementären Helix (A4B4X) einen messbaren Effekt. Dies deutet auf eine allosterische Übertragung der lokalen Helixstabilität über den hydrophoben Kern hin. Das Einfügen von Lactam-Klammern in beide Helices führte nicht zu einer weiteren Erhöhung der mechanischen Stabilität (Tabelle S3, Abbildung S18). Zusammengenommen verdeutlichen diese Ergebnisse, dass Helix-Klammern unterschiedlich auf die thermodynamische und mechanische Stabilität des Modell-CCs wirken. Während die Erhöhung der thermodynamischen Stabilität nicht von der Position der Klammer im A oder B Peptid abhing, war die mechanische Stabilisierung größer, wenn sich die Klammer direkt am Kraftangriffspunkt befand. Interessanterweise erhöhte die Anwesenheit beider Klammern die thermodynamische Stabilität in synergistischer Art und Weise; jedoch war dieser synergistische Effekt in Bezug auf die mechanische Stabilität unter Scherkraft nicht zu beobachten. Diese Ergebnisse validieren den gewählten Ansatz zur Stabilisierung des ausgewählten Modell-CCs. Jedoch muss davon ausgegangen werden, dass der beobachtete Effekt auch von der Peptidsequenz und der Position der Klammer abhängt. Die hier verwendete Lysi→Aspi+4 Lactam-Klammer wurde am C-Terminus eingefügt, da dieser die niedrigste Helixpropensität aufweist (Abbildung S1). Aufgrund ihres Mechanismus der Helixstabilisierung haben Lactam-Klammern auch einen größeren Effekt am C-Terminus als am N-Terminus.18f, 18g Eine Verallgemeinerung der Interpretation, dass die mechanische Stabilität am effektivsten erhöht wird, wenn die Klammer am Kraftangriffspunkt eingefügt wird, ist daher erst möglich, wenn dies auch für weitere Sequenzen sowie N-terminale Klammern gezeigt wird.
Für das hier untersuchte CC stützt die Verringerung von Δx die Hypothese, dass die Entfaltung am C-terminalen Kraftangriffspunkt beginnt; gefolgt von der Dissoziation der teils entfalteten Stränge senkrecht zum Kraftvektor.13a Das Einfügen der Lactam-Klammer im schwächsten Teil der Helix verschiebt den Ausgangspunkt der Entfaltung in einen anderen, vormals stabileren, Teil der Helix. Die direkte Folge dessen ist die Erhöhung der Energiebarriere der Dissoziation (verringerte koff), kombiniert mit einer geringeren Deformierbarkeit (verringerte Δx). Um diese Hypothese zu bestätigen und die CC-Bibliothek zu erweitern, wurde die kovalente Lactam-Klammer (Lysi→Aspi+4) in A4 durch eine reversible His-Ni2+-His Koordinationsklammer ersetzt (Hisi→Hisi+4) und so A4H erhalten. Verglichen mit dem Referenz-CC A4B4 erhöhte sich die Abrisskraft von A4HB4 in Anwesenheit von Ni2+ um ≈7 pN (Abbildung 4 A, Abbildung S16, S17, Tabelle S2). Wie bei der Lactam-Klammer zeigte auch die His-Ni2+-His Koordinationsklammer eine Verringerung von koff, wenn Ni2+ hinzugegeben wurde (Abbildung 4 B, Abbildung S19). Anders als bei A4XB4 war jedoch bei A4HB4 keine Verringerung von Δx im Vergleich zum Referenz-CC A4B4 zu erkennen (Tabelle 1, Tabelle S4). Dies zeigt, dass die His-Ni2+-His Koordinationsklammer höchstwahrscheinlich unter Krafteinwirkung bricht. Für Ni2+-NTA und His6-Tags wurden Abrisskräfte zwischen 40–300 pN gemessen.26 Bei dem hier untersuchten CC reichen jedoch schon geringere Kräfte aus, da nur eine Imidazol-Ni2+ Bindung brechen muss, um die Klammer zu öffnen. Unter Krafteinwirkung wird zum Brechen der reversiblen His-Ni2+-His Koordinationsklammer zusätzliche Energie benötigt, so dass koff verringert ist. Ist die His-Ni2+-His Klammer gebrochen, läuft die Entfaltung des CCs wie in Abwesenheit von Ni2+ ab. Dieser Interpretationsansatz stimmt mit vorigen Experimenten überein, bei denen His-Ni2+-His Koordinationsklammern an beiden Kraftangriffspunkten eingefügt wurden. Auch bei diesen Experimenten wurde eine Verringerung von koff sowie eine nicht signifikante Änderung von Δx beobachtet.8d
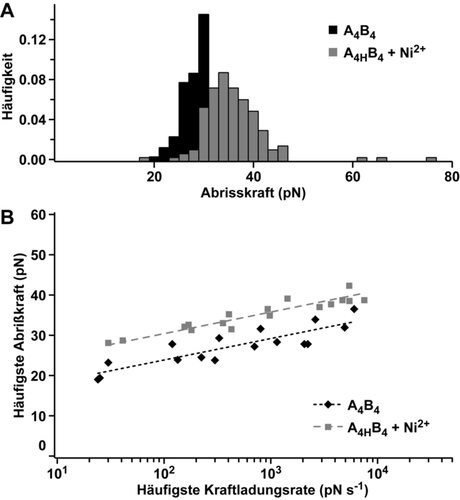
Einzelmolekülkraftspektroskopie des Coiled Coils (CCs) mit His-Ni2+-His Koordinationsklammer und des Referenz-CCs in PIPPS-BS. A) Histogramme der Abrisskraft bei einer Zuggeschwindigkeit von 400 nm s−1. B) Dynamische Kraftspektroskopie durchgeführt in drei unabhängigen Experimenten. Die Daten wurden mit den Bell-Evans Modell gefitted (gestrichelte Linien). Ni2+: ≥500 μM NiCl2.
Zusammenfassend stellt das Einfügen von Klammern eine hocheffektive Strategie dar, um die thermodynamische, kinetische und mechanische Stabilität von CC Heterodimeren zu erhöhen. Der synergistische Effekt auf die thermodynamische Stabilität des CCs konnte jedoch bei mechanischer Belastung nicht festgestellt werden. Berücksichtigt man den schon bekannten Mechanismus zur Trennung der Stränge unter Scherkraft, ist zu vermuten, dass die Kraft zunächst auf den schwächsten Teil der Helix wirkt. Die Stabilisierung dieses Teils der Helix erhöhte die Abrisskraft des CCs und verringerte die Dissoziationsrate um das 10-fache. Eine vergleichbare Erhöhung der Energiebarriere der Dissoziation konnte sowohl bei der Lactam- als auch bei der His-Ni2+-His Koordinationsklammer beobachtet werden, jedoch unterscheiden sich die Dissoziationspfade der CCs unter Krafteinwirkung. Die reversible His-Ni2+-His Koordinationsklammer brach unter Krafteinwirkung auf und ermöglichte die Entfaltung der Helix vom Kraftangriffspunkt aus. Die kovalente Lactam-Klammer hingegen blieb intakt und erzwang so den Beginn der Entfaltung in einem anderen Teil der Helix. Der Fokus zukünftiger Experimente könnte auf dem mechanischen Stabilisierungseffekt von Klammern in unterschiedlichen Positionen der Helix liegen. Beispielsweise könnten die hier untersuchten C-terminalen Klammern mit N-terminalen Klammern oder mehreren Klammern in der gleichen Helix verglichen werden. Im biologischen Kontext gesehen, deuten die hier gezeigten Ergebnisse an, dass ionische Wechselwirkungen in den i→i+4 Positionen natürlich vorkommender CCs die lokale mechanische Helixstabilität erhöhen. Die Abwesenheit von ionischen Interaktionen in bestimmten Helixabschnitten könnte diese demnach zu sensitiven Sollbruchstellen bei Krafteinwirkung machen. Das Einfügen Helix-induzierender Klammern ist somit eine exzellente Strategie, um die mechanische Stabilität von CCs für vielfältige Anwendungen gezielt zu kontrollieren. Insbesondere reversible Metall-Koordinationsklammern, die in situ geformt werden können, haben ein hohes Anwendungspotential zur Herstellung CC-basierter nanomechanischer Bausteine, die beispielsweise als Vernetzer für biomimetische Hydrogele dienen können.
Acknowledgements
Die Autoren danken Ana Vila Verde und Angelo Valleriani für wertvolle Diskussionen über CC Simulationen und die Auswertung der Einzelmolekülkraftspektroskopie-Daten. Diese Arbeit wurde ermöglicht durch die Max-Planck-Gesellschaft (K.G.B., A.E.B.-P.), die International Max Planck Research School (IMPRS) on Multiscale Bio-Systems (P.L.G., I.T.), das Australian Research Council (D.P.F.; DP180103244), das ARC Centre of Excellence (D.P.F., A.D.dA.; CE200100012) und das NHMRC (D.P.F.; SPRF Stipendium 1117017). Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Conflict of interest
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.




