Das Potential von Molybdänkomplexen mit unsubstituierten heterodiatomaren Gruppe-15-Elementen als Linker in der supramolekularen Chemie
Professor E. Niecke zum 80. Geburtstag gewidmet
Abstract
Die Reaktion von tetraedrischen Molybdän-Komplexen mit unsubstituierten heterodiatomaren Gruppe-15-Elementen [Cp2Mo2(CO)4(μ,η2:η2-PE)] (Cp=C5H5, E=As (1), Sb (2)) mit CuI-Halogeniden ergab sieben präzedenzlose, neutrale Supramoleküle. In Abhängigkeit von den Mo2PE-Einheiten und den CuI-Halogeniden werden die Oligomere [⟨{Cp2Mo2(CO)4}{μ4,η2:η2:η2:η1-PE}⟩4⟨{CuX}{Cu(μ-X)}⟩2] (E=As (X=Cl (3), Br (4)); E=Sb (X=Cl (6), Br (7))) oder die 1D-Koordinationspolymere [{Cp2Mo2(CO)4}{μ4,η2:η2:η1:η1-PAs}{Cu(μ-I)}]n (5) und [{Cp2Mo2(CO)4}{μ4,η2:η2:η2:η1-PSb}2{Cu(μ-X)}3]n (X=I (8), Br (9)) erhalten. Diese Festkörper-Aggregate sind die ersten und einzigen Beispiele, die über die metallorganischen heterodiatomaren Mo2PE-Komplexe 1 und 2 als Verbindungseinheiten verfügen. DFT-Rechnungen zeigen, dass die Komplexe 1 und 2 eine neue Klasse von gemischten Donorliganden darstellen, die an CuI-Zentren über das freie P-Elektronenpaar und die P-E-Sigma-Bindung koordinieren und dabei eine bisher nicht beobachtete Koordinationsform aufweisen.
Während der letzten beiden Jahrzehnte hat sich die metallgesteuerte Selbstorganisation als einfache und trotzdem effektive Strategie für die einfache Herstellung von definierten Festkörperstrukturen erwiesen.1 Unter Verwendung dieser Methode konnte durch geschickte Auswahl multitoper organischer Linker unter koordinativer Verknüpfung ungesättigter Metallzentren eine große Vielfalt an diskreten Aggregaten und mehrdimensionalen Anordnungen zugänglich gemacht werden. Die verwendeten Linker sind zumeist organische Moleküle, die N- oder O-Donoren enthalten,1b während Verbindungen, die über S-, Se- und P-Donoren verfügen, weniger verbreitet sind.2 Darüber hinaus sind nur wenige Beispiele von (P,N), (N,O), (P,S) und anderen, gemischten Donorliganden bekannt, welche verschiedene Metallzentren verbinden.3 Im Vergleich zu organischen Molekülen spielten metallorganische Bausteine bisher nur in sehr begrenztem Umfang als Konnektoren in der supramolekularen Chemie eine Rolle.4 Daher entwickelte unsere Gruppe ein Konzept zur Verwendung metallorganischer Komplexe, die über “nackte” Polyphosphor(Pn)-Donoratome verfügen, als verbindende Einheiten zwischen Metallionen.5 Diese Verbindungen besitzen sehr flexible Koordinationsformen, die die Synthese einer großen Anzahl diskreter (monomere,6b, 6c dimere,6a, 6b, 6d sphärischer Aggregate,7 Nano-Schalen8 und Nano-Kapseln9) und polymerer (1D-, 2D- und 3D-Koordinationspolymere (CPs))6a, 10 supramolekularer Aggregate in mäßigen bis ausgezeichneten Ausbeuten ermöglichen. Interessanterweise konnten nur wenige dieser Pn-Verbindungen in 3-Komponenten-Reaktionen zusammen mit AgI- oder CuI-Salzen und ditopen, organischen N-Donormolekülen zur Erzeugung von beispiellosen metallorganisch-organischen Hybridpolymeren verwendet werden.11 Im Gegensatz zu der recht großen Anzahl von Aggregaten, die auf Pn-Ligandkomplexen basieren, konnten wir selbst und andere nur über wenige Aggregate berichten, die Asn-12 bzw. Sbn-Ligandkomplexe als Bausteine verwenden.13 Diese En-Ligandkomplexe weisen ein, zu ihren analogen Pn-Ligandkomplexen, unterschiedliches Koordinationsverhalten gegenüber Metallionen auf, was auf dem Gebiet der supramolekularen Chemie von weichen Lewis-Basen den Weg für Fortschritte ebnet.
Mit Blick auf anfängliche Ergebnisse mit homoatomaren Linkern ergibt sich die Frage, welche Koordinationsform gemischte PnEm-Donorkomplexe (E=As, Sb) eingehen würden, um möglicherweise neue Einblicke in ihr Koordinationsverhalten zu erhalten. Tatsächlich ist zu erwarten, dass sich wegen der eingeschränkten Verfügbarkeit des freien Elektronenpaares beim schwereren Verwandten des Phosphors solche PnEm-Komplexe in ihrem Koordinationsverhalten stark von demjenigen der homoatomaren Pn- oder En-Verbindungen unterscheiden. Darüber hinaus sind wir außerdem mit der Tatsache konfrontiert, dass allgemein gemischte (P,As) Donor-Verbindungen14 sehr selten und (P,Sb)-Verbindungen bisher überhaupt nicht als verbindende Einheiten zwischen Metallionen verwendet worden sind. Hier berichten wir über die ersten Beispielen von Aggregaten in der supramolekularen Chemie, die die tetraedrischen heterodiatomaren Gruppe-15-Komplexe [Cp2Mo2(CO)4(μ,η2:η2-PE)] (E=As (1), Sb (2)) als Linker aufweisen. Ihre Röntgenstrukturen und DFT-Rechnungen zeigen, dass diese Verbindungen eine beispiellose Art von Donorliganden repräsentieren, da sie über das freie P-Elektronenpaar und die P-E-Sigma-Bindung an ungesättigte CuI-Ionen koordinieren.
Um die Bindungssituation gegenüber den ungesättigten CuI-Zentren in den Komplexen 1 und 2 beurteilen zu können, führten wir DFT-Rechnungen auf dem B3LYP/def2TZVP-Niveau der Theorie durch. Die Ergebnisse belegen, dass die freien Elektronenpaare der As- und Sb-Atome im Vergleich zum P-Atom energieärmer sind (Abbildung 1 a). Noch auffallender ist allerdings die Energiezunahme der P-E-Sigma-Bindung der schwereren Homologen, was eine effektivere Überlappung dieser Orbitale mit den unbesetzten Orbitalen des Kupfers ermöglicht, anstelle des freien Elektronenpaars. Dies weist darauf hin, dass bei den schwereren Verwandten die P-E-Sigma-Bindung an der Bindung zu den ungesättigten Übergangsmetallfragmenten beteiligt sein dürfte.
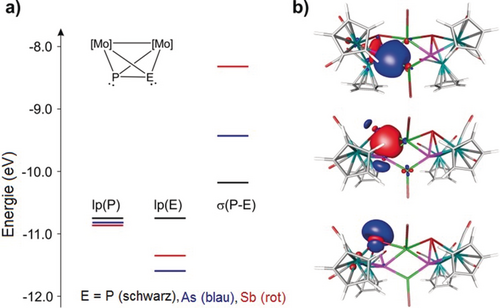
a) Grenzorbital-Energiediagramm von [Cp2Mo2(CO)4(μ,η2-PE)] (E=P, As and Sb), gerechnet auf dem B3LYP/def2-TZVP-Niveau der Theorie. b) Ein Satz lokalisierter Molekülorbitale bei 7, der das freie P-Elektronenpaar darstellt (oben), die P-Sb-Sigma-Bindung (Mitte) und das freie Sb-Elektronenpaar (unten).
Angeregt durch diese Rechnungen wurde der Ligand 115 zunächst mit den CuI-Salzen CuCl, CuBr und CuI in einem stöchiometrischen Verhältnis von 1:1 in einem Gemisch von CH2Cl2 und CH3CN bei Raumtemperatur zur Reaktion gebracht (Abbildung 2 a). Diese Reaktionen ergaben die neutralen oligomeren Komplexe [⟨{Cp2Mo2(CO)4}{μ4,η2:η2:η2:η1-PAs}⟩4⟨{CuX}{Cu(μ-X)}⟩2] (X=Cl (3), X=Br (4)) als auch das neutrale 1D-CP [{Cp2Mo2(CO)4}{μ4,η2:η2:η1:η1-PAs}{Cu(μ-I)}]n (5) in ausgezeichneten Ausbeuten (86–92 %). Interessanterweise sind diese Verbindungen als Festkörper mehrere Tage luft- und lichtstabil, während sie sich in Lösungen in CH3CN an der Luft innerhalb von Stunden zersetzen. Die Verbindungen 3–5 sind in den meisten üblichen organischen Lösungsmitteln unlöslich und lösen sich, in Spuren von Donorlösungsmitteln wie beispielsweise CH3CN, ohne jedoch komplett in ihre Bausteine zu dissoziieren, wie mittels 31P-NMR-Spektroskopie gezeigt werden konnte. Einkristalle der Produkte 3 (orangefarbene Platten), 4 (rote Blöcke) und 5 (orangefarbene Stäbe) wurden mittels Röntgenkristallographie charakterisiert (Abbildung 2 b, c; Tabelle S1 in den Hintergrundinformationen). Ihre Strukturen zeigen für 3 und 4 ähnliche tetramere Gerüste und ein Polymergerüst für 5. Jedes der Moleküle 3 und 4 besteht aus vier Mo2PAs-Einheiten von 1 und vier CuX-Einheiten (X=Cl (3), Br (4)). In diesen Verbindungen sind alle Liganden 1 ähnlich, sie besitzen alle eine η2:η1-Koordinationsform, die gemäß DFT-Rechnungen das günstigste Koordinationsverhalten darstellt. Diese Verbindungen verfügen über zwei Arten von Cu-Atomen (zentrales Cu(innen) und peripheres Cu(außen)) und Halogenid-Ionen (endständige X(ter) und verbrückende X(br)). Die Cu(innen)-Ionen sind jeweils an zwei P-Atome, zwei X−-Ionen und einem CuI-Ion pentakoordiniert, während die Cu(außen)-Ionen jeweils an zwei P-Atome, zwei As-Atome, einem CuI-Ion und einem X−-Ion hexakoordiniert sind. Die Cu(innen)⋅⋅⋅Cu(außen)-Abstände zwischen zwei benachbarten Cu(innen)- und Cu(außen)-Ionen in 3 und 4 sind im Bereich von ca. 2.64 bis 2.69 Å, also kürzer als die Summe ihrer Van-der-Waals-Radien (2.80 Å), was auf eine mögliche Cu⋅⋅⋅Cu-Wechselwirkung hindeutet.16 Im Gegensatz dazu sind die Cu(innen)⋅⋅⋅Cu(innen)-Abstände in den Cu(innen)2X(br)2 viergliedrigen Ringen im Bereich von ca. 3.20 bis 3.28 Å, was auf das Fehlen einer cuprophilen Wechselwirkung schließen lässt. Die Struktur von 5 weist eine lineare 1D-Kette auf, die aus planaren viergliedrigen Cu2I2- und sechsgliedrigen Cu2P2As2-Ringmotiven besteht, die alternierend orthogonal angeordnet sind. Diese Struktur ist derjenigen eines 1D-CPs ähnlich, welches aus der Reaktion seines homodiatomaren Verwandten [Cp2Mo2(CO)4(μ,η2:η2-P2)] erhalten wurde.18 Alle CuI-Ionen in 5 nehmen eine verzerrte tetraedrische Koordinationsgeometrie mit einem P-Atom, einem As-Atom und zwei I−-Ionen ein. Im Gegensatz zu den im Falle der Tetramere 3 und 4 gemachten Beobachtungen besitzen alle Mo2PAs-Liganden (1) in 5 eine η1:η1-Koordinationsform. Die P-As-Bindungslängen in 3–5 (2.240(4)–2.298(4) Å) sind mit denjenigen des nicht-koordinierten Ligandkomplexes 1 (2.232(4) Å) vergleichbar.15b Die Cu-P-Bindungslängen sind im Bereich von (2.210(6)–2.293(1) Å) und die Cu-As-Bindungslängen reichen von 2.461(9) bis 2.584(2) Å. Die Raumtemperatur 31P-NMR-Spektren in CD3CN von 3–5 zeigen einzelne Signale für 3 (22.1 ppm), 4 (22.9 ppm) bzw. 5 (24.1 ppm), die im Vergleich zum freien Komplex (28.5 ppm) 4 bis 6 ppm hochfeldverschoben sind, was auf eine nicht komplette Dissoziation dieser Aggregate in Lösungen von CH3CN hinweist.
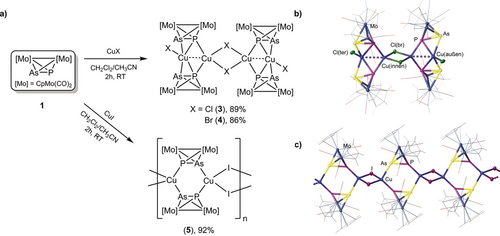
a) Synthese der Verbindungen 3–5. b) Molekülstruktur von 3 (4 hat eine ähnliche Struktur; vgl. Hintergrundinformationen) im Festkörper. c) Abschnitt des 1D-Polymers 5.17
Darüber hinaus wurde der Ligandkomplex [Cp2Mo2(CO)4(μ,η2:η2-PSb)] (2) mit den CuI-Salzen CuCl, CuBr und CuI unter experimentellen Bedingungen ähnlich denen, die im Fall von 1 (Abbildung 3 a) verwendet wurden, zur Reaktion gebracht. Diese Reaktionen ergaben die neutralen oligomeren Komplexe [⟨{Cp2Mo2(CO)4}{μ4,η2:η2η2:η1-PSb}⟩4⟨{CuX}{Cu(μ-X)}⟩2] (X=Cl (6), X=Br (7)) und die neutralen 1D-CPs [{Cp2Mo2(CO)4}{μ4,η2:η2:η2:η1-PSb}2{Cu(μ-X)}3]n (X=Br (9), X=I (8)) in mäßigen bis guten Ausbeuten (52–72 %). Anders als 3–5 sind die Addukte 6–9 luftempfindlich und konnten bei Normalbedingungen nur unter einer Inertgasatmosphäre isoliert und gelagert werden. Darüber hinaus sind diese Verbindungen in gewöhnlichen Lösungsmitteln unlöslich und konnten daher nur im Festzustand charakterisiert werden. Ihre Röntgenstrukturen zeigten, dass 6 und 7 isomorph sind und über ähnliche Strukturen verfügen wie die von 3 und 4, während 8 ein präzedenzloses 1D-Polymer repräsentiert (Abbildung 3 b, c).
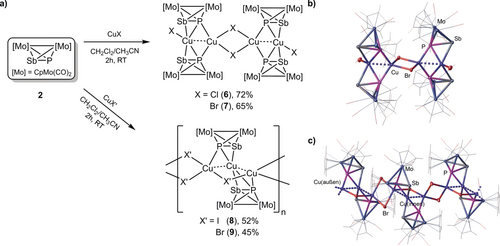
a) Synthese der Verbindungen 6–9. b) Molekülstruktur von 7 (6 hat eine ähnliche Struktur; siehe SI). c) Abschnitt des 1D-Polymers 9 (8 hat eine ähnliche Struktur).17
Die Koordinationsumgebungen aller Cu- und Halogenid-Ionen in 6 und 7 sind denen der für die Tetramere 3 und 4 festgestellten ähnlich. Die [Cp2Mo2(CO)4(μ,η2:η2-PSb)]-Einheiten in diesen Verbindungen besitzen jeweils eine η2:η1-Koordinationsform wie von DFT-Rechnungen vorausgesagt wurde. Die Cu(innen)⋅⋅⋅Cu(außen)-Abstände in 6 und 7 sind im Bereich von ca. 2.53 bis 2.54 Å, was auf eine mögliche Cu⋅⋅⋅Cu-Wechselwirkung hinweist.16 Im Gegensatz zu den im Fall aller Koordinationsverbindungen 3–7 gemachten Beobachtungen weist die Kristallstruktur von 8 darauf hin, dass die Stöchiometrie ihrer Bausteine sich von derjenigen unterscheidet, die während ihrer Synthese aus den Ausgangsmaterialien verwendet wurde. 8 enthält zwei Arten von Cu-Ionen, das zentrale Cu(innen)- und die peripheren Cu(außen)-Ionen, wobei das Cu(innen) an zwei P- und zwei Sb-Atome, und zwei CuI-Ionen hexakoordiniert und die Cu(außen) jeweils an ein P-Atom, ein Cu-Ion und drei I-Ionen pentakoordiniert sind. Die Cu(innen)⋅⋅⋅Cu(außen)-Abstände sind im Bereich zwischen 2.65 und 2.66 Å und deuten damit auf mögliche Cu⋅⋅⋅Cu-Wechselwirkungen hin.16 Interessanterweise unterscheiden sich die Cu(außen)⋅⋅⋅Cu(außen)-Abstände in zwei aufeinander folgenden Cu(außen)2(μ-I)2 viergliedrigen Ringen voneinander (ca. 2.86 und 3.31 Å), wobei beide jedoch länger sind als die Summe ihrer Van-der-Waals-Radien und keinerlei cuprophile Wechselwirkungen aufweisen. Als Folge des kurzen Cu⋅⋅⋅Cu-Abstandes zwischen den Cu(innen)- und Cu(außen)-Ionen in 8 lässt sich die Verbindung ebenfalls als eine unendliche Kette von sich wiederholenden Cu3-Einheiten beschreiben, die von zwei metallorganischen Liganden von 2 und einem I−-Ion stabilisiert und mittels zweier μ-I Liganden miteinander verbunden sind. Soweit uns bekannt ist, wurden bisher über keine derartige, polynukleare CuI-Kette, die von metallorganischen Liganden stabilisiert werden, berichtet.16 Die P-Sb-Bindungslängen in 6–8 (2.445(8)–2.508(3) Å) sind vergleichbar mit derjenigen im nicht koordinierten Komplexes 2 (2.469(9) Å).15b Die Cu-P-Bindungslängen sind im Bereich von 2.280(2) bis 2.508(3) Å und die Cu-Sb-Bindungslängen zwischen 2.667(4) und 2.771(7) Å.
Da die Unterschiede in den elektronischen Strukturen von [Cp2Mo2(CO)4(μ,η2:η2-P2)], 1 bzw. 2 für 2 sehr akzentuiert sind, untersuchten wir die elektronische Struktur des Komplexes 7 mittels DFT Rechnungen (Abbildung 1 b und Hintergrundinformationen). Die Optimierung der Geometrie in der Gasphase resultiert in einer Geometrie, die sehr dicht bei der experimentell ermittelten Geometrie liegt, was darauf hinweist, dass diese Geometrie kein Ergebnis der Packungseffekte im Festzustand ist. Der Cu⋅⋅⋅Cu-Abstand von 2.593 Å in der optimierten Geometrie ist nur geringfügig länger als der experimentell ermittelte Wert von 2.534(4) Å. Die Bindung zwischen den beiden Einheiten von 2 und CuBr in 7 lässt sich am besten als eine Bindung beschreiben, die aus einer Koordination des freien Elektronenpaares am Phosphor an Cu(innen) und einer Koordination der P-Sb-Sigma-Bindung in 2 am Cu(außen)-Atom aufgebaut ist. Dies wird durch die lokalisierten, in Abbildung 1b beschriebenen, Molekülorbitale bestätigt. Die Wegnahme von Elektronendichte an der P-Sb-Sigma-Bindung im Zuge der Koordination von 2 an Kupfer spiegelt sich ebenfalls in den Wiberg-Bond-Indizes (WBIs) wieder. In 7 ist der WBI der P-Sb-Bindung (0.81) beträchtlich geringer als in 2 (1.11). Der WBI der Cu(außen)-P-Bindung (0.57) ist deutlich größer als bei der Cu(innen)-P-Bindung (0.39), während der WBI der Cu(innen)-Sb-Bindung nur 0.29 beträgt. Zwar lässt sich für die Cu(innen)⋅⋅⋅Cu(außen)-Einheit ein WBI von 0.29 bestimmen, jedoch konnte keine ausgeprägte Orbitalüberlappung zwischen den beiden Cu-Zentren festgestellt werden, aber einige Molekülorbitale zeigen geringe Anteile der beiden Kupferzentren in einer bindenden Kombination.
Um den Einfluss variierender Mischungsverhältnisse der Reaktionspartner auf die Bildung der Reaktionsprodukte zu untersuchen, beleuchteten wir exemplarisch die Reaktion von 2 mit CuBr in zwei zusätzlichen stöchiometrischen Verhältnissen (1:2 und 2:3). Aus der ersten Reaktion resultierten zwei Arten von Kristallen: rote Blöcke (7) und dunkelrote Nadeln (9), wobei die zweite Reaktion ausschließlich 9 in einer guten isolierten Ausbeute (45 %) ergab. Die Röntgenstruktur von 9 zeigt ein 1D-Polymer, ähnlich wie das von 8. Die Koordinationsumgebungen aller CuI- und Br−-Ionen sowie der Mo2PSb-Einheiten in 9 sind den für 8 beschriebenen ähnlich, was 9 zu einem weiteren Beispiel einer unendlichen Kette von Cu3-Einheiten macht, gestützt durch den metallorganischen Komplex 2.
Die erhaltenen supramolekularen Aggregate 3–9 zeugen vom großen Potential der tetraedrischen Komplexe Mo2PAs (1) und Mo2PSb (2) als heterodiatomare Donorliganden in der Koordinationschemie von CuI und öffnen die Tür zu ihrer Verwendung in der supramolekularen Chemie. Interessanterweise ergaben die Reaktionen dieser Komplexe mit CuI Produkte, die sich von denen unterscheiden, die unter ähnlichen Reaktionsbedingungen bei Verwendung ihrer homodiatomaren Verwandten [Cp2Mo2(CO)4(μ,η2:η2-E2)] (E=P, As) erhalten wurden.12, 18 Die Ursache dafür liegt in den einzigartigen Donoreigenschaften von 1 und 2, die die Koordination mittels des freien Elektronenpaars des P-Atoms und der P-E-Sigma-Bindung beinhalten. Darüber hinaus sind die beiden 1D-CPs 8 und 9 die ersten Beispiele für unendlich verknüpfte, durch metallorganische Liganden stabilisierte CuI-Ketten. Aktuelle Untersuchungen in diesem Bereich konzentrieren sich auf die Synthese der neuen, bisher nicht existierenden Komplexe der schwereren Homologen [Cp2Mo2(CO)4(μ,η2:η2-AsE′)] (E′=Sb, Bi) und [Cp2Mo2(CO)4(μ,η2:η2-SbBi)] und ihrem möglichen Einsatz als Linker in der supramolekularen Chemie.
Danksagung
Diese Arbeit wurde durch den European Research Council über den Advanced Grant ERC-2013-AdG 339072 unterstützt.
Interessenkonflikt
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.




