Gegensätzliche Reaktivität frustrierter Lewis-Paare mit Selen- und Bor-basierten Lewis-Säuren
Abstract
Die Aktivierung von π-Bindungen in Alkin-substituierten Estern wurde mit weichen und harten Lewis-Säuren untersucht. Im Fall der weichen Selen-Lewis-Säure PhSeCl führte die sequenzielle Aktivierung der Alkine zunächst zu einer Isocumarinverbindung (1 Äquiv. PhSeCl), und dann zu einer tetracyclischen konjugierten Struktur, bei der die Isocumarin-Einheit mit einem Benzoselenopyran-System verknüpft ist (3 Äquiv. PhSeCl). Umgekehrt leitet das Boran B(C6F5)3 als harte Lewis-Säure eine Reaktionskaskade ein, bei der ein komplexes π-konjugiertes System mit einer Phthalid- und einer Inden-Untereinheit erhalten wird.
Die Entdeckung frustrierter Lewis-Paare (FLPs) vor etwa zehn Jahren hat zu einem großen Fortschritt in der Hauptgruppenchemie, insbesondere bei der metallfreien Katalyse, geführt.1 FLP-Chemie kombiniert sterisch gehinderte Lewis-Säuren und Lewis-Basen (Schema 1, oben), bei denen der große Raumbedarf der beiden Komponenten die herkömmliche Adduktbildung unterdrückt und zu einer einzigartigen Reaktivität führt. Heute ist ein breites Spektrum an Lewis-Säure-Base-Kombinationen bekannt, die neue Transformationen und metallfreie katalytische Prozesse einschließlich der Aktivierung kleiner Moleküle (z. B. H2, N2O, CO2, CO, SO2, Alkene, Alkine) ermöglichen.2
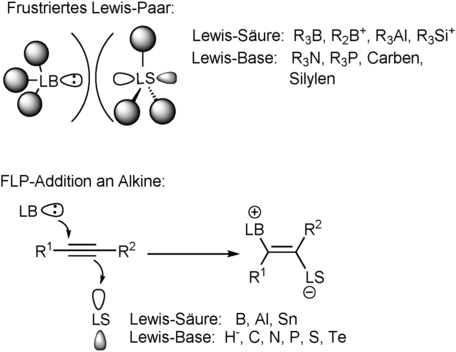
Frustrierte Lewis-Paare (oben) und 1,2-Addition von FLPs an Alkine (unten).
Ein besonderes Thema in diesem Bereich ist die kooperative Addition von FLPs an π-Bindungen (Schema 1, unten), die entweder intra- oder intermolekular erfolgen kann.3 Zwei unterschiedliche Mechanismen sind für die 1,2-Addition von Lewis-Base-Säure-Kombinationen an Alkene und Alkine vorgeschlagen worden, die entweder eine konzertierte 1,2-Addition oder eine Addition nach Aktivierung der π-Bindung vorsehen.4 Für den letzteren Fall wurden π⋅⋅⋅Lewis-Säure-Van-der-Waals-Wechselwirkungen beobachtet.4 Anders als Übergangsmetalle, die in der Lage sind, π-Bindungen in einer synergetischen Art und Weise durch (Metall-Ligand-)Bindung und Rückbindung zu aktivieren, nutzt Bor ausschließlich das freie pz-Orbital zur Aktivierung solcher ungesättigter Bindungen. In diesen Reaktionen kann das nukleophile Zentrum eine Vielzahl von Atomen einschließlich Wasserstoff,5 Kohlenstoff,6 Stickstoff,7 Sauerstoff,8 Phosphor9 oder Schwefel10 darstellen, während die Lewis-saure Komponente auf die ersten beiden Reihen des p-Blocks beschränkt ist. Typischerweise werden harte Lewis-Säuren wie Borane, Alane, Borenium- oder Carbenium-Kationen eingesetzt.
Andere Reaktivitäten im Zusammenhang mit der Verwendung von starken Bor-Lewis-Säuren beinhalten die für Synthesen wichtige Carboborierung sowie relevante Reaktionskaskaden ungesättigter C-C-Bindungen. Neuere Arbeiten von Erker und Yamaguchi et al. zeigen die Verwendung von B(C6F5)3 in einer Reihe von Umlagerungen Aryl-funktionalisierter Diine um komplexe hochkondensierte polyaromatische Systeme wie Dibenzopentalen-Derivate zu erzeugen.11 Die bereits erwähnte Aktivierung von Alkinen ist in dieser Arbeit hervorzuheben, da sie zeigt, dass – abweichend vom herkömmlichen Konzept der HSAB-Theorie – harte Lewis-Säuren in der Tat bei der Aktivierung weicher Lewis-Basen wie Alkine sehr wirksam sein können. Es ist bemerkenswert, dass die Synthese solcher polyaromatischer Systeme selten in der Literatur beschrieben wird. In den beschriebenen Synthesen werden meist seltene, edle oder toxische Metalle wie Palladium, Gold oder Zinn eingesetzt.12 Dies verleiht der Suche nach neuen Synthesemethoden für derartige ausgedehnte konjugierte Systeme eine zusätzliche Triebkraft.
Mit wenigen Ausnahmen wird über die Verwendung von schwereren p-Block-Elementen mit FLP-Reaktivität kaum berichtet.13 Diese schwereren p-Block-Elemente sind durch größere Atomradien und geringere Ladungsdichten viel weicher und leichter polarisierbar und bieten daher deutliche Unterschiede in der Reaktivität im Vergleich zu den leichteren p-Block-Elementen. Viele dieser Elemente sind auch in der Lage gleichzeitig als Lewis-Säuren (durch niedrig liegende freie Orbitale oder σ*-Orbitale) und als Lewis-Basen (aufgrund freier Elektronenpaaren im n−2- oder n−4-Oxidationszustand) zu wirken. Wir vergleichen hier die Reaktivität von Methyl-2-{[2-(phenylethinyl)phenyl]ethinyl}benzoat (1) mit der weichen Selen-Lewis-Säure PhSeCl, und der harten Bor-Lewis-Säure B(C6F5)3 in der Synthese neuer heterocyclischer Verbindungen wie beispielsweise Isocumarinderivate. Isocumarine sind für ihre biologische Aktivität bekannt und haben unter anderem viele Anwendungen als antimikrobielle,14 Antikrebs-15 und als entzündungshemmende16 Mittel.17
Das Diin-Ausgangsmaterial 1 wurde nach Literaturvorschrift in einer Palladium-katalysierten Kreuzkupplung hergestellt.18 Die Reaktivität von 1 in Gegenwart eines Überschusses an Phenylselenenylchlorid (Molverhältnis 1:3) in CDCl3 wurde mittels NMR-Spektroskopie untersucht. Nach einigen Stunden bei Raumtemperatur bildete sich eine neue Verbindung, die nur Signale für aromatische Protonen im 1H-NMR-Spektrum zeigt, was den Verlust des Methylesters bestätigt. Das langsame Verdunsten des Lösungsmittels ergab orangefarbene Kristalle (37 %), die durch Einkristall-Röntgenbeugung charakterisiert wurden und das Salz 2 eindeutig als Produkt bestätigen (Schema 2, Abbildung 1). Das kationische Fragment enthält zwei unterschiedliche Selen-Umgebungen: 1) ein kationisches Selenonium-Zentrum und 2) ein neutrales Selan. Als Gegenion wirkt das [PhSeCl2]−-Anion.
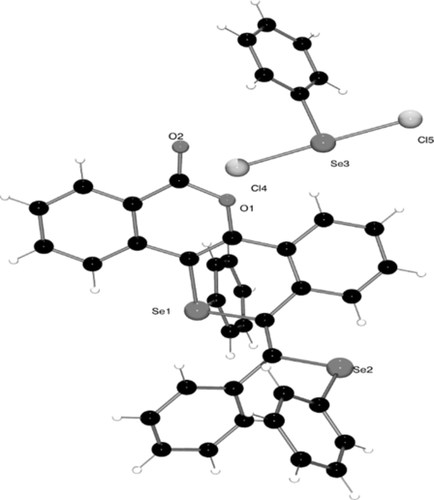
Struktur von 2 im Festkörper. Chloroform-Lösungsmittelmoleküle sind nicht gezeigt.
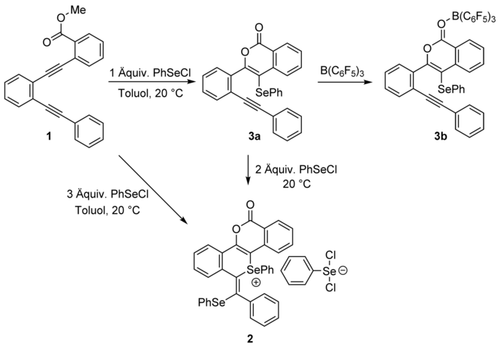
Reaktion von 1 mit Phenylselenenylchlorid (PhSeCl) zu 2 und 3.
Das tetracyclische Grundgerüst von 2 besteht aus einem planaren Isocumarin-Fragment, das als Ergebnis der Cyclisierung mit dem Isoselenochromen verknüpft ist. Das Kation des Selenoniumsalzes nimmt die erwartete tetragonale Geometrie mit einem C-Se-C-Bindungswinkel zwischen 96.57(12)° und 100.86(12)° und Se-C-Einfachbindungen (1.912(2)–1.939(3) Å) ein, sodass die Delokalisierung der Isocumarin-Einheit sich nicht vollständig über das ganze Isoselenochromen-Fragment erstreckt. Tatsächlich belegt die fehlende Planarität über diese beiden Einheiten diese Beobachtung. Das Gegenion [PhSeCl2]− nimmt eine T-förmige Geometrie ein, wobei die Chloratome die axialen Positionen einnehmen. Die Se-Cl-Bindungslängen (2.445(1) und 2.457(1) Å) sowie der Cl-Se-C-Bindungswinkel von 90.47(10)° und 90.72(10)° sind ähnlich den für das bisher nur einmal beschriebene [PhSeCl2]−-Anion.19
Die Reaktion wurde dann mit Molverhältnissen PhSeCl/1 von 1:1 und 2:1 durchgeführt. Wenn ein 1:1-Molverhältnis verwendet wurde, fand die selektive Aktivierung des Alkins neben dem Ester statt, und es erfolgte eine 6-endo-dig-Cyclisierung zum Phenylselenenyl-substituierten Isocumarin 3 a (Schema 2), das in 68 % Ausbeute isoliert wurde. Das Produkt wurde durch NMR-Spektroskopie und Massenspektrometrie charakterisiert. Trotz wiederholter Versuche konnten keine zur Einkristall-Röntgenbeugung geeigneten Kristalle von 3 a erhalten werden. Im 77Se-NMR-Spektrum ergab 3 a das erwartete Singulett, dessen chemische Verschiebung (δ=289.5 ppm) in Übereinstimmung mit zuvor beschriebenen Selanen ist.20
Um diese Reaktivität weiter zu untersuchen, wurde die Umsetzung von 3 a mit zwei weiteren Äquivalenten PhSeCl NMR-spektroskopisch verfolgt. Diese Studien zeigten 1H-NMR-Signale, die auf die Bildung von 2 hinweisen, was darauf hindeutet, dass 3 a ein Zwischenprodukt auf dem Weg zu 2 ist. Ein plausibler Mechanismus für die Umsetzung von 1 zu 2 über 3 a ist die elektrophile Addition von PhSeCl an das Alkin in 1, was zur Bildung eines Selenirenium-Kations führt. In einer intramolekularen Ringöffnung durch nucleophilen Angriff des Carbonyl-Sauerstoffatoms der Estergruppe wird das Isocumarin 3 a gebildet, wobei der anschließende Verlust von Chlormethan im 1H- und 13C-NMR-Spektrum (δ=3.05 bzw. 21.5 ppm) beobachtet werden kann.21 Derartige Selenolactonisierungen sind bereits beschrieben worden.22 Die Umsetzung des Intermediats 3 a zum Zwitterion 2 kann als eine trans-1,2-Addition des Lewis-basischen Selans in 3 a und einem zweiten Äquivalent der Lewis-Säure PhSeCl an das zweite Alkin angesehen werden (wieder über ein Selenirenium-Kation). Die Chloridionen werden nach der 1,2-Addition durch das dritte Äquivalent PhSeCl abgefangen und erzeugen das selenhaltige Gegenion [PhSeCl2]−.
Versuche, die zweite Cyclisierung von 3 a mit der härteren Lewis-Säure B(C6F5)3 durchzuführen, führten nicht zur tetracyclischen Struktur 2. Das stattdessen gebildete Lewis-Säure-Base-Addukt (3 b, Schema 2) reflektiert die harte Natur des Elektronenpaars am Sauerstoffatom im Verhältnis zum weicheren Alkin. Tatsächlich wurde die Struktur der Lewis-Addukts 3 b eindeutig durch Röntgenbeugung (Abbildung 2) bestimmt. Eine solche Adduktbildung wurde bereits zuvor bei langkettigen Alkinylbenzoaten beobachtet, wo auch Adduktbildung statt Alkinaktivierung erfolgt.23 Bei 3 b konnte durch 11B-NMR-Spektroskopie kein Beweis für eine Alkinaktivierung erbracht werden, selbst nach mehrtägigem Erhitzen in Toluol auf 100 °C.
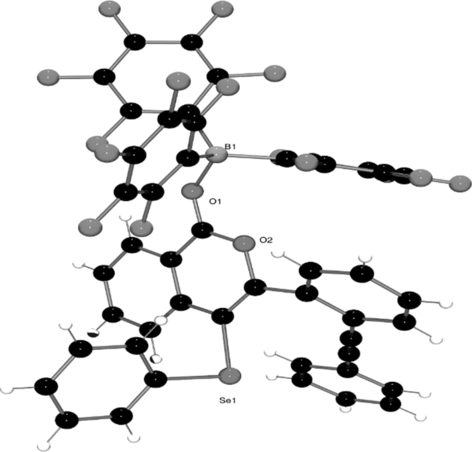
Struktur von 3 b im Festkörper.
Um die Lewis-Acidität von PhSeCl mit üblicheren Lewis-Säuren zu vergleichen, untersuchten wir die Reaktion von 1 mit B(C6F5)3. Die stöchiometrische Reaktion von B(C6F5)3 mit 1 (im Verhältnis 1:1) in Toluol führte in einem sofortigen Farbwechsel zu einer dunkelgrünen Lösung, aus der nach mehreren Stunden blockförmige rote Kristalle (84 %) kristallisierten. Einkristall-Röntgenbeugungsanalyse ergab als Produkt die konjugierte Verbindung 4 (Schema 3, Abbildung 3). In diesem Fall kommt es zu einer FLP-Dominoreaktion, bei der das sperrige Boran das weniger gehinderte Alkin aktiviert und den nucleophilen Angriff durch das stärker gehinderte Alkin ermöglicht, welches wiederum durch die nucleophile Estereinheit angegriffen wird. Interessanterweise steht die Bildung von 4 aus der Cyclisierung von 1 mit der Lewis-Säure B(C6F5)3 in krassem Gegensatz zur Bildung von 2 aus 1 mit PhSeCl. Obwohl biologische und biomimetische Dominoreaktionen oft säurekatalysiert stattfinden, sind Bor-Verbindungen in Lewis-Säure-vermittelten Cyclisierungen vergleichsweise selten eingesetzt worden.24, 25
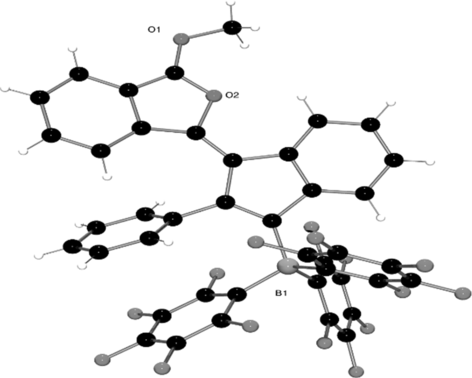
Struktur von 4 im Festkörper. Toluol-Lösungsmittelmoleküle sind nicht gezeigt.

Reaktion von 1 mit B(C6F5)3.
Die Struktur von 4 besteht aus einem Isobenzofuran-Bicyclus, der durch eine Doppelbindung mit einer Inden-Einheit verbunden ist. Obwohl der Isobenzofuran-Heterocyclus und der Indenring konjugiert sind, sind sie im Festkörper nicht perfekt coplanar, sondern mit einem Winkel zwischen den beiden Ringen von 17.99(11)° angeordnet. Die Tatsache, dass diese Ringe nicht in der gleichen Ebene liegen, spiegelt deutlich die sterische Einschränkung im Molekül wider, die sich auch in den NMR-Daten offenbart. Außerdem dreht sich der Phenylsubstituent in 4 auch aus der Ebene des Indenrings heraus (67.87(10)°), was eine nahezu coplanare Geometrie (12.52(9)°) mit einem der C6F5-Ringe der B(C6F5)3-Einheit mit einem Zentroid⋅⋅⋅Zentroid-Abstand von nur 3.4785(16) Å ermöglicht, der etwas kleiner ist als bei anderen C6F5⋅⋅⋅C6H5-Kontakten (3.6421(10) Å).3e
In Lösung wird für 4 im 11B-NMR-Spektrum bei δ=−15.8 ppm ein scharfes Singulett beobachtet, das den Signalen für vierfach koordinierte Vinylboratspezies ähnelt.3 Dagegen ist das 19F-NMR-Spektrum wesentlich komplexer und zeigt die chemische Inäquivalenz der drei C6F5-Ringe durch die eingeschränkte Rotation um die Bor-Inden-Bindung durch die Koordination von B(C6F5)3 mit dem sperrigen organischen Fragment in 4. Drei diskrete Resonanzen sind für die para- und meta-Fluoratome zu beobachten: δ=−160.7 ppm (para-F) und δ=−165.5 (meta-F). Darüber hinaus sind alle ortho-Positionen der C6F5-Ringe inäquivalent, und es werden sechs unterscheidbare Signale zwischen δ=−123.0 und −136.1 ppm beobachtet. Diese sterische Hinderung wird auch im Kalottenmodell offenkundig (siehe die Hintergrundinformationen), das ein sterisch stark beladenes Borzentrum zeigt, in dem der aromatische Ring der Inden-Einheit zwischen zwei C6F5-Ringen liegt.
Zusammenfassend zeigt die Reaktionen von weichen und harten Lewis-Säuren mit Alkin-Estern unterschiedliche Reaktivität, die in der FLP-Chemie beispiellos ist. Die divergierende Reaktivität dieser Systeme ermöglicht die Erzeugung neuer Heterocyclen, die Hauptgruppenelemente enthalten. Bis heute sind Additionen von FLPs an Alkine auf harte Lewis-Säuren beschränkt, während weichere Lewis-Säuren in der Chemie frustrierter Lewis-Paare vergleichsweise selten verwendet werden. Wir werden weiterhin die Nützlichkeit weicher Lewis-Säuren in FLP-Reaktionen erforschen.
Acknowledgements
B.A.R.G. und M.W. danken ERASMUS+ für finanzielle Unterstützung. R.L.M. danken dem EPSRC (Fördernummer EP/N02320X/1) für Unterstützung. Wir bedanken uns bei Prof. Dr. A. S. K. Hashmi, Heidelberg, für eine Probe der Verbindung 1.




