Totalsynthese, Struktur und biologische Aktivität von Adenosylrhodibalamin, dem unnatürlichen Rhodiumhomologen von Coenzym B12
Abstract
B12 ist ein einzigartiges Vitamin, da es nur von bestimmten Prokaryoten synthetisiert werden kann. Die Komplexität seiner Biosynthese resultiert aus der für biochemische Prozesse essenziellen Cobalt-Corrinstruktur, die dem Coenzym B12 (AdoCbl) die Fähigkeit zur Katalyse enzymatischer Radikalreaktionen verleiht. Was macht aber gerade Cobalt so passend für seine Rolle in B12-abhängigen Enzymen? Um dieser Frage nachzugehen, wurde Cobalt in AdoCbl gegen Rhodium ausgetauscht; hierfür wurde das Rh-Analog 5′-Desoxy-5′-adenosylrhodibalamin (AdoRbl) de novo mittels kombinierter biologischer und chemischer Totalsynthese hergestellt. AdoRbl zeigte keine Aktivität in einem mikrobiellen Methionin-Synthase-Bioassay in vivo und war ein In-vitro-Inhibitor einer AdoCbl-abhängigen Diol-Dehydratase. NMR-Analysen zeigten hohe Strukturähnlichkeit von AdoRbl mit AdoCbl. Beim Vergleich der Strukturen im Kristall wurde aber festgestellt, dass RhIII besser in den Corrinring passt als CoIII, was Fragen zur gegenwärtigen Sicht über die Evolution der Corrine aufwirft.
Die biochemische Aktivität der biologischen Formen von B12 basiert auf der zentralen Rolle des vom Corrinring gebundenen Cobaltzentrums.1 Warum aber ist Cobalt, im Unterschied zu anderen Metallen, so hervorragend für die Rolle in B12 geeignet?1b Diese schon früher gestellte Frage ist eine gewaltige Herausforderung.1, 2 Um der “Cobalt-Frage” auf den Grund zu gehen, wurde ein Austausch von Cobalt durch dessen schweres Gruppe-IX-Homologes Rhodium angestrebt. Die spezielle Eignung von Coenzym B12 (5′-Desoxy-5′-adenosylcobalamin, AdoCbl; Abbildung 1) als katalytischer Radikalquelle über enzymkontrollierte homolytische Spaltung seiner Co-C-Bindung3 machte das Rh-Homologe 5′-Desoxy-5′-adenosylrhodibalamin (AdoRbl) zu einem interessanten Syntheseziel. AdoRbl wurde zum ersten Mal in den 1970er Jahren über (metallfreies) Hydrogenobalamin hergestellt, das in niedriger Ausbeute in einer Cobalt-freien Chromatium-vinosum-Kultur zugänglich war, wurde damals aber nur unzureichend charakterisiert.2a Da in der Vergangenheit verschiedene Alternativstrategien zur Herstellung von Metallanalogen natürlicher Corrinoide durch Entfernung von deren Cobalt-Ion keinen Erfolg hatten (siehe z. B. Lit. 4), musste eine neue Strategie zur Herstellung von AdoRbl gefunden werden. Wir berichten hier über eine knappe Totalsynthese von AdoRbl mittels strategischer Kombination von biologischen und chemischen Syntheseschritten sowie über seine strukturellen und biologischen Eigenschaften. Die Frage “Warum nicht Rhodium?” ergab auch neue Denkanstöße zur fundamentalen Problematik der evolutionären Selektion und Adaption des Corrinrings.
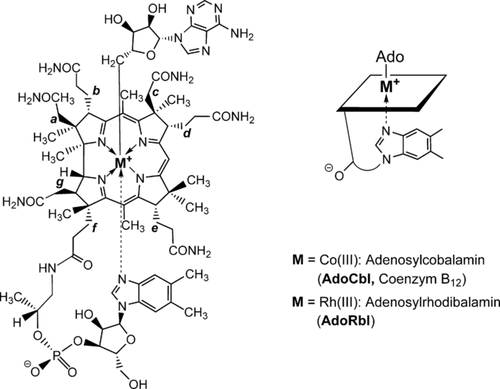
Strukturformeln von Coenzym B12 (M=CoIII, AdoCbl) und 5′-Desoxy-5′-adenosylrhodibalamin (M=RhIII, AdoRbl).
Für die Synthese von 5′-Desoxy-5′-adenosylrhodibalamin (AdoRbl) wurden komplementäre chemische und biologische Methoden entwickelt (Abbildung 2). Dazu wurde Hydrogenobyrinsäure-a,c-diamid (Hbad) in vivo mithilfe eines gentechnisch veränderten E.-coli-Stamms de novo synthetisiert, der mit den zehn relevanten Genen (cobA-I-G-J-M-F-K-l-H-B) für die Biosynthese von B12 aus dem endogenen Vorläufer Uroporphyrinogen III ausgestattet war.5 Aus 30 L Zellkultur wurden 88.2 mg Hbad erhalten. Rhodibyrinsäure-a,c-diamid wurde aus Hbad mittels chemischer Insertion von RhI hergestellt.6 Das zunächst isolierte orangerote Dicyanorhodi(III)byrinsäure-a,c-diamid (CN2-Rhbad)6b (75 % Ausbeute) ließ sich nicht in Adenosylrhodi(III)byrinsäure-a,c-diamid (AdoRhbad) umwandeln. Die Isolierung des Rhodibyrinsäure-a,c-diamids als Dichlor-RhIII-Corrinoid (DCRhbad), das mit UV/Vis-Spektroskopie und Massenspektrometrie charakterisiert wurde, machte aber eine Weiterverarbeitung zu AdoRhbad möglich. Die Reduktion von DCRhbad mit Natriumborhydrid in anaerober Lösung führte zu einem hellgelben RhI-Corrinoid. Nach Zugabe von 5′-Desoxy-5′-iodadenosin (bei 0 °C, dann Raumtemperatur) erhielt man eine orangerote Reaktionslösung, aus der AdoRhbad in 75 % Ausbeute isoliert wurde. Die Molekülformel von AdoRhbad wurde anhand eines ESI-Massenspektrums bestätigt (m/z [M+]=1230.3). Das UV/Vis-Spektrum von AdoRhbad glich jenen der Dichloro- oder Dicyano-RhIII-Analogen (Abbildung S1 der Hintergrundinformationen). Im 1H-NMR-Spektrum von AdoRhbad wies die metallgebundene Methylengruppe des 5′-Desoxyadenosyl-Liganden zwei charakteristische Multipletts im Hochfeldbereich auf, die den diastereotopen Protonen dieser CH2-Gruppe zugeordnet wurden (Abbildung S2). Diese beiden Signale zeigten eine diagnostische 1.7-Hz-Kopplung mit 103Rh (I=1/2).
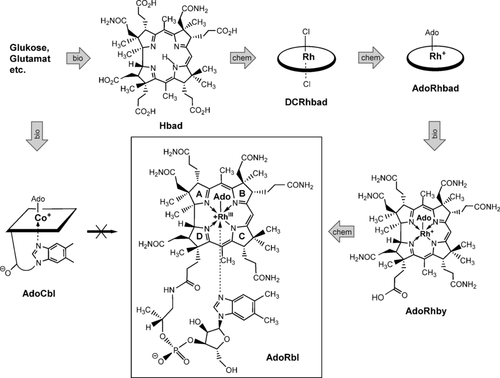
Totalsynthese von 5′-Desoxy-5′-adenosylrhodi(III)balamin (AdoRbl) mittels enzymatischer Umwandlungen der AdoCbl-Biosynthese (bio) und chemischer Syntheseschritte (chem) in der Abfolge bio-chem-chem-bio-chem. AdoRbl kann nicht aus AdoCbl hergestellt werden.
Das Rh-Analog von Adenosylcobyrinsäure-a,c-diamid wurde mithilfe des B12-Biosyntheseenzyms CobQ7 spezifisch an vier der verbleibenden fünf Carboxy-Seitenketten amidiert und so in Adenosylrhodi(III)byrsäure (AdoRhby) überführt (Abbildung 2). Tatsächlich verhielt sich AdoRhbad als außerordentlich gutes Pseudosubstrat für CobQ und ergab AdoRhby in 92 % Ausbeute. Die regiospezifische Vierfach-Amidierung der peripheren Seitenketten wurde mit ESI-MS- und 1H-NMR-Spektren bestätigt.
5′-Desoxy-5′-adenosylrhodibalamin (AdoRbl), das Rh-Analog von Coenzym B12 (AdoCbl), wurde durch chemische Konjugation von AdoRhby mit dem B12-Nukleotidteil hergestellt.1a, 8 Dabei wurde AdoRhby mit 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimid (EDC) aktiviert und mit dem B12-Nukleotidteil zu orangerotem AdoRbl in einer Ausbeute von 79 % umgesetzt. Das UV/Vis-Spektrum von AdoRbl zeigte, wie bereits bekannt,2 Absorptionsmaxima bei λ=512, 491 und 350 nm (Abbildung S1). Überraschenderweise hat das Spektrum von AdoRbl große Ähnlichkeit mit dem von Cyanocobalamin (Vitamin B12) und unterscheidet sich signifikant vom Spektrum von Coenzym B12 (AdoCbl). Wie schon früher beschrieben,2 ist AdoRbl, im Unterschied zum photolabilen AdoCbl, in aerober wässriger Lösung am Tageslicht stabil.9
Im 500-MHz-1H-NMR-Spektrum von AdoRbl in D2O traten Signale aller C-gebundenen H-Atome auf, einschließlich der charakteristischen Dublett- und Triplett-artigen Signale der Rh-gebundenen CH2-Gruppe des Ado-Liganden (Abbildung 3). Dieser Befund steht im frappanten Gegensatz zum früher publizierten Spektrum von AdoRbl, in dem diese Signale nicht auftraten.2 Die Hochfeldsignale der diastereotopen Protonen HAC5RL und HBC5RL von AdoRbl entsprechen den Signalen von Hre and Hsi im Spektrum von AdoCbl, sind aber um δ=1.31 ppm hochfeldverschoben. Die Molekülstruktur von AdoRbl im Kristall zeigt eine antiperiplanare Anordnung von HC4RL und Hre am C5RL, was analog die Zuordnung des Triplett-artigen Signals von HAC5RL zu Hre stützt. Mithilfe der 1H,1H-NOE-Daten (Abbildungen S3 und S4) konnten die “Base-on”-Konstitution von AdoRbl und die Verknüpfung des 5′-Desoxyadenosylteils auf der β-Seite des Corrin-gebundenen Rh-Zentrums nachgewiesen werden. Die 2D-NMR-Daten lieferten chemische Verschiebungswerte (z. B. der Protonen der Seitenketten des Rings B; Tabellen S1–S3), die für AdoRbl und AdoCbl eine ähnliche Konformation des Corrinliganden und der axialen Gruppen anzeigten. AdoRbl und Coenzym B12 (AdoCbl)10 haben also in wässriger Lösung sehr ähnliche Strukturen.
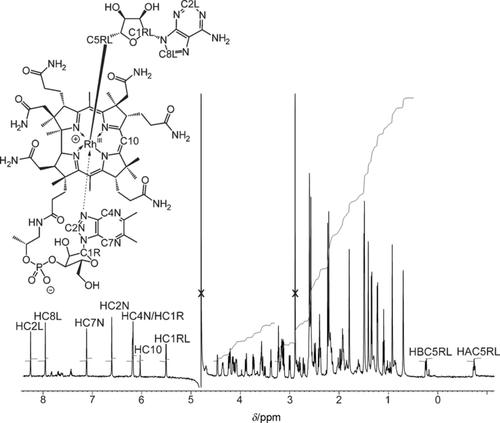
500-MHz-1H-NMR-Spektrum von AdoRbl (0.4 mm in D2O, 10 mm Kaliumphosphat pD 7.4, 298 K, unterdrücktes HDO-Signal).
AdoRbl kristallisierte als dunkelrote monokline Prismen (Raumgruppe C2, Nr. 5) aus Wasser/Acetonitril. Die Analyse der Kristalle von AdoRbl ergab eine hochaufgelöste Röntgenkristallstruktur, die erste eines Metallanalogs der Cobalamine. Sie bestätigte die aus NMR-Daten abgeleitete chemische Konstitution von AdoRbl und zeigte grob dieselben Strukturmerkmale wie die Struktur von AdoCbl11 (Abbildungen 4 und S6). Wie bei AdoCbl ist die Ado-Gruppe von AdoRbl über dem Ring C des Corrinrings positioniert. Allerdings ist sie im Fall von AdoRbl um 24° gegen den Uhrzeigersinn gedreht (Abbildung S7) und ist dort über eine für ein Cbl neuartige Dimerisierungs-Grenzfläche stabilisiert, die den Ado-Teil und beide Seitenketten des Rings B über H-Bindungen verknüpft (Abbildung S9). Die Ado-Gruppe von AdoRbl ist damit näher zum Ring B orientiert (verglichen zur Position in AdoCbl),11 und Ring B nimmt eine in Cbl unbekannte Konformation ein, wie unten weiter diskutiert.
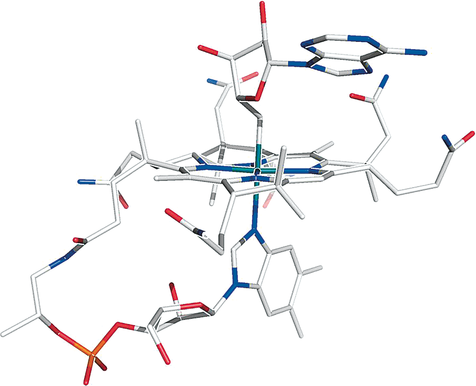
Stabmodell der Molekülstruktur von Adenosylrhodibalamin (AdoRbl) im Kristall (C grau, N blau, O rot, P orange, Rh türkis). Details siehe Abbildungen S6–S8.
Die biologische Aktivität von AdoRbl als AdoCbl-Analog wurde zunächst in einem mikrobiellen Methionin-Synthase(MetH)-Bioassay getestet,12 wie auch anschließend in einem direkten Enzymassay mit Propandiol-Dehydratase (PduCDE). Um die Aktivität von AdoRbl in MetH zu untersuchen, verwendeten wir einen Salmonella-enterica-cobB-metE-Reporterstamm, der für sein Wachstum in minimalem Medium auf exogenes Cbl angewiesen ist. Dabei spiegelt die Größe der Wachstumskreise auf den Agarplatten die aufgetragene Menge an Cbl logarithmisch wider (Abbildung 5).
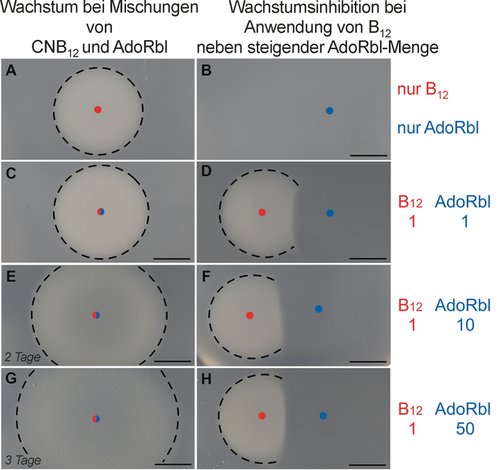
Mikrobieller Bioassay mit AdoRbl. Die Verwendung von Vitamin B12 (CNCbl) fördert das Wachstum des S.-enterica-cbiB-metE-Stamms (Feld A). Kein Wachstum nach Zugabe von AdoRbl allein (Feld B). Eine Mischung von AdoRbl und B12 (Felder C, E, G) verursacht vergrößerte, aber diffusere Wachstumskreise als bei CNCbl alleine. Zugabe von AdoRbl nahe der Auftragung von CNCbl resultiert in einer Inhibitionszone, deren Intensität von der aufgebrachten Menge an AdoRbl abhängt (Felder D, F, H).
Die Zugabe von AdoRbl alleine führte zu keinem Wachstum auf den Bioassayplatten. Nach dem Auftragen von AdoRbl in kurzer Entfernung zu einer identischen Menge CNCbl bildete sich eine Inhibitionszone um die Stelle, an der AdoRbl aufgetragen wurde. Diese vergrößerte sich durch Erhöhung der AdoRbl-Konzentration (Abbildung 5). Unerwarteterweise kam es zur Bildung von größeren, aber diffuseren Wachstumskreisen beim Auftragen einer Mischung von CNCbl und AdoRbl. Diese Befunde zeigen erstens, dass AdoRbl nicht in einen aktiven Cofaktor überführt wird, und zweitens, dass AdoRbl die Aufnahme von Cbl verhindert oder mit Cbl um die Bindungsstelle in MetH konkurriert und so als Inhibitor fungiert. Eine plausible Erklärung für die Vergrößerung der Wachstumskreise beim Mischen von CNCbl mit einem Überschuss an AdoRbl ist die Fähigkeit des Analogs, aktiv mit der Regulierung der Cbl-Aufnahme über einen B12-RNA-Schalter13 zu wechselwirken. In E. coli und S. enterica reduziert der B12-RNA-Schalter btuB13, 14 nach Anlagerung seines hochaffinen Liganden AdoCbl und über eine Rückkopplungsregelung die Produktion des an der Außenmembran aktiven B12-Transporters. Die vergrößerten Wachstumskreise lassen damit auf eine Reduktion der Aufnahme von Cbl durch AdoRbl schließen.
Die Wirkung von AdoRbl auf die Aktivität von AdoCbl-abhängigen Enzymen wurde am Beispiel der 1,2-Propandiol-Dehydratase von Citrobacter freundii analysiert (Abbildungen S10–S12). Die kinetischen Konstanten der Reaktion mit gereinigter 1,2-Propandiol-Dehydratase wurden mittels nichtlinearer Regression bestimmt. Mit AdoRbl als AdoCbl-Ersatz konnte keine Enzymaktivität festgestellt werden. Im Unterschied dazu war das Enzym mit AdoCbl aktiv und ergab Km=3.0 μm und kcat=358 s−1 (basierend auf einer α2β2γ2-Quartärstruktur). In weiterführenden Experimenten wurde gezeigt, dass AdoRbl wie auch Vitamin B12 kompetitive Inhibitoren des Enzyms sind, mit Ki=6.9 μm für AdoRbl und 2.5 μm für Vitamin B12. Diese Befunde bestätigen, dass AdoRbl nicht in der Lage ist, die AdoCbl-abhängige Propandiol-Dehydratase-Reaktion zu katalysieren, und als Inhibitor dieses Enzyms wirkt.
Die biologischen Rollen von Cobalt15 wie auch der funktionellen Formen von B1216 scheinen gegenseitig weitgehend abhängig und bemerkenswert exklusiv zu sein. Die Frage, warum Cobalt und kein anderes Übergangsmetall in B12 gefunden wird, hat somit das Interesse an B12-Metallanalogen geweckt. In diesem Zusammenhang kommt dem Gruppe-IX-Element Rhodium ein außerordentlicher Stellenwert zu. Wir haben deshalb 5′-Desoxy-5′-adenosylrhodibalamin (AdoRbl) synthetisiert, aufbauend auf einer strategischen Anwendung einer präzisen Sequenz biologischer und chemischer Schritte. Die erwartete große Strukturähnlichkeit von AdoRbl zu AdoCbl wurde durch Strukturanalysen in Lösung (NMR) und im Kristall bestätigt. Die Kristallstruktur von AdoRbl zeigte aber auch interessante Konsequenzen des Ersatzes von CoIII durch das größere RhIII in AdoRbl auf. Wie aufgrund des um 0.06 Å größeren Kovalenzradius von Rh17 erwartet, sind alle sechs Bindungen zum Metallzentrum von AdoRbl länger als bei AdoCbl. Bei genauerer Betrachtung sind die vier äquatorialen Bindungen aber um 0.082(5) Å verlängert, die axialen Bindungen nur um 0.035(5) Å (Abbildung 6).
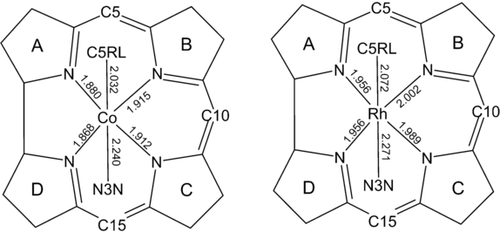
Vergleich von Kristallstrukturdaten von Adenosylrhodibalamin (AdoRbl) und Coenzym B12 (AdoCbl) anhand der Längen der Bindungen (in Å) zu CoIII in AdoCbl und zu RhIII in AdoRbl.
Mit einem Faltungswinkel von rekordmäßig nur 5.9(2)° ist außerdem der Corrinring von AdoRbl ungewöhnlich flach (vgl. 13.3° in AdoCbl; siehe Abbildungen 7, S8 und S9).18 Der Ring B von AdoRbl erfährt gegenüber den Strukturen von AdoCbl und anderer Cbl ebenfalls eine starke Einebnung und weist eine invertierte konformative Verdrillung auf. Die Acetamid- und Propionamidsubstituenten am Ring B sind nun beide in einer pseudo-äquatorialen Position angeordnet. In der Lösung nimmt der Ring B von AdoRbl aber dieselbe Konformation ein wie der von AdoCbl,10 und es gibt keine Hinweise auf die im Kristall auftretende “invertierte” Verdrillung. Tatsächlich ist der Ring B von AdoRbl damit wohl als flexibel einzuschätzen, und seine invertierte Konformation im Kristall ist der dort auftretenden Dimerisierung über H-Bindungen zu verdanken.
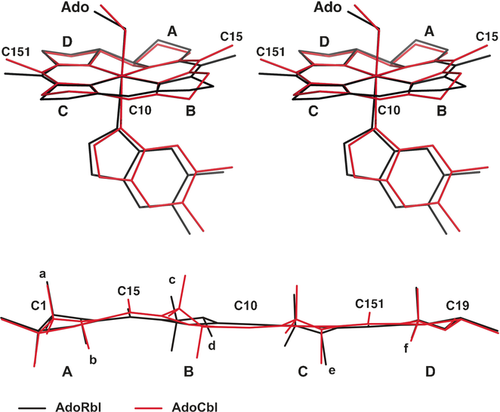
Vergleich der Molekülstrukturen von Adenosylrhodibalamin (AdoRbl, schwarze Linien) und Coenzym B12 (AdoCbl, rote Linien). Oben: Überlagerte Stereoansicht von AdoRbl und AdoCbl mit hervorgehobener Faltung des Corrinrings. Unten: Überlagerte Corrinringstrukturen von AdoRbl und AdoCbl in zylindrischer Projektion, welche die stärkere Faltung des Corrinliganden von AdoCbl (rot) gegenüber AdoRbl (schwarz) und die konformative Inversion von Ring B hervorheben (Kleinbuchstaben: Seitenketten, Großbuchstaben: Ringe des Corrinliganden). Siehe Hintergrundinformationen mehr Details.
Der Vergleich der Strukturen von AdoRbl und AdoCbl zeigt erstaunlicherweise, dass das größere RhIII-Ion besser in den Corrinliganden passt als das biologisch relevante CoIII-Ion. Eschenmoser und Kratky haben die fundamentalen strukturellen Konsequenzen von zu kleinen koordinierten Metallionen (z. B. Low-Spin-NiII) in Tetrapyrrolmakrocyclen untersucht.1a, 19 Sie folgerten, dass eine Verkleinerung des Makrocyclus zu einer korrelierten konformativen Adaption der vier Pyrrolringe führt und so zu nicht planaren (sondern “sattelförmigen”) Porphyrinen. Ähnliche konformative Effekte infolge der Anpassung des Koordinationsraums an das gebundene Metallion wurden in zahlreichen porphyrinoiden Metallkomplexen beobachtet,20 wo der Einfluss der Porphyrindeformation auf die biologische Aktivität von Interesse ist.21
Die Kristallstruktur von AdoRbl lässt darauf schließen, dass der Koordinationsraum des Corrinliganden ein wenig zu groß für die Koordination von CoIII-Ionen ist. Daraus resultiert sowohl die prägnante Faltung der natürlichen CoIII-Corrinoide (13.3° in AdoCbl) als auch die deutliche Verdrillung der Pyrrolringe22 (Abbildung S8). Letztere ist im konformativ “in Phase” verdrillten Ring B am deutlichsten.1a, 22a Im Unterschied dazu kommt es durch die Koordination des größeren RhIII-Ions in AdoRbl, wie in der Kristallstruktur ersichtlich, zu einer konformativen Entspannung des Corrinliganden.
Die Natur hat die einzigartige “konstitutionelle Ringkontraktion” des Corrinliganden1a, 23 entwickelt, um den Koordinationsraum zu verkleinern und so Cobalt zu beherbergen.24 Die hier beschriebenen Untersuchungen deuten darauf hin, dass es noch zu einer zusätzlichen konformativen Adaption des Corrinliganden kommt, um ein CoIII-Ion zu binden. Die hier gemachte Entdeckung, dass RhIII besser in den Corrinliganden passt als das biologisch relevante CoIII, lässt uns schließen, dass der Corrinligand von der Natur nicht primär für CoIII entworfen wurde. Da Rhodium kein essenzielles Element für Leben auf der Erde ist,15 sollte unser Augenmerk der Wechselwirkung des Corrinringes mit Cobalt gewidmet sein, etwa mit seinen reduzierten Formen, CoII und CoI. AdoCbl und Cob(II)alamin weisen sehr ähnliche Cobaltcorrinstrukturen auf,25 doch bis heute gibt es keine kristallographischen Daten zur Struktur von CoI-Corrinen (siehe z. B. Lit. 16a). Es wurde berechnet, dass eine Vergrößerung des Koordinationsraums des Corrinliganden die Reduktion von CoIII- und von CoII-Corrinen zu unterstützen vermag.26 Deshalb ist es naheliegend vorzuschlagen, dass der Corrinligand genau dem polarisierbaren CoI-Ion angepasst ist, das ja das Reaktionszentrum der rätselhaften, “supernukleophilen” CoI-Corrine ist, und es stabilisiert.1b, 16a,16b, 27 In Analogie zur Vorstellung, dass sich Enzyme zwecks Stabilisierung von Übergangszuständen und Absenkung der Aktivierungsenergie von Reaktionen entwickelt haben,28 wäre die vorgeschlagene Fähigkeit des Corrinliganden, den CoI-Zustand gegenüber den CoIII- und CoII-Formen zur stabilisieren, ein essenzieller Aspekt für Reaktionen mit CoI-Corrin-Zwischenprodukten,26, 27, 29 die ja in biologischer Umgebung sehr schwer zugänglich sind.14, 29 Eine solche Fähigkeit hätte es ermöglicht, die Selektion der B12-Struktur fein auf seine Rolle als essenzieller, metallorganischer Katalysator in der präbiotischen Chemie des Lebens abzustimmen.30 Dies ist in Einklang mit dem Vorschlag, dass Cobaltcorrine bereits als urzeitliche Cofaktoren fungiert haben.1a
Das Rezept für die Biosynthese von Coenzym B12 (AdoCbl) ist nur in den Genomen gewisser Prokaryoten kodiert.31 Durch seine Verwendung in einem gentechnisch veränderten E.-coli-Stamm wurde ein effizienter biologisch-chemischer Syntheseweg zu AdoRbl zugänglich. AdoRbl wurde als strukturelles, aber nicht funktionelles Analog des B12-Coenzyms AdoCbl charakterisiert. Die Inaktivität als Coenzym und die inhibitorische Wirkung des weitgehend isostrukturellen Rh-Analogs von AdoCbl lassen auf eine ineffiziente Homolyse der Rh-C-Bindung des enzymgebundenen AdoRbl schließen. Die experimentelle Bestimmung der Stärke der Rh-C-Bindung (siehe Lit. 32) wird Aufschluss über die Richtigkeit dieser Annahme geben.
Nachdem wir die fundamentale Frage “Warum Cobalt?”1 aufgegriffen haben, sollten wir nun vielleicht fragen: “Warum nicht Rhodium oder ein anderes Metall?”. Metallanaloge von Cobalaminen (Metbalamine) gelten, wie auch die Studie von AdoRbl gezeigt hat, als inaktive Cofaktoren. Tatsächlich wurde schon früher gezeigt, dass einige Metbalamine Bakterien-Wachstum hemmen.6 In geeigneter Weise strukturierte Metbalamine könnten also effektive B12-Antimetaboliten oder “Antivitamine B12” sein,33 die im Hinblick auf kürzlich entdeckte neuartige biologische Funktionen von Cbl34 von wachsendem Interesse sein werden. Unser konzertierter biologisch-chemischer Synthesezugang zum “Rhodium-Problem” hat ein neues Tor zur Herstellung von Metbalaminen und Metallocorrinoiden aufgestoßen, einem spannenden, doch kaum erforschten Gebiet im facettenreichen B12-Feld.
Experimentelles
Allgemein: Siehe Hintergrundinformationen für Materialien, Instrumente, Bakterienstämme, die verwendet wurden, Konstruktion von Plasmiden, Details zu präparativen und enzymatischen Prozeduren, Spektroskopie und Röntgenkristallographie.
Röntgenstrukturanalyse: CCDC 1450631 (AdoRbl) enthält die ausführlichen kristallographischen Daten zu dieser Veröffentlichung. Die Daten sind kostenlos beim Cambridge Crystallographic Data Centre erhältlich.
Professor Albert Eschenmoser zum 91. Geburtstag gewidmet
Acknowledgements
Diese Arbeit wurde vom Österreichischen Wissenschaftsfonds (FWF-Proj. P-28892) und vom Biotechnology and Biological Sciences Research Council (BBSRC) (reference BB/K009249/1) unterstützt.




