Das Spektrum melanozytärer Nävi und deren klinische Bedeutung
Redaktion
Prof. Dr. Trautinger, St. Pölten
Bei Verletzungen der Epidermis erfolgt die Repopularisierung der Melanozyten aus dem Stammzellreservoir der Haarfollikel.
Es wird angenommen, dass Melanin einen SPF (sun protection factor) von möglicherweise bis zu 4 bietet.
Grundsätzlich sind MN an „speziellen Lokalisationen“ kein Risikomarker für Malignität.
Durch die tiefe dermale Lage der pigmentierten Melanozyten kommt es zu der klinisch charakteristischen Färbung der Melanozytosen.
Extrasakrale Spots, eine Ausdehnung > 10 cm, sehr dunkle und multiple Flecke sind ein Marker für Persistenz der kongenital dermalen Melanozytose über ein Jahr.
Liegt beim Nävus Ota eine Hyperpigmentierung des Auges vor (Konjunktiva, Sklera, Hornhaut und Uvea) ist eine vollständige ophthalmologische Untersuchung durchzuführen, um ein Glaukom auszuschließen.
Klinisch kann der blaue MN manchmal schwer von einem Melanom, einer kutanen Melanommetastase, von einem Basalzellkarzinom oder einem Morbus Kaposi unterschieden werden.
Die Verteilung nach Altersgruppen zeigte im dritten Jahrzehnt (21–30 Jahre) einen signifikanten Höhepunkt der Gesamtzahl der MN, gefolgt von einem allmählichen Rückgang.
Bestehen bei einem KMN mehr als 50 Satelliten-Nävi, führt dies zur Einordnung in die nächsthöhere Kategorie.
Je früher die somatische Mutation in der Embryonalentwicklung eintritt, umso intensiver ist das klinische Bild des KMN und kann zur Beteiligung anderer Organsysteme führen.
Die Beratung von Patienten mit KMN und deren Angehörigen, welches operative Behandlungsziel zu welchem Zeitpunkt realistischerweise erreicht werden kann, sollte so früh wie möglich an einem dafür spezialisierten Zentrum erfolgen.
Es wird angenommen, dass selbst bei Riesennävi das Entartungsrisiko nicht mehr als circa 3–5 % beträgt.
Spitz-Nävi treten gehäuft bei Kindern, vor allem im Gesicht und den Extremitäten, auf, haben eine Tendenz zu raschem Wachstum und können im Verlauf regredieren.
Es zeigte sich kein prognostischer Nutzen einer Sentinel-Lymphknoten-Biopsie für Patienten mit atypischen Spitz-Tumoren
Der Wiesner-Nävus ist ein durch BRAF-Mutation in Kombination mit einem biallelischen BAP1-Verlust gekennzeichneter spitzoider MN.
In Familien mit Keimbahnmutationen im BRCA1-assoziiertem Protein 1 (BAP1) wurde das erhöhte Auftreten von Melanomen, unter anderem auch Uvea-Melanomen beobachtet.
In der dermatoskopischen Analyse eines MN recurrens ist eine Pigmentierung jenseits der Narbe der stärkste Hinweis auf ein Melanom.
Leider besteht kaum eine Korrelation zwischen klinisch atypischen Nävi und solchen mit histologischen Merkmalen der Dysplasie.
Melanozytäre Nävi und das Melanom teilen gemeinsame Treibermutationen.
Durch die altersbedingte Involution und Apoptose der Melanozyten geht die BRAF-Mutation in MN verloren.
Die Präsenz von multiplen MN im Rahmen von genetischen Syndromen zeigt den multigenetischen Hintergrund der Entwicklung von MN und Melanomen auf.
Bei frühem und/oder familiär gehäuftem Auftreten von Malignomen sollte an ein zugrundeliegendes Tumorsyndrom gedacht werden. Bei Patienten mit einem invasiven Melanom sollte ab dem 3. Melanom und/oder einer positiven Familienanamnese (zwei Verwandte in direkter Linie) eines Melanoms und/oder Pankreaskarzinoms eine genetische Analyse angeboten werden.
Wenn aufgrund der Anamnese, der Klinik und Dermatoskopie einerseits keine eindeutigen Hinweise für Malignität vorliegen, andererseits jedoch auch nicht eindeutig die Benignität des Hauttumors zum Zeitpunkt der Untersuchung bestätigt werden kann, so kann eine Verlaufsbeobachtung innerhalb von zwei bis drei Monaten als Alternative zur Exzision der Läsion erfolgen.
Ein Vergleich mit anderen MN desselben Patienten ist Voraussetzung, um Abweichungen in dem Grundmuster des jeweiligen Patienten zu erkennen und erhöht die Trefferquote bei der Früherkennung von Melanomen (komparativer Ansatz).
Zusammenfassung
Die Größe der Thematik melanozytärer Nävi (MN) steht in einem direkten Verhältnis zur Relevanz in der alltäglichen klinischen Arbeit. Die klinische Präsentation ist hochgradig variabel und verschiedene MN haben unterschiedliche prognostische Bedeutung in Bezug auf Komorbidität und mögliches Entartungsrisiko. Relevante Kriterien in der Einschätzung eines MN sind neben den Kriterien der ABCDE-Regel der Zeitpunkt des Auftretens des MN, die Wachstumstendenz, die Verteilung und der Vergleich mit anderen MN des jeweiligen Individuums.
Es soll hier eine Übersicht gegeben werden, welche Erkenntnisse in Bezug auf die Entwicklung und genetischen Hintergründe MN und ein gegebenenfalls bestehendes Entartungsrisiko gewonnen werden konnten. Zudem können gewisse klinische und/oder dermatoskopische Merkmale dem Kliniker eine Entscheidungshilfe im Management unterschiedlicher MN liefern.
Einleitung
Melanozytäre Nävi (MN) sind gutartige, umschriebene Proliferationen von Melanozyten in der Haut. Im Gegensatz zu der üblicherweise dendritischen Form des einzelnen, in der Epidermis vorkommenden Melanozyten erscheinen Melanozyten in MN rund bis oval oder spindelzellig. Diese zu Nestern aggregierten Melanozyten werden auch als Nävuszellen bezeichnet und stellen eine besondere Differenzierungsform der Melanozyten dar [1].
Gelegen sind diese melanozytären Proliferationen zumeist in der basalen Epidermis (Junktionszone – junktionaler MN) oder auch Dermis (dermaler MN), können sich jedoch in die Tiefe, über die Subkutis hinaus bis in die angrenzende Muskulatur ausdehnen (deep penetrating nevi).
Die Gruppe der melanotischen Flecke (Epheliden/Sommersprossen, Café-au-Lait-Fleck, Lentigo senilis/flache Verruca seborrhoica) zählt definitionsgemäß nicht zu den MN, da hier lediglich eine umschriebene Vermehrung von Pigment vorliegt, die Anzahl der epidermalen Melanozyten aber weitgehend normal oder nur gering vermehrt ist. Diese Hyperpigmentierungen und die damit verbundenen, teilweise komplexen Syndrome werden in diesem Artikel nicht gesondert besprochen und finden gegebenenfalls Erwähnung.
Grundlagen und Funktion der Melanozyten
Menschliche Melanozyten kommen in der gesamten Haut, in Schleimhäuten, Haarfollikeln, in der Haarmatrix sowie in anderen Organsystemen einschließlich des Herzens, der Uvea des Auges, im Innenohr und in den Leptomeningen des Gehirns vor [2, 3].
Entwicklungsgeschichtlich wandern Melanozyten im Laufe der ersten 40 Gestationstage von der Neuralleiste als Melanoblasten in die Haut ein. Die Sequenz der Melanoblastenmigration in die Haut folgt einer zeitlich genau definierten intradermalen (6. bis 8. Schwangerschaftswoche), intraepithelialen (12. bis 13. Schwangerschaftswoche), intrafollikulären (15. bis 17. Schwangerschaftswoche) sowie zephalokaudalen und dorsoventralen Progression [4].
Die weitere Proliferation und Differenzierung von Melanoblasten zu Melanozyten werden durch das umgebende Gewebe reguliert. Bei Verletzungen der Epidermis erfolgt die Repopularisierung der Melanozyten aus dem Stammzellreservoir der Haarfollikel. An der äußeren Haarwurzelscheide sitzen multipotente Stammzellen, aus denen sich unterschiedliche Zelllinien differenzieren können [5, 6]. Sowohl intrinsische (zum Beispiel Signale von Fibroblasten, Keratinozyten, inflammatorischen und neuronalen Zellen) als auch extrinsische Faktoren (wie Medikamente und UV-Strahlung) beeinflussen die Rekrutierung der Melanozyten, die Anzahl der Dendriten und den Transport der Melanosomen (Pigmenttransfer) zu den Keratinozyten [7]. An der Junktionszone sitzend versorgt der einzelne Melanozyt über seine Dendriten eine unterschiedliche Anzahl von Keratinozyten mit Melanosomen – diese Zahl ist sehr stark abhängig von der Körperregion, der damit unterschiedlichen Pigmentierung und UV-Exposition [7]. Die Gesamtheit an Keratinozyten pro versorgenden Melanozyten wird als epidermale Einheit bezeichnet. Der Pigmenttransfer in dieser epidermalen Einheit erfolgt bis hinauf in das Stratum spinosum. Keratinozyten legen das aufgenommene Melanin (ein Polymerisationsprodukt aus Tyrosin) über den Zellkern (supranukleär), um so das Erbgut vor UV-Strahlung zu schützen. Es wird angenommen, dass Melanin einen SPF (sun protection factor) von möglicherweise bis zu 4 bietet [8].
Die Einteilung von MN erfolgt nach unterschiedlichen Gesichtspunkten: Klinische (wie zum Beispiel die anatomische Lage) und histologische Kriterien, aber auch genetische Merkmale. Melanozytäre Nävi an speziellen Lokalisationen sind akrale, umbilikale, subunguale (Melanonychia striata), genitale sowie MN an Mamma/Areola. Diese MN zeigen durch die speziellen Voraussetzungen des Gewebes dieser unterschiedlichen Regionen histologische Auffälligkeiten. Grundsätzlich sind MN an „speziellen Lokalisationen“ kein Risikomarker für Malignität [9].
Die Frage nach dem Zeitpunkt ihrer Entstehung und ob es sich bei MN um genetisch determinierte Fehlbildungen, um Hamartome oder um benigne Neoplasien der Melanozyten handelt, wird kontrovers diskutiert und ist nicht für alle MN einheitlich zu beantworten. So ist bei einem großen kongenitalen MN ein anderes genetisches Muster vorhanden als bei einem unter UV-Strahlung erworbenen, sich in der Pubertät oder auch später manifestierenden MN. Diese Unterschiede zwischen erworbenen und kongenitalen MN können in den unterschiedlichen Mutationen im MAPK-Signalweg nachvollzogen werden.
MN, die sich in utero entwickeln, unterscheiden sich genetisch von denen, die sich später entwickeln. Histopathologische Kriterien allein können die beiden Gruppen nicht unterscheiden. MN, die sich vom Kindes- bis zum jungen Erwachsenenalter auf sonnenexponierter Haut entwickeln weisen häufig BRAF-Mutationen, seltener NRAS-Mutationen auf. Die Ergebnisse korrelieren mit der Beobachtung, dass BRAF-Mutationen in Melanomen an nicht UV-exponierten Regionen (wie an Schleimhäuten) selten sind [10, 11].
Melanozytäre Nävi
In der Literatur wurden viele unterschiedliche MN beschrieben, die in ihrer Gesamtheit hier keinen Einzug finden können und nur namentlich erwähnt werden: Halo-Nävus (mit einem hypopigmentierten Randsaum) [12], Mark-Nävus (behaarter und bis in die Tiefe des dermalen Bindegewebes reichender MN), Kopf-Nävus (Spitz-MN mit Halo-Phänomen), Meyerson MN (ekzematisierter MN), Kerl MN (ancient features) [13].
Dermale Melanozytosen
Zu den dermalen Melanozytosen gehören der Nävus Ota, der Nävus Ito und die kongenitale dermale Melanozytose (Mongolenfleck). Histologisch erkennt man bis tief dermal gelegene pigmentierte spindelzellige bis dendritische Melanozyten. Durch die tiefe dermale Lage der pigmentierten Melanozyten kommt es zu der klinisch charakteristischen Färbung der Melanozytosen. Die blau-graue Farbe ist auf das als Tyndall-Effekt bezeichnete Phänomen der Reflexion von blauem Licht durch dermales Melanin zurückzuführen.
Kongenitale dermale Melanozytose (Mongolenfleck)
Die kongenitale Melanozytose wird in über 90 % bei Neugeborenen im asiatischen Raum beobachtet. In der lumbalen und sakral-glutealen Region präsentiert sich eine verwaschene, blaugraue Verfärbung der Haut, manchmal bestehen extrasakrale Spots. Zumeist entwickelt sich die kongenitale dermale Melanozytose innerhalb der ersten zwei Lebensjahre vollständig zurück, kann aber in etwa 10 % der Fälle klinisch bestehen bleiben [14]. Extrasakrale Spots, eine Ausdehnung > 10 cm, sehr dunkle und multiple Flecke sind ein Marker für Persistenz der kongenitale dermalen Melanozytose über ein Jahr [15].
Hinweise auf Neurokristopathien und angeborene Stoffwechselstörungen wie Hurler-Krankheit (Mucopolysaccharide) und Monosialotetrahexosylgangliosid (GM1)-Gangliosidose können ausgedehnte, dunkle und progressive kongenitale dermale Melanozytosen geben und sollten den Kliniker dazu veranlassen, eine weitere genetische und neurologische Abklärung zu indizieren [16].
Nävus Ito und Nävus Ota
Nävus Ito und Nävus Ota (Abbildung 1) unterscheiden sich histologisch nicht und werden klinisch durch ihre Lage unterschieden. Der Nävus Ito manifestiert sich in der Schulter/Armregion, der Nävus Ota manifestiert sich im Gesicht.
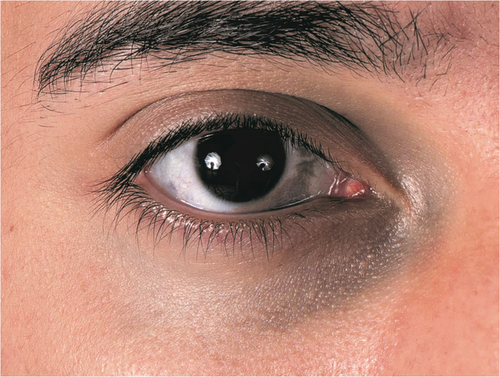
Die asiatische Bevölkerung ist häufiger von diesen Melanozytosen betroffen (0,014 % bis 0,034 % der Bevölkerung) und es besteht ein Gynäkotropismus – (w : m = 5 : 1) [14, 17]. Zumeist treten sie bei der Geburt auf, können aber auch in der Pubertät oder während der Schwangerschaft aufgrund hormoneller Veränderungen auftreten. Einzelne Fallberichte beschreiben maligne Transformationen des Nävus Ota, noch seltener des Nävus Ito [18, 19].
Die exakte Ätiologie der dermalen Melanozytose ist nicht bekannt, sie können im Rahmen von Syndromen auftreten [20] (Tabelle 1).
| Syndrom | Gen | Dermatologische Manifestationen | Weitere Manifestationen |
|---|---|---|---|
| BAP1 Tumor-Prädispositions-Syndrom | BAP 1 | Hautfarbene bis rotbraune, kuppelförmig bis gestielte, gut umschriebene Papeln | Melanome und Uvea-Melanome, bei bi-allelischem Verlust von BAP1-Verlust Mammakarzinom, Schilddrüsenkarzinom, Urothelkarzinom und neuroendokrine Karzinome |
| Carney-Syndrom (LAMB/NAME) | PRKAR1A | Lentigines und blaue MN in sonnenexponierten Arealen | Kutane und kardiale Myxome, myxoide Fibroadenome der Mammae, Hodentumore, Hypophysenadenome |
| Dermatopathia pigmentosa reticularis* | KRT14 | Generalisierte retikuläre Hyperpigmentierung, Onychodystrophie, Alopezie, Hypohidrose | |
| Familiäres atypische multiple Muttermal- und Melanomsyndrom (FAMMM) | CDKN2A/CDK4 | Multiple melanozytäre Nävi, in der Regel >50, Melanome in der Familienanamnese | Malignome anderer Organsysteme wie Pankreas, Gehirn (Melanom- Astrozytom-Syndrom), Ösophagus, Magen, Harnblase, Lunge |
| Hurler-Syndrom | IDUA | Ausgedehnte, dunkle und progressive kongenitale dermale Melanozytosen | Lysosomale Speicherkrankheit mit Skelettanomalien, kognitiver Beeinträchtigung, Kardiomyopathie, Hepato-Splenomegalie, charakteristische Facies, deutlich reduzierte Lebenserwartung |
| LEOPARD-Syndrom | PTPN11 | Lentiginose | EKG Veränderungen Okulär: Hypertelorismus, Pulmonalstenose, Anomalie der Genitale, Retardierung, Deafness-Taubheit |
| McCune-Albright-Syndrom | GNAS1 | Café-au-lait-Flecken (teils segmental und den Blaschko Linien folgend) insgesamt weniger und unregelmäßig berandet im Vergleich zu NF1 | Pubertas praecox, fibröse Dysplasie mit vorzeitigem Epiphysenschluss und konsekutivem Kleinwuchs, Akromegalie, endokrinologische Störungen |
| Mulvihill-Smith-Syndrom | unbekannt | Multiple MN, fehlende Axillarbehaarung, spärliches Kopfhaar | Spitzes Gesicht, vorzeitige Alterung, Minderwuchs, Mikrozephalie +/-IQ Minderung, Hypodontie, Hörverlust, chronische Infektionen |
| Naegeli-Franceschetti-Jadassohn-Syndrom* | KRT14 | Retikuläre Hyperpigmentierung, Onychodystrophie und fehlende Leisten an den Fingern, Hypohidrose, palmoplantaren Hyperkeratosen | Zahnfehlbildung |
| Neurofibromatose (Morbus Recklinghausen) | NF1 | Café-au-lait-Flecken und Freckling axillär, Lisch-Knötchen (melanozytäre Hamartome der Iris), Neurofibrome, Hämangiome, Lymphangiome, Nävus anämicus, juvenile Xanthogranulome | Skelettanomalien (Pseudoarthrose, Keilbeinflügeldysplasie, Verkrümmung der langen Röhrenknochen, Skoliose), Phäochromozytom, spinale Neurofibrome, maligne Nervenscheidentumore, plexiforme Neurofibrome, Optikusgliome |
| Noonan-Syndrom | PTPN11, SOS1, BRAF, KRAS, RAF1 | Café-au-lait-Flecken, diffuses Effluvium, rarefizierte Augenbrauen, Keratosis pilaris, Photosensibilität, Lymphangioma circumscriptum | Fehlbildungen an Herz, Nieren sowie Skelettanomalien, Pterygium colli, Zahnstellungsanomalien, Kryptorchismus oder Hodenaplasie |
| Peutz-Jeghers-Syndrom | STK 11 | Lentiginose an Lippen, Nasen- und Wangenschleimhaut | Intestinale Polypen und Adenokarzinome im Dünndarm, Assoziation mit weiteren Neoplasien innerer Organe |
| Phakomatosis pigmentokeratotica, Überlappung zu Schimmelpenning-Feuerstein-Mims-Syndrom | HRAS | Nävus spilus segmental, Nävus sebaceus | Segmentale Hyperhidrose und Dysästhesie, Ptosis, Taubheit, Epilepsie, Muskelschwäche |
| Tuberöse Sklerose | TSC1/TSC2 | Café-au-lait-Flecken, Eschenlaubflecken, kutane Angiofibrome/ Adenoma sebaceum | Niere: Angiomyolipome und Zysten Herz: Rhabdomyome |
| Turner-Syndrom | X0 Monosomie | Multiple MN, Café-au-lait-Flecken | Minderwuchs, Gonadendysgenesie Gesichtsdysmorphie, Pterygum colli, Aortenisthmusstenose, Nierenfehlbildungen, Lymphgefäßdysplasie, skelettale Deformitäten |
- *Dermatopathia pigmentosa reticularis wird von Naegeli-Franceschetti-Jadassohn-Syndrom durch lebenslange Persistenz der Hauthyperpigmentierung, partielle Alopezie und das Fehlen von Zahnanomalien unterschieden. Im Rahmen von Tumorsyndromen (wie Li-Fraumeni-Syndrom, Lynch-Syndrom [HNPCC; hereditary non-polyposis colorectal cancer] und Cowden-Syndrom) ist prinzipiell auch das Risiko von Melanomen erhöht.
Unterschiedliche Faktoren wurden untersucht: Es konnte gezeigt werden, dass GNAQ in circa 6 % der Fälle von Nävus Ota mutiert ist. Die zusätzliche Monosomie von Chromosom 3 und Zunahme des langen Arms von Chromosom 8q ist ein Risikofaktor für Uvea-Melanome [17, 21, 22]. Wenn Melanome in einem Nävus Ota entstehen, wachsen sie häufig lokal destruktiv. Von den elf in der Literatur beschriebenen Fällen metastasierten fünf (45 %), wobei das am häufigste betroffene Organ die Leber war, gefolgt von der Lunge [23].
Am häufigsten betroffen von einem Nävus Ota ist das Versorgungsgebiet der ersten beiden Äste des Nervus trigeminus, Nervus ophthalmicus und Nervus maxillaris (Naevus fusco-coeruleus ophthalmo-maxillaris oder auch als okulodermale Melanozytose bezeichnet). Daraus folgt die, zumeist einseitige Distribution der schieferblauen/graublauen Macula, selten wurde auch ein beidseitiges Auftreten beschrieben [17, 24–26].
Die Pigmentierung kann neben dem Gesicht auch das Auge, die Mundhöhle und Nasenschleimhaut betreffen. Liegt beim Nävus Ota eine Hyperpigmentierung des Auges vor (Konjunktiva, Sklera, Hornhaut und Uvea) ist eine vollständige ophthalmologische Untersuchung durchzuführen, um ein Glaukom auszuschließen.
- – Typ I (mild): Typ A ist periokulär. Typ B betrifft die Jochbeinregion. Typ C betrifft die Stirn. Typ D betrifft die Nase.
- – Typ II (mäßig): ähnlich wie Typ I, jedoch intensiver in der Ausprägung.
- – Typ III (intensiv): periokulär, Nasen- und Kopfhautbeteiligung.
- – Typ IV: Bilaterale Beteiligung.
Der Nävus Ito (Naevus fusco-coeruleus deltoideo-acromialis oder auch als deltoideoakromiale Melanozytose bezeichnet) präsentiert sich als schieferblaue/grau-blaue Makula an Schulter-, Brust- und seitlicher Armregion im Versorgungsgebiet des Nervus brachialis im Säuglingsalter oder bis zum Zeitpunkt der Pubertät [28]. In der Literatur finden sich sehr seltene Fälle von malignen Transformationen in einem präexistentem Nävus Ito [19, 29]. Klinisches Merkmal für ein Melanom war ein neu entstandener Knoten im Bereich des vorbestehenden Nävus Ito [29].
Es wird immer wieder über eine erfolgreiche Therapie mit einem 755-nm-Pikosekundenlaser von kosmetisch sehr störenden dermalen Melanozytosen berichtet. Laut Autoren waren die Läsionen bei den sechs behandelten Patienten nach nur ein oder zwei Behandlungen fast vollständig verschwunden [30]. Über die Risiken einer Lasertherapie in Bezug auf die Verlaufskontrollen bei MN wird immer wieder diskutiert. Auch unserer Meinung nach ist die kosmetische Behandlung mittels Laser nur in ausgewählten Fällen eine therapeutische Option.
Blaue MN und Varianten
Blauer Nävus, Nävus coeruleus (Jadassohn-Tièche) (Abbildung 2a)
Blaue MN wurden erstmals 1903 von Tièche beschrieben [31]. Zumeist in früher Kindheit erworben, können sich blaue MN genauso im Erwachsenenalter entwickeln und zeigen einen Gynäkotropismus. Der blaue MN manifestiert sich typischerweise als eine solitäre bläuliche Makula oder Papel bis Knoten mit glatter Oberfläche und einem Durchmesser von 0,5–1 cm, meist an Extremitäten (Abbildung 2b), Nates und im Kopfbereich, aber auch an extrakutanen Stellen, wie Genital-, Mund-, Nasenschleimhaut, und Lymphknoten [32-34]. Klinisch kann der blaue MN manchmal schwer von einem Melanom, einer kutanen Melanommetastase, von einem Basalzellkarzinom oder einem Morbus Kaposi unterschieden werden.
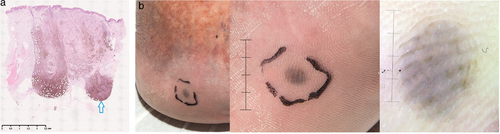
Das dermatoskopisch charakteristische Merkmal der blauen MN ist eine homogene Pigmentierung, die blau, blaugrau, blaubraun oder blauschwarz ist. Es besteht ein breites Spektrum dermatoskopischer Merkmale (Tabelle 2), wie weißliche narbenartige Depigmentierung, Punkte, periphere Streifen oder Gefäße. Die Abgrenzung von Melanomen oder nichtmelanozytären Neoplasien kann dadurch klinisch deutlich erschwert sein und somit eine chirurgische Exzision erforderlich machen [35].
| Pigmentierte Läsion | Für die Läsion typische dermatoskopische Kriterien |
|---|---|
| Blauer Nävus | Strukturlos, blau, blau-weißer Schleier |
| KMN | Zentrale Punkte und Schollen zwischen retikulären Linien, hell-dunkelbraun |
| Lentigo senilis/solaris* | Unterbrechung der parallelen, homogen braunen Pigmentierung durch die Haarfollikel, strukturlos und/oder Punkte, Fehlen von grauen oder dunkelbraunen Strukturen |
| Melanozytärer Nävus | Hautfarben – dunkelbraun pigmentiert, je nach Typ unterschiedliche dermatoskopische Kriterien:
|
| Melanozytosen | Blau-grau/schieferblau und strukturlos |
| MN recurrens | Radiale Linien, Symmetrie und zentrifugales Wachstumsmuster |
| Reed-Nävus | Periphere Pseudopodien oder radiale Linien, dunkelbraun oder annähernd schwarz, strukturlos im Zentrum, Sternenexplosionsmuster (starburst pattern) |
| Spitz-Nävus | Braune oder hautfarbene Schollen, retikuläre weiße/hypopigmentierte Linien |
| Wiesner-Nävus | Strukturlos rosa bis hellbraun mit unregelmäßigen Punkten und Schollen exzentrisch angeordnet, periphere Gefäße |
| Melanom | Mehrere Muster, asymmetrisch angeordnet, mehrere Farben, weiße oder graue Schleier, dicke retikuläre Linien, Pseudopodien |
| Melanoma in situ/Lentigo maligna | Inhomogene Pigmentierung, schiefergraue- bläuliche Farbe, rhomboidales Muster, asymmetrische Follikelöffnungen, Fehlen von Pseudohornzysten |
| Melanoma recurrens | Pigmentierung jenseits der Narbe, Kreise und exzentrische Hyperpigmentierung an der Peripherie |
- Hier bestehen jeweils Varianten und eine vollständige Auflistung kann hier nicht gegeben werden (siehe weiterführende Literatur zur Dermatoskopie MN). Gefäßmuster sind nicht so spezifisch wie Pigmentmuster und werden hier nicht besprochen. Zu bedenken ist, dass die Unterscheidungskriterien durch häufig auftretende Kollisionen von verschiedenen MN sowie Lentigo senilis mit Melanoma in situ, Typ Lentigo maligna an Klarheit verlieren. Die ABCD-Regel (Asymmetrie, Begrenzung, Color, dermatoskopische Struktur) ist ein zusätzlicher Algorithmus für die Abgrenzung MN vom Melanom.
- *Die Lentigo senilis/solaris wird hier aufgrund des wichtigen differentialdiagnostischen Aspektes mitangeführt.
Blaue MN zeigen häufig histologische Überlappungen zwischen der einfachen und der zellreichen Variante [36]. Aufgrund ihres Zellreichtums und des Überflusses an Pigment wurden sie immer wieder als „Melanosarkom“ diagnostiziert.
Der „maligne blaue Nävus“ ist nach aktuellem Verständnis ein Melanom, das sich mit dendritischen Melanozyten, mit oder ohne hoher Zelldichte und teils tief gelegenen und häufig intensiv pigmentierten Melanozyten mit Mitosen und Nekrosen darstellt, aber es ist an sich keine neue oder eigenständige Entität. Die klare Unterscheidung von „zellulären blauen Nävi mit atypischen Merkmalen“ (atypical cellular blue nevi, ACBN) zu zellulären
blauen MN und Melanomen, die mit zellulären blauen MN kombiniert sind, bleibt ein histopathologisches Problem. Um die schwachen diagnostischen Kriterien aufzuzeigen, berichten Barnhill et al. über die Diagnose von 26 verschiedenen zellulären blauen melanozytären Neoplasien (6 Melanome, die sich in oder mit zellulären blauen MN-Attributen entwickelten; 11 „zelluläre blauen Nävi mit atypischen Merkmalen und unbestimmtem biologischem Potenzial“ [ACBN]; 8 herkömmliche zelluläre blaue MN; 1 kombinierter blauer MN) durch 14 Dermatohistopathologen, die routinemäßig melanozytäre Neoplasien untersuchen. Die diagnostische Sensitivität der 14 Pathologen betrug 68,6 % für Melanome, 33,1 % für ACBN und 44,6 % für zelluläre blaue MN.
Die Ergebnisse dieser Studie zeigen sehr deutlich, dass selbst unter erfahrenen Histopathologen erhebliche Uneinigkeit über die Definitionen und die biologische Natur von zellulären blauen melanozytären Neoplasien besteht, insbesondere von solchen, von denen angenommen wird, dass sie atypische Merkmale aufweisen (ACBN) [37].
Lentigo simplex, Junktionsnävus, Compoundnävus, dermaler Nävus
Lentigo simplex ist klinisch eine flache pigmentierte Makula, sie wird als frühe Manifestation eines MN interpretiert und besteht aus einer diskreten Vermehrung der basalen Melanozyten. Ob sich hieraus in weiterer Folge ein MN mit Melanozytennestern entwickelt oder nicht, ist offen. Der nächste Schritt der Nävogenese ist eine fokale Proliferation der junktionalen Melanozyten mit Ausbildung von Nestern, die zunächst als kugelige Gebilde an der Junktionszone aufscheinen (Junktionsnävi), später teils in die Dermis „abtropfen“ (Compoundnävi) und dort strang- oder haufenartige Aggregate ausbilden. Schließlich verschwinden die Zellnester aus der Epidermis und sind nur mehr in der Dermis vorhanden (dermale MN).
Bei der Entstehung von melanozytären Nävi sind verschiedene Faktoren bedeutsam: Genetische Faktoren: Eine größere Anzahl von MN, auch von klinisch atypischen MN, kommt oft familiär gehäuft vor. Hormonelle Faktoren: Die Neuentstehung und Veränderungen von melanozytären Nävi in Pubertät und Schwangerschaft sind bekannt.
UV-Strahlung: Eine intermittierende UV-Exposition mit Erythem-wirksamen Dosen vor allem in der Kindheit ist ein wichtiger Faktor (solare Nävogenese) [38, 39].
Immunsuppression: Sowohl iatrogene Immunsuppression nach Organtransplantation und eine Chemotherapie in der Kindheit als auch die Immundefizienz im Rahmen einer HIV-Infektion können zur Vermehrung oder Veränderung von MN führen [1].
Die am häufigsten beschriebenen und klinisch beobachteten MN mit einer, entweder rein junktionalen, compound (sowohl die Junktionszone als auch die Dermis betreffende Ausdehnung) oder rein dermalen Manifestation sind MN wie Miescher-, Unna- und Clark-Nävi (wobei diese Eigennamen nicht einheitlich verwendet werden und je nach Labor und Befunder auch Eigennamen wie „Zitelli“ vorkommen).
Miescher-Nävus
Der Miescher-Nävus ist ein häufiger, vor allem im Gesicht gelegener, kuppelförmig erhabener und zumeist hautfarbener MN mit gelegentlich verstärktem Haarwachstum, im Volksmund auch als „Hexenwarze“ bezeichnet. Er besitzt histologisch ein endo- und exophytisches Wachstum, eine zumeist ausgedehnte keilförmige dermale Komponente und bezieht die Strukturen der Adnexe bis in die Tiefe mit ein.
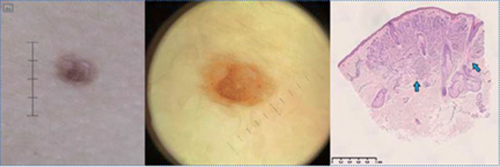
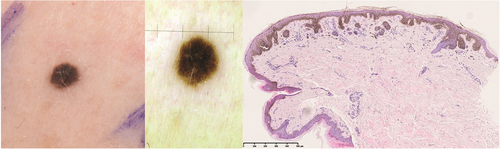
Zitelli-Nävus (Abbildung 3)
Der Zitelli-Nävus ist ein MN, der zumeist am Rumpf als pigmentierte Papel auftritt.
Histologisch zeigt sich (wie beim Miescher-Nävus) zumeist eine keilförmig bis sägezahnartige dermale Komponente und die Strukturen der Adnexe werden miteinbezogen.
Unna-Nävus (Abbildung 4)
Der Unna-Nävus ist ein papillomatöser MN, zumeist am Hals, den Axillen und Leisten lokalisiert.
Klinisch ist gelegentlich die Abgrenzung zu einer seborrhoischen Keratose oder auch zum Fibroma pendulans schwierig. Die Pigmentierung variiert von praktisch hautfarben bis stark pigmentiert. Auch dieser MN hat eine ausgedehnte dermale Komponente, betreffend die papilläre Dermis unter Einbeziehung der Adnexe.
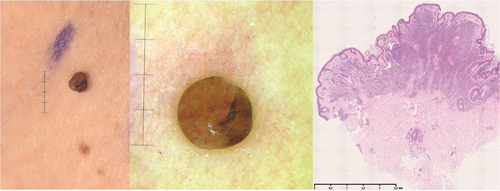
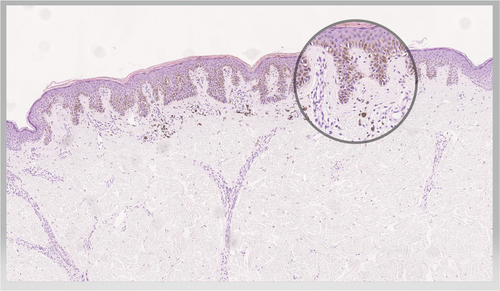
Clark-Nävus (Abbildung 5)
Er präsentiert sich meist als eine flache und scharf berandete Plaque und ist häufig am Rumpf lokalisiert. Histologisch erkennt man eine häufig junktional begrenzte (deshalb klinisch flache und dermatoskopisch retikuläre) und teilweise deutlich pigmentierte Vermehrung der Melanozyten (Abbildung 6). Obwohl Ackerman und Magana-Garcia ursprünglich vorgeschlagen hatten, flache MN als „Clark-Nävi“ zu bezeichnen, werden diese häufig mit dem schlecht definierten Begriff „dysplastischer Nävus“ verwechselt, beziehungsweise als solche bezeichnet [40]. Der immer wieder in der neueren Literatur vorkommende Begriff des Spark-Nävus beschreibt einen MN, welcher histologische Merkmale von sowohl Spitz- als auch des Clark-Nävus aufweist [41]. Klinisch handelt es sich um eine asymmetrische, unregelmäßige, mehrfarbige, pigmentierte Läsion, die klinisch oft nicht klar von einem Melanom oder Clark-Nävus zu unterscheiden ist.
Verteilung von MN in der kaukasischen Bevölkerung
Eine prospektive Studie an 400 Patienten untersuchte die Häufigkeit, Lokalisation sowie Alters- und Geschlechtsverteilung von flachen MN/Clark-Nävi, Miescher-Nävi und Unna-Nävi in der kaukasischen Bevölkerung. Bei 400 Patienten, von denen 47 ein Melanom in der Anamnese hatten, wurden MN gezählt. Das Durchschnittsalter betrug 52,5 Jahre in der Nicht-Melanom-Gruppe und 58,6 Jahre in der Melanom-Gruppe. Das mittlere Alter bei Diagnose eines Melanoms betrug 52,5 Jahre, die mittlere Dicke des Melanoms betrug 2,7 mm. Die mittlere Gesamtzahl der MN bei allen Patienten betrug 64.
Die Verteilung nach Altersgruppen zeigte im dritten Jahrzehnt (21–30 Jahre) einen signifikanten Höhepunkt der Gesamtzahl der MN, gefolgt von einem allmählichen Rückgang. Die Unterschiede zwischen der Melanom-Gruppe und der Nicht-Melanom-Gruppe waren wiederum für alle Jahrzehnte zwischen 21 und 80 Jahren signifikant. Melanozytäre Nävi, die klinisch als flache MN/Clark-Nävi diagnostiziert wurden, stellten den häufigsten MN-Subtyp dar (91,6 % aller Nävi – 92,5 % in der Melanom-Gruppe und 91,3 % in der Nicht-Melanom-Gruppe). Miescher-Nävi, die zumeist im Kopf- und Halsbereich gefunden wurden (45,5%), machten 5,8 % aller MN aus (5 % in der Melanom-Gruppe, 6 % in der Nicht-Melanom-Gruppe). Unna-Nävi, die sich hauptsächlich am Rumpf befanden (65,5 %), waren in beiden Gruppen der am wenigsten verbreitete Nävus-Subtyp (2,4 % in der Melanom Gruppe, 2,6 % in der Nicht-Melanom-Gruppe). Die Summe aller MN war in der Melanom-Gruppe höher [42].
Nävus spilus (spilus: gesprenkelt)
Der Nävus spilus ist ein MN, der durch eine braune Makula gekennzeichnet ist, wobei die Café-au-Lait-Komponente von unterschiedlichster Ausdehnung häufig schon bei Geburt vorhanden ist, die Sprenkel entwickeln sich meist im Laufe der ersten Lebensjahre. Diese Sprenkel können verschiedene Arten von MN darstellen.
Dazu gehören Clark oder kombinierte MN, Spitz Nävi und selten auch blaue MN. Der Nävus spilus ist somit ein kombinierter MN. Das Risiko einer malignen Transformation ist nicht genau definiert, wird jedoch mit einer Häufigkeit von 0,13 %–0,2 % angegeben. So wird in der Literatur auch über einen Patienten mit multifokalen Melanomen am Boden eines Nävus spilus im späten Erwachsenenalter berichtet [43].
Ein segmentaler Nävus spilus kann hinweisend auf das Vorliegen einer RASopathie (heterogene Gruppe von genetischen Erkrankungen deren gemeinsamer Nenner die Mutation im RAS/Mitogen-aktivierten Proteinkinase-Signalwegs ist) sein [44]. Die Symptome der RASopathie betreffen häufig die Haut, das kardiovaskuläres System, Skelett, Muskulatur, Gastrointestinaltrakt, ZNS und Auge. Bei einigen Syndromen liegen charakteristische kraniofaziale Merkmale vor, bei anderen besteht ein erhöhtes Tumorrisiko. Klinisch gibt es starke Überlappungen zwischen den einzelnen Krankheitsbildern, wie auch der Phakomatosis pigmentokeratotica (Tabelle 1) beziehungsweise dem Schimmelpenning-Feuerstein-Mims-Syndrom. Hierbei treten ein Nävus spilus in Kombination mit einem Nävus sebaceus auf [45, 46].
Die zugrundeliegende Mutation der Phakomatosis pigmentokeratotica (Tabelle 1) liegt im HRAS-Gen. Zusätzlich treten hierbei manchmal weitere neurologische Symptome wie Epilepsie und Taubheit auf [47].
Kongenitale melanozytäre Nävi (KMN)
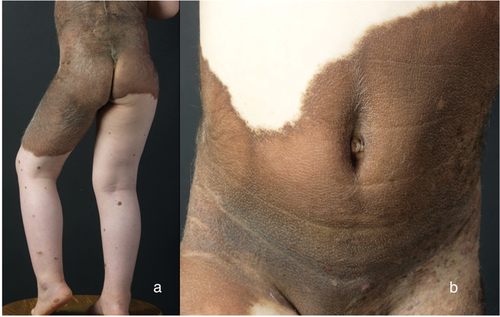
Kongenitale melanozytäre Nävi sind von mäßig brauner bis intensiv dunkelbrauner Pigmentierung, teils mit proliferierenden Knoten, oder vermehrter Behaarung (Tierfellnävus) und können ganze Körperregionen betonen (Badehosennävus). Satellitennävi sind einzelnstehende MN, die in der Umgebung eines KMN auftreten (Abbildung 7).
- – kleine KMN: < 1,5 cm,
- – mittelgroße KMN: 1,5–10 cm,
- – große KMN: 11–20 cm,
- – melanozytäre Riesennävi: > 20 cm.
Der Faktor, mit dem die Größe des KMN multipliziert wird, um die Erwachsenengröße zu berechnen, basiert auf der anatomischen Lage. Kongenitale melanozytäre Nävi am Kopf wachsen circa um den Faktor 1,7, an der unteren Extremität um 3,3 und an der oberen Extremität sowie am Rumpf um den Faktor 2,8 [48].
Innerhalb der melanozytäre Riesennävi wird weiter unterschieden zwischen G1 (21–30 cm), G2 (31–40 cm) und G3 (> 40 cm). Bestehen bei einem KMN mehr als 50 Satelliten-Nävi, führt dies zur Einordnung in die nächsthöhere Kategorie [49].
Bei etwa einer von 20 000 Geburten wird ein Säugling mit einem KMN mit einer Größe von > 20 cm Durchmesser geboren [50], welcher dann üblicherweise mit anderen kleineren KMN (Satelliten-Nävi) assoziiert ist. Genetisch sind sie durch NRAS-Mutationen gekennzeichnet.
KMN sind permanent, wachsen proportional zum Kind und können häufig proliferierende Knoten bilden, welche klinisch teils schwer von einem Melanom zu differenzieren sind [51]. Histologisch sind die Melanozyten in KMN sowohl in der Dermis als auch in der Subkutis und teilweise in noch tieferen Gewebsstrukturen vorliegend, sie infiltrieren vielfach die Adnexepithelien (Haare, Schweißdrüsen) sowie Gefäß- und Nervenstrukturen. KMN sind das Ergebnis einer postzygotischen Mutation. Je nachdem, wann die Mutation eintritt, kann sie eine multipotente Vorläuferzelle treffen. Je früher die somatische Mutation in der Embryonalentwicklung eintritt, umso intensiver ist das klinische Bild des KMN und kann zur Beteiligung anderer Organsysteme führen. Patienten können neben KMN subtile endokrine Dysfunktionen sowie charakteristische Gesichtsmerkmale aufweisen [52, 53]. Bei Auftreten von extrakutanen Symptomen wurde 2012 von Kinsler et al. der Begriff „KMN-Syndrom“ vorgeschlagen, der als ein geeigneterer Begriff als „neurokutane Melanose“ imponiert, da Melanose nur eine Teilmenge der angeborenen neurologischen Anomalien ist, die bei Patienten mit KMN auftreten können und die Prognose wesentlich mitbestimmen [53]. Melanome und extrakutane Symptome treten am wahrscheinlichsten bei Patienten mit KMN auf, die eine Endgröße von > 40 cm im Durchmesser, zahlreiche Satelliten-Nävi und eine Lokalisation am Stamm aufweisen [54]. Die Diagnose einer zerebralen Beteiligung wird mittels Magnet-Resonanz-Tomographie gestellt.
-
Der gesundheitliche Aspekt: Welches Risiko in Bezug auf Melanome sowie auch auf die Entwicklung von anderen, hier vor allem jedoch neurologischen Komplikationen (Epilepsie, Liquor-Stauung, Entwicklungsstörung) besteht.
-
Der kosmetische Aspekt und die damit einhergehende psychische Belastung. Für den Patienten entscheiden zu diesem, meist sehr frühen Zeitpunkt (Säuglingsalter) die Eltern, welche Therapie gewählt wird.
Eine multidisziplinäre Zusammenarbeit ist für die operative Therapie von KMN ab einer gewissen Größe oder auch in Regionen wie dem Gesicht erforderlich [55].
Unterschieden werden oberflächliche (wie Dermabrasio und ablativer Laser) von tiefen Interventionen (serielle Exzisionen mit power-stretching, Lappenplastik sowie Spalthauttransplantationen) [56-58]. Hierbei müssen die Aspekte der Notwendigkeit einer histologischen Beurteilung, Schmerzen und Infektionsrisiko, Dauer der Hospitalisierung, kosmetisches Ergebnis, Rezidiv-Risiko und Melanom-Prävention individuell beurteilt und gegeneinander abgewogen werden [56].
Das Melanomrisiko in Bezug auf KMN wurde in den letzten Jahren mehrfach untersucht und relativiert. In einer systematischen Übersichtsarbeit wurden 2006 insgesamt 14 Studien über die Epidemiologie bezüglich des Entartungsrisikos KMN analysiert [59]. Die in diesen Studien angegebene Entartungsfrequenz lag zwischen 0,05 % und 10,7 % und nahm mit steigender Studiengröße hin signifikant ab. In etwa drei Viertel der Melanom-Fälle handelte es sich um KMN mit einem Durchmesser > 40 cm. Diese Literaturanalyse bestätigt, dass bei Trägern von KMN mit einem Durchmesser von > 40 cm ein erhöhtes Melanomrisiko besteht und dass Melanome bereits in einem wesentlich niedrigeren Alter als für dieses Malignom üblich auftreten können. Es wird angenommen, dass selbst bei Riesennävi das Entartungsrisiko nicht mehr als circa 3–5 % beträgt [59].
Spitz-Nävus und atypische spitzoide Neoplasien (ASN)
Benannt sind Spitz-Nävi nach Sophie Spitz, einer Pathologin, die 1910 in Nashville, Tennessee, geboren wurde, und in New York lebte und arbeitete. In ihrer 1948 erschienen Arbeit „Melanoma of the childhood“ beschreibt sie eine Reihe von 13 Kindern mit speziellen MN. Auf Grund histologischer Kriterien wurden diese MN als Melanome interpretiert, das klinische Verhalten dieser MN zeigte jedoch in zwölf von 13 Fällen einen völlig gutartigen Verlauf [60]. Somit muss angenommen werden, dass es sich in zwölf Fällen um Spitz-Nävi und in einem Fall um ein spitzoides Melanom handelte.
MN mit „Spitz-Nävus ähnlichen Kriterien“ werden als spitzoid beschrieben. Häufig präsentieren sich diese MN als hautfarbene bis orange-rote Papel bis Knoten mit einer Größe von 0,5–2 cm. Spitz-Nävi treten gehäuft bei Kindern, vor allem im Gesicht und den Extremitäten, auf, haben eine Tendenz zu raschem Wachstum und können im Verlauf regredieren.
Es existieren verschiedene histologische Varianten. Eine stark pigmentierte und klinisch auffällige Variante ist der relativ häufige Reed-Nävus (Abbildung 8), der von unterschiedlichen Autoren auf Grund seines distinkten klinisch und dermatoskopischen Erscheinungsbild als eine eigenständige Unterart MN interpretiert wird [61].
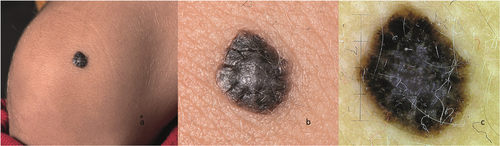
Spitz Nävi bestechen histologisch durch ihre Dominanz von großen epithelioiden und/oder spindelförmigen Melanozyten, die Melanozytennester zeigen eine deutliche Tendenz zur Konfluenz und mitunter auch Mitosefiguren in den oberen Anteilen der Läsion. Selten vorhandene Kamino-Körperchen sind ein spezifisches histologisches Merkmal für Spitz-Nävi, stellen die Überreste apoptotischer Melanozyten dar und werden entlang der dermoepidermalen Junktionszone gefunden.
Das am häufigsten beobachtete veränderte Gen in Spitz Nävi ist das HRAS-Gen. Kumulative Daten aus mehreren Studien ergaben, dass 48 von 293 (16,4 %) Spitz-Nävi HRAS-Veränderungen enthalten. HRAS gehört zur Familie der RAS-Gene, die aus zwei weiteren Mitgliedern besteht, KRAS und NRAS [62]. Eine HRAS-Mutation scheint in MN fast ausschließlich in Spitz Nävi aufzutreten [63]. Fälle mit eindeutigen Merkmalen von Melanomen werden als spitzoides Melanom bezeichnet.
Atypische spitzoide Neoplasien (ASN) oder auch Spitz tumor of uncertain malignant potential (STUMP) stellen laut einigen Autoren eine intermediäre Läsion dar, also eine Art von melanozytären Läsionen mit histologischen Merkmalen, die schwer von denen des Melanoms zu unterscheiden sind [64]. Die Sentinel-Lymphknoten Biopsie wurde als zusätzliches diagnostisches Verfahren zur besseren Absicherung im Patientenmanagement teils mitherangezogen [65].
Obwohl Melanozytennester häufig in den Sentinel-Lymphknoten von Patienten mit atypischen Spitz-Tumoren nachgewiesen werden, ist ihre Prognose wesentlich besser als die von Patienten mit Melanom und positiven Sentinel-Lymphknoten-Biopsien [66].
Wiesner-Nävus
Wiesner et al. beschreiben in zwei nicht verwandten Familien autosomal-dominant vererbte MN, die sich klinisch, histopathologisch und genetisch von anderen erworbenen MN unterscheiden [67] und hinweisend auf das „tumor predisposition syndrome“ sind.
Der Wiesner-Nävus ist ein, durch BRAF-Mutation in Kombination mit einem biallelischen BAP1-Verlust gekennzeichneter spitzoider MN [68].
Keimbahnmutationen in BRCA1-assoziiertem Protein 1 (BAP1) sind mit mehreren Neoplasmen assoziiert (Mammakarzinom, Schilddrüsenkarzinom, Urothelkarzinom und neuroendokrines Karzinom und andere) einschließlich BAP1-inaktivierten melanozytären Tumoren (BIMT) [69]. BAP1-inaktivierte melanozytäre Tumoren werden klassisch als melanozytäre Proliferationen mit BAP1-defizienten großen epithelioiden Melanozyten beschrieben, die verschiedene Grade zytologischer Auffälligkeiten aufweisen.
Diese heterogene Gruppe von MN weisen histologische Merkmale auf, die sowohl bei Spitz-Nävi als auch bei Melanomen auftreten [63]. Ab dem zweiten Lebensjahrzehnt entwickelten betroffene Familienmitglieder nach und nach hautfarben bis rotbraune, kuppelförmig bis gestielte, gut umschriebene Papeln mit einer durchschnittlichen Größe von 5 mm. Die Anzahl der MN pro Patienten variierte deutlich zwischen fünf und über 50. Die zytologischen Merkmale einiger Zellen erinnerten an Spitz-Nävi, charakteristische Merkmale (wie epidermale Hyperplasie, Hypergranulose, Kamino-Körperchen, Spalten um melanozytäre Nester und spindelförmige Melanozyten), die häufig in Spitz-Nävi beobachtet wurden, fehlten jedoch. Zusätzlich zeigten 37 von 42 (88 %) Tumoren in den Familien BRAF-Mutationen, die typischerweise in Spitz-Nävi fehlen [68, 70]. In Familien mit Keimbahnmutationen im BRCA1-assoziierten Protein 1 (BAP1) wurde das erhöhte Auftreten von Melanomen, unter anderem auch Uvea-Melanomen beobachtet. BAP1-inaktivierte melanozytäre Tumoren können als Frühmarker für das erbliche „Tumor-Prädispositions-Syndrom“ dienen [71, 72]. Bei Patienten mit einer Papel, welche sich dermatoskopisch rosa bis hellbraun mit strukturlosen Bereichen und peripheren unregelmäßigen Punkten/Schollen oder Netzwerk präsentiert, sollte der Verdacht auf BIMT geweckt werden [72].
MN recurrens (Persistierender MN, Pseudomelanom)
Eine inkomplette Exzision, wenn sie eine Pigmentläsion betrifft, wird ohne die klinische Angabe der Voroperation immer wieder zu einem pitfall für den Pathologen. Die
Narbenzüge, in denen sich die neuerlich entstehenden Melanozytennester ausbreiten, zeigen eine veränderte Architektur und Anordnung zueinander, sie tendieren zu Konfluenz und sind teils irregulär in die Tiefe versprengt. Im Jahr 2014 wurde in der Fachzeitschrift JAMA Dermatology eine retrospektive Analyse publiziert, welche Merkmale von 98 rekurrierenden MN und 62 rekurrierenden Melanomen analysiert und Kriterien zur genaueren Bewertung dermatoskopischer Muster und Farben in Korrelation mit den histopathologischen Befunden herausarbeitet [73].
Die endgültige Interpretation erfordert die Berücksichtigung des Alters des Patienten, der anatomischen Stelle, der Zeit bis zum Wiederauftreten, des Wachstumsmusters und, falls verfügbar, die histopathologischen Befunde der primären Exzision. Weitere dermatoskopische Kriterien wie radiale Linien, Symmetrie und zentrifugales Wachstumsmuster sind signifikant häufiger bei rekurrierenden MN.
Im Gegensatz dazu sind Kreise und eine exzentrische Hyperpigmentierung an der Peripherie signifikant häufiger bei rekurrierenden Melanomen. Patienten mit rekurrierenden Melanomen sind außerdem signifikant älter als Patienten mit rekurrierenden MN (mittleres Alter 63,1 Jahre gegenüber 30,2 Jahren) [73]. Diese erarbeiteten Kriterien stellen eine gute Unterstützung in der klinischen Beurteilung rekurrierender MN beziehungsweise Melanome dar.
Dysplastischer MN (DMN)
Die histologische Diagnose „dysplastischer Nävus“ wird kontrovers diskutiert und uneinheitlich verwendet. Dies führt dazu, dass der prozentuale Anteil von DMN in Abhängigkeit vom jeweiligen Untersucher starken Schwankungen unterliegt und dieser Begriff von einigen Pathologen erst gar nicht verwendet wird. Im Grunde besteht hier dasselbe Dilemma, wie beim blauen Nävus mit atypischen Merkmalen (atypical cellular blue nevi, ACBN) oder auch Spitz tumor of uncertain malignant potential (STUMP).
Einige Autoren bevorzugen es, den Begriff „atypischer Nävus“ für die klinische Darstellung zu verwenden und „dysplastisch“ für die histologische Diagnose zu reservieren. Leider besteht kaum eine Korrelation zwischen klinisch atypischen Nävi und solchen mit histologischen Merkmalen der Dysplasie [73].
Klinisch ist der DMN eine melanozytäre Läsion, die nach der ABCDE-Regel (A: Asymmetrie, B: Begrenzung, C: Color, D: Diameter, E: Erhabenheit) maligne Kriterien erfüllt.
Melanozytärer Nävus und Melanom
Melanozytäre Nävi sind gutartige klonale Proliferationen von Melanozyten, die insgesamt heterogene klinische und molekulare Eigenschaften besitzen. Melanozytäre Nävi und das Melanom teilen gemeinsame Treibermutationen. Es wird angenommen, dass nach dieser anfänglichen Treibermutation ein Seneszenz-Programm ausgeführt wird, wodurch es zur Beendigung des Wachstums von MN kommt. Erst bei Auftreten zusätzlicher onkogener Veränderungen (second hit), wie zum Beispiel Mutationen im TP53-Gen, das für p53 kodiert (das zu Fehlfunktionen von DNA-Reparaturmechanismen führt und für Zellarrest und Apoptose verantwortlich ist), tritt eine maligne Progression auf [63]. Die Häufigkeit und das Vorherrschen von BRAF-Mutationen hängt auch mit dem histopathologischen Subtyp und dem Stadium der Entwicklung eines MN zusammen [74]. Mit zunehmendem Alter regredieren MN häufig. Durch die altersbedingte Involution und Apoptose der Melanozyten geht die BRAF-Mutation in MN verloren. Dies entspricht auch der Beobachtung, dass in Melanomen jüngerer Patienten häufiger eine BRAF-Mutation nachgewiesen werden kann [75].
Die Präsenz von multiplen MN im Rahmen von genetischen Syndromen (Tabelle 1) zeigt den multigenetischen Hintergrund der Entwicklung von MN und Melanomen auf [63].
Einzelne Syndrome und genetische Merkmale, die mit einer erhöhten Inzidenz an Melanomen einhergehen sind hinreichend bekannt. Das familiäre atypische multiple Muttermal- und Melanom-Syndrom (FAMMM oder auch als BK-Mole-Syndrom bezeichnet) ist in 25 %–50 % der Fälle auf Mutationen im CDKN2A-Gen, das für das Protein p16, eines der Kontrollproteine des Zellzyklus codiert, zurückzuführen. Somit ist das Risiko für die Entwicklung von Malignomen anderer Organsysteme ebenfalls erhöht (Pankreas, Gehirn (Melanom-Astrozytom-Syndrom), Ösophagus, Magen oder Harnblase) [76]. Neben CDKN2A und CDK4 wurden Keimbahnvarianten in MC1R, TERT, ACD, POT1, TERF2IP, MITF und BAP1 in die Liste der Gene aufgenommen, die Melanom-prädisponierende Mutationen beherbergen [77]. Hierbei handelt es sich entweder um direkte onkogene Mutationen, um Proteine die für DNA-Reparatur (wie bei Xeroderma pigmentosum) und Telomer-Stabilität sowie Prozessierung verantwortlich sind (POT1, ACD, und TERF2IP) oder wie bei MC1R (Melanocortin-Rezeptor 1) um einen G-Protein gebundenen Rezeptor, der die Pigmentierung von Haut und Haaren reguliert. Bei frühem und/oder familiär gehäuftem Auftreten von Malignomen sollte an ein zugrundeliegendes Tumorsyndrom gedacht werden. Bei Patienten mit einem invasiven Melanom sollte ab dem 3. Melanom und/oder einer positiven Familienanamnese (zwei Verwandte in direkter Linie) eines Melanoms und/oder Pankreaskarzinoms eine genetische Analyse angeboten werden [77, 78].
Bei Patienten, die einer solchen „Risikopopulation“ angehören, ist die Ganzkörperfotografie und sequenzielle digitale Dermatoskopie ein gutes Werkzeug, um Melanome früh zu diagnostizieren [79].
Ungefähr 30 % der Melanome stammen direkt von MN [80] (Abbildung 9). Trotzdem schreitet die überwiegende Mehrheit der MN, die sich als Folge von BRAF-V600E-aktivierenden Mutationen bilden, niemals zum Melanom fort.

Wenn aufgrund der Anamnese, der Klinik und Dermatoskopie einerseits keine eindeutigen Hinweise für Malignität vorliegen, andererseits jedoch auch nicht eindeutig die Benignität des Hauttumors zum Zeitpunkt der Untersuchung bestätigt werden kann, so kann eine Verlaufsbeobachtung innerhalb von zwei bis drei Monaten als Alternative zur Exzision der Läsion erfolgen [81, 82].
Mackie et al. präsentierten die Zusammenhänge der Melanom-Inzidenz in einer schottischen Population, mit der Gesamtanzahl gutartiger pigmentierter Nävi über 2 mm Durchmesser, Sommersprossenneigung, Anzahl klinisch atypischer Nävi und schweren Sonnenbränden in der Vorgeschichte im Leben sehr klar [83, 84].
Dermatoskopie
Die Dermatoskopie ist ein effektives Standardverfahren in der Diagnostik und Früherkennung von Melanomen. Dabei ist Auswahl der Hautveränderungen für die diagnostische Treffsicherheit der dermatoskopischen Untersuchung entscheidend (ugly duckling). Ein Vergleich mit anderen MN desselben Patienten ist Voraussetzung, um Abweichungen in dem Grundmuster des jeweiligen Patienten zu erkennen und erhöht die Trefferquote bei der Früherkennung von Melanomen (komparativer Ansatz) [83].
Die dermatoskopische Diagnose erfolgt durch die Beschreibung der sichtbaren Befunde (Größe, Farbe, Muster, Aufbau). Handelt es sich um eine Kollisionsläsion, sollten diese unterschiedlichen Aspekte innerhalb einer Läsion berücksichtigt werden (Einzelkomponentenanalyse) und gegebenenfalls eine Einteilung in Quadranten erfolgen [85]. Aus einer Ansammlung von, in der deskriptiven Terminologie auf fünf beschränkte Grundelemente (Linien, Kreise, Pseudopodien, Schollen und Punkte) entsteht ein Muster. Für ein Muster müssen mindestens 25 % der Läsion eingenommen sein [86]. Hinzu kommen Linienmuster (retikulär, verzweigt, abgewinkelt, parallel und gebogen) und Gefäßmuster. In der metaphorischen, bildhaften Terminologie ist die Auswahl an Begrifflichkeiten länger, aber nicht spezifischer. Die Begriffe der beiden unterschiedlichen Terminologien werden häufig nicht streng getrennt und können sich ergänzen [86].
Strukturen wie milienartige Pseudozysten, komedoartige Öffnungen, bläulich-graue homogene Areale, pfefferartige, weiß-bläuliche Strukturen mit Regression und hell gefärbte Areale – all dies lässt sich besser mit polarisierten Dermatoskopen darstellen. Um die Vorteile beider Typen von Dermatoskopen zu vereinen, empfiehlt es sich ein Dermatoskop mit dualen Lichtquellen (unpolarisiert und polarisiert) zu verwenden [87].
Eine Zusammenfassung über die wichtigsten dermatoskopischen Kriterien von MN, Melanomen und deren Differenzialdiagnosen gibt Tabelle 2.
Zusammenfassung
Melanozytäre Nävi sind vielgestaltig und beschäftigen Dermatologen täglich. Die standardisierte Diagnostik ist die Dermatoskopie, die Ganzkörperfotografie sowie die histopathologische Analyse. Verschiedene klinische Aspekte können Hinweise auf mögliche zugrundeliegende Erkrankungen liefern und den Patienten gegebenenfalls einer gezielten Diagnostik und Beratung beziehungsweise Therapie zuführen. Das Wissen über die Entwicklung und die genetischen Hintergründe MN hat sich in den letzten Jahren vervielfacht. Der Artikel soll einen Überblick über die häufigsten und klinisch relevanten Arten von MN und deren Merkmale liefern.
Summary
Clinical differentiation of MN is a daily challenge to health care providers. The standardized diagnosis is dermatoscopy, whole-body photography and histopathological analysis. This article aims to shed light on a complex topic of different MN and offer you a comprehensive guide to a heterogenic field. Various clinical aspects can provide indications of possible underlying diseases and, if necessary, lead the patient to targeted diagnostics and therapy. Knowledge about the development and genetic background of MN has multiplied in recent years. The article aims to provide an overview of the most common and clinically relevant types of MN and their characteristics.
Literatur
CME Questions/Lernerfolgskontrolle
- Welche Aussage ist richtig?
- Melanozyten kommen in allen Geweben des menschlichen Organismus vor.
- Melanozyten kommen nur in Haut und Haarfollikeln vor.
- Melanozyten kommen in der Uvea des Auges, im Innenohr und in den Leptomeningen des Gehirns vor.
- Melanozyten kommen ebenso in ossären Strukturen vor.
- Melanozyten wandern innerhalb des ersten Lebensjahres in die Haut ein.
- Welche Aussage ist richtig?
- Durch die natürliche Melaninpigmentierung wird ein Eigenschutz erreicht, der einem Sonnenschutzfaktor von ungefähr 8 entspricht.
- Der Pigmenttransfer in der Epidermis erfolgt bis in das Stratum basale.
- Es entscheidet die Anzahl der Melanozyten über die Intensität des Hautkolorits.
- Die Aktivität der Pigmentzellen entscheidet über die Intensität des Hautkolorits.
- Die Dichte der Melanozyten an der Junktionszone ist überall an der Haut dieselbe.
- Welche Aussage ist richtig?
- Grundsätzlich sind MN an „speziellen“ Lokalisationen ein Risikomarker für Malignität.
- Erworbene und klassisch kongenitale MN tragen dieselben genetischen Mutationen.
- Die Unterschiede zwischen erworbenen und kongenitalen MN können in den unterschiedlichen Mutationen im MAPK-Signalweg nachvollzogen werden.
- Mittels histopathologischer Kriterien kann man erworbene und kongenitale MN zuverlässig voneinander unterscheiden.
- BRAF-Mutationen sind häufig in kongenitalen MN nachweisbar.
- Welche Aussage ist richtig?
- Kongenitale dermale Melanozytosen (Mongolenflecke) werden zumeist bei Neugeborenen aus dem europäischen Raum beobachtet.
- Die schieferblaue Farbgebung der Melanozytosen kommt durch die sehr oberflächlich gelegenen Melanozyten zustande.
- Kongenitale dermale Melanozytosen (Mongolenflecke) bleiben klinisch praktisch immer persistierend.
- Beim Nävus Ota ist am häufigsten das Versorgungsgebiet des Nervus brachialis beteiligt.
- Die schieferblaue Farbe der Melanozytosen entsteht durch ein physikalisches Phänomen, welches als Tyndall-Effekt bezeichnet wird.
- Welche Aussage ist richtig?
- Angeborene MN und blaue MN beherbergen häufig BRAF-Mutationen.
- Spitz- und atypische Spitz-Tumoren weisen häufig BRAF-Mutationen auf.
- GNAQ-Mutationen in MN sind zusammen mit p53 in der Entstehung des Melanoms ein wesentlicher Faktor.
- In Melanomen junger Patienten werden seltener BRAF-Mutation nachgewiesen als bei Patienten im hohen Alter.
- Ungefähr 30 % der Melanome stammen von MN.
- Welche Aussage ist richtig?
- Das familiäre atypische multiple Muttermal- und Melanomsyndrom (FAMMM) ist in circa 25–50 % der Fälle auf Mutationen im CDKN2A-Gen zurückzuführen.
- Das familiäre atypische multiple Muttermal- und Melanomsyndrom (FAMMM) prädisponiert ausschließlich für Melanome.
- Patienten mit einer Mutation im CDKN2A-Gen entwickeln auch häufig Lymphome.
- Die Anzahl schwerer Sonnenbrände ist kein Risikofaktor für Melanome.
- Die überwiegende Mehrheit der MN, die sich als Folge von BRAF-V600E-aktivierenden Mutationen bilden, schreiten zum Melanom fort.
- Welche Aussage ist richtig?
- Kongenitale MN haben für sich genommen ein erhöhtes Entartungsrisiko.
- Kongenitale MN entwickeln sich zumeist innerhalb der ersten Lebensmonate.
- Kongenitale MN werden abhängig von ihrer Größe in zwei Kategorien eingeteilt.
- Das Vorliegen von über 50 Satelliten Nävi bei KMN (G3) ist von prognostischer Bedeutung in Bezug auf das Vorliegen von Melanomen sowie neurologischen Komplikationen.
- Kongenitale MN weisen zumeist Mutationen in BRAF auf.
- Welche Aussage ist richtig?
- Häufig präsentieren sich die Spitz Nävi als bläulich schimmernde Papel.
- Kamino-Körperchen sind ein häufiges histologisches Merkmal für Spitz Nävi.
- Sophie Spitz beschrieb den Spitz Nävus als „melanoma of the childhood“
- Eine Sentinel-Lymphknoten Biopsie ist von prognostischer Bedeutung für Patienten mit atypischen Spitz-Tumoren.
- Sophie Spitz beschrieb diese rasch wachsenden MN als Spitz tumor of uncertain malignant potential.
- Welche Aussage ist richtig?
- In der dermatoskopischen Analyse eines Rezidivs nach Entfernung einer pigmentierten Läsion ist eine Pigmentierung jenseits der Narbe der stärkste Hinweis auf ein Melanom.
- Wiesner beschrieb eine Gruppe von melanozytären Nävi, welche sich allein auf Grund der klinischen Präsentation eindeutig von anderen MN unterscheiden lassen.
- Bei Patienten, die einer „Risikopopulation“ angehören, sollten MN so rasch wie möglich exzidiert werden.
- Die Ganzkörperfotografie und sequenzielle digitale Dermatoskopie sind ein unzureichendes Werkzeug, um Melanome früh zu erkennen.
- Das Konzept des dysplastischen Nävus ist ein wohl etabliertes und klar definiertes.
- Welche Aussage ist richtig?
- In der Dermatoskopie ist die metaphorische/bildliche Sprache der deskriptiven Terminologie deutlich überlegen.
- Unpolarisierte Dermatoskope sind die besten in der Diagnostik pigmentierter Läsionen.
- Die Musteranalyse ist in pigmentierten Läsionen spezifischer als die Gefäßanalyse.
- Periphere Pseudopodien oder radiale Linien sind ein spezifisches dermatoskopisches Merkmal für den blauen MN.
- Die Grundelemente in der deskriptiven Terminologie sind auf zwölf beschränkt.
Liebe Leserinnen und Leser, der Einsendeschluss an die DDA für diese Ausgabe ist der 30. Juni 2022. Die richtige Lösung zum Thema „Alopecia areata - Current understanding and management“ in Heft 1 (Januar 2022) ist: 1a, 2c, 3b, 4e, 5d, 6a, 7a, 8c, 9a, 10c
Bitte verwenden Sie für Ihre Einsendung das aktuelle Formblatt auf der folgenden Seite oder aber geben Sie Ihre Lösung online unter http://jddg.akademie-dda.de ein.




