Die Porphyrien
Redaktion
Prof. Dr. Trautinger, St. Pölten
Die Porphyrien sind komplexe, vornehmlich erblich bedingte Stoffwechselerkrankungen, die sich mit Hautveränderungen und/oder neurologischen Symptomen manifestieren können.
Bei der Hämbiosynthese katalysieren acht Enzyme die Prozessierung spezifischer Substrate.
Mutationen in den für die einzelnen Enzyme kodierenden Genen resultieren in einer enzymatischen Dysfunktion mit konsekutiver Akkumulation von Intermediärmetaboliten.
Die zytotoxischen Effekte der Intermediärmetaboliten führen zu Hautveränderungen und/oder neurologischen Symptomen.
Die Porphyrien werden in kutane und nichtkutane sowie in akute und nichtakute Formen eingeteilt.
In der Haut abgelagerte Porphyrine absorbieren elektromagnetische Strahlung insbesondere im Bereich der Soret-Bande (400–410 nm), so dass es nach Einwirken von sichtbarem und UV-Licht zu einer phototoxischen Reaktion kommt.
Die Ursachen einer akuten Porphyrieattacke sind eine Anhäufung der Porphyrinvorstufen 5-Aminolävulinsäure und/oder Porphobilinogen sowie der Einfluss endogener und exogener Trigger, insbesondere porphyrinogener Medikamente.
Die Hautveränderungen bei den kutanen Porphyrien manifestieren sich ausschließlich an den lichtexponierten Körperarealen.
Eine akute Porphyrieattacke ist differenzialdiagnostisch schwer einzuordnen und potenziell lebensbedrohlich.
Alle Porphyrien können durch nicht- oder minimalinvasive laborchemische und/oder molekulargenetische Untersuchungen diagnostiziert werden.
Die Porphyria cutanea tarda ist die häufigste Porphyrie weltweit.
Es können drei verschiedene Subtypen der Porphyria cutanea tarda unterschieden werden, die alle auf einer partiellen Defizienz der Uroporphyrinogendekarboxylase beruhen.
Bekannte Realisationsfaktoren, die die klinische Manifestation einer Porphyria cutanea tarda begünstigen, sind erhöhte Serumeisen-Spiegel, Alkohol- und Nikotinabusus, Hepatitis-C-Virusinfektion, Mutationen im Hämochromatose (HFE)-Gen, Östrogene und HIV-Infektion.
Die Differenzialdiagnose der Porphyria cutanea tarda umfasst andere blasenbildende kutane Porphyrien, Epidermolysis bullosa acquisita, polymorphe Lichtdermatose, bullöse photoaggravierte Arzneimittelreaktionen, bullöse phototoxische Kontaktdermatitis und die Hydroa vacciniformia.
In der Behandlung der Porphyria cutanea tarda kommen die Phlebotomie und eine niedrigdosierte Hydroxychloroquin-Therapie zum Einsatz.
Mögliche Komplikationen der Porphyria cutanea tarda sind Leberzirrhose und hepatozelluläres Karzinom.
Die erythropoetische Protoporphyrie ist die häufigste Porphyrie im Kindesalter.
Die Erkrankung resultiert aus einer autosomal-semidominant vererbten Defizienz der Ferrochelatase.
Die subjektiv von den jungen Patienten empfundenen Symptome wie Juckreiz, Brennen, Stechen und Schmerzen in der Haut stehen in Diskrepanz zu den objektivierbaren kutanen Zeichen.
Derzeit ist Afamelanotid, ein synthetisches Analog des α-Melanozyten stimulierenden Hormons, die einzige effektive Therapie.
Mögliche Komplikationen der EPP sind Cholelithiasis, Leberzirrhose mit Leberinsuffizienz sowie fulminantes und terminales Leberversagen.
Die Porphyria variegata gehört zur Gruppe der neurokutanen Porphyrien.
Der Erkrankung liegt eine autosomal-dominant vererbte Dysfunktion der Protoporphyrinogenoxidase zu Grunde.
Klinisch kann sich die Porphyria variegata mit Hautveränderungen und/oder akuten neurologischen und psychiatrischen Symptomen im Rahmen einer akuten Porphyrieattacke manifestieren.
Die Therapie der akuten Porphyrieattacke folgt einem Stufenschema, in Analogie zu einer Konsensusempfehlung des Europäischen Porphyrie-Netzwerks (EPNET).
Zusammenfassung
Die Porphyrien sind klinisch variable und genetisch heterogene, vorwiegend hereditäre metabolische Krankheiten, die durch eine Dysfunktion spezifischer Enzyme der Hämbiosynthese verursacht werden. Wir geben einen Überblick zur Ätiopathogenese, Klinik, Differenzialdiagnose, Labordiagnostik und Therapie dieser komplexen Stoffwechselkrankheiten und stellen die weltweit häufigste Porphyrieform (Porphyria cutanea tarda), die häufigste Porphyrie des Kindesalters (erythropoetische Protoporphyrie) und die häufigste neurokutane Porphyrie (Porphyria variegata) detailliert vor.
Einleitung
Porphyrien sind eine Gruppe komplexer Stoffwechselerkrankungen, die ihre Ursache in einer meistens erblichen, seltener erworbenen Dysregulation einzelner oder mehrerer Enzyme der Hämbiosynthese haben. Die Dysfunktion jedes einzelnen Enzyms führt zu einer spezifischen Porphyrie (Abbildung 1). Durch den Enzymdefekt häufen sich Stoffwechselzwischenprodukte in verschiedenen Organen an, was sich klinisch durch Haut- und/oder neurologische Symptome äußern kann. Da die klinischen Zeichen nicht auf Anhieb eine exakte Diagnose ermöglichen, ist eine weiterführende biochemische Labordiagnostik erforderlich. Allerdings führt auch die biochemische Analyse nicht immer zur unmittelbaren Diagnosestellung, da die verschiedenen Porphyrieformen zum Teil verwirrende Überschneidungen der Laborparameter aufweisen können, was nicht selten durch den Zeitpunkt der Gewinnung und die Lagerung des zu analysierenden Materials (Blut, Urin, Stuhl) bis zur Analyse bedingt ist. Daher bedarf die Interpretation der biochemischen Ergebnisse einer gewissen Erfahrung mit Porphyrieerkrankungen, und in schwierigen Fällen liefern bei nicht eindeutigen Laborkonstellationen oft erst molekulargenetische Untersuchungen den entscheidenden diagnostischen Beitrag. Nach der Diagnosestellung sollte der Patient in einem auf Porphyrien spezialisierten Zentrum beziehungsweise durch einen auf dem Gebiet dieser Erkrankungen versierten Arzt und gegebenenfalls interdisziplinär betreut werden, insbesondere was die Therapie betrifft [1-3].
Ätiopathogenese
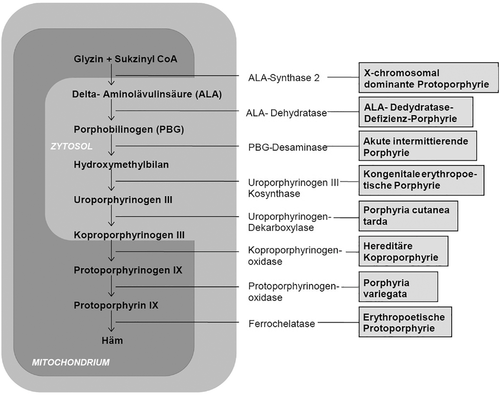
Ausgehend von der Aminosäure Glyzin und dem aus dem Zitronensäurezyklus stammenden Sukzinyl-CoA werden bei der Hämbiosynthese unter Katalyse durch acht Enzyme sukzessiv die einzelnen Substrate des Stoffwechselwegs gebildet, wobei die metabolischen Prozesse zum einen im Zytoplasma, zum anderen im Mitochondrium stattfinden (Abbildung 1). Mutationen in einem der für die jeweiligen Enzyme kodierenden Gene führen zu einer enzymatischen Dysfunktion und einer fehlerhaften oder unzureichenden Substratprozessierung. Dies wiederum resultiert in einer Anhäufung von Intermediärmetaboliten wie Porphyrinen und/oder deren Vorläufer 5-Aminolävulinsäure (ALA) und Porphobilinogen (PBG) in verschiedenen Organen, vornehmlich aber in der Haut, in der Leber, im Blut und im Knochenmark. Die akkumulierenden Stoffwechsel-Zwischenprodukte können unter dem Einfluss verschiedener Induktionsfaktoren wie sichtbares und UV-Licht, porphyrinogene Medikamente, Alkohol oder Hormone zytotoxische und gewebeschädigende Effekte entfalten, die zu Hautveränderungen und/oder akuten sowie chronischen neurologischen Symptomen führen, welche das klinische Erscheinungsbild bestimmen [4, 5].
Klassifikation
Es existieren verschiedenen Klassifikationen der Porphyrien. Da sich fast alle Formen mit akuten und/oder chronischen Hautsymptomen und -veränderungen manifestieren, werden sie aus dermatologischer Sicht in kutane und nichtkutane Formen unterteilt (Tabelle 1). Im weiteren Verlauf dieser Übersicht werden wir uns an dieser Klassifikation orientieren.
| Kutane Porphyrien | Nichtkutane Porphyrien |
|---|---|
|
|
Hingegen ist im medizinischen Alltag in den meisten Fachdisziplinen die Unterteilung in akute und nichtakute Porphyrien sicherlich die gebräuchlichste und sinnvollste, da sie potenziell lebensbedrohliche akute neuroviszerale Attacken berücksichtigt (Tabelle 2) [1-3].
| Akute Porphyrien | Nicht-akute Porphyrien |
|---|---|
|
|
Kutane Porphyrien
Die Gruppe der kutanen Porphyrien beinhaltet die Porphyria cutanea tarda (PCT), die erythropoetische Protoporphyrie (EPP), die Porphyria variegata (PV), die hereditäre Koproporphyrie, die kongenitale erythropoetische Porphyrie, die X-chromosomal dominante Protoporphyrie und die hepatoerythropoetische Porphyrie (Tabelle 1) [1-3].
Nichtkutane Porphyrien
Nichtkutane Porphyrien umfassen die akute intermittierende Porphyrie und die ALA-Dehydratase-Defizienz-Porphyrie (Tabelle 2). Nur bei diesen beiden Porphyrieformen treten niemals Hautveränderungen auf, weshalb sie im weiteren Verlauf nicht ausführlich behandelt werden. Dennoch sollte an dieser Stelle erwähnt werden, dass es sich bei der akuten intermittierenden Porphyrie um die weltweit häufigste akute Porphyrie und eine wichtige Differenzialdiagnose zahlreicher gastrointestinaler, neurologischer und psychiatrischer Erkrankungen handelt [1-3]. Da die Symptome sich häufig unter dem Bild eines akuten Abdomens manifestieren, sollte die Erkrankung vor allem in Notaufnahmen tätigen Ärzten bekannt sein [6].
Pathophysiologie der kutanen Symptome
In der Haut abgelagerte Porphyrine, insbesondere Uroporphyrin, penta-, hexa- und heptakarboxylierte Porphyrine sowie Protoporphyrin IX führen zu erhöhter Photosensitivität, da diese Metaboliten elektromagnetische Strahlung, und somit auch sichtbares und UV-Licht, insbesondere im Bereich der Soret-Bande (400–410 nm) absorbieren und es nachfolgend zu phototoxischen Reaktionen kommt. Diese werden in der Haut von der Bildung freier Sauerstoffradikale und von Lipidperoxiden begleitet, was zu Membrandestruktion und zum Anstieg inflammatorischer Zytokine wie Interleukin (IL)-1 und IL-6, aber auch Kollagenasen führt [1, 2].
Pathophysiologie der neurologischen Symptome
Die plötzlich einsetzenden neurologischen Symptome bei akuten Porphyrieattacken werden durch eine übermäßige Akkumulation der Porphyrinvorstufen ALA und/oder PBG verursacht, wobei auch der Mangel an Häm als mögliche Ursache diskutiert wird. Über die zuvor genannten biochemischen Veränderungen hinaus ist für die Manifestation einer akuten Porphyrieattacke der triggernde Einfluss verschiedener weiterer exogener und endogener Faktoren erforderlich. Zu diesen zählen porphyrinogene Medikamente (unter anderem Barbiturate, Sulfonamide, trizyklische Antidepressiva und Antikonzeptiva), die Einnahme von Hormonen (beispielsweise Östrogene und Gestagene) oder ein intrinsisches hormonelles Ungleichgewicht, übermäßiger Alkoholgenuss, stark eingeschränkte Kalorienzufuhr bei kohlenhydratarmen Diäten oder Fastenkuren und rezidivierende Infektionen [1, 7].
Klinik
Bei Patienten mit kutaner Porphyrie manifestieren sich die Hautsymptome ausschließlich an den lichtexponierten Arealen des Körpers. In diesem Zusammenhang ist es wichtig, sich zu vergegenwärtigen, dass bei zwei Formen der kutanen Porphyrien sowohl Hautveränderungen als auch akute neurologische Symptome auftreten können, weshalb diese auch als neurokutane Porphyrien bezeichnet werden: die Porphyria variegata und die hereditäre Koproporphyrie [8].
Die nichtkutanen Porphyrien hingegen sind durch plötzlich einsetzende und regelhaft über Stunden oder Tage anhaltende neuroviszerale und psychiatrische Symptome gekennzeichnet, die mitunter lebensbedrohliche Ausmaße annehmen und differenzialdiagnostisch schwer einzuordnen sind [9]. Im Rahmen dieser akuten Porphyrieattacken können sich diffuse, kolikartige Bauchschmerzen, Übelkeit und Erbrechen, Tachykardie, Lähmungserscheinungen bis hin zu Para- und Tetraplegie sowie eine Atemlähmung bis hin zum respiratorischen Koma entwickeln [1, 7].
Diagnostik
Neben der Eigen- und insbesondere der Familienanamnese sowie einer gründlichen körperlichen Untersuchung sollte bei allen Betroffenen initial ein fluoreszenzbasierter Plasma-Scan (spektrometrischer Nachweis der verschiedenen Porphyrine im Plasma oder Serum auf Basis ihres spezifischen Fluoreszenzmaximums) und eine biochemische Analyse der Porphyrine und deren Vorstufen ALA und PBG in Blut, Urin und Stuhl durchgeführt werden (Abbildung 2). Sollte dies nicht ausreichen, um die vorliegende Variante der Porphyrien zu diagnostizieren, kann nachfolgend eine molekulargenetische Diagnostik angeschlossen werden. In der Vergangenheit durchgeführte, aber nur von sehr wenigen auf die Porphyriediagnostik spezialisierte Laboratorien angebotene Enzymaktivitätsmessungen haben sich als zu aufwendig und für die Routine ungeeignet herausgestellt [9].
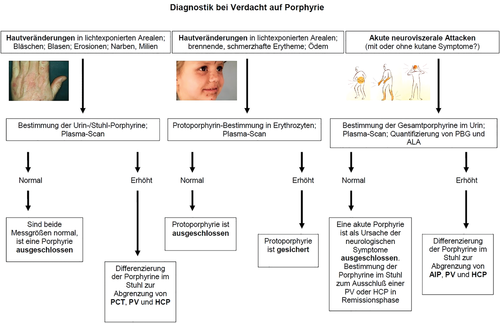
Steht die führende Diagnose einer kutanen Porphyrie im Raum, ist im Allgemeinen von der Entnahme einer Hautbiopsie abzusehen, da diese Untersuchungstechnik zu unspezifisch und diagnostisch nicht wegweisend ist. Dies gilt insbesondere bei Verdacht auf eine sich bereits im Kindesalter manifestierende Porphyrie, da bei den betroffenen jungen Patienten die Entnahme einer Biopsie unangemessen invasiv ist und Patienten mit kutaner Porphyrie in der Regel eine gestörte Wundheilung und verzögerte Narbenbildung aufweisen. Auch die früher häufig durchgeführten Leberbiopsien sind heute nur noch in Ausnahmefällen indiziert, da eine hepatische Beteiligung auch durch moderne bildgebende Verfahren hinreichend sicher nachgewiesen werden kann [10].
Nachfolgend werden drei kutane Porphyrien detailliert dargestellt, die häufigste Porphyrieform weltweit, die häufigste Porphyrie des Kindesalters und die häufigste neurokutane Porphyrie. Die wichtigsten Charakteristika dieser Porphyrien werden darüber hinaus aber auch gemeinsam mit denen der übrigen Porphyrie-Varianten in Tabelle 3 zusammengefasst (Tabelle 3).
| Porphyrie (MIM) | Inzidenz | Manifestationsalter | Klinik | Protein | Gen/Genlocus | Vererbung |
|---|---|---|---|---|---|---|
| Porphyria cutanea tarda | Häufigste Porphyrie weltweit; 1 pro 10 000 | 4. bis 5. Lebensdekade; üblicherweise nicht vor der Pubertät | Milde bis moderate Photosensitivität; erhöhte Hautverletzlichkeit; Hautveränderungen ausschließlich in den lichtexponierten Körperarealen: Bläschen/Blasen, Erosionen, Krusten, Milien, Narben, Hyperpigmentierung, sklerodermiforme Papeln und Plaques, Hypertrichose; mögliche Komplikation: Leberzirrhose; hepatozelluläres Karzinom | Uroporphyrinogendekarboxylase | UROD; 1p34 | Erworben (Typ I); AD (Typ II); unbekannt (Typ III) |
| Hepatoerythropoetische Porphyrie | Extrem selten | Frühes Kleinkindalter | Moderate bis schwere Photosensitivität; erhöhte Hautverletzlichkeit; Hautveränderungen ausschließlich in den lichtexponierten Körperarealen: Bläschen/Blasen, Erosionen, Krusten, Milien, Narben, Hyperpigmentierung, Hypertrichose, Mutilationen | Uroporphyrinogendekarboxylase | UROD; 1p34 | Homozygote Variante der Porphyria cutanea tarda Typ II |
| Porphyria variegata | Selten; 3 pro 1000 in der hellhäutigen Bevölkerung Südafrikas | 3. bis 4. Lebensdekade; üblicherweise nicht vor der Pubertät | Milde bis moderate Photosensitivität; erhöhte Hautverletzlichkeit; Hautveränderungen ausschließlich in den lichtexponierten Körperarealen: Bläschen/Blasen, Erosionen, Krusten, Milien, Narben, Hyperpigmentierung, Hypertrichose; Cave! akute neurologische Attacken; mögliche Komplikation: hepatozelluläres Karzinom | Protoporphyrinogenoxidase | PPOX; 1q22-23 | AD |
| Hereditäre Koproporphyrie | Sehr selten | Üblicherweise nicht vor der Pubertät | Hautveränderungen treten wesentlich seltener auf als bei der Porphyria variegata; milde bis moderate Photosensitivität; erhöhte Hautverletzlichkeit; Hautveränderungen ausschließlich in den lichtexponierten Körperarealen: Bläschen/Blasen, Erosionen, Krusten, Milien, Narben, Hyperpigmentierung; Cave! akute neurologische Attacken; mögliche Komplikation: hepatozelluläres Karzinom | Koproporphyrinogenoxidase | CPOX; 3q12 | AD |
| Kongenitale erythropoetische Porphyrie | Sehr selten | Frühes Kleinkindalter | Moderate bis sehr schwere Photosensitivität; erhöhte Hautverletzlichkeit; Hautveränderungen ausschließlich in den lichtexponierten Körperarealen: Bläschen/Blasen, Erosionen, Krusten, Milien, Narben, Hyperpigmentierung, Hypertrichose | Uroporphyrinogensynthase III | UROS | AR |
| Erythropoetische Protoporphyrie | Zweithäufigste kutane Porphyrie; 1 pro 130 000; häufigste Porphyrie des Kindesalters | Kleinkindalter; spätmanifeste Formen sind sehr selten | Moderate bis schwere Photosensitivität. Subjektive Symptome: Juckreiz, Brennen, Stechen und Schmerzen in der Haut unmittelbar nach Lichteinwirkung. Objektive Symptome: Diffuse Erytheme und Ödeme; seltener Petechien und Purpura. Sehr selten Bläschen/Blasen. Lichenifikation, postinflammatorische Hyperpigmentierung, Narbenbildung; narbenähnliche Hyalinosen (Nasenrücken, Fingerknöchel). Komplikationen: Cholelithiasis, Leberversagen. | Ferrochelatase | FECH; 18q21.3 | ASD |
| X-chromosomal dominante Protoporphyrie | Sehr selten | Kleinkindalter | Moderate bis schwere Photosensitivität. Subjektive Symptome: Juckreiz, Brennen, Stechen und Schmerzen in der Haut unmittelbar nach Lichteinwirkung. Objektive Symptome: diffuse Erytheme und Ödeme; seltener Petechien und Purpura. Sehr selten Bläschen/Blasen. Lichenifikation, postinflammatorische Hyperpigmentierung, Narbenbildung; narbenähnliche Hyalinosen (Nasenrücken, Fingerknöchel). Komplikationen: Cholelithiasis, Leberversagen. | Aminolävulinsäuresynthase 2 | ALAS2; Xp11.21 | XD |
| Akute intermittierende Porphyrie | Häufigste akute Porphyrie; 0,5–1 pro 100 000 | 3. bis 4. Lebensdekade; üblicherweise nicht vor der Pubertät | Akute neurologische Attacken; keine Hauveränderungen; mögliche Komplikation: hepatozelluläres Karzinom | Porphobilinogendesaminase; | PBGD; 11q23.3 | AD |
| ALA-Dehydratase- Defizienz- Porphyrie | Extrem selten | Variabel; Manifestation im Kindes- und Erwachsenenalter beschrieben | Akute neurologische Attacken; keine Hauveränderungen | Aminolävulinsäuredehydratase | ALAD; 9q34 | AR |
Porphyria cutanea tarda (PCT)
Die Porphyria cutanea tarda (PCT; MIM 176090 und 176100) ist die einzige Porphyrie, bei der neben einer hereditären Variante auch eine akquirierte Form unterschieden werden muss [11]. Die Erkrankung wurde im Jahr 1937 erstmalig von Waldenström beschrieben [12]. Mit einer geschätzten Prävalenz von 1 : 10 000 handelt es sich um die weltweit am häufigsten vorkommende Porphyrie [13].
Es werden mindestens zwei, von einigen Autoren jedoch auch drei verschiedene Varianten der PCT unterschieden. Als Ursache gemeinsam ist allen Formen eine enzymatische Defizienz der Uroporphyrinogenkarboxylase (UROD), das fünfte Enzym der Hämbiosynthese (Abbildung 1). Bei der erworbenen Form, die auch als sporadische oder PCT Typ I bezeichnet wird, liegt eine auf etwa 20 % erniedrigte UROD-Enzymaktivität ausschließlich in der Leber vor. Im Gegensatz hierzu besteht bei der hereditären PCT (Synonyme: familiäre PCT oder PCT Typ II), die autosomal-dominant vererbt wird, auf Grund heterogener Keimbahnmutationen im für die UROD kodierenden gleichnamigen UROD-Gen eine um etwa 50 % reduzierte Enzymaktivität in allen Geweben und zusätzlich eine auf etwa 20 % reduzierte residuale hepatische UROD-Aktivität. Bei der PCT Typ III, die nur selten beschrieben worden ist, findet sich eine familiäre Häufung der Erkrankung bei etwa auf 20 % erniedrigter hepatischer UROD-Aktivität, normaler UROD-Aktivität in den extrahepatischen Geweben und fehlendem Nachweis einer Mutation im UROD-Gen [14]. Das Verhältnis der PCT Typ I zur PCT Typ II liegt bei etwa 4 : 1.
Über die eingeschränkte UROD-Defizienz hinaus ist allerdings auch der Einfluss zusätzlicher Realisationsfaktoren zur Manifestation klinischer Symptome erforderlich. Zu diesen Suszeptibilitätsfaktoren gehören erhöhte Serumeisen-Spiegel, Alkohol- und Nikotinabusus, Hepatitis-C-Virusinfektionen, Mutationen im Hämochromatose (HFE)-Gen, Östrogene und HIV-Infektionen [10, 11, 15].
Die PCT verläuft in der Regel chronisch oder chronisch-rezidivierend und manifestiert sich meistens im mittleren Erwachsenalter ab der 5. Lebensdekade, wobei Frauen und Männer gleichermaßen betroffen sind. Klinisch finden sich Primäreffloreszenzen in Form von Bläschen und Blasen auf erythematösem Grund und Sekundäreffloreszenzen wie Erosionen, Krusten, Milien, hyper- und hypopigmentierten Narben (Abbildung 3). Darüber hinaus entwickeln einige Patienten eine Hypertrichose und eine Pseudo-Sklerodermie, die durch gelblich-weißliche, wachsartig anmutende sklerodermiforme Papeln und Plaques charakterisiert ist [16, 17]. Auch kann es zu Kalzifikationen und einer diffusen aktinischen Elastose im Gesichtsbereich kommen. Mit den Hautsymptomen gehen oftmals auch Eisen- und Hämosiderinablagerungen in der Leber einher, was in den früher oft durchgeführten Leberbiopsien durch eine Rotfluoreszenz des Leberstanzzylinders reflektiert wird [10, 11].
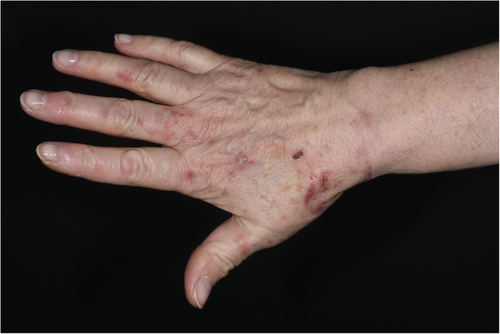
Differenzialdiagnostisch muss die PCT von anderen blasenbildenden Porphyrie-Varianten abgegrenzt werden, insbesondere von der Pseudoporphyria cutanea tarda (bullöse Photosensitivitätsreaktion, die klinisch und histologisch einer PCT gleicht, jedoch nicht mit pathologischen Veränderungen der Urin- oder Serumporphyrine einhergeht), der Porphyria variegata, der hereditären Koproporphyrie und milden Formen der hepatoerythropoetischen Porphyrie. Darüber hinaus sollten Epidermolysis bullosa acquisita, polymorphe Lichtdermatose, bullöse photoaggravierte Arzneimittelreaktionen, bullöse phototoxische Kontaktdermatitis und Hydroa vacciniformia ausgeschlossen werden [4, 11, 16, 17].
Laborchemisch resultiert aus gesteigerter Eisenablagerung in verschiedenen Organen ein Anstieg des Eisenspiegels im Serum sowie des Ferritins und Transferrins. Im Urin der Patienten findet sich eine deutliche Erhöhung der Gesamtporphyrine, des Uroporphyrins und der hochkarboxylierten Porphyrine, wobei der Nachweis heptakarboxylierter Porphyrine ebenso wie der von Isokoproporphyrin im Stuhl pathognomonisch für die Erkrankung ist. Zur Abgrenzung der PCT Typ II von den übrigen Formen kann eine molekulargenetische Untersuchung zum Nachweis einer Mutation im UROD-Gen durchgeführt werden [9].
Nach Diagnose einer PCT sollten die Patienten zunächst über die bekannten Triggerfaktoren aufgeklärt und auf die Bedeutung einer ausreichenden Photoprotektion hingewiesen werden. Hierzu ist am besten eine Bekleidung mit langen Ärmeln und Hosenbeinen sowie ein lichtundurchlässiger breitkrempiger Hut geeignet. Nur Sonnenschutzpräparate mit physikalischen Lichtfiltern sind für die topische Prophylaxe geeignet und sinnvoll. Alkoholgenuss und Nikotinkonsum sollten eingestellt werden, die Einnahme von Hormonen auf ihre medizinische Notwendigkeit hin kritisch überprüft werden [4, 11, 17].
Zur aktiven Behandlung der PCT stehen zwei Therapiestrategien zur Verfügung. Die Phlebotomie nach Ippen ist seit Jahrzehnten etabliert [18]. Obwohl verschiedene Schemata existieren und propagiert werden, empfiehlt es sich, die Aderlässe in 14-tägigen Intervallen mit jeweils 400–500 ml Blut durchzuführen, bis sich keine neuen Blasen mehr bilden, eine klinische Remission eingetreten ist und das Serum-Ferritin bei ∼40–50 ng/ml liegt [19]. Hierbei sollte berücksichtigt werden, dass sich die kutanen Symptome in der Regel weit vor der Normalisierung der Laborwerte zurückbilden [10]. Neben der Phlebotomie kann auch eine niedrigdosierte Hydroxychloroquin-Therapie mit 100 mg zweimal pro Woche durchgeführt werden. Hydroxychloroquin bewirkt eine verstärkte Ausscheidung von in der Leber akkumulierendem Uroporphyrin und hochkarboxylierten Porphyrinen über den Urin, indem es die Wasserlöslichkeit dieser Metaboliten erhöht. Diese Dosierung sollte streng eingehalten werden, da eine Überdosierung die Erkrankung unterhält oder sogar verschlechtern kann. Vor und während der Hydroxychloroquin-Behandlung sollte die Porphyrin-Exkretion im Urin als Ausgangswert bestimmt und im Krankheitsverlauf regelmäßig in zweimonatigen Intervallen kontrolliert werden. Auch unter dieser Therapie stellt sich die klinische Remission vor der biochemischen Normalisierung der Porphyrinausscheidung ein [10]. Die mittlere Behandlungsdauer beträgt neun bis zwölf Monate [11, 17]. Das früher ebenfalls verwendete und sehr gut wirksame Chloroquin [10, 11] wurde vom Hersteller im Juli 2019 vom deutschen Markt genommen und steht daher leider nicht mehr für die Behandlung der PCT zur Verfügung. Bezüglich der insbesondere für betroffene Frauen sehr unangenehmen Hypertrichose stehen derzeit keine Behandlungsoptionen zur Verfügung.
Mögliche Komplikationen der PCT sind zum einen Leberzirrhose, die als langfristige Leberschädigung auf Grund der Akkumulation von Porphyrinen in den Hepatozyten entsteht. Die abgelagerten Porphyrine imponieren histologisch als doppelbrechende nadelförmige Einschlüsse in den Leberzellen [20]. Prophylaktisch sind daher regelmäßige Vorsorgeuntersuchungen wie eine Oberbauchsonographie und die Bestimmung des Alpha-1-Fetoprotein zu empfehlen. Hohe Konzentrationen dieses Glykoproteins können auch auf die Entwicklung eine hepatozellulären Karzinoms hinweisen, das mehrfach bei der PCT beschrieben worden ist [21, 22].
Erythropoetische Protoporphyrie
Die Erythropoetische Protoporphyrie (EPP; MIM 177000) ist die zweithäufigste kutane Porphyrie und die häufigste sich bereits im Kindesalter manifestierende Porphyrie-Variante. Die Erkrankung wurde erstmals von Kosenow und Treibs im Jahr 1953 bei einem Kind mit gesteigerter Photosensitivität und Akkumulation von Porphyrinen im Blut beschrieben [23]. Erst acht Jahre später ordneten Magnus et al. das Krankheitsbild unter dem Namen EPP der Gruppe der Porphyrien zu [24]. Die Erkrankung hat eine geschätzte Prävalenz von 1 zu 130 000 und kommt bei weiblichen und männlichen Individuen gleichhäufig und in allen Ethnien vor [1, 2].
Die autosomal-semidominant vererbte EPP wird durch eine partielle Defizienz des achten Enzyms des Hämbiosynthesewegs verursacht, der Ferrochelatase (FECH). Der FECH-Mangel führt zu einer massiven Anhäufung von lipophilem Protoporphyrin (PP) in der Haut, in den Erythrozyten, in der Leber, und in anderen Organen. Protoporphyrin ist ein metallfreies Porphyrin, das ein Absorptionsmaximum im blauen Wellenlängenbereich des sichtbaren Lichts zwischen 400 und 410 nm (Soret-Bande) aufweist und als Photosensibilisator wirkt [1, 25, 26].
Die enzymatische Dysfunktion der FECH wird zum einen durch heterozygote Mutationen im gleichnamigen FECH-Gen verursacht. Diese Mutationen auf dem einen elterlichen Allel allein führen jedoch nur zu einer Verminderung der residualen Enzymaktivität von lediglich ∼ 50 %, was für die Ausbildung klinischer Symptome nicht ausreichend ist. Erst bei einer zusätzlichen Reduktion der FECH-Aktivität um weitere 30–35 % durch einen FECH-Polymorphismus in trans auf dem zweiten elterlichen Allel und einer daraus resultierenden Restaktivität der FECH von lediglich 15–20 % manifestiert sich die Erkrankung klinisch [27-29].
Bereits im Kleinkindalter werden die Patienten nach kurzem Aufenthalt im Freien und Kontakt mit sichtbarem und UV-Licht unruhig und beklagen innerhalb von Minuten nach der Lichtexposition Juckreiz, Brennen, Stechen und Schmerzen in der Haut. Die Herausforderung bei der EPP ist, dass die subjektiven Symptome der meist kleinen Patienten zum Zeitpunkt der Erstmanifestation in Diskrepanz zu den objektivierbaren Zeichen an der Haut stehen, die sich oftmals erst eine halbe Stunde bis mehrere Stunden nach Lichteinwirkung einstellen und auch dann diskret und kaum wahrnehmbar sein können [30]. Die subjektiven Symptome der akuten Photosensibilität werden von diffusen Erythemen und Ödemen an den sonnenexponierten Körperarealen begleitet (Abbildung 4a). Seltener hingegen entwickeln sich Petechien und eine Purpura (Abbildung 4b) [25, 26, 31]. Die phototoxische Reaktion geht in der Regel ohne Bildung von Bläschen oder gar Blasen einher, und nur wenn die Betroffenen über längere Zeiträume hinweg gezwungenermaßen in der Sonne verbleiben (müssen), weil ihre subjektiven Beschwerden schlichtweg von den sie umgebenden Erwachsenen nicht ernst genommen oder die Kinder gar als Simulanten und „Quälgeister“ abgetan werden, kann es sehr selten auch zur Entwicklung von Vesiculae und Bullae kommen, ähnlich dem Reaktionsmuster bei einer schweren Dermatitis solaris. Die Symptome treten vornehmlich im Frühjahr und Sommer auf, und durch die in aller Regel über mehrere Jahre hinaus verzögerte Diagnosestellung kann die kontinuierliche Lichtexposition zu Lichenifikation, postinflammatorischer Hyperpigmentierung und Narbenbildung führen. Pathognomonisch ist in diesem Zusammenhang die Entwicklung narbenähnlicher Hyalinosen, insbesondere über den Fingerknöcheln und am Nasenrücken (Abbildung 4c) [25, 26, 30].
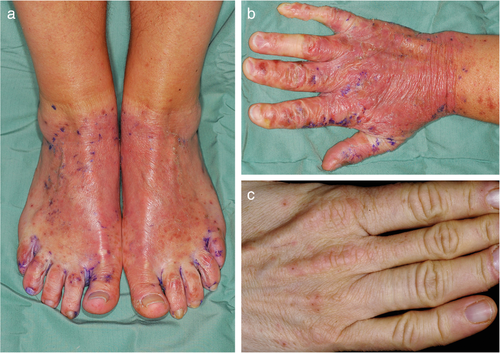
Differenzialdiagnostisch muss die EPP in erster Linie von der X-chromosomal dominanten Protoporphyrie abgegrenzt werden, was allein auf Basis der klinischen Symptome nicht möglich ist. Darüber hinaus kommen andere durch eine erhöhte Photosensitivität charakterisierte Erkrankungen in Betracht, wie die Urticaria solaris, die polymorphe Lichtdermatose, phototoxische oder photoallergische Dermatitiden, das Bloom-Syndrom und das Rothmund-Thompson-Syndrom [32].
Diagnostisch zeigt sich im Plasma-Scan ein charakteristisches Emissionsmaximum bei 634 nm. Im Stuhl und im Blut findet sich ein deutlicher Anstieg des PP, wobei auch eine alleinige Untersuchung des Bluts ausreichend ist. Eine Urinanalyse kann bei führender Diagnose einer EPP unterbleiben, da PP lipophil ist und nicht mit dem Urin ausgeschieden wird. Bei Bestimmung der residuellen FECH-Aktivität findet sich eine auf 15–25 % des Normalwerts erniedrigte Enzymaktivität. Zur Abgrenzung von der X-chromosomal dominanten Protoporphyrie kann eine molekulargenetische Analyse des FECH-Gens durchgeführt werden [32, 33].
In der Akutsituation mit Juckreiz, Brennen und Schmerzen in der Haut sollten die Patienten dunkle Räumlichkeiten ohne Lichteinfall aufsuchen und die betroffenen Körperregionen ausreichend kühlen, entweder unter fließendem Wasser oder mit feuchten Kompressen beziehungsweise Kühlpackungen. Therapeutisch steht derzeit Afamelanotid (Scenesse®), ein synthetisches Analog des α-Melanozyten stimulierenden Hormons, als effektives Medikament für die Prävention der Phototoxizität bei Erwachsenen mit EPP zur Verfügung [32, 34]. Es besitzt eine Zulassung zur Behandlung ab dem 18. Lebensjahr, wodurch es jedoch ausgerechnet denjenigen verwehrt bleibt, die es auf Grund des frühen Manifestationsalters der Erkrankung eigentlich am dringendsten benötigen: Kinder und Jugendliche. Ein weiterer Wermutstropfen ist die seit Jahren unverändert restriktive Politik des Herstellers bezüglich der streng selektionierten Gruppe von Ärzten, die das Medikament, das in Form eines Implantats alle zwei Monate subkutan appliziert wird, anwenden dürfen. Hier gilt, dass Afamelanotid nur von auf die EPP spezialisierten Ärzten in anerkannten Porphyrie-Zentren verordnet und auch nur von einem Arzt implantiert werden darf, der vom Zulassungsinhaber in der Applikation des Implantats geschult und akkreditiert worden ist. Diese Restriktionen hatten und haben zur Folge, dass derzeit nicht alle erwachsenen EPP-Patienten in Deutschland eine Behandlung mit Afamelanotid erhalten können, da die Kapazitäten der wenigen Zentren beschränkt sind.
Von einer systemischen Behandlung mit β-Carotin oder Vitamin E und C, denen in einigen früheren Veröffentlichungen positive Effekte nachgesagt wurden, muss abgeraten werden, da diese Wirkstoffe allenfalls eine geringe und nicht reproduzierbare Wirkung haben [32].
Zu den möglichen Komplikationen der EPP gehören eine Cholelithiasis, eine Leberzirrhose mit Leberinsuffizienz und als schwerste Komplikation ein fulminantes und terminales Leberversagen. Diesbezüglich sollten zur Vorsorge regelmäßige Laborkontrollen der Leber- und Cholestaseparameter sowie jährlich eine Oberbauchsonographie durchgeführt werden. Allen zuvor genannten komplizierenden Krankheitsbildern liegt eine massive Anhäufung von wasserunlöslichem PP in den abführenden Gallengängen und in der Leber zu Grunde [25, 35].
Porphyria variegata
Die Porphyria variegata (PV; MIM 176200) ist die häufigste neurokutane Porphyrie und durch eine große klinische Variabilität und genetische Heterogenie gekennzeichnet. Die auch unter den Synonymen mixed hepatic porphyria und südafrikanische Porphyrie bekannte Erkrankung wurde erstmalig im Jahr 1951 von Barnes beschrieben [36]. Die allgemeine Inzidenz und Prävalenz der PV ist nicht bekannt, jedoch wird die Inzidenz in der hellhäutigen Bevölkerung Südafrikas auf Grund eines sogenannten Gründereffekts auf etwa 3 : 1000 geschätzt [37, 38].
Die Erkrankung wird autosomal-dominant vererbt und beruht auf einer Dysfunktion des siebten Enzyms der Hämbiosynthese, der Protoporphyrinogenoxidase (PPOX) Die katalytische Defizienz dieses Enzyms resultiert aus in der Regel heterozygoten, in seltenen Fällen auch gemischt heterozygoten oder homozygoten Mutationen im gleichnamigen PPOX-Gen [39, 40].
Klinisch manifestiert sich die PV in der Regel erst mit Einsetzen der Pubertät, wobei sich Hautveränderungen an den lichtexponierten Arealen des Körpers und/oder akute neurologische und psychiatrische Symptome entwickeln können. An der Haut finden sich seltener Primäreffloreszenzen in Form intakter Bläschen und Blasen als vielmehr Sekundäreffloreszenzen wie Erosionen, Krusten, Milien und Narben. Ebenso wie bei der PCT wird regelmäßig eine vor allem fazial lokalisierte Hypertrichose beobachtet (Abbildung 5) [8, 41, 42]. Der neurologisch-psychiatrische Symptomenkomplex kann sich als akute Porphyrieattacke unabhängig von den Hautveränderungen oder aber auch gemeinsam mit diesen manifestieren. Das Leitsymptom sind Bauchschmerzen, die mit Übelkeit, Erbrechen, Diarrhoe (aber auch Obstipation), Parästhesien, motorischen und sensorische Ausfällen und Lähmungserscheinungen bis hin zur Para- und Tetraplegie einhergehen können.
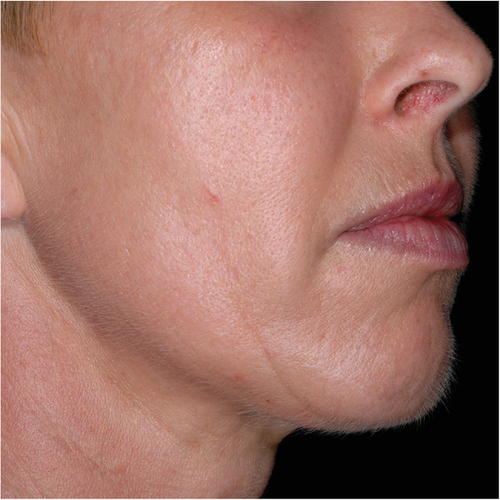
Differenzialdiagnostisch können die Hautveränderungen nicht von denen anderer blasenbildender Porphyrien wie der PCT, hereditären Koproporphyrie und milder Varianten der hepatoerythropoetischen oder kongenitalen erythropoetischen Porphyrie unterschieden werden. Ebenso wenig lassen sich die neuropsychiatrischen Symptome von denen der akuten intermittierenden Porphyrie, hereditären Koproporphyrie oder der ALA-Dehydratase-Defizienz Porphyrie abgrenzen. Darüber hinaus können alle sich unter dem Bild eines akuten Abdomens manifestierenden Erkrankungen sowie zahlreiche neurologische und/oder psychiatrische Krankheitsbilder eine akute Porphyrie beziehungsweise eine akute Porphyrieattacke imitieren [7, 8, 41].
In der Diagnostik der PV wurde schon im Jahr 1980 ein charakteristisches Fluoreszenzemissionsmaximum bei 625–626 nm im Rahmen der spektralphotometrischen Untersuchung des Plasmas betroffener Patienten beschrieben [43]. Diese pathognomonische Plasmaemissionsspitze ist bei symptomatischen erwachsenen Patienten für die Unterscheidung von der PCT und den anderen akuten Porphyrien ausreichend spezifisch. Bei Kindern und nichtsymptomatischen Erwachsenen hingegen ist der Plasma-Scan nicht hinreichend sensitiv [41]. In der Urinanalyse zeigt sich im Rahmen einer akuten Porphyrieattacke eine mäßig bis stark erhöhte Ausscheidung der Porphyrin-Vorläufer ALA und PBG, wobei die PV dadurch nicht von den übrigen Formen der akuten Porphyrien unterschieden werden kann. Hierzu kann nur eine Stuhlanalyse mit Nachweis einer erhöhten Ausscheidung von Proto- und Koproporphyrin beitragen, wobei üblicherweise das Protoporphyrin höhere Werte aufweist als das Koproporphyrin. Sind die biochemischen Untersuchungsergebnisse nicht wegführend, kann eine molekulargenetische Analyse mit Sequenzierung des PPOX-Gens angeschlossen werden [8, 33, 41].
-
Identifikation und Elimination möglicher porphyrinogener Triggerfaktoren.
-
Initial gegebenenfalls intensivmedizinische Überwachung und suffiziente supportive Therapie mit Analgetika, Antiemetika, Neuroleptika und Antihypertensiva.
-
Spezifische Therapie mit intravenös applizierten Häm-Präparaten: in Europa mit Hämin-Arginat (Normosang®), in den USA, Süd- und Mittelamerika mit Hämin (Panhematin®).
-
Als neue Behandlungsoption für die Prophylaxe rekurrenter Porphyrieattacken steht Givosiran (Givlaari®) zur Verfügung, dessen Wirkung auf der RNA-Interferenz beruht und in klinischen Studien eine hohe Wirksamkeit gezeigt hat [44]. Es blockiert die ALA-Synthase, und somit den geschwindigkeitsbestimmenden Schritt der Hämbiosynthese. Unter Anwendung von Givosiran ist von mehreren Autoren die Entwicklung einer schweren Homozysteinämie beschrieben worden [45-47].
Als mögliche Komplikationen kann im Rahmen einer akuten Porphyrieattacke eine Lähmung der Atemhilfsmuskulatur mit Übergang in ein respiratorisches Koma auftreten, weshalb die akuten Porphyrien ein potenziell lebensbedrohliches Krankheitsbild darstellen, das einer sofortigen therapeutischen Intervention bedarf [1, 4, 7, 41].
Zusammenfassung
Allen Porphyrien liegt eine katalytische Dysfunktion spezifischer Enzyme der Hämbiosynthese zugrunde. Die enzymatische Defizienz hat eine Akkumulation einzelner oder mehrerer Stoffwechselprodukte wie Porphyrinvorstufen und/oder Porphyrine zur Folge, die nach Induktion durch verschiedene Auslösefaktoren zyto- und gewebetoxische Effekte entfalten können. Klinisch äußern sich diese Effekte durch Hautveränderungen wie bei den hier vorgestellten kutanen Porphyrien PCT und EPP oder durch variable kutane und/oder neurologische Symptome wie bei der hier exemplarisch für die neurokutanen Porphyrien im Detail beschriebenen PV. In der Diagnostik steht die biochemische Untersuchung von Urin, Blut und Stuhl im Vordergrund, die falls erforderlich durch eine molekulargenetische Diagnostik komplementiert werden kann. Die exakte Diagnosestellung ist von entscheidender Bedeutung für die Differenzierung einzelner Porphyrie-Formen und die Einleitung spezifischer Therapiemaßnahmen.
Danksagung
Wiebke Muschalek wurde durch ein Reisestipendium der Deutschen Dermatologischen Gesellschaft (DDG) zur Teilnahme an der DDG-Tagung 2020 in Dresden unterstützt.
Matthias A. Hermasch wurde unter anderem durch ein Stipendium des Göttinger Promotionskollegs für Medizinstudierende unterstützt, das durch die Else-Kröner-Fresenius-Stiftung (2017_Promotionskolleg.04), Bad Homburg, gefördert wird. Weitere Unterstützung erhielt er durch ein Stipendium der Deutschen Stiftung Dermatologie, Berlin, sowie ein Stipendium der Studienstiftung des deutschen Volkes. Darüber hinaus hat er das Kurt und Eva Herrmann-Stipendium der Alfred-Marchionini-Stiftung erhalten.
Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Interessenkonflikt
J.F. erklärt, dass er sich bei der Erstellung des Beitrages nicht von wirtschaftlichen Interessen leiten ließ. Er legt die folgenden potenziellen Interessenkonflikte offen:
Er hat von den Firmen Genzyme und Shire Vortragshonorare und eine finanzielle Unterstützung für den 2. Weltkongresses für Genodermatologie im Jahr 2011 in Maastricht, Niederlande, erhalten. Er hat von den Firmen Roche, Bristol-Myers Squibb, Novartis, MSD und Orphan Europe Germany GmbH Vortragshonorare und finanzielle Unterstützung zur Durchführung von Fortbildungsveranstaltungen erhalten. Darüber hinaus hat er von der Firma Clinuvel eine Reisekostenunterstützung zur Teilnahme am 23. Weltkongress für Dermatologie in Vancouver, Kanada, erhalten und war als Studienleiter an zwei klinischen Studien der Phase 2 und 3 der Firma Clinuvel beteiligt. Er hat für die Organisation und Durchführung des Weltkongresses für Porphyrie-Erkrankungen 2015 (International Congress on Porphyrins and Porphyrias 2015) finanzielle Unterstützung von den Firmen Alnylam Pharmaceuticals, Orphan Europe, Clinuvel Pharmaceuticals, La Roche-Posay und Lilly Deutschland GmbH erhalten. Ferner hat er von Alnylam Pharmaceuticals Honorare für die Teilnahme an Advisory Board-Veranstaltungen erhalten. W.M., M.A.H. und P.P.-G. geben keine Interessenkonflikte an.
Literatur
CME Questions/Lernerfolgskontrolle
- Welche der nachfolgend genannten Untersuchungen ist in der Diagnostik der kutanen Porphyrien nicht wegführend und sollte daher heutzutage unterbleiben?
- Inspektion, Eigen-/Fremdanamnese
- Hautbiopsie
- Biochemische Untersuchungen
- Enzymatische Untersuchungen
- Molekulargenetische Untersuchungen
- Welches Untersuchungsmaterial benötigen Sie nicht, um eine Porphyrie-Erkrankung zu diagnostizieren?
- Plasma
- Stuhl
- Blut
- Liquor
- Urin
- In der Haut abgelagerte Porphyrine können unter Einfluss von UV-Licht eine phototoxische Reaktion auslösen. Welche der nachfolgenden Symptome/klinischen Veränderungen werden bei den Porphyrien üblicherweise nicht durch diese Reaktion verursacht?
- Brennende Schmerzen
- Blasen
- Erythem
- Hauttumoren
- Ödem
- Welche Porphyrie-Variante ist weltweit die häufigste?
- Kongenitale erythropoetische Porphyrie
- Porphyria variegata
- Akute intermittierende Porphyrie
- Hepatoerythropoetische Porphyrie
- Porphyria cutanea tarda
- Welche der nachfolgend genannten Porphyrie-Varianten manifestiert sich üblicherweise nicht bereits im Kindesalter?
- Hepatoerythropoetische Porphyrie
- Porphyria cutanea tarda
- Erythropoetische Protoporphyrie
- X-chromosomal dominante Protoporphyrie
- Kongenitale erythropoetische Porphyrie
- Neben einer Genmutation bedarf es oft triggernder Faktoren, um bei der Porphyria cutanea tarda klinische Symptome auszulösen. Welcher Faktor gehört nicht dazu?
- Alkohol
- Östrogene
- Hepatitis-B-Virusinfektion
- Erhöhtes Serum-Eisen
- UV-Licht
- Bei welcher Porphyrie-Erkrankung treten nie Hautveränderungen auf?
- Porphyria variegata
- Akute intermittierende Porphyrie
- Hereditäre Koproporphyrie
- Hepatoerythropoetische Porphyrie
- Kongenitale erythropoetische Porphyrie
- In der Haut abgelagerte Porphyrine absorbieren Licht einer bestimmten Wellenlänge (Soret-Bande) und werden dadurch angeregt. Die Soret- Bande befindet sich im Wellenlängen-Bereich von …
- 200–250 nm
- ∼ 300 nm
- 340–370 nm
- 400–410 nm
- 450–500 nm
- Bei welcher der nachfolgend genannten Porphyrie-Erkrankungen können sich sowohl kutane als auch akute neurologische Symptome entwickeln?
- Porphyria cutanea tarda
- Akute intermittierende Porphyrie
- Kongenitale erythropoetische Porphyrie
- Porphyria variegata
- Erythropoetische Protoporphyrie
- Welche dieser Therapieoptionen bietet derzeit die beste Behandlungsmöglichkeit bei der erytheropoetischen Protoporphyrie?
- Anwendung topischer Lichtschutzpräparate
- Umstellung des Tag-Nacht-Rhythmus
- Afamelanotid
- β-Carotin
- Regelmäßige Aderlässe (400–500 ml)
Liebe Leserinnen und Leser, der Einsendeschluss an die DDA für diese Ausgabe ist der 31. Mai 2022. Die richtige Lösung zum Thema „Häufige Nagelerkrankungen: Diagnostik und Therapie“ in Heft 12 (Dezember 2021) ist: 1e, 2e, 3e, 4d, 5e, 6a, 7a, 8e, 9c, 10b.
Bitte verwenden Sie für Ihre Einsendung das aktuelle Formblatt auf der folgenden Seite oder aber geben Sie Ihre Lösung online unter http://jddg.akademie-dda.de ein.