Arzneimittelexantheme unter modernen zielgerichteten Therapien – Immuncheckpoint- und EGFR-Inhibitoren
Redaktion
Prof. Dr. Trautinger, St. Pölten
Der zunehmende Einsatz moderner zielgerichteter Therapien führt zum Auftreten neuartiger kutaner Nebenwirkungen, die es zu erkennen und therapieren gilt.
Immuncheckpoint-Inhibitoren und EGFR-Inhibitoren sind häufig eingesetzte zielgerichtete Therapien, die jeweils mit einem spezifischen kutanen Nebenwirkungsprofil verbunden sind.
Kutane Nebenwirkungen sind die am frühesten auftretenden immunvermittelten Nebenwirkungen unter Immuncheckpoint-Inhibitor-Therapie.
Immunvermittelte kutane Nebenwirkungen beeinträchtigen die Fortführung der Immuntherapie zumeist nicht.
Unter Immuncheckpoint-Inhibitoren treten am häufigsten unspezifische makulopapulöse Exantheme auf, die klinisch klassischen makulopapulösen Arzneimittelexanthemen ähneln.
Lichenoide Arzneimittelexantheme können mehrere Monate nach Therapieeinleitung auftreten. Eine sichere klinische oder histopathologische Unterscheidung vom idiopathischen exanthematischen Lichen ruber ist nicht möglich.
Die Erstmanifestation oder Verschlechterung einer Psoriasis ist eine bekannte Nebenwirkung unter PD-1/PD-L1- Therapie.
Ein Immuntherapie-assoziiertes bullöses Pemphigoid tritt im Vergleich zu anderen kutanen Nebenwirkungen zeitlich verzögert, durchschnittlich rund sechs Monate nach Therapiebeginn auf.
Bei therapierefraktären pruritischen Veränderungen unter Immuntherapie ist differenzialdiagnostisch an ein bullöses Pemphigoid im präbullösen Stadium zu denken.
Bullöse lichenoide Exantheme sind eine wichtige Differenzialdiagnose schwerer bullöser Arzneimittelreaktionen (SJS/TEN) unter Immuntherapie, die äußerst seltene Nebenwirkungen sind.
Bei Patienten mit allogener Stammzelltransplantation und Immuntherapie können makulopapulöse Exantheme Zeichen einer akuten GvHD sein, die häufig von einer Hepatopathie und gastrointestinalen Symptomatik begleitet wird.
Bei ausgeprägten, therapieresistenten oder atypischen Exanthemen werden Hautbiopsie und fallspezifische Laboruntersuchungen zur besseren ätiologischen Einordnung empfohlen.
Bei Exanthemen mit Betonung photoexponierter Areale sind Kollagenose-assoziierte Exantheme in Betracht zu ziehen.
Die meisten kutanen irAE sind mild (Grad I/II), durch frühzeitige adäquate Lokaltherapie gut beherrschbar und beeinträchtigen die Fortführung der Immuntherapie nicht.
Die Hauptsäulen der Therapie stellen topische Glukokortikoiden bei milden und systemische Glukokortikoide bei schweren Exanthemen dar. Eine Unterbrechung der Immuntherapie ist bei persistierenden und schweren Exanthemen (Grad ≥ III) notwendig.
Die anhaltenden immunologischen Effekte der Immuntherapie bedingen nicht selten einen protrahierten Verlauf der kutanen irAE auch nach Beendigung der Therapie.
Bei spezifischen dermatologischen Manifestationen können entsprechende zielgerichtete und immunmodulierende Therapieansätze zum Einsatz kommen. Hierzu eignen sich beispielsweise die Phototherapie und Retinoide bei psoriasiformen und lichenoiden Exanthem sowie Dapson oder Doxycyclin für das bullöse Pemphigoid.
Der EGFR ist ein wichtiger Regulator der kutanen Homöostase und jeglicher Eingriff im EGFR-Signalweg kann zu dem typischen kutanen Nebenwirkungsspektrum führen.
Die häufigste kutane Nebenwirkung stellen papulopustulöse Exantheme dar. Zudem können Exsikkationsekzeme, Paronychien und Haarveränderungen vorkommen.
Papulopustulöse Exantheme treten bei bis zu 90 % der Patienten unter EGFRI-Therapie auf, besonders häufig bei dem Einsatz von monoklonalen Antikörpern und Afatinib.
Typisch ist das Auftreten von papulopustulösen Hautveränderungen in den seborrhoischen und UV-exponierten Arealen in den ersten zwei Therapiewochen.
Therapieadhärenz und Lebensqualität der Patienten können aufgrund der belastenden Symptome leiden, sodass eine Aufklärung über das Krankheitsbild und prophylaktische Maßnahmen bereits bei Therapiebeginn dringend notwendig sind.
Bei Substanzen mit hoher Inzidenz an papulopustulösen Exanthemen erscheint eine Tetrazyklin-Prophylaxe mit EGFRI-Therapiebeginn für zumindest acht Wochen sinnvoll, während bei Tyrosinkinasehemmern mit niedrigem Exanthemrisiko auch eine zuwartende Strategie gerechtfertigt sein kann.
Die Hauptsäulen der Therapie stellen antibiotische und steroidhaltige Externa sowie systemische Tetrazykline dar.
Zusammenfassung
Der zunehmende Einsatz moderner zielgerichteter Therapien führt dazu, dass Dermatologen stetig mit neuartigen kutanen Nebenwirkungen dieser Substanzen konfrontiert werden. Eine rasche Diagnose und Therapie sind notwendig, um die planmäßige Fortführung der onkologischen Therapie zu ermöglichen und eine Beeinträchtigung der Lebensqualität der Patienten zu verhindern. Immuncheckpoint- und EGFR-Inhibitoren sind häufig eingesetzte zielgerichtete Therapien mit spezifischen kutanen Nebenwirkungsspektren. Exanthematische Hautveränderungen stellen hierbei eine besondere diagnostische Herausforderung dar. Immuncheckpoint-Inhibitoren können vielfältige immunvermittelte kutane Nebenwirkungen hervorrufen; am häufigsten sind dies makulopapulöse, lichenoide oder psoriasiforme Exantheme. Das Auftreten bullöse Autoimmundermatosen und Kollagenose-assoziierter Exantheme ist möglich. Bei atypischen, ausgeprägten oder therapieresistenten exanthematischen Hautveränderungen ist eine dermatologische Abklärung inklusive Hautbiopsie zur genauen Einordnung indiziert. Die Hauptsäule der Therapie stellen topische und systemische Glukokortikoide dar. Unter EGFR-Inhibitor-Therapie sind papulopustulöse Exantheme die häufigste kutane Nebenwirkung, die je nach Substanz bei bis zu 90 % der Patienten innerhalb der ersten beiden Therapiewochen auftreten. Neben topischen Antibiotika und Glukokortikoiden sind systemische Tetrazykline die Therapie der ersten Wahl und können auch prophylaktisch eingesetzt werden.
Einleitung
Die Entwicklung moderner zielgerichteter Therapeutika erweiterte in den letzten beiden Jahrzehnten die therapeutischen Möglichkeiten, insbesondere in der Onkologie. Viele molekulare Angriffspunkte haben sich für eine zielgerichtete Therapie mit small molecules und monoklonalen Antikörpern etabliert. Diese neuen therapeutischen Ansätze führten nicht selten zum Auftreten neuartiger kutaner Nebenwirkungen. Exanthematische Hautveränderungen stellen hierbei wegen der häufig notwendigen Polypharmazie eine besondere Herausforderung dar. Neben benignen Exanthemen bei Spättypreaktionen und den selteneren schweren Arzneimittelexanthemen auf schon bekannte Medikamente, die als CME-Artikel bereits behandelt wurden [1, 2], gilt es somit, neuartige Arzneimittel-assoziierte Exantheme differentialdiagnostisch zu erkennen und zu therapieren. Aufgrund ihres häufigen und zunehmenden Einsatzes im klinischen Alltag fokussiert der folgende CME-Artikel auf Exantheme unter der Therapie mit Immuncheckpoint-Inhibitoren und Inhibitoren des epidermalen Wachstumsfaktorrezeptors (EGFR), deren Differenzialdiagnosen und Therapiemöglichkeiten. Durch frühe Diagnosestellung und adäquate Therapie können diese kutanen Nebenwirkungen häufig gut kontrolliert und damit die Beeinträchtigung der Lebensqualität sowie Unterbrechungen einer effektiven onkologischen Therapie verhindert werden.
Immuncheckpoint-Inhibitoren
Die Blockade inhibitorischer immunologischer Kontrollpunkte mittels Immuncheckpoint-Inhibitoren (CPI) wird in der Onkologie als Immuntherapie bezeichnet und erfährt eine zunehmend breite Anwendung bei diversen malignen Erkrankungen. Immuncheckpoint-Inhibitoren können gegen das cytotoxic T-lymphocyte-associated protein 4 (CTLA-4) oder das programmed cell death protein 1 (PD-1) beziehungsweise dessen Liganden (PD-L1) gerichtet sein. Basierend auf ihrer aktivierenden Wirkung auf das Immunsystem sind sie mit einem neuen und breitgefächerten Spektrum an kutanen immunvermittelten Nebenwirkungen (immune-related adverse events, irAE) assoziiert. Diese treten bei 47–60 % der mit CTLA-4-Inhibitoren und bei 30–40 % der mit PD-1/PD-L1-Inhibitoren behandelten Patienten auf [3]. Regelmäßig manifestieren sich kutane irAE bereits in den ersten Wochen nach Therapiestart, nicht selten bereits nach der ersten Gabe [3, 4]. Kutane irAE sind damit die am häufigsten und am frühesten auftretenden immunvermittelten Nebenwirkungen.
Die Bandbreite möglicher Exantheme unter Immuntherapie ist groß und reicht von diversen entzündlichen Manifestationen bis zu bullösen Formen (Tabelle 1) [5]: Am häufigsten treten unspezifische pruritische makulopapulöse Hautveränderungen auf. Die Exantheme können jedoch auch bekannten entzündlichen Dermatosen ähneln und werden dementsprechend als lichenoide oder psoriasiforme Exantheme bezeichnet. Zudem können exanthematische Hautveränderungen Symptome neu aufgetretener oder demaskierter Autoimmunerkrankungen, beispielsweise eines, sein [6]. Bei bullösen Exanthemen müssen differenzialdiagnostisch vor allem das bullöse Pemphigoid, schwere bullöse Arzneimittelreaktionen sowie bullöse Varianten lichenoider Exantheme bedacht werden [5, 7].
| Durchschnittliche Latenz bis zum Auftreten der Hautveränderungen nach Therapiebeginn (Wochen) | |
|---|---|
| Nichtbullöse Exantheme | |
| Makulopapulöse Exantheme | 2–6 |
| Lichenoide Exantheme | ∼12 |
| Psoriasiforme Exantheme | 0–4 (vorbestehende Psoriasis) ∼12 (Erstmanifestation) |
Kollagenose-assoziierte Exantheme
|
Unbekannt (ab Woche 0 berichtet) ∼10 |
| Morbus-Grover-artige Exantheme | 3–6 |
Auswahl wichtiger Differenzialdiagnosen:
|
|
| Bullöse Exantheme | |
| Bullöses Pemphigoid | ∼24 |
| Bullöse lichenoide Exantheme | ∼12 |
| Stevens-Johnson-Syndrom/toxisch epidermale Nekrolyse | 0–4 (Fälle mit verzögertem Auftreten wurden berichtet) |
Auswahl wichtiger Differenzialdiagnosen:
|
|
Die Schweregradeinteilung erfolgt nach der CTCAE (Common Terminology Criteria for Adverse Events) Klassifikation (Grad I–V) [8]. Die meisten Exantheme unter Immuntherapie sind hierbei als mild einzustufen mit weniger als 3 % höhergradiger (≥ CTCAE-Grad III) Reaktionen bei Mono-Immuntherapie und weniger als 5 % bei kombinierter Immuntherapie (PD-1- und CTLA-4-Inhibitoren) [5, 9, 10]. Auch ausgeprägte Hautveränderungen mit der Notwendigkeit einer dermatologischen fachärztlichen Betreuung führten in lediglich rund 25 % zur Therapieunterbrechung, wovon 16 % der Patienten die Behandlung in weiterer Folge wieder aufnehmen konnten [11].
Das Auftreten kutaner irAE unter Immuntherapie war in mehreren Studien mit besserem Therapieansprechen assoziiert. Dies gilt insbesondere für die Vitiligo bei Patienten mit Melanom. Einige Studien deuten auf eine ähnlich positive Assoziation Immuntherapie-assoziierter Exantheme mit dem Therapieansprechen hin [12, 13].
Makulopapulöse Exantheme
Unspezifische makulopapulöse Exantheme treten bei 10–25 % der Patienten in den ersten 2–6 Wochen nach Therapiestart und gelegentlich bereits nach der ersten CPI-Verabreichung auf. Unter kombinierter Immuntherapie und CTLA-4-Inhibitoren werden sie häufiger und früher als unter Therapie mit PD-1/PD-L1-Inhibitoren beobachtet. Der Verlauf ist zumeist mild. Klinisch finden sich stammbetonte hellrote Maculae und Papeln mit regelmäßiger Aussparung des Gesichtes sowie der Hand- und Fußflächen. Die Hautveränderungen können mit Pruritus sowie milder Schuppung einhergehen [5]. Histopathologisch zeigt sich häufig ein lymphozytäres perivaskuläres Infiltrat in der superfiziellen Dermis, gelegentlich mit Eosinophilen und Spongiose [14]. Differenzialdiagnostisch müssen häufige alternative medikamentöse Auslöser makulopapulöser Arzneimittelexantheme, beispielsweise Antibiotika, durch eine gründliche Medikamentenanamnese berücksichtigt werden. Zudem können unspezifische makulopapulöse Hautveränderungen initiale Manifestationen spezifischer Exantheme und schwerer Arzneimittelreaktionen sein, sodass Patienten dahingehend observiert werden müssen.
Lichenoide Exantheme
Fallbericht 1: Bei einem 76-jährigen Patienten bestanden seit wenigen Wochen stark juckende generalisierte Hautveränderungen mit Betonung der Streckseiten der oberen und unteren Extremitäten (Abbildung 1). Der Körperstamm war geringgradig betroffen und die Schleimhäute präsentierten sich unauffällig. Aufgrund eines Adenokarzinoms des linken Lungenoberlappens erhielt der Patient eine lokale Radiatio und seit zehn Monaten eine Immuntherapie mit einem PD-1-Inhibitor (Pembrolizumab). Entsprechend seiner internistischen Vorerkrankungen bestand zudem eine langjährig unveränderte Dauermedikation mit Enalapril, Bisoprolol, Acetylsalicylsäure und Fenofibrat.
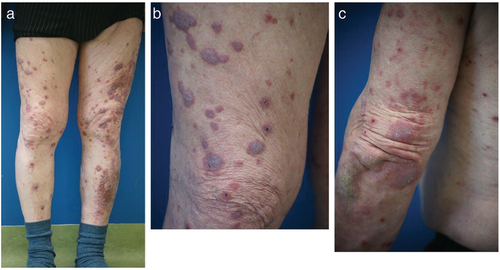
Lichenoide Exantheme sind eine häufige Manifestationsart Immuntherapie-assoziierter Exantheme. Sie treten überwiegend unter Therapie mit PD-1/PD-L1-Inhibitoren auf, bei denen sie bei bis zu 17 % der Patienten beschrieben wurden [5, 15]. Lichenoide Veränderungen werden vermutlich unterdiagnostiziert und von einigen Autoren gar als häufigstes klinisches und/oder histopathologisches Muster entzündlicher kutaner irAE angesehen [11, 16]. Lichenoide Exantheme treten Wochen bis mehrere Monate (durchschnittlich 12 Wochen) nach Therapiebeginn und somit später als makulopapulöse Exantheme auf [17].
Das klinische Bild ist variabel. Die Exantheme können aus klassischen, teils zu größeren Plaques konfluierenden lichenoiden Papeln mit Wickham-Streifung, als auch aus weniger spezifischen makulopapulösen Hautveränderungen und hyperkeratotischen Plaques, ähnlich einem hypertrophen Lichen ruber planus (LRP), bestehen (Abbildung 1). Begleitend kommt häufig ein ausgeprägter Pruritus vor. Die Hautveränderungen können lokalisiert oder generalisiert auftreten. Bullöse Veränderungen, palmoplantare Manifestationen oder Beteiligung der Schleimhäute sind möglich [5, 18].
Immunvermittelte bullöse lichenoide Exantheme, insbesondere bei Mundschleimhautbeteiligung, stellen eine wichtige Differenzialdiagnose zu schweren bullösen Arzneimittelreaktionen dar [7]. Differenzialdiagnostisch müssen zudem andere medikamentöse Auslöser lichenoider Arzneimittelexantheme sowie ein idiopathischer exanthematischer LRP bedacht werden. Beispiele für häufige Auslöser lichenoider Arzneimittelreaktionen sind kardiologische Medikamente (Betablocker, Angiotensin-Converting-Enzym-Hemmer, Diuretika), Antimalariamittel und Tumor-Nekrose-Faktor (TNF)α-Blocker. Im Gegensatz zu den Prädilektionsstellen des klassischen LRP (Extremitäten-Beugeseiten) sind die Hautveränderungen bei lichenoiden Arzneimittelexanthemen vermehrt an den Extremitäten-Streckseiten inklusive der Handrücken und an lichtexponierten Arealen lokalisiert. Morphologisch zeigt sich häufig eine vergleichsweise prominente ekzematöse Komponente mit Schuppung. Die Diagnostik lichenoider Arzneimittelreaktionen wird durch das häufig verzögerte Auftreten von bis zu mehreren Monaten nach Medikamenteneinleitung und die langsame Abheilung nach Absetzen des vermuteten Auslösers erschwert [19]. Eine allergologische Abklärung, beispielsweise mittels Epikutantest, ist selten ergiebig und daher nicht zielführend [20]. Bei Auftreten lichenoider Hautveränderungen in den ersten Monaten nach PD-1/PD-L1-Therapieeinleitung erscheint aufgrund deren Häufigkeit eine Assoziation mit der Immuntherapie wahrscheinlich, sodass von einem voreiligen Absetzen essenzieller internistischer Medikamente Abstand genommen werden sollte.
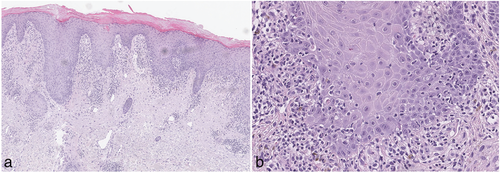
Histopathologisch sind Immuntherapie-assoziierte lichenoide Exantheme oft nicht von einem idiopathischen LRP zu unterscheiden [14]. Klassischerweise zeigt sich subepithelial ein bandförmiges lymphozytäres epidermotropes Entzündungsinfiltrat, das mit vakuolärer Degeneration der dermoepidermalen Junktionszone bis zur subepithelialen Spaltbildung (bullöse Formen) einhergeht, sowie eine irreguläre Akanthose, Hypergranulose und Melanophagen [14]. Eine vergleichsweise Häufung von CD163+ Makrophagen, CD4+ Lymphozyten und eine vermehrte histologische Variabilität mit Auftreten von LRP-untypischer Spongiose, eosinophilen Granulozyten und einer Parakeratose wurden vereinzelt als hinweisend für eine Arzneimittel-assoziierte Genese beschrieben [14, 17].
Fortsetzung Fallbericht 1: Ein Hautbiopsat zeigte das histologische Bild eines Lichen ruber verrucosus (Abbildung 2). In Zusammenschau der Befunde wurde ein Pembrolizumab-assoziiertes lichenoides Exanthem diagnostiziert. Therapeutisch erfolge eine steroidhaltige Lokaltherapie (Klasse IV), eine UVB-Phototherapie und eine Retinoid-Therapie (Acitretin). Die Hautveränderungen besserten sich kontinuierlich über mehrere Monate bis zur kompletten Abheilung. Die Pembrolizumab-Therapie wurde bei komplettem Tumoransprechen aufgrund der dermatologischen Nebenwirkung beendet und der Patient ist seit zwei Jahren anhaltend tumorfrei.
Erythemato- und papulosquamöse Exantheme
Psoriasiforme Exantheme sind vor allem unter Therapie mit PD-1/PD-L1-Inhibitoren bekannt [5, 11]. Sie können de novo oder auch als Exazerbation einer vorbestehenden Psoriasis entstehen [11, 16, 21, 22]. In letzterem Fall treten die exanthematischen Hautveränderungen häufig bereits innerhalb des ersten Therapiemonats auf, während dies bei Erstmanifestation später, rund drei Monate nach Therapiebeginn, der Fall ist [21]. Klinisch findet sich meist eine Psoriasis vom Plaque-Typ, andere Subtypen (palmoplantare, pustulöse, guttata, erythrodermatische oder inverse Psoriasis) treten selten auf [21-23]. Zudem können unter Immuntherapie aufgetretene papulosquamöse Exantheme auch einer Pityriasis rubra pilaris ähneln [24].
Bullöses Pemphigoid
Immuntherapie-assoziierte bullöse Pemphigoide treten vornehmlich unter PD-1/PD-L1-Blockade und zeitlich verzögert, durchschnittlich sechs Monate nach Therapiebeginn, auf [25, 26]. Das bullöse Pemphigoid ist, wie in der Allgemeinbevölkerung auch, die häufigste bullöse Autoimmundermatose unter Immuntherapie, wenngleich es insgesamt eine seltene Nebenwirkung ist, die bei rund 0,9 % der Patienten auftritt [15, 25, 26]. Zum Vergleich, in der Allgemeinbevölkerung ist eine Inzidenz von 7,6/100 000 Einwohner/Jahr zu beobachten, wobei diese bekanntermaßen mit steigendem Alter deutlich zunimmt [27].
Klinisch zeigen sich, ähnlich der klassischen Form, im präbullösen Stadium stark juckende urtikarielle bis makulopapulöse Erytheme und im weiteren zeitlichen Verlauf die diagnoseweisenden prallen subepidermal lokalisierten Blasen [28]. Eine Beteiligung der oralen Schleimhaut ist möglich [28, 29]. Bei therapierefraktären pruritischen Erythemen unter Immuntherapie ist daher auch immer ein bullöses Pemphigoid im präbullösen Stadium in die differenzialdiagnostischen Überlegungen einzubeziehen.
Das histo- und immunpathologische Bild entspricht weitgehend dem des klassischen bullösen Pemphigoids: Histopathologisch finden sich typischerweise eine unterschiedlich stark ausgeprägte subepidermale Spaltbildung sowie ein dermales Entzündungsinfiltrat aus Lymphozyten, Eosinophilen und Neutrophilen und in der direkten Immunfluoreszenz eine lineare Ablagerung von C3 und/oder IgG entlang der dermoepidermalen Junktionszone [14]. Serologisch sind bei bis zu drei Viertel der Patienten Autoantikörper gegen BP180 nachweisbar, seltener gegen andere Bestandteile der dermoepidermalen Junktionszone [30]. Ein negativer Autoantikörpernachweis schließt jedoch die Diagnose nicht aus [29, 30].
Differenzialdiagnostisch sind andere unter Immuntherapie beschriebene bullöse Exantheme zu berücksichtigen, wie bullöse lichenoide Exantheme [7, 31], Lichen planus pemphigoides [32-34] oder schwere bullöse Arzneimittelreaktionen [7, 35, 36]. Klinisch finden sich die prallen Blasen bei bullösen lichenoiden Exanthemen ausschließlich auf lichenoiden Plaques und entstehen infolge einer ausgeprägten Interface-Dermatitis mit subepidermaler Spaltbildung [32]. Beim Lichen planus pemphigoides hingegen zeigen sich neben klassischen lichenoiden Plaques pralle Blasen auch auf nicht lichenoid veränderter Haut, die durch sekundäre Autoantikörper-Bildung, vergleichbar mit dem bullösen Pemphigoid, zustande kommen [32].
Zudem sind bei bullösen Eruptionen Erkrankungen aus dem Pemphigus-Formenkreis abzugrenzen, welche jedoch unter Immuntherapie eine Rarität darstellen dürften: Lediglich Einzelfallberichte existieren für die Demaskierung oder Manifestation eines paraneoplastischen Pemphigus unter Immuntherapie [37, 38]. Dies könnte dadurch erklärt werden, dass der paraneoplastische Pemphigus eine seltene Erkrankung ist und zudem am häufigsten (84 %) bei hämatologischen Erkrankungen vorkommt, die aktuell kein klassisches Einsatzgebiet der Immuntherapie sind [39]. Das Auftreten eines klassischen Pemphigus vulgaris wurde bisher nicht berichtet.
Kollagenosen-assoziierte Exantheme
Fallbericht 2: Bei einer 56-jährigen Patientin mit einem metastasierten Lungenkarzinom traten nach dem 2. Zyklus einer kombinierten Chemoimmuntherapie mit Pembrolizumab, Pemetrexed und Carboplatin leicht juckende Hautveränderungen beginnend am Dekolleté auf. Nach dem 4. Zyklen, etwa zehn Wochen nach Therapieeinleitung, kam es zu deutlicher Exazerbation mit Ausbreitung auf das gesamte Integument (Abbildung 3). Die Schleimhäute waren unauffällig.
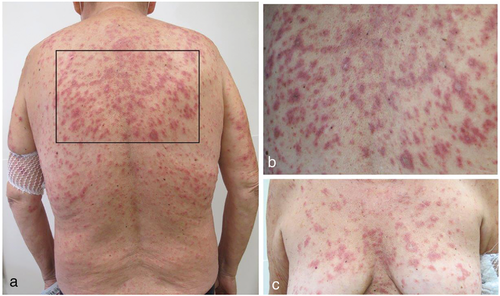
Exanthematische Hautveränderungen unter Immuntherapie können Ausdruck neu manifestierter autoimmunologisch bedingter Bindegewebserkrankungen (Kollagenosen) sein. Bei dieser insgesamt seltenen Nebenwirkung sind vor allem der kutane Lupus erythematodes (LE) und die Dermatomyositis zu nennen.
Das Auftreten eines kutanen LE, meistens subakut kutaner Lupus erythematodes (SCLE), wurde zwei Wochen bis zu mehrere Monate (durchschnittlich rund 10 Wochen) nach Beginn einer PD-1/PD-L1-Inhibitor-Therapie berichtet [6, 40–43]. Epidemiologische Daten sind rar; in einer kleinen Kohorte von Patienten mit PD-1/PD-L1-Inhibitor-Therapie wurde die Inzidenz des medikamenteninduzierten LE auf 0,5 % geschätzt [41]. Zum Vergleich, in der Allgemeinbevölkerung wird die Inzidenz des SCLE mit 0,6/100 000 Einwohner angegeben, wobei bei bis zu einem Drittel der Fälle eine Medikamentenassoziation eine Rolle spielen dürfte [44, 45]. Die Arbeit von Marzano et al. [46] gibt einen guten Überblick zum medikamenteninduzierten LE. Der SCLE ist dessen häufigste Variante, noch vor dem systemischen LE. Der medikamenteninduzierte SCLE wurde häufig mit Diuretika, Antihypertensiva, Protonenpumpenhemmern, Antimykotika, TNFα-Blockern sowie neuerdings auch mit PD-1/PD-L1 Inhibitoren assoziiert. Klinisch zeigen sich teils ausgedehnte anuläre oder papulosquamöse Plaques, bevorzugt an den photoexponierten Arealen. Vesikulobullöse und Erythema exsudativum multiforme-artige Formen wurden beschrieben. Häufig sind beim medikamenteninduzierten SCLE die antinukleären (ANA) und SSA(Ro)-Antikörper positiv sowie Anti-Histon-Antikörper negativ. Eine Beteiligung innerer Organe fehlt in der Regel.
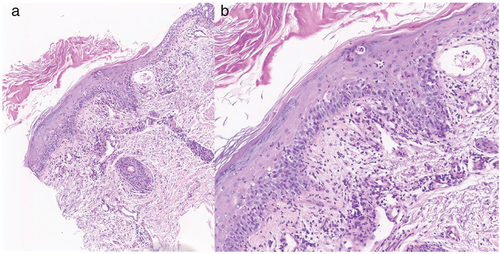
Histologisch ist der kutane LE unter anderem durch eine Interface-Dermatitis, ein perivaskuläres und periadnexielles lymphohistiozytäres Infiltrat, Basalmembranverdickung, epidermale Atrophie und dermale Muzinablagerungen charakterisiert [47]. Die Ausprägung der einzelnen Merkmale variiert zwischen den klinischen Subtypen mit fließenden Übergängen, sodass eine klinisch-pathologische Korrelation zur Diagnosestellung erforderlich ist [47]. Auch ist eine sichere Unterscheidung zwischen einem systemischen und kutanen LE und die Abgrenzung zur Dermatomyositis rein histopathologisch nicht möglich [47].
Eine Immuntherapie-assoziierte Erstmanifestation einer Dermatomyositis kann mit ausgeprägten krankheitstypischen Hauterscheinungen inklusive Gottron-Papeln, heliotropen periorbitalen Erythemen und flächigen Erythemen in bevorzugt photoexponierten Arealen am Stamm und an den Extremitäten einhergehen. Begleitend können muskuläre Beschwerden auftreten. Die Symptome beginnen nicht selten kurz nach Therapieeinleitung, gelegentlich bereits nach der ersten Gabe [48, 49]. Die ANA sind häufig positiv, während Myositis-spezifische Autoantikörper fehlen können [48]. Bei Nachweis von Myositis-spezifischen Autoantikörpern finden sich häufig Anti-transcriptional intermediary factor-1γ (TIF-1γ) Antikörper [49-51], welche mit der paraneoplastischen Dermatomyositis assoziiert sind [52].
Pathophysiologisch ist neben einer primär medikamenteninduzierten Genese auch die Demaskierung einer latenten Autoimmunität möglich. Dies erscheint insbesondere beim Auftreten einer Dermatomyositis mit Paraneoplasie-assoziiertem Autoantikörperprofil plausibel. So wurde von einer nach Einleitung einer Immuntherapie exazerbierten Anti-TIF-1γ-Antikörper-positiven paraneoplastischen Dermatomyositis berichtet, die zuvor subtil und undiagnostiziert blieb [53].
Fortsetzung Fallbericht 2: Zur weiteren Abklärung wurden eine Hautbiopsie (Abbildung 4) und laborchemische Bestimmungen durchgeführt. Es fanden sich bei der Patientin hochpositive ANA (Titer 1 : 1280) und SSA-Antikörper bei negativen dsDNA-Antikörpern. Klinisch und laborchemisch ergab sich kein Hinweis für eine systemische Organbeteiligung. Nach klinisch-pathologischer Korrelation wurde ein SCLE unter Pembrolizumab (CTCAE III) diagnostiziert und eine systemische Prednisolontherapie (1 mg/kg Körpergewicht) sowie eine steroidhaltige Lokaltherapie etabliert. Die Hautveränderungen bildeten sich daraufhin zurück und die Prednisolontherapie konnte über mehrere Wochen reduziert werden. Die Immuntherapie wurde aufgrund der dermatologischen Nebenwirkung abgesetzt.
Schwere kutane Arzneimittelreaktionen
Schwere bullöse Arzneimittelreaktionen wie Stevens-Johnson-Syndrom (SJS) oder toxisch epidermale Nekrolyse (TEN), wurden als äußerst seltene Nebenwirkung unter Immuntherapie beschrieben [7, 11, 35, 54]. Klassischerweise zeigen sich rasch progrediente, konfluierende, düsterrote Maculae und atypische Kokarden mit Blasenbildung, positivem Nikolski-Phänomen und hämorrhagisch-erosiver Schleimhautbeteiligung [35]. Oftmals wurde bei erstmaliger Einnahme das auslösende Arzneimittel innerhalb der letzten vier Wochen neu angesetzt. Auch unter CPI-Therapie traten die meisten Reaktionen nach der ersten oder zweiten Gabe auf [35], wobei die lange Halbwertszeit von Substanzen wie Pembrolizumab einen möglichen Abstand von drei Wochen nach der ersten Gabe oder das Auftreten kurz nach der zweiten Applikation erklären kann. Vereinzelt wurde unter Immuntherapie auch von verzögerter Entwicklung schwerer bullöser Arzneimittelreaktionen über Wochen und Monate berichtet, wobei sich die Hautveränderungen initial als unspezifische makulopapulöse Exantheme zeigten [35, 36]. Von Reschke et al. [7] wurde jedoch postuliert, dass einige SJS/TEN-Fallberichte in der Literatur mehr bullösen lichenoiden Arzneimittelexanthemen zuzurechnen wären. Differenzialdiagnostisch können diese deutlich häufigeren bullösen lichenoiden Exantheme aufgrund zahlreicher histopathologischer und klinischer Überschneidungen schwer zu unterscheiden sein. Sie gehen jedoch mit einem langsameren klinischen Verlauf, einer milderen Schleimhautbeteiligung und einer besseren Prognose einher. Histopathologisch zeigt sich beim SJS/TEN das Bild einer zytotoxischen Interface-Dermatitis mit variabler epidermaler Nekrose und spärlichem lymphozytären dermalen Infiltrat [14]. Akanthose, Hypergranulose und prominenteres lichenoides lymphozytäres Infiltrat sprechen hingegen für ein lichenoides Arzneimittelexanthem [7, 14].
Zudem sind differenzialdiagnostisch auch häufige alternative medikamentöse Auslöser eines SJS/TEN wie beispielsweise Allopurinol, Sulfonamide oder aromatische Antiepileptika durch eine sorgfältige Medikamentenanamnese zu berücksichtigen und bullöse Autoimmundermatosen sowie ein staphylococcal scalded skin syndrome (SSSS) auszuschließen [7].
Zu anderen schweren kutanen Arzneimittelreaktionen unter Immuntherapie, wie dem drug reaction with eosinophilia and systemic symptoms (DRESS)-Syndrom [55, 56] und der akuten generalisierten exanthematischen Pustulose (AGEP) [57, 58], existieren lediglich vereinzelte Fallberichte. Weitere gut aufgearbeitete Fallberichte und -serien sind notwendig, um diese tatsächlich als seltene Immuntherapie-assoziierte Arzneimittelreaktionen einzuordnen.
Sonstige exanthematische Hautveränderungen
Morbus-Grover-artige Exantheme mit pruritischen stammbetonten Papeln und Papulovesikeln wurden unter CPI-Therapie beobachtet und traten häufig bereits in den ersten 3–6 Wochen nach Therapiebeginn auf [5, 59].
Sukkulente erythematöse Plaques und Fieber im zeitlichen Zusammenhang mit einer Immuntherapie können auf ein Sweet-Syndrom hindeuten, das in Fallberichten vor allem unter Ipilimumab (CTLA-4 Inhibitor) beschrieben wurde [60-62].
Immuncheckpoint-Inhibitoren werden zunehmend bei Patienten mit allogener Stammzelltransplantation eingesetzt, beispielsweise beim rezidivierenden oder therapierefraktären Hodgkin-Lymphom. Dies scheint mit einem erhöhten Risiko für eine Graft-versus-Host-Erkrankung (GvHD), insbesondere für schwere akute Verlaufsformen, einherzugehen und muss bei diesen Patienten berücksichtigt werden [63, 64]. Häufig manifestiert sich die akute GvHD an der Haut mit Pruritus und einem generalisierten makulopapulösen Exanthem, das seinen Ausgang von schmerzhaften palmoplantaren und retroaurikulären Erythemen nimmt. Begleitend zeigt sich häufig eine Hepatopathie und gastrointestinale Beteiligung (Tenesmen, wässrige Diarrhö, Emesis), die differenzialdiagnostisch die Abgrenzung zu klassischen Arzneimittelexanthemen und Chemotherapie-assoziierten Nebenwirkungen wie dem Hand-Fuß-Syndrom erleichtern können. Weiters sind infektiologische Ursachen inklusive viraler Exantheme bei diesen Patienten auszuschließen [65].
Neben diesen exanthematischen Präsentationen können unter Immuntherapie auch andersartige kutane irAE auftreten, beispielsweise Sarkoidose-artige Reaktionen [66-68], eine Vitiligo insbesondere bei Patienten mit malignem Melanom oder Pruritus [5].
Diagnostisches Vorgehen
Bei Verdacht auf Immuntherapie-assoziierte Exantheme müssen in einem ersten Schritt alternative Ursachen, insbesondere Arzneimittelexantheme durch andere Medikamente und infektiöse Exantheme, ausgeschlossen werden. Das Auftreten der Hautveränderungen in den ersten Wochen und Monaten nach Einleitung der Immuntherapie erhärtet nach Ausschluss der Differenzialdiagnosen eine CPI-assoziierte Genese (Tabelle 1).
Da makulopapulöse Exantheme die Initialmanifestation spezifisch einzuorndender Exantheme und schwerer kutaner Arzneimittelreaktionen sein können, soll bei ausgeprägten, therapieresistenten oder atypischen Exanthemen stets eine dermatologische Abklärung inklusive einer Hautbiopsie (Histologie und direkte Immunfluoreszenz) und fallspezifischen Laboruntersuchungen erfolgen. Das Auftreten bekannter Warnzeichen für schwere kutane Arzneimittelreaktionen (Fieber, Gesichts- und Lymphknotenschwellung, Eosinophilie, Schleimhautbeteiligung, schmerzempfindliche gräuliche Haut, epidermale Ablösung und Erosionen) erfordert eine rasche Abklärung [69].
Bei Exanthemen mit Betonung photoexponierter Areale ist auf andere Kollagenose-typische Hautveränderungen zu achten. Eine histologische und laborchemische Abklärung inklusive ANA, SSA-/SSB-, dsDNA-, Anti-Histon- und Myositis-Antikörper sowie Bestimmung der Kreatininkinase bei muskulären Beschwerden ist in diesem Fall empfehlenswert.
Bei Auftreten bullöser Hautveränderungen oder Hautveränderungen mit ausgeprägtem therapierefraktärem Pruritus müssen blasenbildende Autoimmundermatosen, insbesondere ein bullöses Pemphigoid und dessen präbullöse Form, ausgeschlossen werden. Hierzu sind die Durchführung einer Hautbiopsie und eine serologische Abklärung inklusive einer indirekten Immunfluoreszenz und Bestimmung von BP-180/BP-230 Autoantikörper notwendig.
Therapie
Allgemeine Grundsätze zur Therapie kutaner irAE
Das therapeutische Management orientiert sich am Schweregrad der kutanen Nebenwirkung nach der CTCAE-Klassifikation, der somit standardmäßig bestimmt und dokumentiert werden sollte [4, 70]. Die CTCAE-Klassifikation Version 5 liefert eine detaillierte Schweregradeinteilung für verschiedenste kutane Nebenwirkungen, wobei die betroffene Körperoberfläche, die Schwere der assoziierten Begleitsymptome und die Beeinträchtigung des Patienten im Alltag und in seiner Lebensqualität die wichtigsten Kriterien für die Einteilung sind [8]. Tabelle 2 fasst relevante Kriterien für Immuntherapie-assoziierte Exantheme und die damit verbundenen therapeutischen Konsequenzen zusammen. Auch wenn die CTCAE-Klassifikation für Nicht-Dermatologen ein gutes Hilfsinstrument darstellt, ist jedoch aus dermatologischer Sicht eine genauere diagnostische Einordnung der kutanen irAE gemäß der dargestellten Varianten von immunvermittelten Exanthemen anzustreben. Hierdurch können eine bessere Einschätzung des weiteren Krankheitsverlaufes und eine gezieltere Therapieauswahl erfolgen. So ergibt sich beispielweise durch die Diagnose eines SJS, das aus dermatologischer Sicht durchwegs diskussionswürdig als Grad-III-Reaktion nach CTCAE eingeordnet wird (Tabelle 2), eine andere prognostische und therapeutische Konsequenz als beispielsweise durch ein makulopapulöses Exanthem des gleichen CTCAE-Schweregrades.
| Grad I (mild) | Grad II (moderat) | Grad III (schwer) | Grad IV (lebensbedrohlich) | Grad V (Tod) | |
|---|---|---|---|---|---|
| Symptome |
|
|
|
|
– |
| Therapie kutaner irAE [4] |
|
|
|
|
– |
- Abk.: BADL, basic activities of daily living (Beispiele: Körperpflege, Essen); CTCAE, Common Terminology Criteria for Adverse Events; KOF, Körperoberfläche; IADL, instrumental activities of daily living (Beispiele: Kochen, Einkaufen, Hausarbeit, Benutzen von Transportmittel); irAE, immune-related adverse event; SJS, Stevens-Johnson-Syndrom; TEN, toxisch epidermale Nekrolyse.
- *Bei gesicherter Diagnose eines SJS/TEN kurzfristig begrenzte systemische Steroid-Therapie < 1 Woche und Evaluierung der frühzeitigen Gabe von Ciclosporin (3–5mg/kg für 10 Tage).
Der Großteil der kutanen irAE, insbesondere die häufigen makulopapulösen, lichenoiden und psoriasiformen Exantheme, ist von milder Schwere (Grad I/II), durch eine frühzeitige adäquate Lokaltherapie gut beherrschbar und beeinträchtigt die Fortführung der Immuntherapie in der Regel nicht [11, 21].
Grundsätzlich kommen bei milden Symptomen vor allem zeitlich beschränkte topische mittel- bis hochpotente Glukokortikoide zur Anwendung. Eine Therapieunterbrechung und gegebenenfalls systemische Glukokortikoidtherapie sind bei persistierenden und schweren (Grad ≥ III) Exanthemen notwendig (Tabelle 2). Im Einzelfall ist individuell und interdisziplinär über die Therapiefortführung zu entscheiden. Bei dieser Entscheidung sind unter anderem das bisherige onkologische Therapieansprechen, die Therapiezielsetzung (palliativ oder kurativ), die Lebensqualitätsbeeinträchtigung durch die kutanen irAE und deren Therapieansprechen auf eine topische und systemische dermatologische Therapie zu berücksichtigen. Jedenfalls dauerhaft zu beenden ist die Immuntherapie bei Diagnose einer schweren kutanen Arzneimittelreaktion [54].
Klassische Arzneimittelexantheme bilden sich nach Absetzen des auslösenden Medikaments in der Regel rasch zurück. Im Gegensatz dazu kommt es bei den immunvermittelten kutanen Nebenwirkungen aufgrund der anhaltenden immunologischen Effekte nicht selten auch nach Therapieende zu einem protrahierten und teils rezidivierenden Verlauf [17, 28]. Eine Erhaltungstherapie kann dementsprechend notwendig sein und Schübe mit erhöhter Krankheitsaktivität können nach weiteren Immuntherapie-Gaben auftreten [11].
Spezifische Therapiemaßnahmen
Bei spezifischen dermatologischen Manifestationen können für die entsprechende Dermatose geeignete Therapieoptionen eingesetzt werden, was die Wichtigkeit einer möglichst genauen Einordnung der Exantheme unterstreicht. Aufgrund des onkologischen Patientenkollektives baut man hierbei auf den Einsatz möglichst zielgerichteter und immunmodulierender Substanzen, um den möglicherweise negativen Einfluss einer breiten Immunsuppression auf die antitumoröse Wirkung der Immuntherapie gering zu halten. Aufgrund ähnlicher Bedenken mit Biologika bei diesem Patientengut gibt es hierzu wenig Erfahrungen, sodass deren Einsatz therapierefraktären Fällen vorbehalten bleibt [22, 35, 71]. Studiendaten weisen jedoch darauf hin, dass zumindest der Einsatz von systemischen Glukokortikoiden zur Therapie von irAE nicht mit einer schlechteren Prognose einhergeht [72].
Als spezifische Therapiemaßnahmen können bei ausgeprägten lichenoiden Exanthemen inklusive bullöser Formen Retinoide und eine Phototherapie, letztere mit Einschränkungen bei Melanom-Patienten, eingesetzt werden [18, 31]. Bei psoriasiformen Exanthemen, die durch eine topische Therapie mit Glukokortikoiden und Vitamin-D3-Analoga nicht adäquat kontrolliert werden können, sind ebenfalls die Phototherapie und Retinoide sowie in einem nächsten Schritt Apremilast und Methotrexat gut erprobte Therapieoptionen [21, 22].
Bei protrahiertem Verlauf können bei einem Immuntherapie-assoziierten SCLE Hydroxychloroquin und bei der Dermatomyositis intravenöse Immunglobuline eingesetzt werden [42, 46, 48, 49].
Eine Therapieunterbrechung/-abbruch ist bei bullösem Pemphigoid oder Lichen planus pemphigoides häufig notwendig, wobei über die Fortsetzung der Immuntherapie von Fall zu Fall zu entscheiden ist [11, 26]: Bei milden Verläufen ist die Fortführung unter Therapie mit topischen Steroiden und engmaschigen dermatologischen Kontrollen möglich [28, 29]. Bei ausgeprägten Fällen sind jedoch eine systemische Glukokortikoidtherapie und Unterbrechung der Immuntherapie notwendig [25, 28]. Eine Erhaltungstherapie ist oftmals indiziert, hierzu eignen sich vor allem immunmodulierende Substanzen wie beispielsweise Doxycyclin oder Dapson [11, 26, 32]. Omalizumab wurde ebenso erfolgreich, insbesondere bei erhöhtem Gesamt-IgE, eingesetzt [26, 73]. Einzelfallberichte existieren auch zu Rituximab mit teils unterschiedlichem Erfolg [29, 74, 75]. Unter fortlaufender Erhaltungstherapie kann eine Reduktion der systemischen Steroiddosis und ein Wiederbeginn der Immuntherapie möglich sein [26].
Bei gesicherter Diagnose eines SJS/TEN empfiehlt es sich, zeitnah Ciclosporin (3–5 mg/kg KG über 10 Tage) einzusetzen und eine gegebenenfalls bereits eingeleitete systemische Steroidtherapie auf wenige Tage zu begrenzen [76, 77].
Inhibitoren des epidermalen Wachstumsfaktorrezeptors
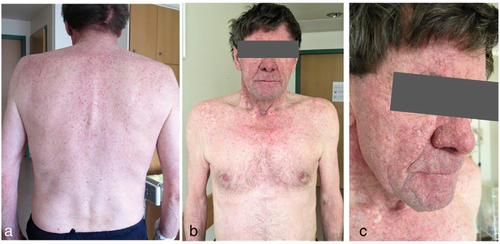
Fallbericht 3: Bei einem 73-jährigen Patienten trat am 5. Tag nach der Einleitung einer EGFR-Inhibitor-Therapie mit Erlotinib bei metastasiertem Lungenkarzinom ein papulopustulöses Exanthem am oberen Rücken, Dekolleté und im Gesichtsbereich auf (Abbildung 5). Begleitend wurde ein milder Juckreiz berichtet.
EGFR-Inhibitoren (EGFRI) haben in der Onkologie ein breites Einsatzgebiet und kommen unter anderem bei Karzinomen der Lunge, der Brust, des Gastrointestinaltrakts sowie bei Plattenepithelkarzinomen der Haut und der Hals-Kopf-Region zur Anwendung. Der EGFR-Signalweg kann extra- und intrazellulär blockiert werden – extrazellulär durch parenteral zu verabreichende monoklonale Antikörper und intrazellulär mit peroralen small molecules.
Der EGFR wird weit verbreitet in der Haut exprimiert, insbesondere in den basalen Keratinozyten, der äußeren Haarwurzelscheide sowie in den Schweiß- und Talgdrüsen [78]. Durch Hemmung des EGFR kommt es zu einer gestörten Differenzierung von Keratinozyten und von Epithelzellen der Hautanhangsgebilde, was sowohl in betroffener als auch in gesunder Haut histopathologisch nachgewiesen werden konnte [79, 80]. Zudem fand sich unter EGFR-Blockade eine gesteigerte Expression von proinflammatorischen Zytokinen und Chemokinen sowie eine Reduktion von antimikrobiellen Peptiden [79, 81]. Letzteres könnte die erhöhte Anfälligkeit für kutane Superinfektionen, insbesondere durch Staphylococcus aureus, unter EGFRI- Therapie erklären [82]. Der EGFR ist somit ein wichtiger Regulator der kutanen Homöostase und Eingriffe im EGFR-Signalweg sind mit einem typischen kutanen Nebenwirkungsspektrum assoziiert.
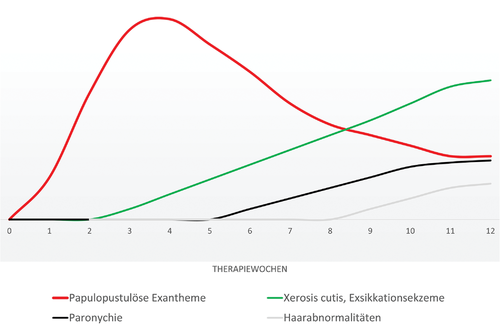
Papulopustulöse Exantheme sind hierbei die häufigste kutane Nebenwirkung. Bei rund 30 % der Patienten stellt sich zudem nach mehrwöchiger Therapie mit einem EGFRI eine Xerosis cutis mit Neigung zu Exsikkationsekzemen ein. Weitere kutane Nebenwirkungen sind Pruritus, eine gesteigerte Photosensitivität und Haarveränderungen (Trichomegalie, Alopezie, Hirsutismus) [83]. Für die Patienten besonders belastend erweisen sich häufig schmerzhafte Paronychien, die bei 17 % der Patienten rund zwei Monate nach Therapiebeginn und insbesondere an den Großzehen auftreten [84, 85]. Die Nagelveränderungen sind initial steril, neigen jedoch zu bakteriellen und mykotischen Superinfektionen [85]. Der typische zeitliche Verlauf der kutanen Nebenwirkungen unter EGFRI ist in Abbildung 6 dargestellt.
Exantheme im Rahmen schwerer kutaner Arzneimittelreaktionen unter EGFRI-Therapie stellen eine Rarität dar. Es existieren lediglich Einzelfallberichte zu schweren bullösen Arzneimittelreaktionen (SJS/TEN) für Osimertinib [86-88], Afatinib [89, 90] und Cetuximab [91, 92].
Papulopustulöse Exantheme
Die häufigste kutane Nebenwirkung von EGFRI sind papulopustulöse Exantheme. Die Schweregradeinteilung erfolgt ebenso nach den CTCAE-Kriterien (Tabelle 2) [8]. Monoklonale Antikörper und Afatinib (Tyrosinkinasehemmer der 2. Generation mit irreversibler und breiter Blockade der gesamten ErbB-Rezeptor-Familie) führen häufiger (70–90 %) und zu höhergradigeren papulopustulösen Exanthemen (Grad-III/IV-Exantheme bei 10–15 %) [93]. Bei anderen Tyrosinkinasehemmern, insbesondere bei jenen der 3. Generation (Beispiel Osimertinib), scheinen Hautreaktionen seltener aufzutreten und milder zu verlaufen [94, 95].
Klinisch zeigen sich innerhalb der ersten zwei Wochen nach Therapiebeginn follikuläre Papeln und Pusteln (Abbildung 5). Betroffen sind die seborrhoischen und UV-exponierten Körperareale, wohingegen Lokalisationen mit vorhergegangener Strahlentherapie ausgespart bleiben [96]. Trotz der regelmäßig verwendeten englischen Bezeichnung acneiform rash fehlen im Vergleich zur klassischen Akne Komedonen und es treten häufig begleitende Dysästhesien und Pruritus auf [83]. Im weiteren Therapieverlauf verkrusten die Papulopusteln, teils hämorrhagisch, und es kommt zu einer langsamen Abmilderung der Symptomatik [83]. Nach Rückbildung bleiben in den betroffenen Arealen häufig Erytheme mit Teleangiektasien, eine Xerosis cutis und seltener postinflammatorische Hyperpigmentierungen zurück [79].
Aufgrund des engen zeitlichen Zusammenhanges und wegweisenden klinischen Bildes bestehen zumeist keine differenzialdiagnostischen Schwierigkeiten. Mit geringerer Häufigkeit können jedoch auch andere Arzneimittel eine Acne medicamentosa hervorrufen (Tabelle 3) [97]. Klinisch zeigen sich hierbei ebenso monomorphe papulöse bis papulopustulöse Hautveränderungen (initial ohne Komedonen) mit abruptem Auftreten in einem für eine Akne vulgaris untypischen Alter und teils mit einer Ausdehnung über die seborrhoischen Areale hinweg [97]. Bei atypischem klinischen Bild und Verlauf sind zudem infektiöse Follikulitiden mittels mikrobiologischer Diagnostik auszuschließen.
| Wirkstoffgruppe | Substanzen |
|---|---|
| Steroide | Glukokortikoide, anabol-androgene Steroide |
| Tuberkulostatika | Isoniazid, Rifampicin |
| Neuropsychiatrische Therapien | Lithium, Antiepileptika (Phenytoin, Carbamazepin, Lamotrigin), Aripiprazol |
| Vitamine | Hochdosiert Vitamin B1, B6 und B12 |
| Immunsuppressive Therapie | Ciclosporin |
| Halogene | Brom, Jod, chlorierte Kohlenwasserstoffe |
| Zielgerichtete Therapien | |
| EGFR-Inhibitoren | Monoklonale Antikörper (Cetuximab, Panitumumab), small molecules (Gefitinib, Erlotinib, Afatinib, Dacomitinib, Lapatinib, Osimertinib) |
| MEK-Inhibitoren | Trametinib, Cobimetinib |
| Multi-Tyrosinkinase-Inhibitoren | Sorafenib, Sunitinib, Regorafenib, Axitinib |
| mTOR-Inhibitoren | Sirolimus, Everolimus, Temsirolimus |
| Proteasom-Inhibitor | Bortezomib |
- Abk.: EGFR, epidermal growth factor receptor; mTOR, mechanistic target of rapamycin.
Prognose
In diversen Studien konnte für Patienten mit EGFRI-assoziierten papulopustulösen Exanthemen ein besseres onkologisches Therapieansprechen gezeigt werden [98, 99]. Ansätze zur Dosisfindung durch eine Dosissteigerung bis zur Ausbildung von papulopustulösen Hautveränderungen ergaben jedoch keinen Effekt auf das Gesamtüberleben und haben sich nicht etabliert [100, 101]. Das Auftreten eines tolerierbaren papulopustulösen Exanthems stellt folglich auch keine Kontraindikation für die Fortführung der Therapie dar. Die Therapieadhärenz der Patienten kann aber aufgrund der belastenden Symptomatik leiden, sodass eine Aufklärung über das Krankheitsbild und die Einleitung von prophylaktischen Maßnahmen bereits bei Therapiebeginn dringend notwendig sind.
Prophylaxe
- ▸ Anwendung einer rückfettenden harnstoffhaltigen Basispflege zweimal täglich und von pH-neutralen, milden Duschzusätzen,
- ▸ Vermeiden von mechanischen, physikalischen und chemischen Hautirritationen,
- ▸ konsequenter Sonnenschutz mit hohem Lichtschutzfaktor aufgrund der therapiebedingten gesteigerten Photosensitivität. Ein positiver Effekt auf EGFRI-vermittelte papulopustulöse Exantheme durch Sonnenschutzcreme konnte jedoch nicht gezeigt werden [102].
Die prophylaktische Off-Label-Anwendung von Tetrazyklinen wird in der S3-Leitlinie der deutschen Krebsgesellschaft mit einem Empfehlungsgrad B genannt [93]. Sie führt primär zu einer Reduktion der moderat-schweren Exantheme um 50–70 % mit geringer Auswirkung auf die generelle Exantheminzidenz [93, 103]. Negative Auswirkungen auf den Tumor-bezogenen Therapieerfolg zeigten sich nicht und eine retrospektive Studie konnte gar einen positiven Effekt auf das Gesamtüberleben durch den prophylaktischen Einsatz von Tetrazyklinen feststellen [104, 105]. In der Prophylaxe werden Tetrazykline in therapeutischer Dosierung mit Beginn der EGFRI-Therapie für zumindest acht Wochen gegeben. Vor allem bei Substanzen mit hoher Inzidenz für papulopustulöse Exantheme erscheint eine Tetrazyklin-Prophylaxe sinnvoll, während bei Tyrosinkinasehemmern mit niedrigem Exanthemrisiko auch eine zuwartende Strategie gerechtfertigt sein kann.
Therapie
Die Lokaltherapie von papulopustulösen Exanthemen erfolgt mit topischen Antibiotika (1 % Clindamycin, 0,75–2 % Metronidazol, 1 % Nadifloxacin) im Wechsel mit topischen mittel- bis hochpotenten Steroiden. Klassische topische Aknetherapeutika (Benzoylperoxid, Azelainsäure, Retinoide) werden aufgrund ihrer austrocknenden Wirkung ebenso wie topische Calcineurininhibitoren nicht empfohlen. Wird noch keine prophylaktische systemische Tetrazyklintherapie durchgeführt, ist eine solche zu etablieren (Doxycyclin 200 mg/Tag, Lymecyclin 300 mg/Tag, Minocyclin 100 mg/Tag). Ein Therapieansprechen zeigt sich nach 1–4 Wochen, jedoch liegen keine Studien zur optimalen Therapiedauer vor. Pragmatisch gesehen kann bei gutem Ansprechen nach frühestens acht Wochen Therapie ein Auslassversuch oder eine proaktive Fortführung in reduzierter Dosierung (Doxycyclin 40 mg/Tag) erwogen werden. Es ist jedoch von einem erhöhten Rezidivrisiko bei nachgewiesener reduzierter Wirksamkeit subantimikrobieller Dosierungen auszugehen [106]. Bei pustulösen Hautveränderungen mit Verdacht auf eine bakterielle Superinfektion wird die Entnahme eines bakteriellen Abstriches empfohlen, wodurch Tetrazyklin-resistente Keime nachgewiesen werden können. Eine antibiogrammgerechte Antibiose, beispielsweise mit Cephalosporinen der 1. Generation, soll anschließend etabliert werden. Bei schweren Exanthemen (Grad III/IV) ist bei Versagen der Tetrazyklintherapie eine Umstellung auf niedrigdosiertes Isotretinoin (20–30 mg/Tag) und eine kurzfristige systemische Glukokortikoidtherapie möglich. Ab CTCAE-Grad III sind zudem die substanzspezifischen Fachinformationen zur Therapieunterbrechung und Dosismodifikation zu beachten [93, 107, 108].
Fortsetzung Fallbericht 3: Aufgrund des klinischen Bildes und des zeitlichen Zusammenhanges mit der Erlotinib-Therapieeinleitung wurde die Diagnose eines EGFRI-assoziierten papulopustulösen Exanthems (CTCAE-Grad III) gestellt. Eine Therapie wurde systemisch mit Lymecyclin 300 mg/Tag sowie lokal mit Clindamycin-Lotion und steroidhaltigen Externa der Klasse III durchgeführt. Hierunter kam es zu einer langsamen Rückbildung der pustulösen Hautveränderungen. Die Erlotinib-Therapie wurde dosisreduziert bis zum Tumorprogress fortgeführt.
Fazit
Durch die anhaltende Entwicklung neuer zielgerichteter Therapien, insbesondere in der Onkologie, wird die Dermatologie auch in Zukunft mit neuartigen kutanen Nebenwirkungen konfrontiert sein. Adäquate Diagnose und Therapie dieser Nebenwirkungen sind nicht zuletzt für eine erfolgreiche onkologische Therapie von großer Bedeutung, da dadurch unnötige Therapieunterbrechungen und -abbrüche verhindert werden können. Angesichts der rasch zunehmenden Literatur ist eine kontinuierliche und auch kritische Auseinandersetzung mit dieser notwendig. Nicht selten existieren lediglich einzelne oder unvollständig dokumentierte Fallberichte zu seltenen kutanen Nebenwirkungen, bei welchen der kausale Zusammenhang mit einem bestimmten Arzneimittel in weiterer Folge durch gut dokumentierte Fallserien und Studien zu verifizieren ist.
Danksagung
Die Autoren bedanken sich bei Dr. Petar Noack für die Unterstützung bei der Bereitstellung und Befundung des histopathologischen Bildmaterials.
Isabella Pospischil Finanzielle Interessen: Nein Erklärung zu nicht-finanziellen Interessen: Nein Wolfram Hötzenecker Finanzielle Interessen: Nein Erklärung zu nicht-finanziellen Interessen: ÖGDV, ÖGA
Literatur
CME Questions/Lernerfolgskontrolle
- Welche Aussage zu lichenoiden Arzneimittelexanthemen ist richtig?
- Bei Auftreten eines lichenoiden Arzneimittelexanthems kann das auslösende Medikament durch eine allergologische Hauttestung mit großer Wahrscheinlichkeit identifiziert werden.
- Durch eine histopathologische Untersuchung kann ein lichenoides Arzneimittelexanthem sicher von einem klassischen Lichen ruber planus unterschieden werden.
- Im Gegensatz zum klassischen Lichen ruber planus tritt Juckreiz äußerst selten bei Immuntherapie-assoziierten lichenoiden Arzneimittelexanthemen auf.
- Immuntherapie-assoziierte lichenoide Arzneimittelexantheme verlaufen häufig schwer.
- Lichenoide Exantheme stellen eine relativ häufige immunvermittele Nebenwirkung unter Checkpoint-Inhibitor-Therapie dar.
- Welche Aussage zu kutanen immunvermittelten Nebenwirkungen unter Immuntherapie mit Checkpoint-Inhibitoren ist richtig?
- Sie stellen seltene immunvermittelte Nebenwirkung dar.
- Ein Auftreten von Immuntherapie-assoziierten Exanthemen bereits nach der ersten Checkpoint-Inhibitor-Gabe ist nicht möglich.
- Nach Absetzen der Immuntherapie bilden sich die Hautveränderungen häufig rasch und spontan zurück.
- Häufig sind die kutanen immunvermittelten Nebenwirkungen mild und beeinträchtigen die Therapiefortführung nicht.
- Exantheme im Rahmen von neu aufgetretenen Kollagenosen sind die häufigste Manifestation von Immuntherapie-assoziierten Exanthemen.
- Welche der folgenden autoimmunbullöse Dermatosen kommt am häufigsten unter Immuntherapie mit Checkpoint-Inhibitoren vor?
- Pemphigus vulgaris
- lineare IgA-Dermatose
- bullöses Pemphigoid
- paraneoplastischer Pemphigus
- Pemphigus foliaceus
- Eine Patientin entwickelt zwei Wochen nach Einleitung einer PD-1-Inhibitor-Therapie ausgeprägte livide Erytheme mit Betonung der photoexponierten Areale (Dekolleté, Gesicht, Handrücken). Darüber hinaus wird eine zunehmende muskuläre Schwäche in den proximalen Extremitäten angegeben. Welche diagnostische Maßnahme trägt am wenigsten zur weiteren Diagnosefindung bei?
- Autoimmunserologie (ANA, Myositis-Antikörper)
- Hautbiopsie
- Bestimmung der Kreatininkinase
- Elektromyographie
- Abdomensonographie
- Welche Aussage zu psoriasiformen Exanthemen unter Immuntherapie mit Checkpoint-Inhibitoren ist richtig?
- Unter PD-1/PD-L1-Inhibitor-Therapie kommt es nicht selten zu einer exanthematischen Exazerbation einer vorbekannten milden Psoriasis.
- Bei Auftreten einer Psoriasis unter PD-1/PD-L1-Therapie muss die Immuntherapie in der Regel abgebrochen werden.
- Bei Immuntherapie-assoziierten psoriasiformen Exanthemen stellen die modernen Biologika die Therapie der ersten Wahl dar.
- Die generalisierte pustulöse Psoriasis stellt unter Immuntherapie mit Checkpoint-Inhibitoren die häufigste Psoriasis-Verlaufsform dar.
- Eine Psoriasis Erstmanifestation unter Checkpoint-Inhibitor Therapie wurde bisher nicht beschrieben.
- Welche Aussage zur Therapie von Immuntherapie-assoziierten Exanthemen ist richtig?
- Eine rasche und aggressive immunsuppressive Therapie ist notwendig.
- Der Einsatz von systemischen Glukokortikoiden zur Therapie von immunvermittelten Nebenwirkungen geht nachgewiesener Weise mit einer schlechteren Tumorprognose einher.
- Bei einem Immuntherapie-assoziierten bullösen Pemphigoid stellt Rituximab die Therapie der ersten Wahl dar.
- Bei lichenoiden und psoriasiformen Exanthemen unter Immuntherapie sind Retinoide und eine Phototherapie kontraindiziert.
- Vor Wiederbeginn der Immuntherapie wird empfohlen eine Prednisolondosis von ≤ 10 mg zu erreichen.
- Welche der folgenden ist keine bekannte kutane Nebenwirkung unter EGFRI-Therapie?
- Exsikkationsekzeme
- Papulopustulöse Exantheme
- Trichomegalie
- Paronychie
- Vitiligo
- Welche Aussage zum Management von papulopustulösen Exanthemen unter EGFRI-Therapie ist richtig?
- Prophylaktische Maßnahmen sind nicht möglich.
- Klassische Lokaltherapeutika für die Akne vulgaris wie Benzoylperoxid oder Retinoide stellen Therapien der ersten Wahl dar.
- Bei Auftreten eines papulopustulösen Exanthems muss eine EGFRI-Therapie sofort abgebrochen werden.
- Topische Therapiemaßnahmen spielen in der Therapie von EGFRI- assoziierten papulopustulösen Exantheme keine Rolle.
- Bei fehlenden Kontraindikationen kann besonders bei monoklonalen EGFR-Antikörpern eine prophylaktische Therapie mit Tetrazyklinen ab Beginn der EGFRI-Therapie angeboten werden.
- Welches der folgenden Arzneimittel ist höchstwahrscheinlich nicht für das Entstehen von papulopustulösen Hautveränderungen verantwortlich?
- Glukokortikoide
- Aripiprazol
- Sirolimus
- Ciclosporin
- Ramipril
- Welche Aussage zur klinischen Präsentation von papulopustulösen Hautveränderungen unter EGFRI- Therapie ist richtig?
- Komedonen treten regelmäßig mit Beginn der papulopustulösen Hautveränderungen auf.
- Die papulopustulösen Exantheme treten meist erst nach mehreren Therapiemonaten auf.
- Pruritus und Dysästhesien sind häufige Begleitsymptome.
- Für die Patienten stellen sie nur selten eine Beeinträchtigung in ihrer Lebensqualität dar.
- Im Gegensatz zur Akne vulgaris finden sich die Hautveränderungen nicht in den seborrhoischen Arealen.
Liebe Leserinnen und Leser, der Einsendeschluss an die DDA für diese Ausgabe ist der 31. Januar 2022. Die richtige Lösung zum Thema „Bekanntes und Neues zum Basalzellkarzinom“ in Heft 7 (Juli 2021) ist: (1c, 2e, 3c, 4c, 5d, 6c, 7d, 8d, 9c, 10a).
Bitte verwenden Sie für Ihre Einsendung das aktuelle Formblatt auf der folgenden Seite oder aber geben Sie Ihre Lösung online unter http://jddg.akademie-dda.de ein.




