Charakteristika von Dermatomyositis-Patienten mit und ohne Malignom-Assoziation
Zusammenfassung
Hintergrund
Die Dermatomyositis gehört zur Gruppe der seltenen, idiopathischen, inflammatorischen Myositiden. Für die paraneoplastische Form der Dermatomyositis wurde in der Vergangenheit ein Zusammenhang mit Malignomen erkannt. Faktoren, die für eine Malignom-Assoziation sprechen, werden bis heute untersucht.
Patienten und Methodik
Es wurden retrospektiv über einen Zeitraum von 15 Jahren die Daten von 63 Patienten mit Dermatomyositis analysiert.
Ergebnisse
Folgende Faktoren gaben einen Hinweis für eine Dermatomyositis mit Malignom-Assoziation: ein höheres Patientenalter (> 52 Jahre [P = 0,001], > 65 Jahre [P = 0,002], ≥ 75 Jahre [P = 0,002]), eine kürzere Zeit zwischen Erstmanifestation und Erstdiagnose (Malignom-Gruppe: 59 Tage vs. Nicht-Malignom-Gruppe: 137 Tage [P = 0,022]), eine Hautbeteiligung in Form von Gottron-Zeichen (P = 0,045), zentrofazialen Erythemen (P = 0,036) oder typischen Erythemen an den Ober-/Unterarmen (P = 0,019), eine oropharyngeale Beteiligung (P = 0,015) und eine GPT-Erhöhung (P = 0,031). Folgende Faktoren sprachen eher gegen eine Malignom-Assoziation: ein jüngeres Patientenalter (≤ 52 Jahre [P = 0,001], 40–65 Jahre [P = 0,045]) und Juckreiz (P = 0,026).
Schlussfolgerungen
In der Literatur finden sich heterogene Ergebnisse zu den genannten Faktoren hinsichtlich ihrer Eignung als Marker für eine Malignom-Assoziation. Erschwert ist die Faktorenfindung aufgrund kleiner Studienpopulationen, wenigen prospektiven und kontrollierten Studien, die Einordnung von Populationen als Myositis-Patienten ohne Differenzierung und eine inkonsistente Verwendung der Nomenklatur. Mit unserer Studie wollen wir einen wichtigen Beitrag zur Identifizierung von Risikofaktoren bei Dermatomyositis mit Malignom-Assoziation leisten.
Einleitung
Die Dermatomyositis (DM) ist eine seltene, weltweit vorkommende Autoimmunerkrankung, die sowohl die Haut als auch die Muskulatur betreffen kann. Sie gehört zur Gruppe der idiopathischen inflammatorischen Myositiden. Neben der adulten Form, die paraneoplastisch auftreten kann, gibt es auch eine juvenile DM [1]. Aufgrund der Seltenheit der Erkrankung liegen insgesamt nur wenige Daten vor, die über Fallbeschreibungen oder Fallserien hinausgehen. In der Literatur werden viele Faktoren, die für eine Malignom-Assoziation sprechen, diskutiert. Hierzu zählen sowohl Haut- und Muskelsymptome als auch Laborparameter. Die erste Assoziation der DM zu Malignomen wurde 1916 von Stertz berichtet, der einen DM-Patienten mit einem Magenkarzinom beschrieb [2]. Auch in der Klassifikation von Bohan und Peter ist die DM mit Malignom-Assoziation eine Subgruppe. Bis heute wird in mehreren Studien und Fallserien immer wieder gehäuft von Malignomen in Verbindung mit einer DM berichtet. Der Zusammenhang gilt als gesichert [3-5]. Oftmals kann die Diagnose des Malignoms innerhalb des ersten Jahres nach DM-Diagnose gestellt werden. Prinzipiell kann ein Malignom aber auch schon zuvor bestehen oder sich erst im Verlauf entwickeln. 25–42 % der DM-Patienten haben eine solche Malignom-Assoziation [6]. Berichtet werden teils stark schwankende Prozentzahlen von 6–60 % [7]. Im Gegensatz zur Normalbevölkerung hat ein DM -Patient ein 6–12-fach erhöhtes Risiko ein Malignom zu entwickeln [6].
Die Tumorsuche und -nachsorge nehmen daher eine wichtige Rolle ein. Bis heute existieren keine einheitlichen und verbindlichen Nachsorge- und Tumor-Richtlinien [5, 8]. Eine Zusammenfassung gängiger Empfehlungen sowie der häufigsten assoziierten Tumoren [2, 9–14] und Risikofaktoren [2, 5, 6, 10, 15–19] ist dem Online-Supplement zu entnehmen.
Auffällig bei der Literaturrecherche war der heterogene Gebrauch der Nomenklatur der Hautbefunde. So wird oftmals entweder von Gottron-Zeichen oder Gottron-Papeln gesprochen; selten gibt es eine Unterscheidung wie bei Sontheimer [20] oder der Einteilung des Cutaneous Dermatomyositis Disease Area and Severity Index (CDASI) [21]. Beispiele hierfür sind im Online-Supplement aufgeführt [22, 23]. Didona et al. machen deutlich, dass die bekannten Klassifikationskriterien einer Überarbeitung bedürfen und führen an, dass die Hautsymptome für die Diagnose einer DM eine herausragende Rolle spielen [24].
Die vorliegende Arbeit liefert sowohl weitere Daten zur Analyse der Erkrankung der DM als auch einen Beitrag zu der wichtigen Frage, welche Risikofaktoren für und welche gegen eine Malignom-Assoziation sprechen.
Patienten und Methodik
Studienpopulation
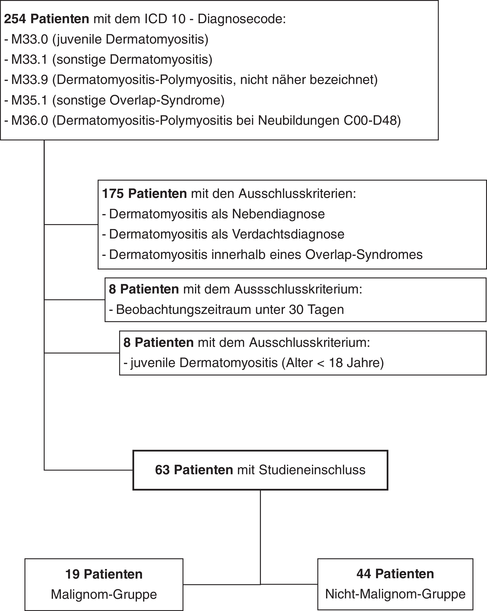
Die vorliegende Arbeit ist eine retrospektive, monozentrische Datenanalyse von Patienten, die zwischen Januar 2000 und Dezember 2015 in der Universitäts-Hautklinik Tübingen mit der Diagnose einer DM behandelt wurden. Zur Identifikation der Patienten diente die elektronische Krankenakte. Aus ursprünglich 254 Patienten wurden 63 Patienten ausgewählt (Tabelle 1). Diese wurden in zwei Gruppen unterteilt. Patienten, die ein oder mehrere Malignome hatten, gehabt hatten oder entwickelten, wurden zur Malignom-Gruppe gezählt, die restlichen Patienten wurden der Nicht-Malignom-Gruppe zugeordnet.
 |
Daten
Ab 2003 erhobene Laborwerte konnten aus dem Labor-EDV-System abgerufen werden. Die Einteilung der Hautmanifestationen erfolgte in Anlehnung an die von Sontheimer definierten Kriterien [20] mit zusätzlichen Erweiterungen aus der Literatur und eigenen Beobachtungen.
Statistik
Die statistische Auswertung erfolgte mit IBM SPSS Statistics Version 26. Ein P-Wert von < 0,05 wurde als statistisch signifikant gewertet. Zur Überprüfung der Signifikanzen wurde bei unabhängigen, qualitativen Merkmalen der Chi-Quadrat Test eingesetzt. Bei Stichproben < 20 oder Fallzahlen < 5 wurde Fishers exakter Test eingesetzt. Zur Überprüfung der Signifikanzen bei unabhängigen, quantitativen Merkmalen wurde bei Normalverteilung der t-Test eingesetzt und bei nicht-normalverteilten Stichproben der U-Test.
Ergebnisse
Patientenkollektiv
Dreiundsechzig Patienten wurden untersucht, von denen 19 Patienten (30,2 %) zur Malignom-Gruppe und 44 Patienten (69,8 %) zu der Nicht-Malignom-Gruppe gezählt wurden. Die Verteilung des Geschlechts war in beiden Gruppen ähnlich: In der Malignom-Gruppe waren 63,2 % Patienten weiblich versus 66,0 % in der Nicht-Malignom-Gruppe (Tabelle 2).
| MG | NMG | P-Wert | Test | ||
|---|---|---|---|---|---|
| Patientenkollektiv | |||||
| Geschlecht (♀/♂) | 63,2 %/36,8 % | 66,0 %/34,1 % | n.s. | – | |
| Alter bei ED, Mittelwert [LJ] | 68,8 | 52,4 | 0,001 | t-Test | |
| Zeit zwischen EM und ED, Median [Tage] | 59 | 137 | 0,022 | U-Test | |
| Alterseinteilung nach Autorenvorgaben, % (n) | |||||
| Fardet et al. [6] | ≤ 52 Jahre | 5,3 % (1) | 50,0 % (22) | 0,001 | Chi-Quadrat-Test |
| > 52 Jahre | 94,7 % (18) | 50,0 % (22) | 0,001 | Chi-Quadrat-Test | |
| Hill et al. [28] | < 45 Jahre | 5,3 % (1) | 25,0 % (11) | n.s. | – |
| ≥ 45 Jahre | 94,7 % (18) | 75,0 % (33) | n.s. | – | |
| Stockton et al. [25] | < 45 Jahre | 5,3 % (1) | 25,0 % (11) | n.s. | – |
| 45–74 Jahre | 52,6 % (10) | 68,2 % (30) | n.s. | – | |
| ≥ 75 Jahre | 42,1 % (8) | 6,8 % (3) | 0,002 | Fisher-Test | |
| Modifiziert nach Tang et Thevarajah [26] | < 40 Jahre | 5,3 % (1) | 18,2 % (8) | n.s. | – |
| 40–65 Jahre | 31,6 % (6) | 59,1 % (26) | 0,045 | Chi-Quadrat-Test | |
| > 65 Jahre | 63,2 % (12) | 22,7 % (10) | 0,002 | Chi-Quadrat-Test | |
- Abk.: ED, Erstdiagnose; EM, Erstmanifestation; LJ, Lebensjahre; MG, Malignom-Gruppe; n, Patientenanzahl; NMG, Nicht-Malignom-Gruppe; n.s., nicht signifikant; ♂, männlich; ♀, weiblich.
- Kursiv = signifikante P-Werte.
Die Zeit zwischen dem Auftreten erster Symptome (Erstmanifestation) bis zur Diagnosestellung zeigte signifikante Unterschiede und konnte in der Malignom-Gruppe bei allen und bei der Nicht-Malignom-Gruppe bei 81,8 % bestimmt werden. Der Median lag bei 59 Tagen bei der Malignom-Gruppe versus 137 Tagen bei der Nicht-Malignom-Gruppe (U-Test, P = 0,022) (Tabelle 2).
Das mittlere Alter bei Diagnosestellung lag bei der Malignom-Gruppe höher als bei der Nicht-Malignom-Gruppe: 68,8 ± 11,6 Lebensjahre versus 52,4 ± 15,2 Lebensjahre (t-Test; P = 0,001). In beiden Gruppen war das mittlere Diagnosealter bei den weiblichen Patienten niedriger als bei den männlichen Patienten (Malignom-Gruppe: ♀ 66,6 ± 12,9 Lebensjahre und ♂ 72,6 ± 8,5 Lebensjahre vs. Nicht-Malignom-Gruppe: ♀ 49,4 ± 15,9 Lebensjahre und ♂ 58,2 ± 12,1 Lebensjahre).
Tabelle 2 zeigt zusätzlich eine Aufteilung unserer Population nach Altersgrenzen verschiedener Autoren [6, 25, 26] zur besseren Vergleichbarkeit der Daten.
Malignom-Gruppe
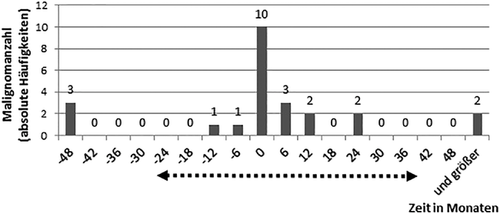
Charakteristika der Malignom-Gruppe können Tabelle 3 entnommen werden. Bei diesen 19 Patienten wurden insgesamt 24 Malignome dokumentiert. Bei 16 dieser 24 Malignome wurde die DM als Paraneoplasie gewertet (66,7 %) und bei acht Malignomen (33,3 %) war der Zusammenhang zwischen Malignom und DM unklar. Bei fünf Patienten (26,3 %) waren gleichzeitig oder nacheinander zwei Malignom-Erkrankungen dokumentiert worden. Am häufigsten vertreten waren das Mammakarzinom (50,0 %) und das Prostatakarzinom (42,9 %), gefolgt vom Ovarialkarzinom (33,3 %), dem Bronchialkarzinom (15,8 %) und dem Melanom (15,8 %). Das kolorektale Karzinom trat bei 10,5 % auf, während das nasopharyngeale Karzinom, das Meningeom und das CUP-Syndrom jeweils bei 5,3 % auftraten. Die Zeit zwischen der Malignom-Erkrankung und der Erstdiagnose der DM lag im Median bei 152 Tagen. 79,2 % der Malignome traten in einem Zeitraum von fünf Jahren um die Erstdiagnose der DM auf (innerhalb der zwei Jahre vor Erstdiagnose der DM und innerhalb der ersten drei Jahre danach; siehe gepunktete Linie in Abbildung 1). Zum Zeitpunkt der DM-Erstdiagnose wurden 41,7 % (n = 10) der Malignome diagnostiziert. In den darauffolgenden zwei Jahren nochmals 29,2 % (n = 7).
| Patient # | Alter bei ED [LJ] | Geschlecht | Tumorentität | Bewertung | Zeit zwischen Malignom und DM [Tage] |
|---|---|---|---|---|---|
| 13 † | 77 | ♂ | Lunge (SCLC) | PNP | 30 |
| Prostata | Unklar | –2708 | |||
| 41 | 69 | ♀ | Ovarial* | PNP | 91 |
| 51 | 82 | ♀ | Ovarial | PNP | 639 |
| Kolorektal | PNP | 639 | |||
| 62 | 73 | ♂ | Prostata | Unklar | –4748 |
| Meningeom | Unklar | –153 | |||
| 67 | 60 | ♀ | Melanom | Unklar | 2250 |
| 70 | 84 | ♂ | Nasopharynx | PNP | 91 |
| 76 | 73 | ♀ | Brust | PNP | 0 |
| 91 | 58 | ♂ | CUP* | Unklar | 337 |
| 124 | 65 | ♂ | Lunge (NSCLC) | PNP | 0 |
| 135 | 56 | ♀ | Brust* | PNP | 0 |
| 162 | 72 | ♀ | Brust | PNP | –366 |
| 167 | 78 | ♀ | Brust | PNP | 21 |
| Melanom* | Unklar | 21 | |||
| 171 | 75 | ♂ | Prostata | PNP | –151 |
| 222 | 79 | ♀ | Brust | Unklar | –2312 |
| Kolorektal | PNP | 184 | |||
| 223 † | 53 | ♀ | Ovarial* | PNP | 0 |
| 225 | 75 | ♀ | Ovarial | PNP | 0 |
| 226 | 38 | ♀ | Brust* | PNP | –306 |
| 246 | 64 | ♀ | Melanom | Unklar | 3103 |
| 249 | 76 | ♂ | Lunge | PNP | 0 |
- Abk.: DM, Dermatomyositis; ED, Erstdiagnose; LJ, Lebensjahre; NSCLC, non small cell lung cancer; PNP, Paraneoplasie; SCLC, small cell lung cancer; ♂, männlich; ♀, weiblich.
- *metastasiert; –, vor Erstdiagnose der Dermatomyositis; †, Tod innerhalb des Beobachtungszeitraumes.
Klinik
Hautbeteiligung: In beiden Gruppen konnten bei allen Patienten die Hautmanifestationen erhoben werden. Für die ausführliche Aufzählung der Befunde verweisen wir auf Tabelle 4. Folgende Hautbefunde erwiesen sich als statistisch signifikant: Gottron-Zeichen (Malignom-Gruppe: 68,4 % vs. Nicht-Malignom-Gruppe: 40,9 %; Chi-Quadrat-Test, P = 0,045; Odds Ratio [OR] = 3,130, 95 %-Konfidenzintervall [KI]: 1,002–9,774), Juckreiz (Malignom-Gruppe: 5,3 % vs. Nicht-Malignom-Gruppe: 31,8 %; Fisher-Test, P = 0,026; OR = 0,119, 95 %-KI: 0,014- 0,983), typische Erytheme zentrofazial (Malignom-Gruppe: 84,2 % vs. Nicht-Malignom-Gruppe: 56,8 %; Chi-Quadrat-Test, P = 0,036; OR = 4,053, 95 %-KI: 1,030– 15,946) und typische Erytheme an den Oberarmen/Unterarmen (Malignom-Gruppe: 68,4 % vs. Nicht-Malignom-Gruppe: 36,4 %; Chi-Quadrat-Test, P = 0,019; OR = 3,792, 95 %-KI: 1,206–11,926). Die nicht signifikante Verteilung aller anderen Hautveränderungen ist dem Online-Supplement zu entnehmen.
| MGHäufigkeit (n = 19) | NMGHäufigkeit (n = 44) | P-Wert | Test | ||
|---|---|---|---|---|---|
| Major- Hautkriterien | Gottron-Papeln | 52,6 % (10) | 72,7 % (32) | n.s. | – |
| Heliotropes Erythem | 94,7 % (18) | 86,4 % (38) | n.s. | – | |
| Gottron-Zeichen | 68,4 % (13) | 40,9 % (18) | 0,045 | Chi-Quadrat-Test | |
| Minor- Hautkriterien | Juckreiz | 5,3 % (1) | 31,8 % (14) | 0,026 | Fisher-Test |
| TE an der Kopfhaut/ vorderer Haaransatz | 36,8 % (7) | 29,5 % (13) | n.s. | – | |
| Holster-Zeichen | 15,8 % (3) | 34,1 % (15) | n.s. | – | |
| TE zentrofazial | 84,2 % (16) | 56,8 % (25) | 0,036 | Chi-Quadrat-Test | |
| V-Zeichen | 78,9 % (15) | 54,5 % (24) | 0,067 | Chi-Quadrat-Test | |
| TE an den Oberarmen/Unterarmen | 68,4 % (13) | 36,4 % (16) | 0,019 | Chi-Quadrat-Test | |
| Shawl-Zeichen | 26,3 % (5) | 18,2 % (8) | n.s. | – | |
| TE palmar | 0,0 % (0) | 18,2 % (8) | n.s. | – | |
| TE periungual | 47,4 % (9) | 43,2 % (19) | n.s. | – | |
| Calcinosis cutis | 0,0 % (0) | 9,1 % (4) | n.s. | – | |
| Poikiloderma | 5,3 % (1) | 9,1 % (4) | n.s. | – | |
| Ulzerationen | 21,1 % (4) | 6,8 % (3) | n.s. | – | |
| Teleangiektasien | 26,3 % (5) | 13,6 % (6) | n.s. | – | |
| Mechanikerhände | 0,0 % (0) | 9,1 % (4) | n.s. | – | |
| TE im Ohrbereich | 10,5 % (2) | 9,1 % (4) | n.s. | – | |
| TE am Oberbauch/Stamm/Bauch | 15,8 % (3) | 13,6 % (6) | n.s. | – | |
| Weitere Kriterien | Erythemaussparung im Mundbereich | 10,5 % (2) | 9,1 % (4) | n.s. | – |
| Alopezie | 0,0 % (0) | 11,4 % (5) | n.s. | – | |
| Photosensitivität (anamnestisch) | 0,0 % (0) | 9,1 % (4) | n.s. | – | |
| Raynaud-Zeichen | 5,3 % (1) | 18,2 % (8) | n.s. | – | |
| Heliotropes Erythem und/oder TE zentrofazial | 94,7 % (18) | 97,7 % (43) | n.s. | – | |
Muskelbeteiligung: In beiden Gruppen konnte bei allen Patienten die Muskelbeteiligung erhoben werden. Eine detaillierte Zusammenfassung der Muskelbeteiligung findet sich im Online-Supplement. Ein signifikanter Unterschied zeigte sich im Auftreten einer Beteiligung der oropharyngealen Muskulatur, die gehäuft in der Malignom-Gruppe zu finden war (Malignom-Gruppe: 70,6 % vs. Nicht-Malignom-Gruppe: 35,1 %; Chi-Quadrat-Test, P = 0,015; OR = 4,431, 95 %-KI: 1,279- 15,350). Dies zeigte sich in Form einer Dysphonie (Malignom-Gruppe: 75,0 % vs. Nicht-Malignom-Gruppe: 76,9 %) und/oder Dysphagie (Malignom-Gruppe: 58,3 % vs. Nicht-Malignom-Gruppe: 38,5 %) (Tabelle 5).
| MGHäufigkeit (n = 17) | NMGHäufigkeit (n = 37) | ||
|---|---|---|---|
| Zeitpunkt der Muskelbeteiligung | Initial | 70,6 % (12) | 64,9 % (24) |
| Sekundär | 29,4 % (5) | 29,7 % (11) | |
| Vor der Hautmanifestation | 0,0 % (0) | 5,4 % (2) | |
| Qualität der Muskelbeteiligung | Muskelschmerz | 23,5 % (4) | 21,6 % (8) |
| Muskelatrophie | 5,9 % (1) | 2,7 % (1) | |
| Muskelschwäche | 82,4 % (14) | 81,1 % (30) | |
| Oropharyngeale Beteiligung | 70,6 % (12) | 35,1 % (13) | |
| Dysphonie | 75,0 % (9) | 76,9 % (10) | |
| Dysphagie | 58,3 % (7) | 38,5 % (5) | |
- Abk.: MG, Malignom-Gruppe; n, Anzahl; NMG, Nicht-Malignom-Gruppe.
- Kursiv hervorgehoben = signifikante P-Werte (Test: Chi-Quadrat-Test).
Labor: Alle Laborwerte sind zusammengefasst in Tabelle 6 dargestellt. Ein signifikanter Unterschied zeigte sich nur für die Häufigkeitsverteilung der Erhöhung der Glutamat-Pyruvat-Transaminase (GPT; Malignom-Gruppe: 88,2 % vs. Nicht-Malignom-Gruppe: 58,1 %; Chi-Quadrat- Test, P = 0,031). Die Odds Ratio lag bei 5,417 (95 %-KI: 1,052–27,891). Details zu wichtigen Labordaten sowie zu Myositis-spezifischen Antikörpern (MSA) und Myositis-assoziierten Antikörpern (MAA), welche nicht in Tabelle 6 erfasst sind, finden sich im Online-Supplement.
| MG | NMG | P-Wert | ||
|---|---|---|---|---|
| CK | CK-Wert (Median [U/l]), (N) | 1382,5 (18) | 396,0 (31) | n.s. |
| CK-Erhöhung, % (N, n) | 83,3 % (18, 15) | 64,5 % (31, 20) | n.s. | |
| CK-Erhöhung >1000 U/l, % (N, n) | 55,6 % (18, 10) | 35,5 % (31, 11) | n.s. | |
| LDH | LDH-Wert (Median [U/l]), (N) | 418,0 (17) | 334,5 (31) | n.s. |
| LDH-Erhöhung, % (N, n) | 82,4 % (17, 14) | 67,7 % (31, 21) | n.s. | |
| Leukozyten | Leukozyten-Wert (Median [*1000/μl]), (N) | 6,16 (17) | 7,43 (30) | n.s. |
| Leukozytose, % (N, n) | 17,6 % (17, 3) | 10,00 % (30, 3) | n.s. | |
| Leukopenie, % (N, n) | 11,8 % (17, 2) | 10,00 % (30, 3) | n.s. | |
| Lymphozyten | Lymphozyten-Wert (Median [*1000/μl]), (N) | 0,89 (15) | 1,00 (22) | n.s. |
| Lymphopenie, % (N, n) | 66,7 % (15, 10) | 68,2 % (22, 15) | n.s. | |
| Neutrophile | Neutrophilen-Wert (Median [*1000/μl]), (N) | 4,55 (15) | 5,15 (22) | n.s. |
| Neutrophilie, % (N, n) | 33,3 % (15, 5) | 27,3 % (22, 6) | n.s. | |
| Neutropenie, % (N, n) | 0,0 % (15, 0) | 4,5 % (22, 1) | n.s. | |
| NLR | NLR-Wert (Median), (N) | 4,4 (15) | 5,5 (22) | n.s. |
| NLR ≥ 5,5, % (N, n) | 40,0 % (15, 6) | 50,0 % (22, 11) | n.s. | |
| GOT | GOT-Wert (Median [U/l]), (N) | 90,5 (16) | 55,5 (28) | n.s. |
| GOT-Erhöhung, % (N, n) | 81,3 % (16, 13) | 64,3 % (28, 18) | n.s. | |
| GOT-Erhöhung >200 U/l, % (N, n) | 31,3 % (16, 5) | 14,3 % (28, 4) | n.s. | |
| GPT | GPT-Wert (Median [U/l]), (N) | 80,0 (17) | 55,0 (31) | n.s. |
| GPT-Erhöhung, % (N, n) | 88,2 % (17, 15) | 58,1 % (31, 18) | 0,031 | |
| GPT-Erhöhung >200 U/l, % (N, n) | 5,9 % (17, 1) | 12,9 % (31, 4) | n.s. | |
| CRP | CRP-Wert (Median [mg/dl]), (N) | 0,4 (14) | 0,2 (23) | n.s. |
| CRP-Erhöhung, % (N, n) | 35,7 % (14, 5) | 43,5 % (23, 10) | n.s. | |
| ANA | ANA-Positivität mittels Enzymimmunoassay, % (N, n) |
20,0 % (15, 3) | 19,4 % (36, 7) | n.s. |
ANA-Positivität mittels HEp-2 Zellen, % (N, n) |
55,6 % (9, 5) | 75,0 % (28, 21) | n.s. | |
| MSA | Anti-Mi-2, % (N, n) | 20,0 % (5, 1) | 27,3 % (11, 3) | n.s. |
| MAA | Anti-Ro/Anti-SSA, % (N, n) | 40,0 % (5, 2) | 9,5 % (21, 2) | n.s. |
| Anti-U1RNP, % (N, n) | 0,0 % (6, 0) | 12,5 % (16, 2) | n.s. |
- Abk.: ANA, antinukleäre Antikörper; CK, Kreatinkinase; CRP, C-reaktives Protein; GOT, Glutamat-Oxalacetat-Transaminase; GPT, Glutamat-Pyruvat-Transaminase; LDH, Laktatdehydrogenase; MAA, Myositis-assoziierte Antikörper; MG, Malignom-Gruppe; MSA, Myositis-spezifische Antikörper; N, Gesamtanzahl; n, Anzahl; NLR, Neutrophilen-Lymphozyten-Ratio; NMG, Nicht-Malignom-Gruppe; n.s., nicht signifikant.
- Kursiv hervorgehoben = signifikante P-Werte (Test: Chi-Quadrat-Test).
- Die genannten Laborwerte lagen nicht für alle Patienten vor, weshalb ein Format mit N, n gewählt wurde: N = Gesamtanzahl; dies bedeutet, bei N-Patienten wurde dieser Wert bestimmt. n = Anzahl; dies bedeutet, bei n-Patienten aus N-Patienten war dieser Wert erhöht/erniedrigt.
Diskussion
In unserer Studie untersuchten wir Faktoren, die für eine DM mit Malignom-Assoziation sprechen. Das mittlere Alter bei Erstdiagnose war in unserer Studie bei der Malignom-Gruppe signifikant höher als bei der Nicht-Malignom-Gruppe (68,8 Lebensjahre vs. 52,4 Lebensjahre). Ein höheres Alter (Tabelle 3) gilt im Allgemeinen als Risikofaktor für die Entwicklung einer DM mit Malignom-Assoziation [2, 6, 10, 25, 26]. Lu et al. zeigten in einer Metaanalyse, dass Malignom-Patienten in einem späteren Alter an einer DM erkranken als Nicht-Malignom-Patienten [17]. Jedoch gibt es bis dato nur wenige Studien, die eine „reine“ DM -Population untersucht haben. In der Studie von Fardet et al. hatten DM-Patienten mit Malignom-Assoziation ein medianes Alter von 60 Jahren, während DM-Patienten ohne Malignom-Assoziation ein medianes Alter von 50 Jahren aufwiesen [6]. Wir konnten das mittlere Alter der Patienten als Risikofaktor bestätigen. Statistisch signifikante Häufigkeitsunterschiede mit einer Odds Ratio > 1 ergaben sich in unserer Studie bei den Altersgruppen der Über-52-Jährigen, den Über-65-Jährigen und den Patienten, die 75 Jahre alt und älter waren. Eine Odds Ratio > 1 spricht hier für die erhöhte Wahrscheinlichkeit an einer DM mit Malignom-Assoziation zu erkranken. Dagegen legt eine Odds Ratio < 1 bei der Altersklasse der Patienten, die 52 Jahre und jünger waren sowie der 40–65-Jährigen die Wahrscheinlichkeit nahe, eher keine DM mit Malignom-Assoziation zu entwickeln. Fardet et al. zeigten ebenfalls statistisch signifikant in ihrer DM-Studie, dass Über-52-Jährige eine erhöhte Wahrscheinlichkeit für eine DM mit Malignom-Assoziation aufweisen [6]. In der Studie von Marie et al. ist die Rede von einer signifikant erhöhten Wahrscheinlichkeit (bei DM- und Polymyositis-Patienten) im Alter ≥ 65 Jahre an einem Malignom zu erkranken [27]. Eine erhöhte Wahrscheinlichkeit für die Gruppen, die 45 Jahre und älter waren sowie der Gruppe der 15–44-Jährigen, wie von Hill et al. angegeben, und eine erhöhte Wahrscheinlichkeit für die Gruppe der 45–75-Jährigen, an einer DM mit Malignom-Assoziation zu erkranken, wie Stockton et al. sie beschreiben, konnte in unserer Studie nicht gezeigt werden [25, 28].
In unserer Studie konnte ein statistisch signifikanter medianer Unterschied zwischen den beiden Gruppen bezüglich der Zeit zwischen der Erstmanifestation und Erstdiagnose gezeigt werden (Malignom-Gruppe: 59 Tage vs. Nicht-Malignom-Gruppe: 137 Tage). Daraus ließe sich ableiten, dass die Malignom-Patienten früher diagnostiziert wurden als die Nicht-Malignom-Patienten. Diesen Sachverhalt zeigten auch Fardet et al.: Bei Patienten mit einer Malignom-Assoziation wurde die Diagnose früher gestellt, im Median nach zwei Monaten, Patienten ohne Malignom-Assoziation hingegen wurden im Median erst nach fünf Monaten diagnostiziert. Zudem beschrieben Fardet et al., dass die Wahrscheinlichkeit, an einer DM mit Malignom-Assoziation zu leiden, erhöht ist, wenn die Zeit zwischen Erstmanifestation und Erstdiagnose weniger als vier Monate beträgt [6]. Eine mögliche Ursache hierfür könnte sein, dass DM-Patienten mit einer Malignom-Assoziation oftmals individuell akute und schwerer imponierende Hautsymptome und eher refraktäre Muskelsymptome aufweisen können [8, 9, 15]. Dies könnte zu früherer Vorstellung beim Arzt und so zu schnellerer Diagnosestellung führen. Auch in unserer Population fand sich ein solcher Fall einer vesikobullösen DM als Zeichen für eine Paraneoplasie [29].
In unserem Patientenkollektiv wiesen 30,2 % der Patienten eine Malignom-Assoziation auf. Dies deckt sich mit den Angaben in der Literatur (25–42 %) [6]. Fünf unserer Patienten wiesen zwei Tumorentitäten auf. Dieser Sachverhalt findet sich ebenfalls bei Stockton et al. und András et al. [2, 25]. Hill et al. haben in ihrer Untersuchung gezeigt, dass DM-Patienten vor allem an Ovarial-, Lungen-, Magen-, Kolon-, Pankreas- und Non-Hodgkin-Tumoren erkranken, aber auch andere Tumorentitäten wurden beschrieben [28]. In unserem Kollektiv waren das Mammakarzinom und das Prostatakarzinom am häufigsten, gefolgt vom Ovarialkarzinom, Bronchialkarzinom und dem Melanom. In unserer Studie wurde jeder Patient, bei dem ein Malignom gefunden wurde, ungeachtet der Entität, mit Ausnahme nichtmelanozytärer Hauttumoren, zur Malignom-Gruppe gerechnet. Seltene Tumorentitäten konnten somit erfasst werden. Selten in der Literatur dokumentierte Fälle schließen das Melanom [11, 12, 30, 31], die seltene Kombinationen aus DM und CUP-Syndrom [14] und DM und Meningeom [13, 32] ein.
In unserer Studie konnten wir zeigen, dass die meisten Malignome (41,7 %) zum Zeitpunkt der DM-Diagnose und in den darauffolgenden zwei Jahren (29,2 %) entdeckt werden. Diese Zeitfenster werden auch von anderen Studien diskutiert und teils bestätigt [2, 16, 28, 33]. Dass die Malignome vor allem um den Zeitpunkt der Diagnosestellung der DM gefunden werden, ist teilweise erklärbar durch die umfangreichere Diagnostik, die betrieben wird, besonders wegen der bekannten Assoziation der DM mit Malignomen [34].
In unserer Studie deuteten Gottron-Zeichen, typische zentrofaziale Erytheme und typische Erytheme an Ober- und/oder Unterarmen auf eine erhöhte Wahrscheinlichkeit hin, eine DM mit Malignom-Assoziation zu haben. Juckreiz hingegen war ein Symptom, das für eine DM ohne Malignom-Assoziation sprach.
Fang et al. konnten in ihrer univarianten Analyse signifikant zeigen, dass Malignom-Patienten mit höherer Wahrscheinlichkeit Gottron-Zeichen aufweisen als Patienten der Nicht-Malignom-Gruppe. In der multivarianten Analyse ließ sich dieses Ergebnis nicht mehr reproduzieren [18]. Fang et al. beschrieben jedoch nur Gottron-Zeichen und trafen keine Unterscheidung gegenüber Gottron-Papeln. Die Vergleichbarkeit mit der genannten Studie ist zudem durch die Wahl der Studienpopulation eingeschränkt, die sowohl Patienten mit Polymyositis einschließt als auch Patienten mit juveniler DM und Overlap-Patienten. In unserer Studie haben wir bewusst darauf verzichtet, diese Fälle einzuschließen. Auch András et al. haben in ihrer Studie von 2019 signifikant zeigen können, dass Gottron-Papeln häufiger bei der Malignom-Gruppe zu finden sind als in ihrer Vergleichsgruppe [10]. In der Studie von András et al. von 2008 [2] wurde noch zwischen Gottron-Zeichen und Gottron-Papeln unterschieden, in der Studie von 2019 [10] jedoch nicht mehr.
Ähnliche Schwierigkeiten mit der Nomenklatur finden sich für das heliotrope Erythem beziehungsweise den Erythemen im Gesichtsbereich. In unserer Studie haben wir auf Basis der klinischen Dokumentation unterschieden zwischen dem heliotropen Erythem, mit dem ein Erythem um die Periorbitalregion und an den Augenlidern gemeint war, und einem typischen zentrofazialen Erythem. Die Häufung der typischen zentrofazialen Erytheme bei den Malignom-Patienten war statistisch signifikant (P = 0,036). Für das heliotrope Erythem allein und in Kombination mit den typischen zentrofazialen Erythemen konnten wir keine signifikanten Unterschiede zwischen den Gruppen zeigen. Während Fang et al. einen signifikanten Unterschied und eine vermehrte Häufung für das heliotrope Erythem bei Malignom-Patienten zeigen konnten [18], waren die Unterschiede in den Studien von Fardet et al. [6] und Chen et al. [35] nicht signifikant. Ein Konsens ist hier unseres Erachtens unbedingt nötig, um Daten aus Studien valide vergleichen zu können.
In der Literatur gibt es unseres Wissens bis heute keine statistisch signifikanten Aussagen zur Häufigkeit von Erythemen an Ober- und/oder Unterarmen in Bezug auf die Zugehörigkeit zur Malignom- beziehungsweise Nicht-Malignom-Gruppe von DM-Patienten.
Wir konnten in unserer Studie zeigen, dass Juckreiz statistisch signifikant gehäuft bei der Nicht-Malignom-Gruppe vorkommt. In vielen Publikationen spielt der Juckreiz eine diagnostische Rolle, wobei in der Übersicht nicht klar ist, ob er für oder gegen eine Malignom-Assoziation spricht. Andras et al. untersuchten die Symptome Ulzeration und Juckreiz und konnten eine signifikant erhöhte Häufung in der von ihnen untersuchten Malignom-Gruppe zeigen. Jedoch wurde das Symptom des Juckreizes zusammen mit Ulzerationen untersucht [2]. Ulzerationen jucken nicht, sondern schmerzen. Da diese per se einen aggressiveren Prozess darstellen und gehäuft im onkologischen Setting beobachtet werden, ist es denkbar, dass das Zusammenfassen der Symptome Juckreiz und Ulzeration zu einem Bias geführt haben könnte. Gallais et al. berichteten, dass Juckreiz ein statistisch signifikanter prädikativer Faktor sei, ein Malignom zu entwickeln [36]. Wohingegen Kim et al. [37] keinen signifikanten Unterschied zwischen den beiden Gruppen zeigen konnten.
Eine Aufgabe für künftige Untersuchungen sollte es sein, auch klinische Eindrücke, die über die Kriterien von Bohan und Peter [4] hinausgehen, zu dokumentieren, um so neue Parameter und Faktoren finden zu können, die eine Aussage bezüglich der Malignomwahrscheinlichkeit erlauben könnten. Genauso wichtig erscheint aber auch die Einhaltung einer einheitlichen Nomenklatur. Erst dadurch werden klinische Befunde vergleichbar. Erwähnt werden sollte zusätzlich, dass zum Teil in klinischen Studien der CDASI Verwendung findet. Vorteile dieses Scores sind seine Objektivität und Verlässlichkeit bezüglich des klinischen Befundes von DM-Patienten, ebenso wie er eine Interpretation und Vergleichbarkeit von Studien ermöglicht [21]. Ein entscheidender Nachteil ist der hohe Zeitaufwand, weswegen er in der klinischen Routine selten Verwendung findet. Der CDASI war in unserer Auswertung bei keinem der Patienten verfügbar.
Bei der Mehrzahl der DM-Patienten kommt es im Laufe der Erkrankung zu Muskelbeteiligung. Sie ist eines der Kriterien von Bohan und Peter [4]. Statistisch signifikant war die Beteiligung der oropharyngealen Muskulatur bei der Malignom-Gruppe (Tabelle 5). Dieser Risikofaktor wird in der Literatur häufig unter dem Gesichtspunkt einer Dysphagie und/oder Dysphonie diskutiert [2, 10, 17, 18, 35, 38]. Jedoch konnten nur wenige Studien – wie Fang et al. [18], Lu et al. in ihrer Metaanalyse [17] und So et al. [38] – einen signifikanten Unterschied der Gruppen mit erhöhter Wahrscheinlichkeit bei der Malignom-Gruppe zeigen.
Einen signifikanten Unterschied der Häufigkeitsverteilung fanden wir für die GPT-Erhöhung (Malignom-Gruppe: 88,2 % vs. Nicht-Malignom-Gruppe: 58,1 %; Tabelle 6). Unsere Daten legen nahe, dass die Wahrscheinlichkeit erhöht ist, bei einer initialen GPT-Erhöhung ohne Therapie-Assoziation auch eine DM mit Malignom-Assoziation zu haben. Dies steht im Widerspruch zu den von Lu et al. in ihrer Metaanalyse beschriebenen Ergebnissen, wonach eine GPT-Erhöhung eher in der Gruppe ohne Malignität auftritt [17]. Als Grundlage dienten hier drei Studien [6, 39, 40]. Statistisch signifikant konnten unter diesen drei Studien nur Prohic et al. zeigen, dass Malignom-Patienten im Mittel einen höheren GPT-Wert haben, jedoch auch, dass beide Gruppen eine GPT-Erhöhung zeigen [39]. Fardet et al. zeigten, dass erhöhte GPT-Werte eher für eine DM mit Malignom-Assoziation sprechen, dass aber Werte > 200 U/l bei der Malignom-Gruppe weniger zu finden sind [6]. Lee et al. führen an, dass Nicht-Malignom-Patienten im Mittel höhere GPT-Werte haben als Malignom-Patienten, wobei der Mittelwert der Malignom-Patienten im Normbereich liegt [40]. Die Befunde der Studien zeigen sich sehr heterogen. Zum einen mag das an den unterschiedlichen Populationsgrößen liegen, zum anderen daran, dass unterschiedliche Werte (Mittelwert vs. Median) verwendet wurden. In den wenigsten Arbeiten wird darauf eingegangen, ob die GPT initial oder im Verlauf erhöht war, lediglich Lee et al. gaben dies an [40]. Als Aussage kann festgehalten werden, dass eine GPT-Erhöhung relevant sein könnte, es hierzu jedoch zu wenig Daten gibt. Die Untersuchung von MSA und MAA erfolgte bei einzelnen Patienten, jedoch erst zum Ende des von uns ausgewerteten Zeitraums hin. Signifikante Werte ließen sich aus den Ergebnissen nicht ablesen. Aus dem gleichen Grund wurde auf die Auswertung von ANA auf HEp2-Zellen verzichtet. Aufgrund einer ungenauen Dokumentation waren die Daten unvollständig. Da Nicolétis et al. für eine Neutrophilen-Lymphozyten-Ratio (NLR) ≥ 5,5 eine positive Assoziation zwischen DM/Polymyositis-Patienten und Malignomen zeigen konnten, untersuchten wir diesen Wert [41]. Unsere Daten ließen hierzu keine statistisch signifikanten Aussagen zu. Zur besseren Übersicht werden in Tabelle 7 alle in der Literatur diskutierten Faktoren aufgezählt und unseren Ergebnissen gegenübergestellt.
| MG | NMG | ||
|---|---|---|---|
| Risikoerhöhung | |||
| Demographie | n.s. | n.s. | |
|
Ja | Nein | |
|
Ja | Nein | |
| Hautzeichen |
|
k.A. | k.A. |
| n.s. | n.s. | ||
|
n.s. | n.s. | |
|
n.s. | n.s. | |
|
Ja | Nein | |
|
k.A. | k.A. | |
|
k.A. | k.A. | |
| Muskelzeichen |
|
n.s. | n.s. |
|
Ja | Nein | |
|
k.A. | k.A. | |
|
k.A. | k.A. | |
| Labor |
|
n.s. | n.s. |
|
k.A. | k.A. | |
|
k.A. | k.A. | |
| k.A. | k.A. | ||
| Risikominimierung | |||
| Overlap-Eigenschaften |
|
k.A. | k.A. |
|
k.A. | k.A. | |
|
n.s. | n.s. | |
|
k.A. | k.A. | |
|
k.A. | k.A. | |
|
k.A. | k.A. | |
|
k.A. | k.A. | |
|
n.s. | ||
Limitierend muss angeführt werden, dass es sich um eine retrospektive Datenanalyse handelt. Neue Forschungsergebnisse können nur allmählich in den klinischen Alltag integriert werden. Ebenso sind die Daten in retrospektiven Analysen meist unvollständig, was sich in unserer Auswertung vor allem an den fehlenden Labordaten aus der Routinediagnostik zeigt. So wurde erst in den letzten Jahren des betrachteten Zeitraums die Bestimmung von Antikörpern, sofern verfügbar, routinemäßig veranlasst und sie fehlen somit weitgehend für unsere Analyse. Klinische Befunde sind sehr abhängig vom Untersucher, standardisierte Befunderhebungen mittels CDASI waren in der Routine nicht etabliert.
Mit unserem Artikel möchten wir einen Beitrag zur besseren Beschreibung der seltenen DM leisten. Unseres Wissens nach handelt es sich neben der Studie von Fardet et al. [6] und einzelnen Fallserien wie jene von Maier et. al [42] um eine der wenigen Arbeiten, die sich mit einer reinen DM-Population und ihrem Bezug zu Neoplasien befasst haben. Weitere, insbesondere prospektive Studien mit einheitlicher Nomenklatur sind nötig, um eine Vergleichbarkeit der Risikofaktoren in Bezug auf eine DM mit Malignom-Assoziation zu erlauben. Die von uns herausgearbeiteten, teils stark diskrepanten, Unterschiede in der Nomenklatur bei den Hautbefunden (siehe Online-Supplement) illustrieren die Schlüsselfunktion klinisch tätiger Ärzte und unterstreichen die Notwendigkeit standardisierter Befundungen, beispielsweise mittels CDASI. Bisher wurden keine einheitlichen Richtlinien zur primären Tumoruntersuchung und Nachsorge bei DM-Patienten veröffentlicht, obwohl eine Assoziation zu Malignomen als gesichert gilt [8]. Das Design zukünftiger Studien sollte daher so gewählt werden, dass sie Aussagen hierzu möglich machen.
Danksagung
Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Interessenkonflikt
Keiner.